Časné těhotenské ztráty a vrozené trombofilní stavy
Early pregnancy loss and inherited thrombophilic states
Objective:
Review the literature regarding inherited thrombophilic states and early pregnancy loss.
Design:
Literary review.
Setting:
Department of Gynekology and Obstetrics, 1st Faculty of Medicine, Charles University Prague.
Subject and methods:
Thrombotic risk is increased in normal pregnancy. This risk is further enhanced in women with congenital or aquired thrombophilia. As an adequate placental circulation is dependent on the normal balance procoagulant and anticoagulant mechanism, inherited thrombophilia may be associated with fetal loss. Literary review.
Conclusions:
Placental thrombosis may be final common pathophysiologic pathway in most women with habitus abortions and repeated pregnancy wastage. Preliminary nonrandomized studies suggest a benefit for prophylaxis with unfractioned and low-molecular-weight heparin (LMWH), and prospective randomized trials are in progress to define whether LMWH is effective in preventive pregnancy loss and other gestational vascular complications in women with thrombophilia and previus fetal wastage.
Key words:
inherited trombophilia, pregnancy loss, venous thromboembolism, low-molecular-weight heparin.
:
D. Kašparová; Tomáš Fait
:
Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha, přednosta prof. MUDr. A. Martan, DrSc.
:
Ceska Gynekol 2009; 74(5): 360-365
Cíl studie:
Vytvořit literární přehled problematiky kauzality hereditárních trombofilií a časných těhotenských ztrát.
Typ studie:
Literární přehled.
Název a sídlo pracoviště:
Gynekologicko-porodnická klinika 1. LF UK a VFN v Praze.
Předmět a metoda studie:
Riziko trombembolické nemoci (TEN) se zvyšuje již v případě fyziologického těhotenství, ještě vyšší riziko pak představuje přítomnost vrozené nebo získané trombofilní mutace v anamnéze. Vrozené trombofilie mohou být spojeny s časnými těhotenskými ztrátami narušením rovnováhy mezi prokoagulačními a antikoagulačními mechanismy. Literární přehled.
Závěr:
Placentární trombóza se zdá být častou patofyziologickou příčinou habituálního potrácení u žen s anamnézou trombofílie. Prozatímní nerandomizované studie nastínily benefit profylaxe nízkomolekulárním heparinem a prospektivní randomizované studie přinášejí přehled účinnosti jednotlivých preparátů v prevenci časných těhotenských ztrát u žen s trombofilií.
Klíčová slova:
vrozené trombofilie, těhotenské ztráty, trombembolická nemoc, nízkomolekulární heparin.
ÚVOD
Ke spontánním potratům dochází asi u 15-20 % těhotenství; ve skutečnosti bude toto číslo ještě mnohem vyšší, protože odhadem více než 40 % gravidit skončí ještě před jejich vlastním diagnostikováním. Opakované těhotenské ztráty postihují 0,4-1 % žen. Etiologie habituálního potrácení je multifaktoriální. Může se jednat o příčiny genetické, anatomické, hematologické, endokrinologické, infekční, imunologické, environmentální, psychologické či idiopatické.
U většiny žen s anamnézou opakovaných těhotenských ztrát se zdá být často konečným patofyziologickým mechanismem placentární trombóza. Adekvátní placentární cirkulace totiž závisí na rovnováze mezi faktory prokoagulačními a antikoagulačními, vrozené trombofilie mohou tuto rovnováhu narušit, proto bývá přítomnost trombofilních mutací spojována s těhotenskými ztrátami.
TROMBEMBOLICKÁ NEMOC A GRAVIDITA
Flebotrombóza je jednou z nejzávažnějších komplikací gravidity a puerperia. V těhotenství se vyskytují všechny 3 složky Wirchovovy triády. Výsledkem je až šestinásobně vyšší riziko vzniku žilní trombembolie u těhotných žen a žen po porodu vzhledem k ženám netěhotným.
Složitý hemostatický a fibrinolytický systém je těhotenstvím ovlivněn prokoagulačně, což potencuje význam vrozených koagulopatií v etiopatogenezi některých porodnických komplikací.
Gravidita zvyšuje riziko hluboké žilní trombózy nejen vlastním zpomalením krevního toku vlivem tlaku zvětšující se dělohy, ale i hyperkoagulací vyvolanou hormonálními změnami v těhotenství, uvolňováním faktorů ovlivňujících koagulační i fibrinolytický systém a v neposlední řadě aktivací endotelových buněk. A právě pochody doprovázející růst trofoblastu a placentární invazi významným způsobem ovlivňují aktivitu endotelových buněk.
Těhotenství je spojeno až s 200% nárůstem koncentrací fibrinogenu a faktoru II, VII, VIII, X a XII, zatímco koncentrace faktoru V a IX zůstávají na stejné úrovni. Koncentrace endogenních antikoagulancií stoupají minimálně (TFPI, alfa-2-makroglobulin), zůstávají nezměněny (antitrombin III, C protein, heparin II kofaktor), nebo se snižují (S protein).
TROMBOFILNÍ MUTACE
Vrozené trombofilie jsou skupinou geneticky podmíněných koagulopatií zvyšujících riziko TEN. Ačkoli je jejich dominantní role rizika v oblasti ve venózním řečišti nesporná, mnohem méně jasně je dána role trombofilních mutací v oblasti arteriálního řečiště.
Pochopení podstaty trombofilních mutací je stěžejní i pro management vysoce rizikových těhotenství.
Vrozené koagulopatie totiž mohou indukovat tvorbu trombóz v uteroplacentárním a intervilózním prostoru, čímž mohou vést k intrauterinní růstové retardaci, intrauterinní smrti plodu a jiným komplikacím (tab. 1).
V retrospektivní analýze u žen, jež se zúčastnily studie European Prospective Cohort on Thrombophilia (EPCOT), byl zpozorován mírný vzestup rizika těhotenských ztrát u pacientek s vrozenou trombofílií (168/571) vs. (93/395), (odds ratio 1,35, 95% confidence interval) [32].
Brenner a spol. zveřejnili výsledky studie, v níž 42 ze 188 těhotenství (22 %) u 60 žen s hereditární trombofilií (deficit antitrombinu III, protein C, protein S) skončilo těhotenskou ztrátou v porovnání s kontrolní skupinou 23/202 (11 %) (OR 20, 95% Cl 1,2-3,3) [4].
Mutace faktoru V Leiden
Mutace genu pro faktor V Leiden (1691 GA) vzniká v důsledku záměny DNA báze guaninu za adenin v genu koagulačního faktoru V, což vede k záměně aminokyseliny argininu za glutamin na 506. pozici polypeptidového řetězce faktoru V. Důsledkem je vyšší odolnost faktoru V vůči štěpení aktivovaným proteinem C, a laboratorně pak současně prokazatelná elevace hladiny cirkulujícího protrombinu na 150-200 % původní hodnoty.
Heterozygotní výskyt mutace faktoru V Leiden je v české populaci asi 5 %, počet homozygotů FV Leiden je 1/5000 obyvatel. U nositelů leidenské mutace je až sedmkrát vyšší riziko hluboké žilní trombózy.
Mutace faktoru V Leiden je nalézána u 20-40 % pacientek s venózní trombózou [30], u 60 % pacientek s trombózou v graviditě [15], dále je majoritní příčinou trombózy při současném užívání hormonální antikoncepce [31].
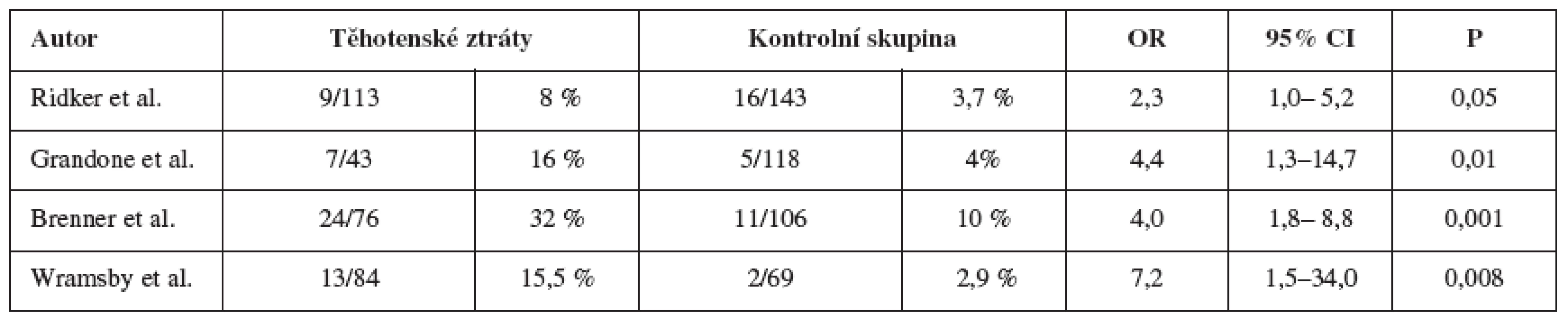
Ačkoliv existují etnické rozdíly v subpopulaci, mnoho studií potvrdilo vyšší prevalenci faktoru V u žen s anamnézou opakovaných těhotenských ztrát (tab. 2). Podle Grandoneho a spol. je u žen s habituálním potrácením a neznámou kauzální příčinou vyšší výskyt nositelek této mutace [12]. Ridker a spol. uvádějí dvakrát až třikrát vyšší prevalenci mutace faktoru V u pacientek s anamnézou opakovaných těhotenských ztrát [26]. Většina těhotenských ztrát proběhne v I. trimestru, pozdní těhotenské ztráty jsou častější u pacientek s trombofilií v anamnéze ve srovnání s ženami bez zmíněné trombofílie: 160/429 (37 %) ve srovnání s 39/162 (24 %) [28].
![Placentární vaskulární komplikace u pacientek s trombofilií [4]](https://www.cs-gynekologie.cz/media/cache/resolve/media_object_image_small/media/image/45c85f393301c89d7476a169d606331f.png)
Jak uvádí Meinardi a spol. riziko habituálního potrácení je vyšší u pacientek s mutací faktoru V v homozygotní konstituci oproti nosičkám mutace faktoru V v heterozygotní konstituci [21].
Je důležité zmínit, že většina žen s mutací faktoru V těhotenskou ztrátu v anamnéze nemá, ale v přítomnosti další trombofilie nebo vlivem lokálních placentárních faktorů se může habituální potrácení objevit.
APC rezistence
Při analýze kauzality APC rezistence (tj. rezistence vůči aktivovanému proteinu C) a opakovaných těhotenských ztrát je třeba zdůraznit, že v průběhu fyziologické gravidity dochází k poklesu APC senzitivity [16]. Tranzientní APC rezistence je možná i u žen s absencí mutace faktoru V během fyziologického těhotenství [25].
Sarig a spol. zveřejnili výsledky prospektivní studie, v níž byla APC rezistence zjištěna u 39 % ze 145 žen s anamnézou opakovaného potrácení ve srovnání s udávanými 3 % ve skupině kontrolní, v přibližně polovině případů pak byla APC rezistence zjištěna v kombinaci s mutací faktoru V a zbytek jako solitární defekt koagulace [28].
Protrombinová mutace
Bodová mutace v 3’-UTR (v nepřepisované oblasti) mRNA protrombinu - faktor II - protrombin (20210GA) - u jedinců vyvolá zvýšení produkce protrombinu, a tím i větší dispozici ke srážení krve.
Výskyt mutace genu pro protrombin se u nás pohybuje mezi 1–2 %. Podle Poorta a spol. jsou polymorfismy v genu protrombinu spojeny s vyšším rizikem žilní trombózy [22].
Ve studii, v níž u 76 žen s těhotenskou ztrátou v anamnéze byla prokázána mutace faktoru II v 7,8 % procentech ve srovnání s kontrolní skupinou, kde byla frekvence nositelek této mutace 3,8 % z celkových 106 žen (relativní riziko = 1,95, 95% konfidence interval, 0,83-46) [5].
U heterozygotních nositelů této mutace se riziko vzniku žilní trombózy zvyšuje asi dvakrát až třikrát.
Naproti tomu Sarig a spol. uvádějí, že mutace faktoru II a MTHFR C677T, jakožto solitární defekty, nejsou spojeny se zvýšením rizika opakovaných těhotenských ztrát ve srovnání s kontrolní skupinou, nelze však vyloučit možné riziko kauzality mutace faktoru II na habituální potrácení [9, 22].
Jak mutace faktoru V Leiden, tak i mutace faktoru II jsou spojeny se zvýšeným rizikem intrauterinní smrti plodu [20]. Celkem 11 ze 67 (16 %) pacientek s pozdní těhotenskou ztrátou a 13 z 232 (6 %) žen v kontrolní skupině mělo buď přítomnou mutaci faktoru V, nebo mutaci faktoru II [4].
Hyperhomocysteinémie a MTHFR C677T
Polymorfismy genu pro metylentetrahydrofolátreduktázu - MTHFR (677 CT), MTHFR (1298 AC) - souvisí s eventuálním zvyšováním hladiny homocysteinu zejména při deficitu vitaminů B6, B12 nebo kyseliny listové.
Hladina homocysteinu klesá v těhotenství přibližně o 50 %. Hyperhomocysteinémie byla zjištěna u 26 % pacientek s abrupcí placenty, u 11 % pacientek s intrauterinní smrtí plodu a u 38 % pacientek s intrauterinní růstovou retardací ve srovnání s uváděnými 2-3 % v kontrolní skupině [4]. Podobně pak hyperhomocysteinémie byla přítomna u 26/84 (31 %) žen s placentárními infarkty nebo abrupcí, ve srovnání 4/46 (9 %) s kontrolní skupinou. V případě opakovaných těhotenských ztrát byla objevena hyperhomocysteinémie u 6/35 (17 %) pacientek [5].
Hladina homocysteinu je zvýšena též při urémii. Odhaduje se, že mutace MTHFR (677 CT) se v homozygotní formě vyskytuje asi u 8–10 % osob kavkazské populace. Hyperhomocysteinémie je jedním z rizikových faktorů rozvoje aterosklerózy a kardiovaskulárních chorob, ale i žilní trombózy.
Data poukazují na skutečnost, že hyperhomocysteinémie je rizikovým faktorem pro habituální potrácení, nosičství MTHFR v homozygotní konstituci, jakožto solitární trombofilie, rizikový faktor časných těhotenských ztrát nezvyšuje.
Deficit AT III
Antitrombin III je přirozeně se vyskytující antikoagulans. Jedná se o sérový inhibitor inaktivující trombin a faktory IXa, X, XIa. Deficit antitrombinu III patří mezi heterogenní poruchy zapříčiněné více jak 80 možnými mutacemi, převážně převládá autosomálně dominantní dědičnost.
Deficit antitrombinu III je spojen se zvýšeným rizikem TEN v těhotenství a šestinedělí. Více než 70 % žen s deficitem antitrombinu III v průběhu gravidity prodělalo trombembolickou příhodu [10]. Podle Prestona a spol. je na místě zřejmá asociace deficitu AT III a časných těhotenských ztrát a taktéž intrauterinního úmrtí plodu [23].
Kombinované trombofilní mutace
Kombinace vrozených nebo získaných trombofilních mutací zvyšuje riziko habituálního potrácení i trombózy.
Studie provedená Sarigem a spol. shledala minimálně jednu trombofilii; byla nalezena u 96/145 (66 %) pacientek s časnou těhotensku ztrátou v anamnéze ve srovnání s kontrolní skupinou, v níž trombofilii diagnostikovali u 41/145 (28 %) pacientek [28]. Kombinace trombofilních mutací byla zastižena u 31/145 (21 %) žen s opakovanou těhotenskou ztrátou oproti kontrolní skupině 8/145 (5,5 %). APC rezistence bez přítomnosti faktoru V byla rozpoznána u 18 % těhotenských ztrát, z toho polovina byla zjištěna v kombinaci s další trombofilní mutací [4].
PREVENCE A TERAPIE TROMBOFILNÍCH STAVŮ V GRAVIDITĚ
Griseova prospektivní randomizovaná studie řešila účinky heparinu u žen s hereditární trombofilií a anamnézou dvou či více spontánních potratů nebo jednoho úmrtí plodu bez zjevné příčiny. U 160 žen s mutací faktoru V Leiden, protrombinovou mutací či deficitem S proteinu porovnávali Gris a spol. léčbu 40 mg enoxaparinu denně a podávání 100 mg kyseliny acetylsalicylové. Začátek terapie obou preparátů byl situován do 8. týdne gravidity. Četnost porodu živých dětí dosáhla ve skupině pacientek léčených enoxaparinem 86 % (OR pro porod živého dítěte při podávání nízkomolekulárního heparinu rovno 15, 95% IS 7-34), zatímco ve skupině pacientek při terapii kyselinou acetylsalicylovou jen 29 % [13]. Kritizovaným nedostatkem této studie byla absence zaslepení zvolené terapie a vysoká incidence těhotenských ztrát ve skupině užívající nízkou dávku kyseliny acetylsalicylové.
Brenner a spol. provedli studii LIVE-ENOX, tj. multicentrickou randomizovanou studii s cílem posoudit efekt a bezpečnost dvou dávek enoxaparinu u 183 žen s anamnézou opakovaných těhotenských ztrát a hereditární trombofílie. Enoxaparin výrazně zvyšuje četnost porodu živých dětí a snižuje četnost dalších těhotenských ztrát v celkovém porovnání s předchozí anamnézou pacientek. Opakované těhotenské ztráty zde byly definovány jako minimálně 3 spontánní potraty před koncem I. trimestru, dvě a více těhotenské ztráty v II. trimestru, nebo jedno nitroděložní úmrtí plodu během III. trimestru. Ze 166 žen dokončilo studii 135 žen, z toho 70 porodilo živé děti (84,3 %) ve skupině léčené 40 mg enoxaparinu denně a 65 (78,3 %) ve skupině léčené 80 mg enaxaparinu denně. Mezi výsledky gravidity pacientek tak nebyl zaznamenán významný rozdíl, celkově se četnost porodu živých plodů pohybovala při profylaxi nízkomolekulárním heparinem (LMWH) v rozmezí 76,9-84,3 % oproti pouhým 28 % v předchozích graviditách bez profylaxe [6]. Slabinou studie byla současná role pacientek na terapii LMWH jakožto kontrolní skupiny (tab. 3).
![Terapeutické možnosti prevence těhotenských ztrát u pacientek s trombofilií [3]](https://www.cs-gynekologie.cz/media/cache/resolve/media_object_image_small/media/image/304a076673da9e576a2fe2c9aa11374a.png)
Rovněž Kupferminc a spol. léčili skupinu 33 žen s trombofílií a anamnézou úmrtí plodu nebo jiných komplikací podáváním LMWH a nízké dávky kyseliny acetylsalicylové, přičemž u léčených pacientek nebyla zaznamenána opakovaná těhotenská ztráta. Tato skupina pak také publikovala data o vysoké četnosti recidivujících komplikací těhotenství u žen s anamnézou ztráty plodu a hereditární trombofílií v rozmezí 66-83 % [19].
ZÁVĚR
Není pochyb o tom, že nosičství hereditární trombofilní mutace v homozygotní konstituci (s dále zmíněnou výjimkou v případě MTHFR mutace) nebo nosičství kombinace více trombofilních mutací zvyšuje riziko TEN.
Nosičství trombofilní mutace faktoru V Leiden a protrombinové mutace prokazatelně zvyšují riziko nejen TEN, ale i opakované a jinak nevyvětlitelné ztráty plodu po 9. týdnu gestačního stáří. Nosičství mutace MTHFR tvoří výjimku, protože prokoagulačně působí pouze v současné přítomnosti hyperhomocysteinémie. Celoplošný screening trombofilních mutací se neprovádí, o většině do té doby asymptomatických pacientkách tak nemáme možnost vědět.
Pozornost v souvislosti s možnými rizikovými faktory TEN budí i tzv. tranzitorní faktory, tj. dlouhodobá imobilizace, fixace končetiny, hyperestrogenní stavy a další. Samotná gravidita zvyšuje riziko TEN šestkrát. Podání heparinu, a zejména nízkomolekulárního heparinu jednoznačně představuje nejlepší metodu prevence a léčby TEN v těhotenství.
Doporučené postupy prevence TEN v gynekologii a porodnictví upravují pravidla podání LMWH vydaná ve spolupráci s Českou gynekologicko-porodnickou společností a Českou hematologickou společností [2]. Pravidla se týkají načasování LMWH terapie v graviditě a v puerperiu. Podnětem byla klinická zkušenost, kdy po průkazu prokoagulačního vlivu trombofilních mutací byly těhotné diagnostikované nosičky trombofilní mutace zajištěny LMWH po celou dobu gravidity i šestinedělí.
Zde nelze opomenout možný nejčastěji uváděný nežádoucí účinek podávání LMWH preparátů, a sice možné riziko heparinem indukované trombocytopenie, i když je nižší v případě podání LMWH v porovnání s terapií nefrakciovaným heparinem. Přesto je pravidelný monitoring počtu trombocytů při dlouhodobém užívání LMWH na místě.
Nemalou pozornost vzbudila i možná souvislost trombofilních mutací s časnými těhotenskými ztrátami a pozdními komplikacemi gravidity typu intrauterinní růstové retardace, preeklampsie, abrupce placenty, intrauterinní smrt plodu. Podkladem byla skutečnost, že u pacientek s vrozenou koagulopatií může dojít k abnormální prokoagulační aktivitě, jež může vyústit tvorbou trombů a infarktů v uteroplacentární cirkulaci, klinicky se manifestující časnou těhotenskou ztrátou. Kontroverzním faktem studií prevence časných těhotenských ztrát LMWH zůstává bez pochyb právě pestrá etiologie možných, někdy i vzájemně se kombinujících, kauzálních příčin potratu. Právě problémy s randomizací jsou oním kritickým místem pro zpochybnění výsledků dosavadních studií týkajících se zajištění nosiček trombofilní mutace v graviditě.
Přesto výstupy jednotlivých publikovaných studií přinesly převážně důkazy o benefitu LMWH profylaxe u pacientek s anamnézou habituálního potrácení.
Doporučený počátek zahájení LMWH terapie je třeba situovat do 8. týdne gestačního věku, tedy do doby formování uteroplacentární cirkulace.
MUDr. Dita Kašparová
Gynekologicko-porodnická klinika
1. LF UK a VFN
Apolinářská 18
128 00 Praha 2
e-mail: dita.schondorfova@seznam.cz
Sources
1. Binder, T. Prevence trombembolické nemoci v těhotenství. Gyn po promoci, 2005, 4, s. 8-11.
2. Binder, T. Zabraňuje heparin nežádoucím výsledkům těhotenství spojeným s vrozenou trombofilií? Gyn po promoci, 2008, 1, s. 57-59.
3. Blumenfeld, Z., Brenner, B. Thrombophilia- associated pregnancy wastage. Fertil Steril, 1999, 5, p. 765-775.
4. Brenner, B., Kupferminc, B. Inherited thrombophilia and poor pregnancy outcome. Best Pract Res Clin Obstet Gynec, 2003, 3, p. 427-439.
5. Brenner, B., Blumenfeld, B. Thrombophilia and fetal loss. Blood Rev, 1997, 97, p. 551-554.
6. Brenner, B., Hofman, R., Blumenfeld, Z., et al. Gestational outcome in thrombophilic women with recurrent pregnancy loss treted by enoxaparin. Thromb Haemost, 2000, 83, p. 693-697.
7. Brenner, B., Mandel, H., Lanir, N., et al. Activated protein C resistancecan be associated with recurrent fetal loss. Brit J Haematol, 1997, 97, p. 551-554.
8. Brenner, B., Sarig, G., Weiner, Z., et al. Thrombophilic polymorphisms are common in women with fetal loss without apparent cause. Thromb Haemost, 1999, 82, p. 6-9.
9. Brenner, B., Vulfsons, SL., Lanir, N., et al. Coexistence of familial antiphopolipids syndrome and factor V Leiden- impact of thrombosis diathesis. Brit J Haematol, 1996, 94, p. 166-167.
10. Girling, J., de Swiet, M., et al. Inherited thrombophilia and pregnancy. Curr Opin Obstet Gynecol,1998, 10, p. 135-144.
11. Grandone, E., Brancaccio, V., Colaizzo, BS., et al. Preventing adverse obstetrics outcomes in women with genetic thrombophilia. Fertil Steril, 2002, 78, p. 371-375.
12. Grandone, E., Margaglione, M., Colaizzo, D., et al. Factor V Leiden is assciated with repeated and recurrent unexplained fetal losses. Thromb Haemost, 1997, 77, 822-824.
13. Gris, JC., Mercier, E., Quere, I., et al. Low-molecular-weight heparin versus low-dose aspirin in woman with fetal loss in women with one fetal loss and a constitutional thrombophilic disorder. Blood, 2004, 103, p. 3695-3699.
14. Hajšmanová, Z., Šlechtová, J., Šigutová, P., et al. Průběh těhotenství při dlouhodobém podávání nízkomolekulárního heparinu pro opakované těhotenské ztráty. Čes Gynek, 2008, 5, s. 278-283.
15. Hellgren, M., Svenson, PJ., Daehlback, B., et al. Resistance to activated protein C as a basis for venous thrombembolism associated with pregnancy and oral contraceptives. Am J Obstet Gynecol, 1995, 173, p. 517-522.
16. Kjelberg, U., Andersson, NE., Rosen, S., et al. APC resistance and other haemostatic variablesduring pregnancy and puerperium. Thromb Haemost, 1999, 81, p. 527-531.
17. Krajčovičová, R., Hudeček, R., Kalvodová, J., et al. Diferenciální diagnostika a terapie opakovaných těhotenských ztrát - 1. část, Prakt Gynek, 2007, 4, s. 164-169.
18. Kupferminc, MJ., Eldor, A., Steinman, N., et al. Increased ferquency of genetic thrombophilia in women with complications of pregnancy. N Engl J Med, 1999, 340, p. 9-13.
19. Kupferminc, MJ., Fait, G, Mang, A., et al. A Low molecular weight heparin for the prevention of obstetric complications in women with thrombophilia. Hypertens Pregnancy, 2001, 20, p. 35-44.
20. Martinelli, I., Taioli, J., Cetin, I., et al. Mutations in coagulation factors in women with unexplained late fetal loss. N Engl J Med, 2000, 343, p. 1015-1018.
21. Meinardi, JR., Middeldorp, S., de Kam, PJ., et al. Increased risk for fetal loss in carriers of the factor V Leiden mutation. Ann Intern Med, 1999, p. 736-739.
22. Poort, SW., Rosendal, FR., Reitsma, PH., et al. A common genetic variation in the 3@- untranslated region of the prothrombine gene is associated with elevated plasma prothrombin levels and increase in venous thrombosis. Blood, 1996, 88, p. 3698-3703.
23. Preston, EF., Rosendal, FR., Walker, ID., et al. Increased fetal loss in women with heritable thrombophilia. Lancet, 1996, 348, p. 913-916.
24. Procházka, M. Žilní trombembolie v těhotenství. Gyn po promoci, 2008, 5, s. 19-22.
25. Ridker, PM., Hennekens, CH., Lindpaintner, K., et al. Mutation in the gene coding for coagulation factor V and the risk of myocardial infarction, stroke and venous thrombosis in apperently healthy men. N Engl J Med, 1995, 332, p. 912-917.
26. Ridker, PM., Miletich, JP., Buring, JE., et al. Factor V Leiden mutation as a risk factor for recurrent pregnancy loss. Ann Intern Med, 1998, 128, p. 1000-1003.
27. Roztočil, A. Opakované těhotenské ztráty: negenetické příčiny. Gyn po promoci, 2007, 5, s. 20-23.
28. Sarig, G., Hoffman, R., Younis, J., et al. Thrombophilia is common in women with pregnancy loss and is associated with late pregnancy wastage. Fertil Steril, 2002, 77, p. 342-347.
29. Scott, JR., Rote, NS., Brand, DW., et al. Immunologic aspects of reccurent abortions and fetal death. Obstet Gynecol, 1987, 70, p. 645-656.
30. Svensson, PJ., Daehlback, B., et al. Resistance to activated protein C as a basis for venous thrombosis. N Engl. J. Med, 1994, 330, 517-522.
31. Vandenbroucke, JP., Koster, T, Briet, T., et al. Increased risk of venous thrombosis in oral-contraceptives users who are carriers of factor V Leiden mutation. Lancet, 1994, 344, 1453-1457.
32. Vossen, CY., Preston, FE., Conard, J., et al. Hereditary thrombophilia and fetal loss: a prospective follow up study. J Thromb Haemost, 2003, 2, p. 592-596.
33. Wramsby, ML., Sten-Lindner, M., Bremme, K., et al. Primary habitual abortions are associated with high frequency of factor V Leiden mutation. Fertil Steril, 2000, 74, p. 987-991.
34. Younis, J. S., Brenner, B., Ohel, G., et al. Activated protein C resistance and factor V Leiden mutation can with first- as well as second- trimestr loss. Am. J. Reprod. Immun., 2000, 43, 31-35
35. Younis, JS., Ohel, G., Brenner, B., et al. The effect of thromboprophylaxis on pregnancy outcomes in patients with reccurent pregnancy loss associated with factor V Leiden mutation. Brit J Obstet Gynaecol, 2000, 107, p. 415-419.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2009 Issue 5
Most read in this issue
- Current knowledge of ductal carcinoma in situ
- Acute hysterectomy for huge submucous leiomyoma prolaps
- Cancer of endometrium - rare variant of remote metastases
- Early pregnancy loss and inherited thrombophilic states
