Komplikace radikálních onkogynekologických operací
Complications of radical oncogynecological operations
Objective:
Information sheet about the most frequently complications of radical oncogynecological operations.
Design:
Literature review with case reports.
Setting:
Department of Gynaecology and Obstetrics, Faculty of Medicine, Masaryk’s University and Faculty Hospital, Brno.
Methods:
Literature review about complications of radical oncogynecological operations with illustrative case reports.
Conclusions:
Radical oncogynecological operations, due to their size, associated with a higher morbidity compared with traditional gynecological surgery. The literature states morbidity parameters between 25‑45% depending on the center of erudition and range of out performance. Basic division of surgical complications is on perioperative complications and postoperative complications, which are further divided into early and late.
The most frequently intraoperative complication is large blood loss requiring the application of blood substitutes. Less common complications are injury to the urinary bladder, ureter, rarely bowel or neural structures, especially nerve obturatorius. Among early postoperative complications are dominated urological complications, particularly urinary bladder hypotonia, another important group are the vascular complications, ie trombembolia and bleeding. Between late postoperative complications is possible to define several basic groups, ie urology, intestinal, lymphovascular and complications associated with laparotomy wound suture.
Prevention of complications should be based on several basic assumptions. These include adequate erudition and composition of the operating team, perfect knowledge of anatomical conditions in the pelvic retroperitoneum, the paraaortic, the paracaval and inguinal area, implementation radicality adequate performance in relation to the extent of the disease and developing new surgical techniques (eg nerve sparing surgery). Absolute necessity is also the possibility of interdisciplinary cooperation with other surgical disciplines, which is important both in terms of preventing complications, and for their event. subsequent solutions.
Key words:
intraoperative and postoperative complications, blood loss, injury to the urinary bladder and ureter, urinary fistula, thromboembolic complications, lymphedema, lymphocyst, hemangioma.
:
Luboš Minář 1
; Vít Weinberger 1
; P. Kysela 2
:
Gynekologicko-porodnická klinika LF MU a FN, Brno, přednosta prof. MUDr. P. Ventruba, DrSc.
1; Chirurgická klinika LF MU a FN, Brno, přednosta prof. MUDr. Z. Kala, CSc.
2
:
Ceska Gynekol 2010; 75(4): 346-352
Cíl studie:
Informační přehled o nejčastějších komplikacích radikálních onkogynekologických operací.
Typ studie:
Literární přehled s kazuistikou.
Název a sídlo pracoviště:
Gynekologicko-porodnická klinika klinika LF MU a FN Brno.
Metodika:
Literární přehled o komplikacích radikálních onkogynekologických operací s ilustrativní kazuistikou.
Závěr:
Radikální onkogynekologické operace jsou vzhledem ke svému rozsahu spojeny s vyšší morbiditou ve srovnání s klasickou gynekologickou operativou. V literatuře se uvádějí parametry morbidity v rozmezí 25-45 % v závislosti na erudici centra a spektru prováděných výkonů. Základní rozdělení komplikací operačních výkonů je na komplikace peroperační a komplikace pooperační, které se dále dělí na časné a pozdní.
Nejčastější peroperační komplikací je velká krevní ztráta vyžadující aplikaci krevních náhrad. Méně časté komplikace pak představují poranění močového měchýře, ureteru, vzácněji trávicí trubice nebo nervových struktur, zejména nervus obturatorius. Mezi časnými pooperačními komplikacemi dominují komplikace urologické, zejména hypotonie močového měchýře, další významnou skupinu pak představují komplikace vaskulární, tj. trombembolie a krvácení. Mezi pozdními pooperačními komplikacemi je možno vymezit několik základních skupin, tj. urologické, intestinální, lymfovaskulární a komplikace spojené s hojením laparotomické sutury.
Prevence komplikací by měla vycházet z více základních předpokladů. Mezi ně patří adekvátní erudice a složení operačního týmu, dokonalá znalost anatomických poměrů v oblasti retroperitonea pánve, v oblasti paraaortální, parakavální a krajiny třísel, provádění výkonů adekvátní radikality ve vztahu k rozsahu onemocnění a rozvíjení nových operačních technik (např. nerve sparing surgery). Naprostou nezbytností je rovněž možnost interdisciplinární spolupráce s dalšími chirurgickými obory, která je důležitá jak z hlediska předcházení komplikacím, tak i pro jejich event. následné řešení.
Klíčová slova:
peroperační a pooperační komplikace, krevní ztráta, poranění močového měchýře a ureteru, močová píštěl, trombembolické komplikace, lymfedém, lymfocysta, hemangiom.
ÚVOD
Komplikace operačních výkonů lze obecně rozdělit na komplikace peroperační a komplikace pooperační, které se dále dělí na časné a pozdní. Podle statistických údajů se výskyt peroperačních komplikací gynekologické operativy pohybuje v dosti širokém rozmezí 0,2 26 %. Laparoskopická chirurgie ve srovnání s klasickou laparotomickou operativou rovněž nevykazuje snížení rizika peroperačního poranění okolních pánevních orgánů [4, 31]. Radikální onkogynekologická operativa je pochopitelně spojena s nejvyšším rizikem operačních komplikací, a to jak peroperačních, tak i pooperačních, ve srovnání s klasickou gynekologickou operativou. Nejvyšší riziko se pak týká exenterační pánevní chirurgie vyžadující interdisciplinární spolupráci onkogynekologa, chirurga a urologa, kde se závažná morbidita pohybuje v rozmezí 60-70 %. Incidence těchto komplikací přitom závisí na celé řadě faktorů, mezi něž patří např. zkušenost a erudice operatéra, indikace k operaci a rozsah operačního výkonu. K faktorům, které snižují riziko komplikací, patří zejména posun diagnózy do časnějších stadií (a s tím související nižší frekvence neoadjuvantní léčby, zejména radioterapie, která způsobuje fibrotizaci a obtížnější preparaci tkání) nebo zlepšení operačních technik [9].
PEROPERAČNÍ KOMPLIKACE
Nejčastější peroperační komplikací radikální onkogynekologické operativy je velká krevní ztráta vyžadující aplikaci krevních náhrad. Méně časté komplikace pak představují poranění močového měchýře, ureteru, vzácněji trávicí trubice nebo nervových struktur, zejména nervus obturatorius.
Větší krevní ztráta vznikající v průběhu radikální onkogynekologické operace je dána rozsahem radikality výkonu i vlastnostmi nádorově postižených tkání vyznačujících se většinou zvýšenou maligní neovaskularizací. V oblasti retroperitonea se onkogynekolog pohybuje v těsné blízkosti velkých cévních kmenů i drobných pletení. Obecně platí, že z hlediska event. iatrogenního poranění jsou rizikovější kmeny žilní. Je to jednak oblast dolní duté žíly, především nad její bifurkací, kde odstupují četné drobné vény, které mohou být při preparaci vytrženy z cévní stěny. Laterodorzálně odstupuje z aorty a dolní duté žíly řada lumbálních větví, které jsou další rizikovou oblastí z hlediska poranění. Dále je to oblast vena iliaca externa směrem do tříselného kanálu s odstupem vena dorsalis clitoridis interna, která představuje spojku mezi zevní a vnitřní ilickou žílou a je lokalizována zpravidla na zadní stěně symfýzy. Další rizikovou oblastí je obturatorní fossa, zejména část infraobturatorní pod průběhem stejnojmenného nervu s interindividuálně variabilním větvením vena iliaca interna na spodině fossy. V oblasti tepenných kmenů je pak nutné věnovat zvýšenou pozornost oblasti paraaortální s odstupem většinou poměrně gracilní a. mesenterica inferior, která zajišťuje adekvátní krevní zásobení kliček tenkého střeva (obr. 1).
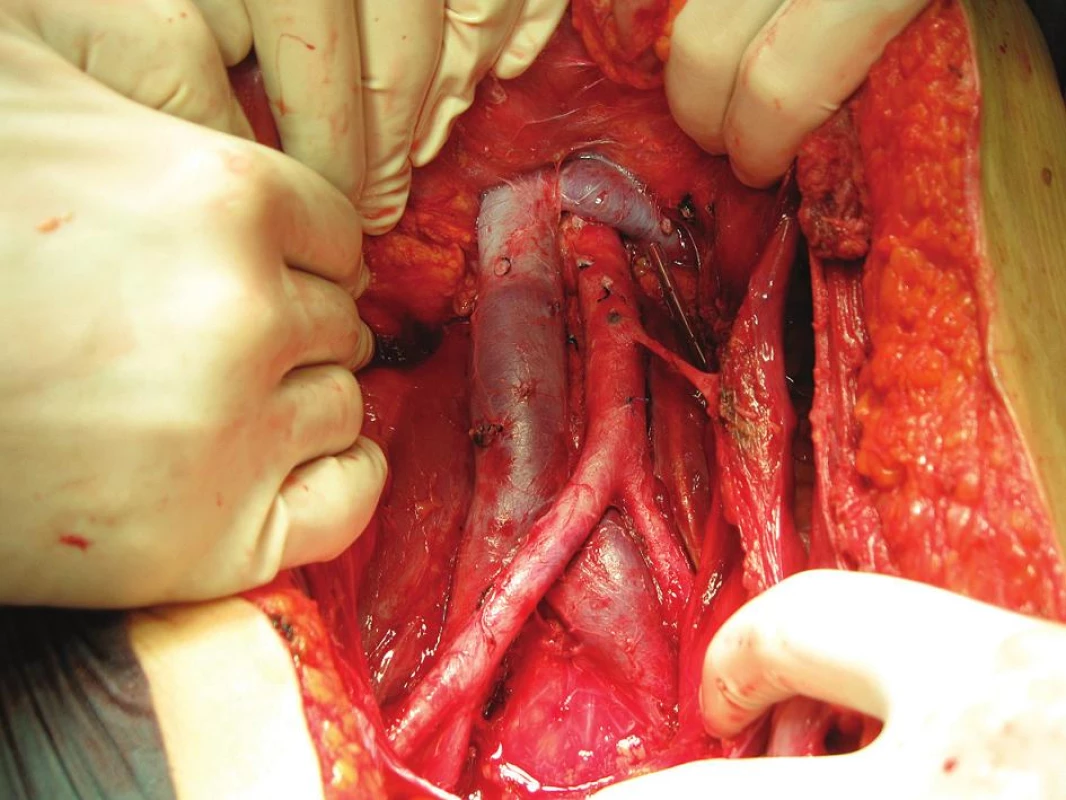
Kromě poranění standardních cévních struktur však může operatéra překvapit i náhodně se vyskytující koincidující léze, jejíž poranění může být rovněž příčinou život ohrožujícího krvácení v rámci operačního výkonu, jak bude prezentováno v níže uvedené kazuistice.
Poranění močového měchýře může vzniknout při tupém oddělování hrdla děložního od močového měchýře, kdy může dojít přímo i k perforaci stěny. Na poranění nás upozorní přítomnost čiré tekutiny v operačním poli, viditelná léze stěny měchýře, event. při laparoskopické operaci i distenze sběrného močového sáčku plynem. Ze statistik vyplývá, že při laparoskopických výkonech je riziko iatrogenního poranění močového měchýře 2-10krát vyšší než při klasickém přístupu a tento trend roste v souvislosti se zvyšující se složitostí pánevní laparoskopické chirurgie.
Při podezření na poranění je nutné provést přímou inspekci stěn měchýře, při negativitě naplnění např. roztokem metylenové modři ve fyziologického roztoku se sledováním případného úniku barviva, v krajním případě následuje již urologem provedená cystotomie a revize měchýře. Při poranění během výkonů z vaginálního přístupu je nejvhodnější metodou k detekci léze cystoskopie, kdy současně zjišťujeme vztah defektu k ureterálním ústím.
Častěji než s perforací se setkáváme s poraněním a následným oslabením detruzoru a vznikem hypotonie močového měchýře, v krajním případě dochází v oslabené, ztenčené stěně k ischemickým změnám s následnou extravazací a vznikem fistuly [9].
Nejčastější komplikací při radikální pánevní chirurgii je však zhoršení mikce na podkladě ztráty uterovaginální podpory měchýře a přerušení nervových pletení v oblasti parametrií. Nejrizikovější varianta radikální hysterektomie z tohoto pohledu je hysterektomie III. stupně radikality, při které jsou postranní parametria resekována kompletně až na dno pánevní a zadní parametria asi 2 cm od kosti křížové, což je spojeno s vysokým rizikem poranění hypogastrického nervového plexu, jehož vlákna podle současných znalostí anatomie nervového zásobení pánve probíhají v bázi zadních parametrií a částečně v kaudální části postranních parametrií [26]. Z tohoto pohledu je snaha o rozvoj operační techniky, která by umožnila zachování autonomní inervace pánevních orgánů při současném zachování adekvátní radikality operace, tzv. nerve sparing surgery.
Postup dosud nelze považovat za jednoznačně standardizovaný, dosud největší soubor výkonů publikoval v roce 2006 Raspagliesi, kdy srovnával parametry morbidity u výkonů rozdílné radikality u celkem 110 pacientek operovaných pro karcinom děložního hrdla. Při vlastním výkonu je nervový plexus poprvé identifikován v presakrální oblasti při pánevní lymfadenektomii, následně se nachází mediálně po obou stranách při otevření pararektálního prostoru. Postranní parametria se resekují do výše odstupu a. rectalis media, přední parametrium by mělo být po sesunutí močového měchýře a preparaci paravezikální fossy disekováno na dvě části - horní část asi v polovině nebo při stěně močového měchýře, dolní část s nervovým plexem je zachována. Rovněž tak by měla být provedena i disekce dvou částí zadních parametrií - mediální část obsahující sakrouterinní vazy může být resekována podle požadované radikality, část laterální s hypogastrickým plexem zůstává zachována, parakolpium je pak doresekováno směrem k pochvě rovněž nad úrovní nervové pleteně [19].
Poranění ureteru se udává asi u 0,5-2 % hysterektomií a neradikálních pánevních gynekologických operací a asi u 10 % radikálních hysterektomií. Ureter je v průběhu radikálních hysterektomií preparován v různém rozsahu v závislosti na stupni radikality hysterektomie. U I. stupně, kdy je technika výkonu totožná s extrafasciální hysterektomií, ureter není mobilizován, ale pouze odsunut laterálně ve svém průběhu parametrii. U II. stupně je ureter uvolněn ve svém průběhu z postranních parametrií, ale ponechán na předních parametriích, která nejsou resekována, což je důležité pro zachování cévního zásobení distální části močovodu. U III. stupně radikality je pak ureter zcela mobilizován až ke vstupu do močového měchýře [17].
Preparaci ureteru při výkonu může komplikovat celá řada faktorů, jako jsou obezita, fibrotické změny tkání po předchozích výkonech, zánětlivé změny nebo nádorová infiltrace, ty mohou současně způsobovat i dislokaci ureteru. Naprostá většina lézí ureteru postihuje jeho distální část a vzniká při ošetřování obtížně stavitelného krvácení v oblasti postranních parametrií. Podstatně vzácnější je poranění ureteru proximálněji při nakládání stehů v oblasti infundibulopelvického vazu. K poranění ureteru může dojít při jeho preparaci i v rámci radikálního operování z přístupu vaginálního [22], s kterým však má zkušenost v našich podmínkách jen minorita onkogynekologických operatérů, a není tudíž příliš rozšířen a preferován. Při vaginálním přístupu může dojít k poranění ureteru i během rekonstrukce poševního pahýlu. Ureter může být peroperačně poraněn nastřižením nebo úplným přerušením, event. může být částečně excidován s přiléhající tkání. Rovněž může dojít k jeho zhmoždění při nasazení nástroje, většinou peánu, kdy dojde i bez ligatury k ischemizaci stěny a nekróze s následným vznikem defektu. Ureter může být poškozen i elektrokoagulací nebo ligaturou s následnou nekrózou stěny [15].
Všechny tyto situace jsou spojeny s extravazací moči. Z poranění terminálního ureteru může rezultovat i vznik vezikovaginální fistulace [16]. Devaskularizace ureteru se může v mírnější formě projevit i vznikem striktury, většinou až za několik dnů nebo týdnů jako komplikace pooperační. Zranitelné cévní zásobení má především střední třetina ureteru, dolní třetina a terminální část jsou zásobeny ze stěny pánevní, z větví vezikálních, rektálních i pudendálních.
V případě, že je poranění ureteru zjištěno peroperačně, je nutná pečlivá revize, samozřejmě pod vedením urologa, protože bezprostřední rekonstrukční výkony mají ve srovnání s odloženými výkony podstatně lepší výsledky (až 100 % vs. 67 %) a nižší počet komplikací. Možnosti řešení závisí na typu a rozsahu poranění, patří mezi ně zavedení ureterálního stentu, resekce postiženého úseku a provedení ureteroureteroanastomózy nebo reimplantace ureteru [6].
Poranění trávicí trubice mohou vzniknout při uvolňování adhezí střevních kliček po předchozích operacích, kdy dochází k deserozaci nebo na základě nešetrné operační techniky ve smyslu termického poškození nebo přímé perforace. Poranění v oblasti žaludku a duodena při onkogynekologické operační léčbě je raritní. Častěji se setkáváme s poraněním střeva, frekventnější je výskyt těchto poranění u laparoskopických radikálních výkonů, kde se udává v rozmezí 0,1-0,6 %, s častějším postižením tenkého střeva. Příčinou bývá většinou elektrokoagulační poranění s nekrózou a následným vytvořením nástěnného defektu [4, 31]. S poraněním rekta se setkáváme častěji u vaginálního operačního přístupu, kde se pohybuje do 2 %. Možnosti ošetření poranění, které jsou v kompetenci břišního chirurga, představují prostá sutura, resekce postižené části střeva s anastomózou, resekce poraněné části střeva a založení dvouhlavňové stomie nebo stomie orálního úseku a uzavření aborálního úseku střeva (tzv. resekce podle Hartmanna) [9].
Poranění nervus obturatorius ve formě přerušení se může rovněž raritně vyskytnout v rámci radikální pánevní chirurgie při provádění pánevní lymfadenektomie v souvislosti s nešetrnou operační technikou a nedostatečnou praktickou erudicí operatéra. Řešení suturou je v těchto případech v kompetenci neurochirurga. Daleko častěji se setkáváme s různě silně vyjádřenými klinickými projevy iritace nervu (poruchy hybnosti, tj. addukce nebo čití v oblasti příslušné dolní končetiny) na podkladě manipulací s následným edémem nervu při systematické pánevní lymfadenektomii v oblasti obturatorní fossy. Klinické potíže bývají přechodného rázu a různě rychle ustupují v souvislosti s adekvátní pooperační rehabilitační péčí.
POOPERAČNÍ KOMPLIKACE
Mezi časnýmipooperačními komplikacemi radikální onkogynekologické operativy dominují komplikace urologické, zejména hypotonie močového měchýře, další významnou skupinu pak představují komplikace vaskulární, tj. trombembolie a krvácení. K hypotonii močového měchýře disponuje tupé oddělování děložního hrdla od močového měchýře s oslabením detruzoru, v rámci radikálních výkonů pak zejména léze nervových vláken hypogastrického plexu v parametriích, kdy dochází k dysfunkci močového měchýře na pokladě poruchy kontraktility detruzoru v souvislosti s postižením autonomní inervace [19]. Zásadní je zajištění drenáže močového měchýře permanentním katétrem, epicystostomií, event. pravidelným cévkováním. Drenáž je možné odstranit až po obnovení spontánní mikce, v opačném případě hrozí ireverzibilní poškození detruzoru se vznikem atonického měchýře.
Mezi pozdnímipooperačními komplikacemi je možno vymezit několik základních skupin, tj. urologické, intestinální, lymfovaskulární a komplikace spojené s hojením laparotomické sutury.
Mezi urologické komplikace patří kromě přetrvávání hypotonie močového měchýře např. rozvoj močové inkontinence s výrazným zastoupením stresové složky na základě změny anatomických poměrů po kompletních výkonech se ztrátou uterovaginální podpory močového měchýře.
Závažnou skupinu urologických komplikací představují močové píštěle. Vznikají při nerozpoznaném poranění vývodných cest močových, pokud dojde k ohraničení pasáže moči směrem k nezahojené ráně pochvy nebo vzácně do laparotomické rány. Fistula se zpravidla manifestuje mezi 4.-8. pooperačním dnem, nejpozději za 15 dnů po operaci. Nejčastější varianta je fistula vezikovaginální, vzácně se může objevit také ureterovaginální nebo uretrovaginální. K diagnostice a orientační lokalizaci píštěle se používá zkouška tří tamponů s plněním močového měchýře fyziologickým roztokem zbarveným metylénovou modří. Mezi další metody sloužící k diagnostice pak patří cystografie, uretrocystoskopie, která může být součástí retrográdní ureteropyelografie nebo intravenózní vylučovací urografie [9].
Řešení těchto komplikací je v kompetenci urologa. V oblasti ureteru se může jednat o zavedení stentu, resekční výkon s anastomózou, reimplantaci ureteru, v případě rozsáhlejšího poškození se provádí rekonstrukce interpozicí ilea nebo apendixu (v literatuře je zmiňována úspěšnost až v 80 % případů). Jednoduché vezikovaginální píštěle lze uzavřít sblížením zdravých okrajů jednotlivých vrstev obou orgánů, u komplikovaných píštělí (po rozsáhlém poranění, infekčních komplikacích, následné radioterapii) je vhodné obě strany píštěle oddělit ještě další tkání, nejčastěji s využitím tkáně omenta. Větší úspěch rekonstrukce je u píštělí zjištěných během prvních dvou týdnů po primárním operačním výkonu, kdy jsou tkáně ještě poddajné a nezjizvené, výjimkou jsou píštěle uretrovaginální, zpravidla spojené s poškozením svěrače uretry, kdy se naopak rekonstrukční výkon odkládá do doby, kdy je zbylá tkáň sfinkteru pevná a provádí se rovněž plastika svěrače současně s uzavřením defektu [16].
Stenóza ureteru s následným rozvojem hydronefrózy může jako pozdní komplikace vzniknout na podkladě devaskularizace ureteru při jeho rozsáhlejší skeletizaci, kdy dochází ke vzniku striktury většinou až za několik dnů nebo týdnů po operaci. V diagnostice je základní vyšetřovací metodou ultrazvuk doplněný intravenózní vylučovací urografií. Řešení může být endoskopické, pokud je stenóza do 2 cm a je zjištěna během prvních tří pooperačních měsíců, a sice provedením endoureterotomie a balonkové dilatace, v ostatních případech je indikovaná otevřená operace s provedením resekce a anastomózy nebo reimplantační výkony [15].
Mezi komplikace intestinální patří zvýšené riziko rozvoje střevní neprůchodnosti, většinou se v rámci pozdních komplikací jedná o ileus mechanický. Predisponujícím faktorem je zejména zvýšené riziko adhezivního procesu v pánvi při velké ranné ploše. Na základě poranění hypogastrického nervového plexu při radikální hysterektomii dochází i k ovlivnění funkčnímu ve smyslu oslabení peristaltiky.
Mezi komplikace lymfovaskulární patří rozvoj lymfedému dolních končetin, který je možnou komplikací lymfadenektomie. Klinicky se projevuje jako otok jedné či obou končetin vznikající v průběhu 12 měsíců po operaci a má tendenci přecházet do chronického stadia. V etiopatogenezi se uplatňuje postižení lymfatické uzliny nádorem nebo přerušení lymfatické drenáže při lymfadenektomii odstraněním uzliny, a zároveň porucha nervového zásobení cév vedoucí k chronické vazodilataci [29]. Rozvoj lymfedému záleží na lokalizaci a stadiu nádorového onemocnění, radikalitě provedeného operačního výkonu, provedení systematické lymfadenektomie nebo pouze biopsie sentinelové uzliny a na počtu a lokalizaci odstraněných lymfatických uzlin [24]. Nejvyšší prevalence lymfedému se udává po operacích pro karcinom vulvy, na druhém místě je karcinom děložního hrdla, těsně následovaný karcinomem endometria a nejméně často se lymfedém vyskytuje po radikálních operacích pro karcinom ovaria. Po operacích pro karcinom vulvy se udává výskyt lymfedému v rozmezí 36-69 % [1, 7, 23, 28]. Prevalence lymfedému u pacientek s karcinomem děložního hrdla, u kterých byla součástí radikálního chirurgického výkonu lymfadenektomie, se popisuje v rozmezí 17-27 % [12, 20, 28]. U pacientek po operaci pro karcinom endometria s pánevní lymfadenektomií se popisuje prevalence lymdefému 16-25 % [28, 30]. Nejméně často se lymfedém vyskytuje se po chirurgické léčbě karcinomu ovaria, v literatuře se uvádí prevalence 5-7 % [1, 28].
Pro detekci lymfedému se využívá několik vyšetřovacích metod. Základní orientační metodou je měření obvodů na předem určených místech postižené končetiny a jejich porovnávání s rozměry zdravé končetiny. Novou neinvazivní metodou k detekci lymfedémů je multifrekvenční bioelektrická impedanční analýza. Metoda měří specificky množství extracelulární vody, která odpovídá kompartmentu lymfedému, a to pomocí rezistence tkáně při průchodu elektrického proudu o různých frekvencích [10, 14]. Metodou, která je využívaná převážně pro lymfoterapeuty k detailnějšímu popsání lokalizace poruch lymfatické drenáže, je lymfoscintigrafie. Využívá subkutánní aplikaci radioaktivního koloidu do postižené končetiny s následným sledováním transportu této látky lymfatickými cévami gama kamerou. Pro lymfedém je charakteristický chybějící nebo zpomalený transport aplikované látky. Metoda má poměrně vysokou senzitivitu (75-95 %) a 100% specificitu [18]. Mezi další pomocné diagnostické metody patří ultrasonografie, CT a magnetická rezonance. Komplexní terapie lymfedému zahrnuje péči o kůži, úpravu životního stylu, lymfatickou drenáž, zevní kompresi a podpůrná cvičení [2, 18, 21]. Doplňkem léčby je farmakoterapie využívající léky s fibrinolytickými a proteolytickými účinky a mobilizující makrofágy, např. Detralex, Wobenzym.
Další lymfovaskulární komplikaci v souvislosti s radikální onkogynekologickou operativou a exenterací lymfatických uzlin představují lymfocysty. Vznikají při déletrvající secernaci lymfy z přerušených lymfatických kmenů, kdy dochází k hromadění lymfy především v pánevním retroperitoneálním prostoru pod novotvořeným nástěnným peritoneálním krytem. Přispívají k rozvoji rozsáhlejších lymfedémů, tlakem na cévní svazky mohou potencovat rozvoj zánětlivých a trombotických komplikací žilního systému pánve a dolních končetin [25, 27]. Rovněž jsou predispozicí pro vznik pánevních zánětlivých komplikací včetně abscesových formací [11]. Prevencí tvorby lymfocyst je dlouhodobě akceptovaný konsensus týkající se neprovádění peritonealizace po lymfadenektomiích a adekvátní pooperační drenáž dutiny břišní.
Mezi komplikace spojené s hojením laparotomické sutury patří riziko ranné infekce a vznik herniace v jizvě. Výskyt infekčních komplikací ovlivňují lokální a celkové rizikové faktory. Mezi lokální patří primárně infikovaný operační terén, pooperační hematom nebo ponechaná nekrotická tkáň, k celkovým faktorům pak patří diabetes mellitus, imunosuprese nebo malnutrice.
VLASTNÍ POZOROVÁNÍ
Prezentujeme život ohrožující komplikaci způsobenou nadměrnou krevní ztrátou v průběhu radikální onkogynekologické operace. Šlo o ženu ve věku 66 let, důchodkyni, s negativní rodinnou onkologickou anamnézou. Anamnesticky byla pacientka od dětství sledována pro poměrně rozsáhlý kavernózní hemangiom pravého boku (obr. 2) přecházející do oblasti vulvy a na vnitřní stranu pravého stehna (obr. 3). V této souvislosti podstoupila celkem 6 operačních výkonů na pracovištích plastické chirurgie, avšak jen s minimálním efektem. Vzhledem k opakovaným tromboflebitidám v oblasti kavernózní pleteně hlavně v oblasti pravé dolní končetiny měla chronickou perorální antikoagulační terapii.
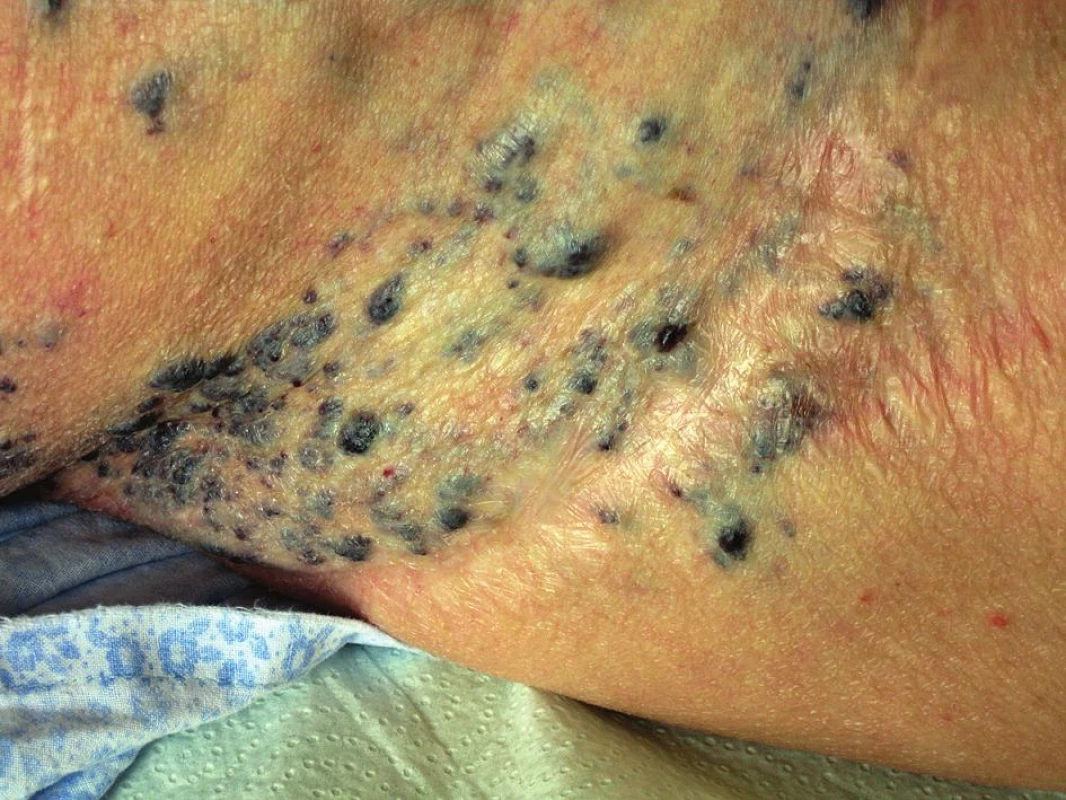
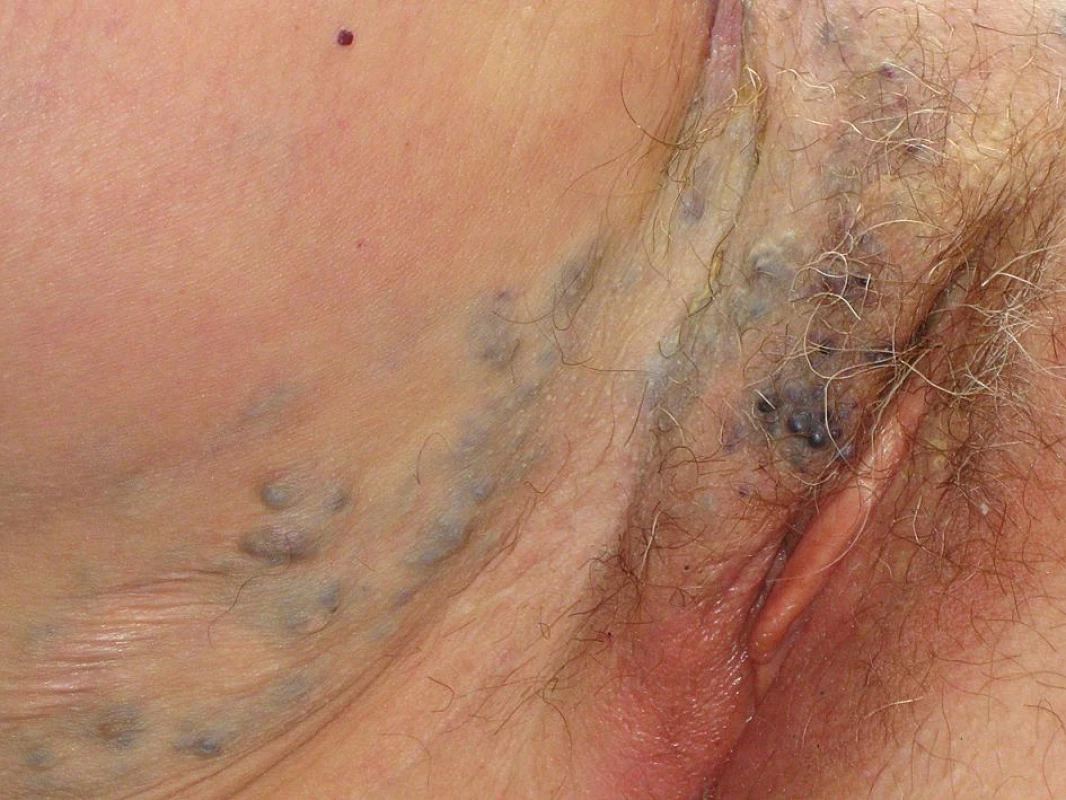
V červenci 2009 podstoupila na našem pracovišti z indikace postmenopauzální metroragie a suspektní hyperplazie endometria frakcionovanou kyretáž s histologickým nálezem špatně diferencovaného endometroidního adenokarcinomu těla dělohy, event. invazi myometria nebylo možné z dodaného materiálu určit. Na základě stagingových vyšetření bylo vysloveno podezření na invazi myometria nepřesahující polovinu síly děložní stěny na její zadní stěně, bez pravděpodobného postižení cervixu, další vyšetření byla negativní. Vedlejším nálezem byla podle UZ a CT vyšetření voštinovitá struktura lokalizovaná v břišní stěně v oblasti pravého boku nad průběhem zevních ilických cév, její popisovaná velikost byla 15 x 7 x 6 cm a odpovídala nálezu kavernózního hemangiomu. Pacientka byla indikována k operačnímu výkonu, vzhledem ke koincidujícímu nálezu hemangiomu byl indikován laparotomický přístup.
Při otevření dutiny břišní byl při revizi pánve a dutiny břišní detekován subperitoneálně plošný hemangiom masivně vyklenující nástěnné peritoneum nad průběhem zevních ilických cév (obr. 4, 5). V rámci výkonu byla standardně provedena laváž, extrafasciální hysterektomie s oboustrannou adnexektomií, z freez histologie potvrzen nález předoperačního UZ vyšetření, tj. invaze nepřesahující polovinu síly myometria a rovněž špatně diferencovaný grading tumoru.
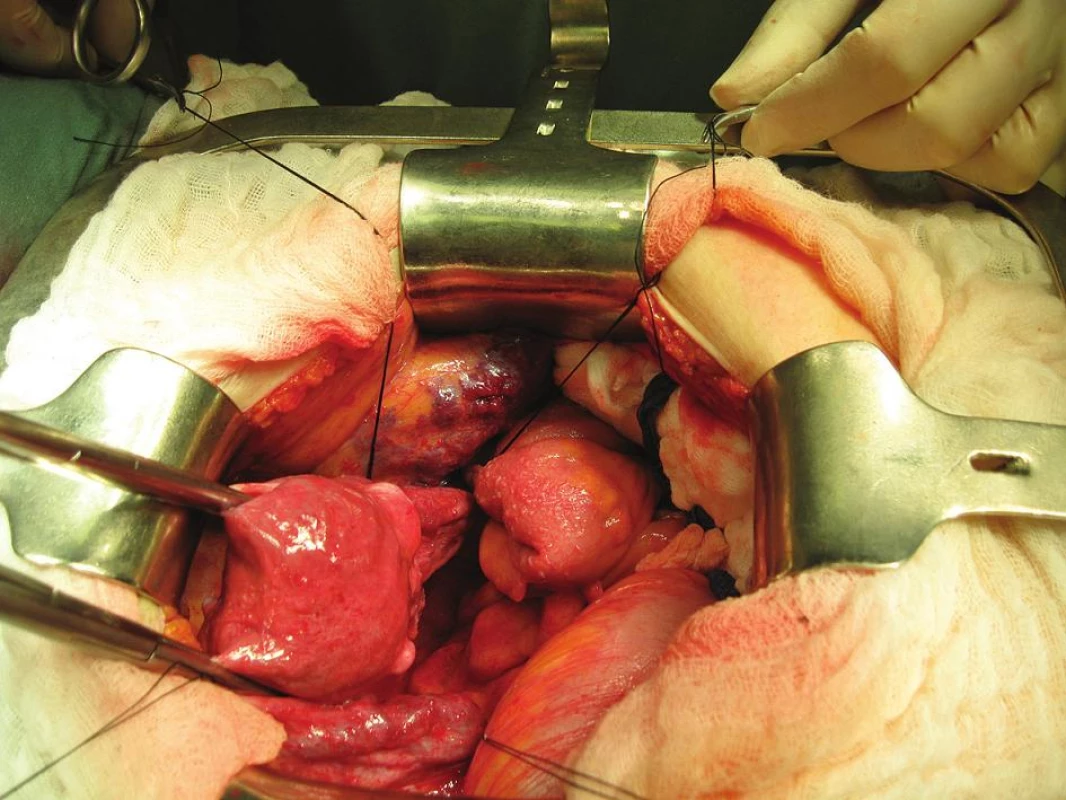
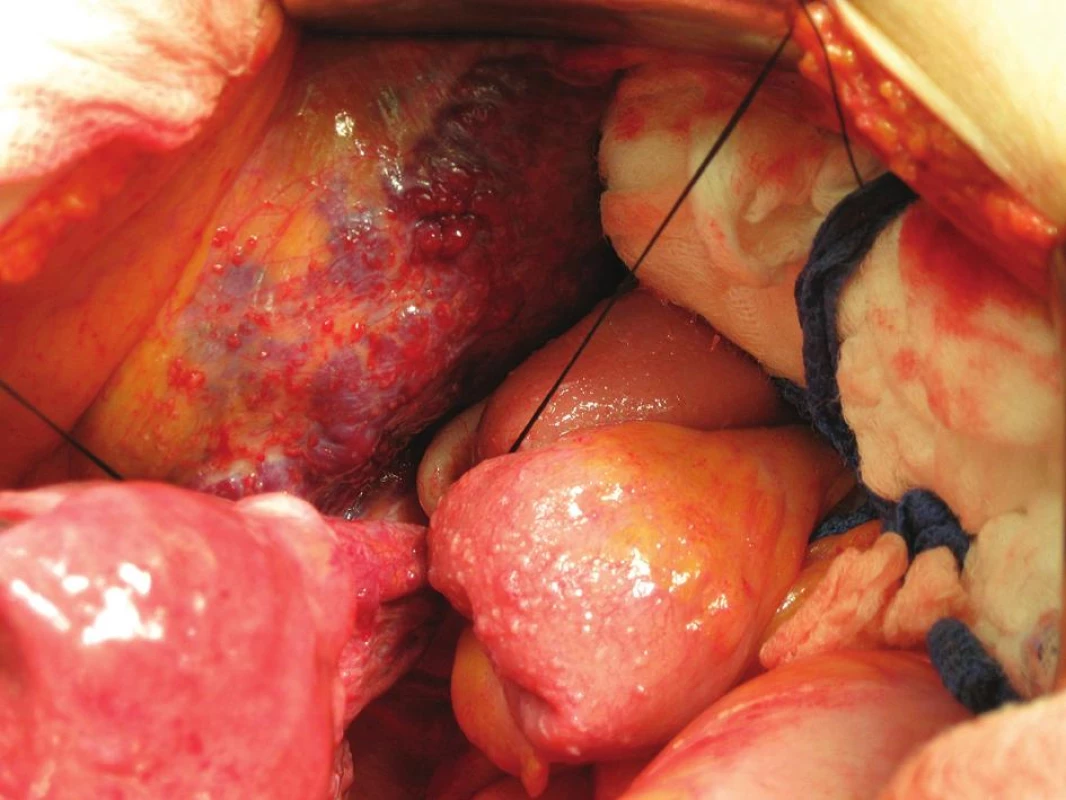
Na základě histologie se pokračovalo ve výkonu v rozsahu pánevní lymfadenektomie. Levostranná byla provedena standardním způsobem, v pravostranné lokalizaci bylo vzhledem k přítomnosti hemangiomu postupováno atypicky po preparaci ureteru exenterací nejdříve oblasti obturatorní fossy a interních ilických cév. Zevní ilické cévy byly ozřejmeny z kaudálního pohledu, kraniálně již na ně naléhaly kaverny hemangiomu. Při tupé palpaci suprailické krajiny směrem do ingvinálního kanálu, kde již nástěnné peritoneum nebylo vyklenuto hemangiomem, však došlo k profuznímu zakrvácení venózní krví a při následném odklopení peritonea bylo detekována krvácení z perforované marginální kaverny hemangiomu. Oblast byla tamponována a k výkonu přivolán cévní chirurg. Vzhledem k nálezu s rizikem exsangvinace se v první fázi postupovalo z oblasti pravého třísla, kde byly postupně přerušeny zdroje hemangiomu z oblasti saphenofemorální junkce, po odpojení hemangiomu v třísle pokračováno revizí z dutiny břišní, kde byly přerušeny další žilní spojky odstupující z vena iliaca externa a interna k hemangiomu. Následně byla pánev tamponována, provedena adaptační sutura stěny břišní. Celková krevní ztráta při výkonu dosáhla 3500 ml a byla v jeho průběhu adekvátně hrazena.
Týž den byla ještě doplněna digitální subtrakční angiografie, při které nebyla nalezena jednoznačná extravazace, aplikováno bylo menší množství spongostanového materiálu do descendentního řečiště arteria iliaca externa l.dx. Za necelých 48 hodin po výkonu byla provedena extrakce břišní tamponády, oblast hemangiomu byla již bez známek event. krvácení. Definitivní histologie potvrdila nález z peroperační biopsie, následná brachyradioterapie již byla radioterapeutem kontraindikována a pacientka byla převedena do standardní dispenzární péče, v níž se nyní nachází bez známek recidivy základního onemocnění.
ZÁVĚR
Radikální onkogynekologické operace jsou vzhledem ke svému rozsahu pochopitelně spojeny s vyšší morbiditou ve srovnání s klasickou gynekologickou operativou. V literatuře se uvádějí parametry morbidity v rozmezí 25-45 % v závislosti na erudici centra a spektru prováděných výkonů. Prevence komplikací by měla vycházet z více základních předpokladů. Mezi ně patří adekvátní erudice a složení operačního týmu, dokonalá znalost anatomických poměrů v oblasti retroperitonea pánve, v oblasti paraaortální, parakavální a krajiny třísel, provádění výkonů adekvátní radikality ve vztahu k rozsahu onemocnění a rozvíjení nových operačních technik (např. nerve sparing surgery) [8, 19]. Naprostou nezbytností je rovněž možnost interdisciplinární spolupráce s dalšími chirurgickými obory, která je důležitá jak z hlediska předcházení komplikacím, tak i pro jejich event. následné řešení. Aby byly splněny tyto předpoklady, je zřejmé, že léčba musí být centralizována a prováděna v onkogynekologických centrech na základě mezioborové spolupráce [3, 5].
MUDr. Luboš
Minář
Gynekologicko-porodnická
klinika
LF
MU a FN Brno
Obilní
trh 11
625
00 Brno
e-mail:
lubosminar@seznam.cz
Sources
1. Beesley, V., Janda, M., Eakin, E., et al. Lymphedema after gynecological cancer treatment. Cancer 2007, 109 (12), p. 2607-2614.
2. Benda, K. Lymfedém končetin v ordinaci praktického lékaře. Med pro praxi 2006, 6, s. 276-279.
3. Benedetti-Panici, P., Angioli, R. Gynecologic oncology specialty. Eur J Gynaecol Oncol 2004, 25 (1), p. 25-26.
4. Bishoff., JT., et al. Laparoscopy bowel injury: incidence and clinical presentation. J Urol 1999, 161(3), p. 887-890.
5. Bouda, J., Rokyta, Z., Mleziva, J. Onkogynekologický operatér - subspecializace. Čes Gynek 1999, 64(2 Suppl), s. 31-32.
6. Brandes, S., Coburn, M., Armenakas, N., et al. Diagnosis and management of ureteric injury: an evidence-based analysis. Brit J Urol Internat 2004, 94(3), p. 277-289.
7. Brouns, E., Donceel, P., Stas, M. Quality of life and disability after ilio-inguinal lymphadenectomy. Acta Chir. Belg 2008, 108(6), p. 685-690.
8. Cibula, D., Kesic, V. Surgical education and training in gynecologic oncology I: European perspective. Gynecol Oncol 2009, 114(2 Suppl), p.52-55.
9. Cibula, D., Petruželka, L., et al. Onkogynekologie. Praha: Grada 2009, s. 171-186.
10. Cornish, BH., Thomas, BJ., Ward, LC. Improved prediction of extracellular and total body water using impedance loci generated by multiple frequency bioelectrical impedance analysis. Phys Med Biol 1993, 38, p. 337-346.
11. Franchi, M., Ghezzi, F., Riva, C., et al. Postoperative complications after pelvic lymphadenectomy for the surgical staging of endometrial cancer. J Surg Oncol 2001, 78(4), p. 232-237.
12. Füller, J., Guderian, D., Köhler, C., et al. Lymphedema of the lower extremities after lymphadenectomy and radiotherapy for cervical cancer. Strahlenther Onkol 2008, 184 (4), p. 206‑211.
13. Goff, BA. Surgical education for gynecologic oncologists. Gynecol Oncol, 2009, 114(2 Suppl), p. 46.
14. Halaška, M.J., Komárek, V., Malá, I., et al. A method for the detection of post-operative lymphoedema after operation for breast cancer: multifrequency bioelectrical impedance analysis. J Appl Biomed 2006, 4, p. 179-185.
15. Hanuš, T., Jarolím, L., Petřík, R. et al. Iatrogenní léze močovodu u žen. Rozhl Chir 1997, 76(6), s. 302-305.
16. Hanuš, T., Jarolím, L., Petřík, R., et al. Vesikovaginální a uretrovaginální píštěle. Rozhl Chir 1997, 76(6), s. 306-309.
17. Hoffman, MS. Extent of radical hysterectomy: evolving emphasis. Gynec Oncol 2004, 94, p. 1.
18. Horning, KM., Guhde, J. Lymphedema: an under-treated problem. Medsurg Nurs 2007, 16 (4), p. 221-227.
19. Ju, XZ., Li, ZT., Yang, HJ., et al. Nerve-sparing radical hysterectomy and radical hysterectomy: a retrospective study. Zhonghua Fu Chan Ke Za Zhi 2009, 44(8), p. 605-609.
20. Kim, JH., Kim, HJ., Hong, S., et al. Post-hysterectomy radiotherapy in FIGO stage IB-IIB uterine cervical carcinoma. Gynecol Oncol 2005, 96, p. 407-414.
21. Kim, SJ., Park, YD. Effects of complex decongestive physiotherapy on the oedema and the quality of live of lower unilateral lymphoedema following treatment for gynaecological cancer. Eur J Cancer Care 2008, 17(5), p. 463‑468.
22. Mehra, G., Weekes, A., Vantrappen, P., et al. Laparoscopic assisted radical vaginal hysterectomy for cervical carcinoma: Morbidity and long-term follow-up. Eur J Surg Oncol 2010, 36(3), p. 304-308.
23. Moore, RG., Robison, K., Brown, AK., et al. Isolated sentinel node dissection with conservative management in patients with squamous cell carcinoma of the vulva: A prospective trial. Gynecol Oncol 2008, 109 (1), p. 65-70.
24. Nováčková, M., Halaška, M., Chmel, R., et al. Lymfedémy dolních končetin po chirurgické léčbě gynekologických nádorů. Gynekolog 2009, 18(6), s. 208-211.
25. Ogawa, D., Shikata, K., Matsuda, M., et al. Pelvic lymphocyst infection associated with maternally inherited diabetes mellitus. Diabetes Res Clin Pract 2003, 61(2), p. 137‑141.
26. Piver, MS., et al. Five classes of extended hysterectomy for women with cervical cancer. Obstet Gynec 1974, 44, p. 265.
27. Recio, F., Ghamande, S., Hempling, R., et al. Effective management of pelvic lymphocysts by laparoscopic marsupialization. JSLS 1999, 3(2), p. 97-102.
28. Ryan, M., Stainton, MC., Slaytor, EK., et al. Aetiology and prevalence of lower limb lymphoedema following treatment for gynaecological cancer. Aust N Z J Obstet Gynaecol 2003, 43, p. 148-151.
29. Sadmani, S., Lachmann, E., Nagler, W. Unilateral extremity swelling in female patients with cancer. J Womens Health Gend Based Med 2001, 10 (4), p. 319-326.
30. Tada, H., Teramukai, S., Fukushima, M., Sasaki, H. Risk factors for lower limb lymphedema after lymph node dissection in patients with ovarian and uterine carcinoma. BMC Cancer 2009, 9, p. 47.
31. Yan, X., Li, G., Slang, H., et al. Complications of laparoscopic radical hysterectomy and pelvic lymphadenectomy-experience of 117 patients. Int J Gynecol Cancer 2009, 19(5), p. 963-967.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2010 Issue 4
Most read in this issue
- Shoulder dystocia during vaginal delivery
- Repair of the 3rd and 4th degree obstetric perineal tear
- Perinatal brachial plexus palsy
- Complications of radical oncogynecological operations
