Biochemické aspekty fetálnej hypoxie
Biochemical aspects of fetal hypoxia
Objective:
To evaluate validity of biochemical diagnostic methods of fetal hypoxia.
Design:
A case-control study.
Setting:
Department of Gynecology and Obstetrics, Jessenius Faculty of Medicine, Comenius University, Martin, Slovak Republic.
Methods:
We included 67 patients, and they were retrospectively divided into group of controls (n=36), and studied group (n=31) according to pH in umbilical artery (UA) <7.15. Acid-base parameters were assessed with Rapidlab 248, Bayer Healthcare LLC, East Walpole, USA. We determined criterion for metabolic acidosis (MAC) as pH UA <7.15, resp. base deficit (BD) UA >12 mmol/l. Postpartal lactate concentration in umbilical vein (UV) and UA was determined with lactatemeter Accutrend Lactate, Roche Diagnostics, Switzerland. Quantitative assessment of fetal human protein S100B was provided with ELISA (Sangtec 100 ELISA, DiaSorin Inc., Stillwater, Minnesota, USA). Fetal erythropoietin concentration in UV was examined with immunoenzymatic assessment Access EPO (Beckman Coulter, Inc., Fullerton, CA, USA). Statistics: histograms, Kolmogorov-Smirnov test, Mann-Whitney test, Spearman’s rho; statistical significance: p<0.05, Receiver Operating Characteristic curves, Area Under the Curve.
Results:
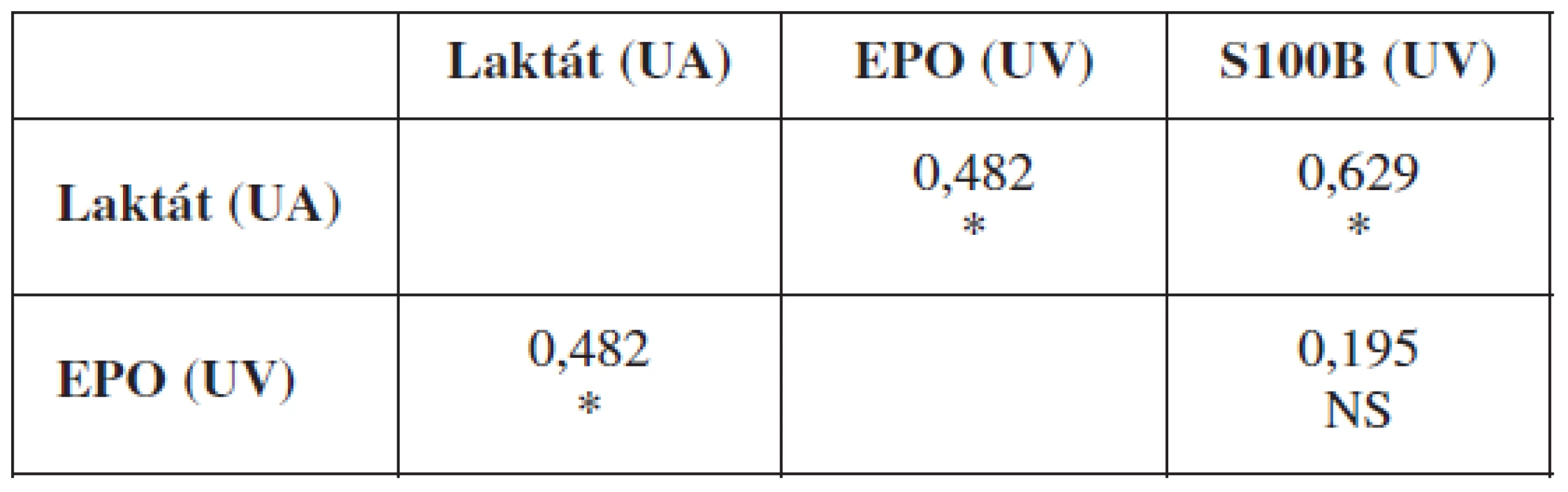
The best correlation was between fetal acid-base parameters and lactate in UA (p<0.0005). Significant correlation was between EPO in UV, and protein S100B in UV (p<0.05). EPO in UV significantly correlated with lactate in UA (p<0.05). Correlation between EPO in UV and protein S100B was not significant. According to ROC curves in prediction of fetal hypoxia, we found an excellent accuracy (AUC>0.9) for lactate in UA, good accuracy (AUC>0.7) had EPO in UV. Results for protein S100B were not significant. The highest sensitivity had EPO in UV, while the highest specificity has had lactate in UA.
Conclusion:
An indisputable evidence of labor management quality is the fetal metabolic status. On the basis of our results, the suitable clinical markers are lactate and EPO, in addition to acid-base parameters.
Key words:
fetal hypoxia, acid-base, lactate, erythropoietin, protein S100B.
Authors:
K. Biringer 1; J. Danko 1; K. Dókuš 1; K. Maťašová 2; M. Zibolen 2; R. Pullmann 3
Authors‘ workplace:
Gynekologicko-pôrodnícka klinika JLF UK a UNM, Martin, prednosta prof. MUDr. J. Danko, CSc.
1; Neonatologická klinika JLF UK a UNM, Martin, prednosta prof. MUDr. M. Zibolen, CSc.
2; Ústav klinickej biochémie JLF UK a UNM, Martin, prednosta prof. MUDr. RNDr. R. Pullmann, PhD.
3
Published in:
Ceska Gynekol 2011; 76(4): 285-291
Overview
Cieľ štúdie:
Posúdenie validity biochemických diagnostických metód hypoxie plodu.
Typ štúdie:
Case-control štúdia.
Názov a sídlo pracoviska:
Gynekologicko-pôrodnícka klinika, Jesseniova lekárska fakulta, Univerzita Komenského, Martin.
Metodika:
Do štúdie sme zaradili 67 rodičiek a retrospektívne sme ich rozdelili na základe pH v umbilikálnej artérii (UA) <7,15 na dve skupiny: kontrolnú (n=36) a sledovanú (n=31). Vyšetrenie parametrov acidobázy sme realizovali prístrojom Rapidlab 248, Bayer Healthcare LLC, East Walpole, USA. Za kritérium metabolickej acidózy (MAC) sme si stanovili pH v UA <7,15, resp. deficit báz (BD) v UA >12 mmol/l. Koncentráciu laktátu z umbilikálnej vény (UV) a UA post partum sme stanovili laktátmetrom Accutrend Lactate, Roche Diagnostics, Švajčiarsko. Kvantitatívne stanovenie fetálneho humánneho sérového proteínu S100B sme vykonali ELISA metodikou (Sangtec 100 ELISA, DiaSorin Inc., Stillwater, Minnesota, USA). Stanovenie koncentrácie fetálneho EPO v sére z UV bolo realizované imunoenzymatickým vyšetrením Access EPO (Beckman Coulter, Inc., Fullerton, CA, USA). Štatistika: histogramy, Kolmogorov-Smirnovov test, Mannov-Whitneyov test, neparametrický Spearmanov korelačný koeficient; hranica štatistickej významnosti: p<0,05, Receiver Operating Characteristic, AUC – Area Under the Curve.
Výsledky:
S acidobázou plodu signifikantne najlepšie korelovala koncentrácia laktátu v UA (p<0,0005). Signifikantný vzťah k acidobáze sme zaznamenali aj pri EPO v UV a proteíne S100B v UV (p<0,05). EPO koreloval aj s laktátom (p<0,05). Vzájomná korelácia EPO v UV a proteínu S100B nebola signifikantná. Porovnaním ROC kriviek v predikci fetálnej hypoxie sme zistili, že výbornú presnosť (AUC>0,9) má koncentrácia laktátu v UA, dobrú presnosť (AUC>0,7) má EPO v UV. Výsledky pre proteín S100B neboli štatisticky signifikantné. Najvyššiu senzitivitu vyšetrenia dosiahol EPO v UV, kým špecificita bola najvyššia pri laktáte v UA.
Záver:
Nespochybniteľným dôkazom kvality manažmentu pôrodu je metabolický stav plodu. Vhodnými klinickými markermi sa na základe našich výsledkov javia okrem parametrov acidobázy aj laktát a EPO.
Kľúčové slová:
fetálna hypoxia, acidobáza, laktát, erytropoetín, proteín S100B.
Úvod
Hlavným nedostatkom súčasných diagnostických metodík fetálnej hypoxie je ich limitovaná validita, ktorá je na jednej strane spojená s falošnou negativitou, a teda možným poškodením plodu, na druhej strane falošná pozitivita vedie k nadbytočnej operačnej intervencii. Aj keď naďalej je zlatým štandardom biochemickej diagnostiky intrauterinného stavu plodu vyšetrenie acidobázických parametrov, klinické a vedecké úsilie vedie k hľadaniu nových, valídnejších biochemických markerov eliminujúcich postihnutie plodu hypoxicko-ischemickým inzultom, predikujúcich postihnutie centrálnych orgánov ešte vo fáze pred ich ireverzibilným defektom. V súčasnosti existuje celý rad študovaných parametrov. V našej štúdii sme sa zamerali najmä na pH, deficit báz (BD), laktát, fetálny erytropoetín (EPO) a proteín S100B.
Súbor a metodika
Vyšetrenie laboratórnych markerov fetálnej hypoxie prebiehalo na Gynekologicko-pôrodníckej klinike Jesseniovej lekárskej fakulty Univerzity Komenského a Univerzitnej nemocnice v Martine (JLF UK) od januára 2004 do júla 2007 po schválení Etickou komisiou JLF UK. Do štúdie sme po uplatnení vstupných a vylučovacích kritérií zaradili 67 rodičiek. Vstupné kritériá: podpísaný písomný informovaný súhlas rodičky, ukončený 36. týždeň jednoplodovej gravidity, pozdĺžna poloha živého plodu, naliehanie hlavičkou, začiatok kontinuálneho kardiotokografického (CTG) monitorovania stavu plodu minimálne 20 min. pred začiatkom druhej pôrodnej doby. Vylučovacie kritériá: preterminálny vstupný kardiotokografický záznam (CTG) alebo mŕtvy plod, primárna indikácia k cisárskemu rezu, odmietnutie vyšetrení počas pôrodu, život ohrozujúce stavy rodičky, antenatálne zistená vrodená vývinová chyba plodu, závažné systémové ochorenia rodičky.
Vedenie pôrodu: Pri fyziologickom CTG zázname boli pôrody ukončené vaginálnou cestou. Rozhodnutie o operačnom ukončení pôrodu z indikácie matky, ako aj plodu spočívalo na indikujúcom lekárovi. Indikácia o operačnom ukončení pôrodu z dôvodu hroziacej hypoxie plodu bola založená najmä na charaktere CTG. Operačné ukončenie pôrodu bolo vykonané do 20 min. od ukončenia monitorovania plodu. Klinické vyšetrenie novorodenca a stanovenie Apgarovej skóre v 1., 5. a 10. minúte života vykonával ošetrujúci neonatológ.
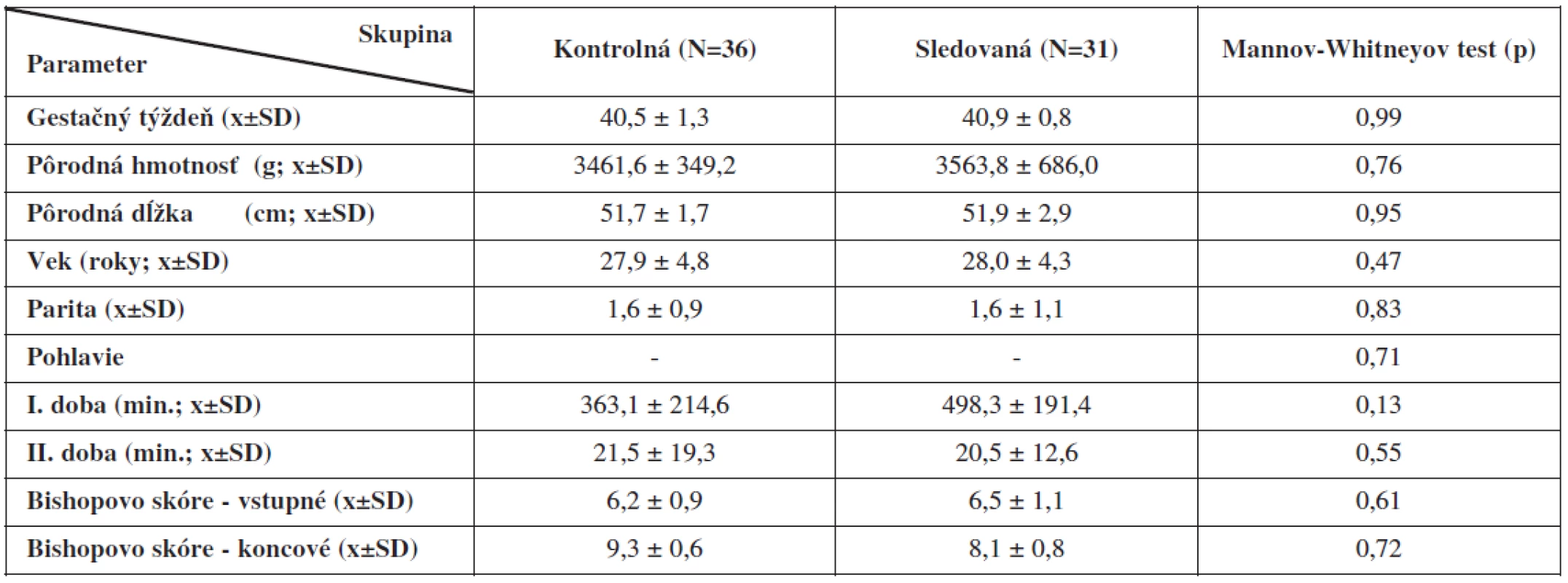
Pre zhodnotenie validity jednotlivých vyšetrovacích metodík sme pacientky retrospektívne rozdelili na základe pH v umbilikálnej artérii <7,15 na dve skupiny: kontrolnú (n=36) a sledovanú (n=31). Sledovali sme tieto parametre: gestačný týždeň, pôrodnú hmotnosť, dĺžku a pohlavie novorodenca; vek a paritu rodičky; dĺžku prvej a druhej pôrodnej doby, vaginálny nález podľa Bishopovho skóre na začiatku a konci snímania; Apgarovej skóre v 1., 5. a 10. minúte života.
Odber umbilikálnej krvi na stanovenie laboratórnych parametrov sme vykonali z umbilikálnej artérie (UA) a umbilikálnej vény (UV) ihneď po dvojitom zaklemovaní a odstrihnutí asi 15 cm dlhého segmentu pupočníka po pôrode plodu, ešte pred jeho prvým nádychom. Venóznu krv sme odobrali do úplného kolapsu UV, aby sme predišli možnosti arteficiálneho miešania venóznej a arteriálnej krvi. Následne sme vykonali punkciu UA. Pre vyšetrenie acidobázických parametrov sme arteriálnu a venóznu krv odoberali do heparinizovaných kapilár. Tie boli okamžite uložené do nádoby s ľadom a transportované do laboratória (Ústav klinickej biochémie JLF UK). Stanovenie prebehlo do 20 min. od pôrodu plodu. Arteriálna a venózna krv na stanovenie koncentrácií laktátu bola odoberaná do štandardných sterilných skúmaviek. Pre analýzu koncentrácií proteínu S100B a EPO sme používali zrazenú venóznu krv. Celkový objem odobratej arteriálnej krvi bol asi 5 ml a venóznej minimálne 15 ml (resp. do kolapsu UV). Vyšetrenie parametrov acidobázy sme realizovali pomocou prístroja Rapidlab 248, Bayer Healthcare LLC, East Walpole, USA. Za kritérium metabolickej acidózy (MAC) sme stanovili pH v UA <7,15, resp. BD v UA ≥12 mmol/l. Koncentráciu laktátu z UV a UA post partum sme stanovili z kvapky celej krvi (20–25 μl) pomocou laktátmetra Accutrend Lactate, Roche Diagnostics, Švajčiarsko. Princíp merania spočíva v enzymatickej detekcii a reflekčnej fotometrii pri 660 nm. Kvantitatívne stanovenie hladín fetálneho humánneho sérového proteínu S100B sme vykonali pomocou dvojstrannej, jednokrokovej ELISA metodiky (Sangtec 100 ELISA, DiaSorin Inc., Stillwater, Minnesota, USA). Umbilikálnu venóznu krv sme zbierali do sterilných skúmaviek bez obsahu EDTA alebo citrátu sodného. Nechali sme ju zrážať pri izbovej teplote po dobu 20–30 min., následne sme ju do 2 hodín od odberu centrifugovali počas 10 min. pri 800–1000 otáčkach za min. Získané sérum sme uskladnili pri teplote -20 °C. Pred samotnou analýzou boli reagenty, ako aj vzorky rozmrazené pri izbovej teplote (20–25 °C) počas 20 min. za opakovaného premiešavania. Po štandardnej kalibrácii pomocou bovinného antigénu S-100 sme k 50 μl séra pridali 150 μl indikátora (myšacia monoklonálna protilátka anti-S-100B konjugovaná s tzv. chrenovou peroxidázou (HRP), bovinným sérovým albumínom (BSA) a 0,5% ProClin 300). Zmes sme inkubovali 2 hodiny pri izbovej teplote, potom 3krát premyli 300 μl tzv. wash bufferu (fosfátový fyziologický roztok, PBS). Po pridaní 100 μl 0,05% 3,3’,5,5’tetrametylbenzidínu (TMB) sme pokračovali v inkubácii pri izbovej teplote asi 15 min. Reakciu sme ukončili pridaním 100 μl 0,4 N kyseliny sírnej. Absorband sme odčítali pri 450 nm. Na kalkuláciu sme použili tzv. Cubic Spline algoritmus. Hraničná (cut-off) hodnota analýzy bola 1,5 μg/l (95. percentil). Detekčný limit metodiky je 0,03 μg/l, limit procedúry vyjadrený tzv. high-dose hook efektom je stanovený na 3000 μg/l. Stanovenie koncentrácie fetálneho EPO v sére z UV bolo realizované tzv. sendvičovým imunoenzymatickým vyšetrením Access EPO (Beckman Coulter, Inc., Fullerton, CA, USA) s použitím monoklonálnej protilátky proti EPO, blokujúceho reagentu, konjugátu alkalickej fosfatázy a chemiluminiscenčného substrátu Lumi-Phos* 530. Limit metodiky je 0,6–750 mIU/ml. Limit tzv. hook efektu je 30 000 mIU/ml.
Štatistické hodnotenie získaných výsledkov sme vykonali pomocou programu R (R Foundation for Statistical Computing, Viedeň, Rakúsko). Získané výsledky, ako aj porovnávané skupiny pacientok sme podrobili analýze normality distribúcie hodnôt pomocou histogramov a Kolmogorovho-Smirnovovho testu. Keďže väčšina premenných nepodliehala normálnej distribúcii hodnôt, nasledujúca analýza bola dominantne postavená na neparametrických štatistických metódach. Na porovnanie demografických ukazovateľov skupín sme použili Mannov-Whitneyov test. Korelácie laboratórnych diagnostických metodík sme hodnotili pomocou neparametrického Spearmanovho korelačného koeficientu. Hranicou štatistickej významnosti rozdielov (α) bola hodnota p<0,05. Senzitivitu a špecificitu použitých vyšetrení sme analyzovali pomocou ROC kriviek (Receiver Operating Characteristic). Presnosť diagnostiky sme potom hodnotili pomocou tzv. plochy pod krivkou (AUC – Area Under the Curve). Pritom presnosť diagnostiky bola pri AUC > 0,5 nedostatočná, pri AUC > 0,6 dostatočná, pri AUC > 0,7 dobrá, pri AUC > 0,8 uspokojivá a pri AUC > 0,9 výborná.
Výsledky
U pacientok, ktoré boli zaradené do štúdie (n=67) sme pH v UA <7,15 diagnostikovali v 31 prípadoch, pH v UA <7,10 v 4 prípadoch a pH v UA < 7,05 v 1 prípade. Ani u jedného plodu sme nezistili závažnú MAC s pH v UA <7,00. Preto sme pre vzájomné porovnanie diagnostických metód rodičky rozdelili do kontrolnej (n=36) a sledovanej (n=31) skupiny na základe pH v UA < 7,15.
Demografické parametre skupín
Štatistickým porovnaním demografických ukazovateľov kontrolnej a sledovanej skupiny rodičiek sme nezistili signifikantné rozdiely v dĺžke gestácie, vo veku rodičiek, ich parite, v pôrodnej hmotnosti, dĺžke a pohlaví narodených detí. Dĺžka trvania prvej a druhej pôrodnej doby sa medzi skupinami štatisticky nelíšila, aj keď v sledovanej skupine nachádzame tendenciu k dlhšiemu trvaniu prvej pôrodnej doby. Nesignifikantné rozdiely sme našli pri hodnotení vstupného a koncového Bishopovho skóre (tab. 1).
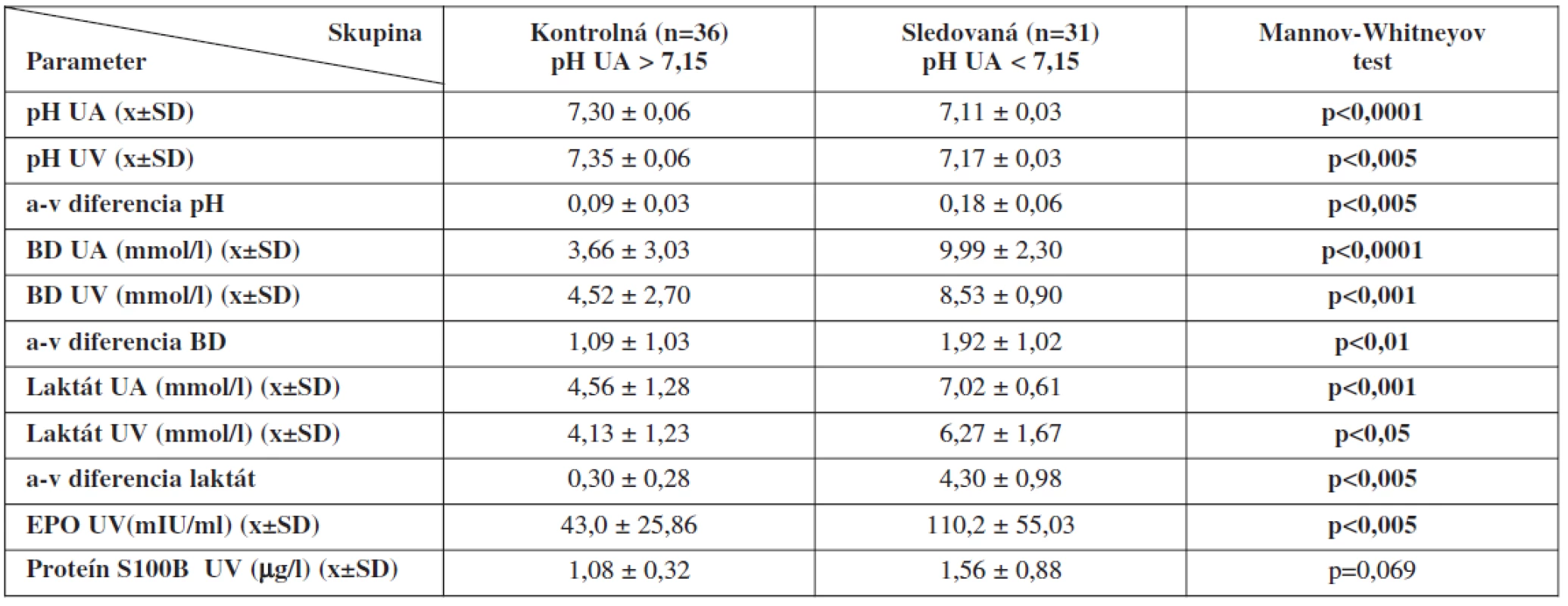
V skupinách sme porovnali rozdiely hodnôt laboratórnych markerov v UA (pH, BD, laktát) a v UV (pH, BD, laktát, EPO, proteín S100B). Signifikantné rozdiely sme našli pri pH, BD, laktáte a EPO (tab. 2).
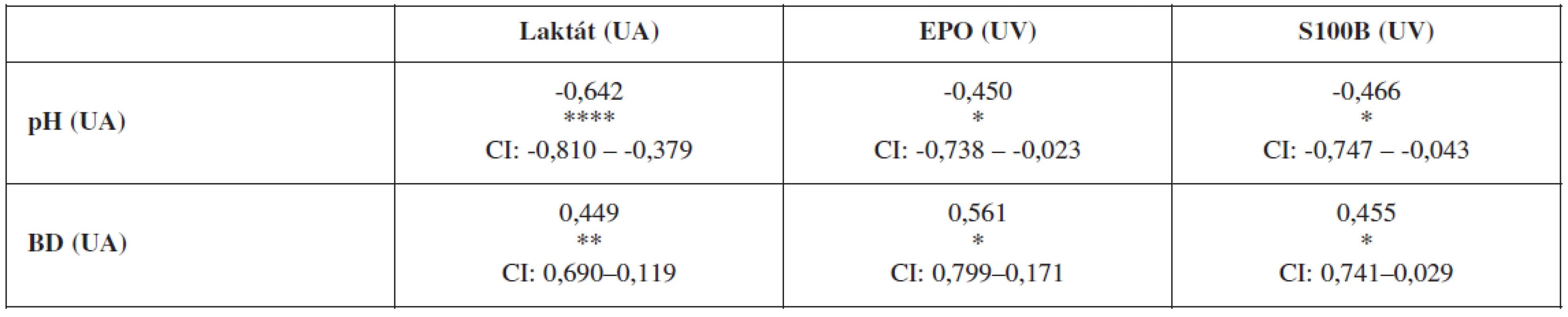
Laboratórny dôkaz hypoxie plodu sa môže opierať o viacero ukazovateľov. Nami sledovanými markermi boli: acidobáza a krvné plyny, koncentrácie laktátu, EPO a proteínu S100B v umbilikálnej krvi tesne po pôrode plodu. Zlatým štandardom aj naďalej v klinickej praxi zostávajú acidobázické parametre v podobe pH a BD, voči ktorým sa obvykle korelujú ostatné laboratórne ukazovatele. V nasledujúcom prehľade uvádzame koreláciu koncentrácie laktátu z krvi UA a hladín EPO a proteínu S100B z krvi UV voči pH a BD z UA a vzájomné korelácie hladín laktátu, EPO a S100B (tab. 3 a 4).
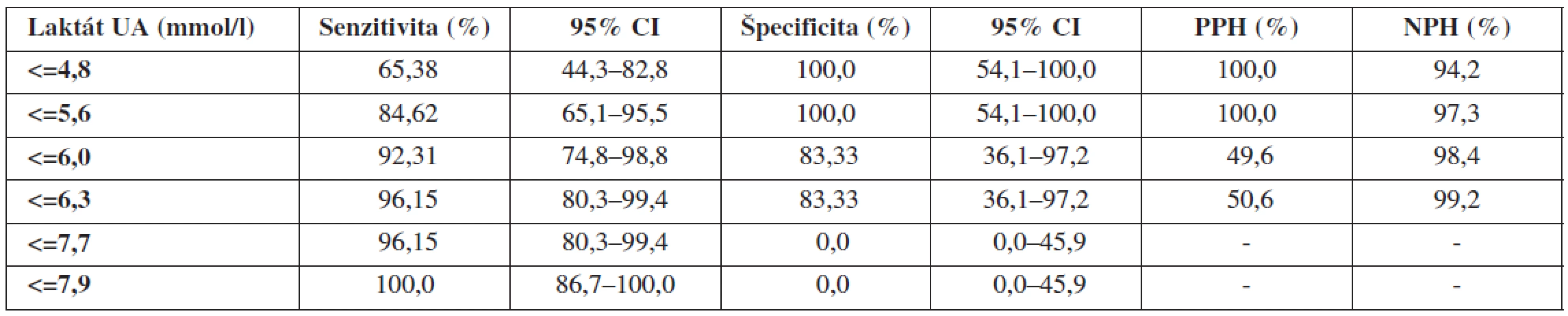
Na obrázkoch 1–3 a v tabuľkách 5–7 uvádzame senzitivitu, špecificitu, pozitívnu prediktívnu hodnotu (PPH) a negatívnu prediktívnu hodnotu (NPH) pre všetky použité diagnostické metódy hypoxie plodu.
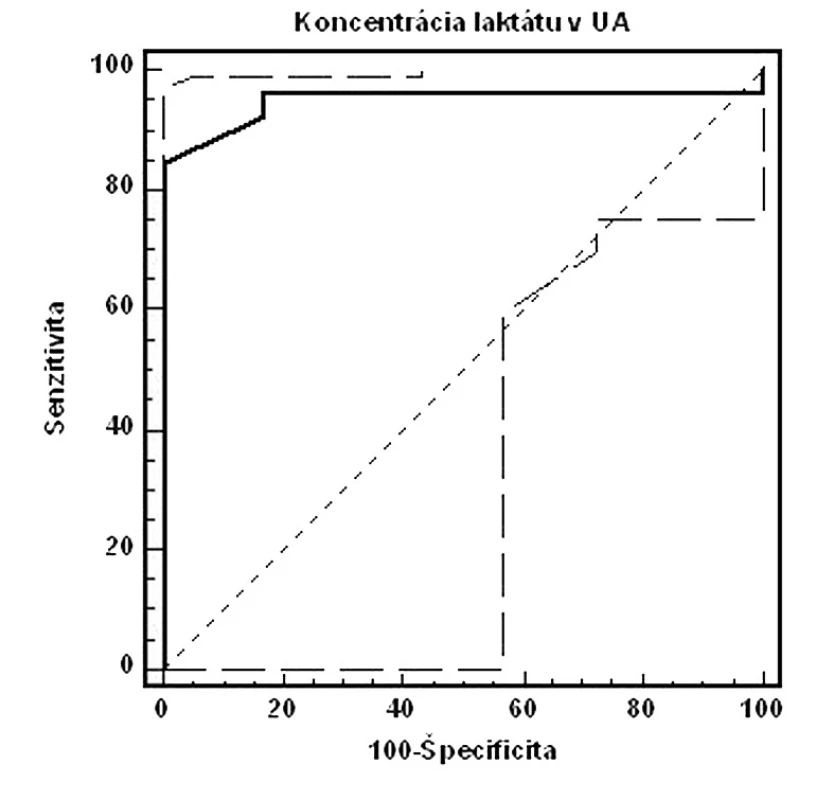
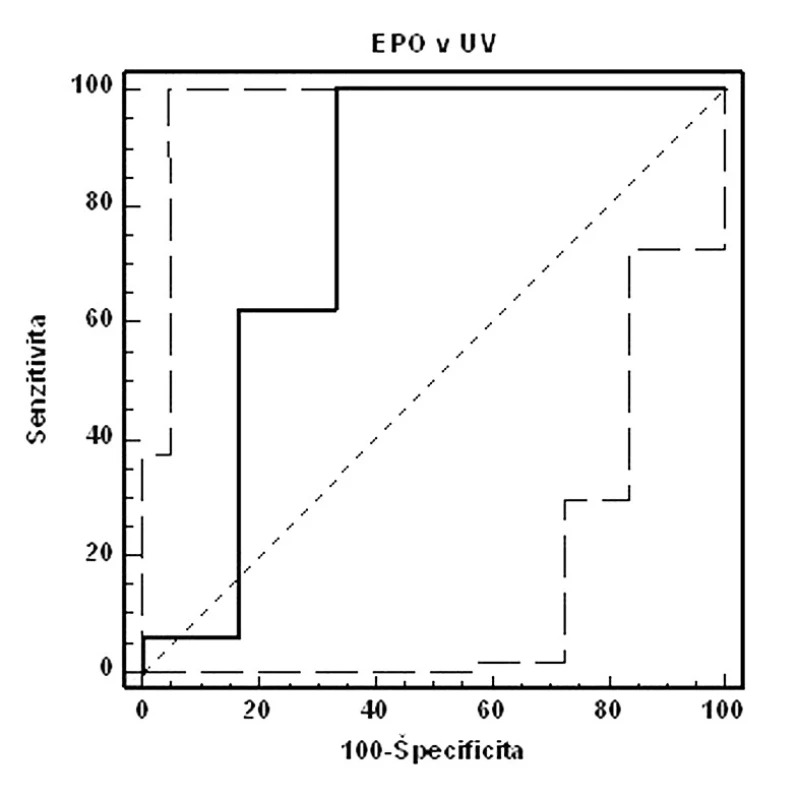
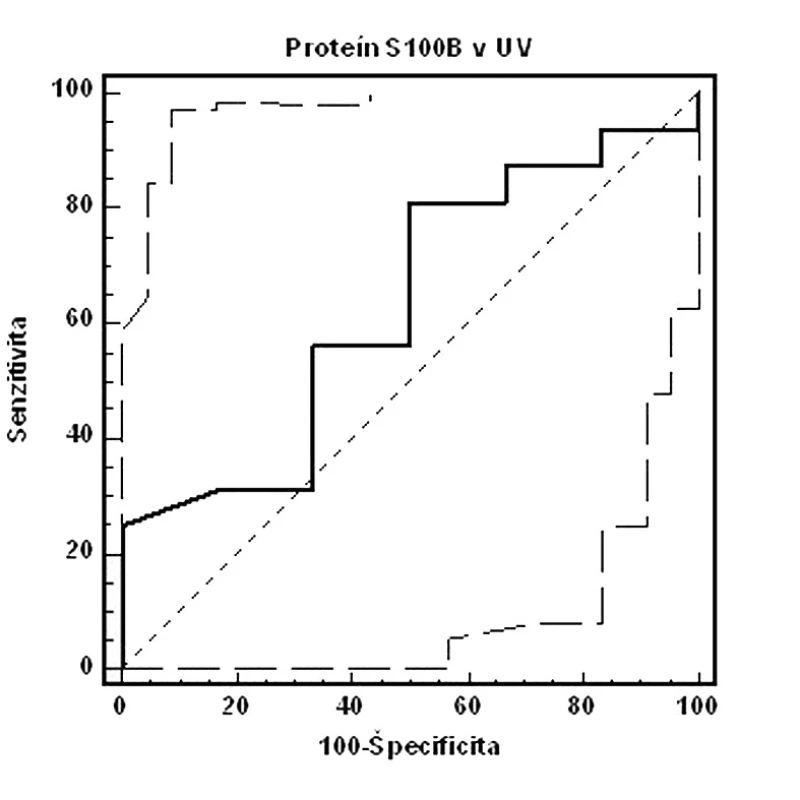
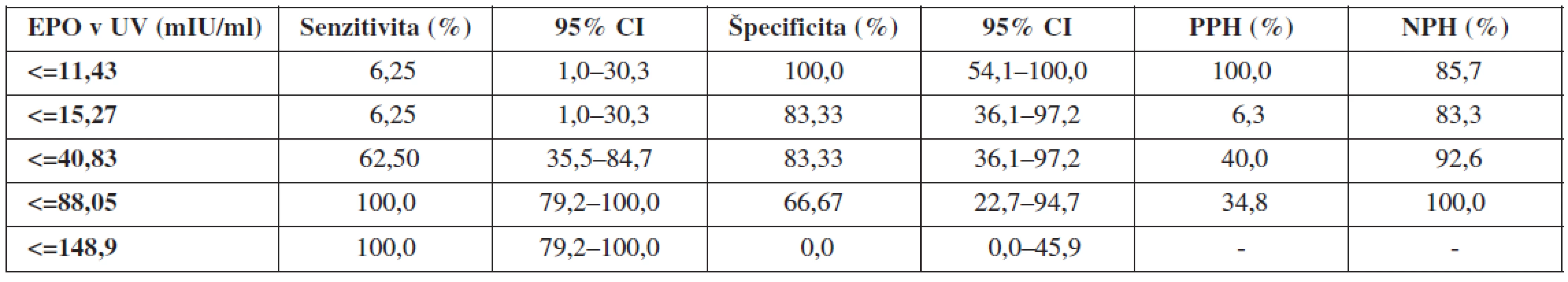
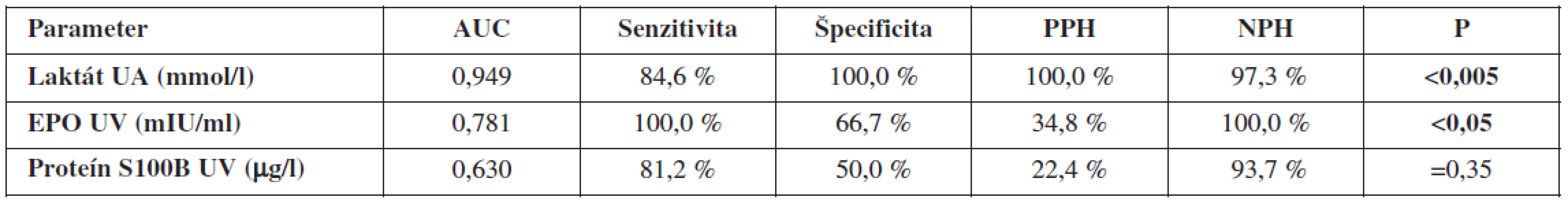
Porovnaním ROC kriviek jednotlivých diagnostických prístupov pri cut-off hodnote pH v UA < 7,15 sme zistili, že výbornú presnosť (AUC >0,9) má koncentrácia laktátu v UA, dobrú presnosť (AUC >0,7) má EPO v UV. Výsledky pre proteín S100B neboli štatisticky signifikantné. Najvyššiu senzitivitu vyšetrenia dosiahli EPO v UV, kým špecificita bola najvyššia pri koncentráciách laktátu v UA (tab. 7).
Diskusia
Napriek závažnosti problematiky a množstvu uskutočnených štúdií neexistuje dodnes jednoznačne stanovená hranica MAC na základe vyšetrenia acidobázických parametrov z UA. Neustále prebieha diskusia o hraničných hodnotách pre umbilikálne arteriálne pH a BD. Do úvahy pripadajú pre pH hodnoty 7,00 až 7,20 a pre BD hodnoty 12 mmol/l až 16 mmol/l [1, 11, 17, 20]. Vzhľadom na veľkosť nami sledovaných skupín rodičiek a žiaden, resp. nízky počet plodov s pH v UA < 7,00, resp. < 7,10 sme za kritérium fetálneho distresu zvolili pH v UA < 7,15. Toto kritérium nie je tak benevolentné v diagnostike fetálneho distresu ako nižšie stanovené hraničné hodnoty, avšak jeho nedostatkom je, že hodnoty pH sú ľahko ovplyvniteľné respiračnou zložkou acidémie. Aj takto možno vysvetliť to, že v sledovanej skupine rodičiek pri pH v UA <7,15 nedošlo ani v jednom prípade k neurologickému deficitu novorodenca.
Porovnaním rozdielov laboratórnych (acidobáza, laktát, EPO, proteín S100B) metodík diagnostiky stavu plodu in utero sme zistili, že medzi kontrolnou a sledovanou skupinou pri cut-off hodnote pH v UA < 7,15 nastali štatisticky najväčšie rozdiely pri umbilikálnom arteriálnom pH, BD a koncentráciách laktátu. Signifikantný rozdiel sme zaznamenali aj v prípade EPO z UV. Rozdiely nenastali pri koncentráciách proteínu S100B.
Koreláciu acidobázických parametrov a umbilikálnej koncentrácie laktátu potvrdzujú Borruto a spol. [3]. Autori prospektívne sledovali 188 pôrodov, pričom potvrdili aj dobrú koreláciu koncentrácií skalpového a umbilikálneho laktátu. V ďalšej štúdii zároveň uvádzajú, že hodnoty laktátu a pH sú najlepšími parametrami pre odlíšenie normálnych a asfyktických novorodencov [4]. Dobrú koreláciu medzi acidobázou a koncentráciou laktátu u 763 novorodencov uvádzajú aj Martin a spol. [12].
Pri akútnej stredne ťažkej až ťažkej hypoxii plodu dochádza v intervale 2–3 hodín k elevácii koncentrácií fetálneho EPO [9, 23]. EPO je zároveň vhodným markerom odlíšenia akútnej a chronickej fetálnej hypoxie [6]. Naša práca potvrdila tieto literárne údaje, keď v sledovanej skupine došlo k signifikantnému vzostupu EPO v UV.
Vzhľadom na to, že ani u jedného plodu sme nezaznamenali priebeh ťažkej MAC, sa dá predpokladať, že nedošlo ani k závažnému hypoxicko-ischemickému inzultu a teda k poškodeniu CNS plodu. Koncentrácie proteínu S100B v UV sa preto medzi nami uvedenými skupinami pôrodov signifikantne neodlišovali. Hypoxicko-ischemické poškodenie ako predpoklad elevácie proteínu S100B uvádzajú aj Murabayashi a spol. [13]. U normálnych novorodencov boli pritom koncentrácie S100B v deň pôrodu v intervale 1,61–3,37 μg/l. Nami sledované plody mali koncentráciu S100B v intervale 0,57–2,08 μg/l (kontrolná skupina), resp. 0,93–2,81 μg/l (sledovaná skupina), čo dokazuje, že žiaden plod nebol vystavený závažnému hypoxicko-ischemickému inzultu. K rovnakým záverom dospeli aj Nagdyman a spol. [15]. V ďalšej štúdii potvrdzujú, že koncentrácie S100B v deň pôrodu majú iba limitovanú schopnosť predikcie poškodenia CNS spôsobeného perinatálnou asfyxiou [14].
Všetky sledované diagnostické markery hypoxie (laktát, EPO, proteín S100B) sme porovnávali so zaužívaným štandardom hodnotenia nových klinických parametrov hypoxie – s acidobázickými ukazovateľmi v UA. Tie totiž priamo odzrkadľujú metabolický stav plodu. Naše výsledky potvrdili výbornú negatívnu koreláciu umbilikálnej arteriálnej koncentrácie laktátu a umbilikálneho arteriálneho pH (p<0,0005) a BD (p<0,05). Vzájomná previazanosť acidobázy a koncentrácie laktátu je nesporným faktom. Ako bolo zistené, pre zmenu pH je potrebný vyšší vzostup koncentrácie laktátu oproti pCO2, či koncentrácii H+. To predurčuje laktát pre presnejšiu predikciu MAC než pCO2 alebo H+, ktoré reprezentujú respiračnú zložku acidémie, ľahko odbúrateľnú prvým nádychom novorodenca [18]. Podľa Branda a spol. [5] je medzi umbilikálnym laktátom a pH z UA signifikantná súvislosť (r<0,001). K podobným výsledkom (p<0,001) v štúdii so 188 pôrodmi dospeli aj Borruto a spol. [3]. Niektorí autori sa dokonca domnievajú, že laktát je lepším prediktorom MAC než pH [7]. Laktát môže takto slúžiť ako veľmi spoľahlivý ukazovateľ MAC plodu [4].
Koncentrácie fetálneho EPO v UV u nami sledovaných pacientok signifikantne nepriamo úmerne korelovali tak s pH v UA (p<0,05), ako aj s BD v UA (p<0,05). Koncentrácie EPO sa zvyšujú už samotným vaginálnym pôrodom, čo by mohlo predstavovať istý adaptačný mechanizmus plodu. Pritom pri elektívnom cisárskom reze nedochádza k tak výraznému zvýšeniu sekrécie EPO ako pri vaginálnom pôrode [22]. Nami zistenú nepriamu koreláciu umbilikálneho pH a EPO potvrdzujú i Teramo a spol. [21] a Jazayeri a spol. [8].
Výsledky korelácie umbilikálnych koncentrácií proteínu S100B v UV s pH v UA a BD v UA boli skôr na hranici signifikantnosti (p=0,03, resp. p=0,04). Ako sme už uviedli, vzhľadom na to, že ani u jedného plodu sme nezaznamenali priebeh ťažkej MAC, sa dá predpokladať, že nedošlo ani k závažnému hypoxicko-ischemickému inzultu, teda k poškodeniu CNS plodu, a preto neexistoval dôvod pre eleváciu proteínu S100B. Predpokladom takéhoto vzostupu je totiž vznik hypoxicko-ischemického poškodenia CNS plodu [13].
Validitu vyšetrenia umbilikálneho laktátu hodnotíme na základe našich výsledkov za výbornú (AUC >0,9). Metodika má 84,6% senzitivitu, 100,0% špecificitu, 100,0% PPH a 97,3% NPH. Najvyššia validita vyšetrenia bola pri koncentrácii laktátu v UA=5,6 mmol/l. Vychádzajúc z biochemických poznatkov, laktát predstavuje priamy metabolit vznikajúci počas anaeróbnych podmienok. Jeho uvoľňovanie nie je podmienené deštrukciou celulárnych alebo subcelulárnych štruktúr, či priamou hormonálnou reguláciou. Koncentrácia laktátu v cirkulácii preto priamo odzrkadľuje metabolický status plodu. Z tohto pohľadu nie je udivujúce, že viacerí autori potvrdzujú výbornú koreláciu laktátu s acidobázickými parametrami.
Podľa Branda a spol. [5] je medzi umbilikálnym laktátom a pH z UA signifikantná súvislosť (p<0,001). Niektorí autori sa dokonca domnievajú, že laktát je lepším prediktorom MAC než pH alebo BD [7]. Z hľadiska predikcie nízkeho Apgarovej skóre je senzitivita a špecificita laktátu signifikantne vyššia než stanovením pH (laktát: 58 % a 76 %, pH: 30 % a 73 %) [7, 10, 16]. V predikcii stredne závažnej a závažnej HIE má laktát vyššiu senzitivitu a špecificitu ako pH (laktát: 67 % a 76 %, pH 50 % a 73 %) [10]. Odporúčané cut-off hodnoty závisia od použitej analytickej metodiky a pohybujú sa od 4,2 mmol/l po 5,0 mmol/l [2, 5]. V našom súbore sme koncentráciu umbilikálneho arteriálneho laktátu stanovovali pomocou prístroja Accutrend Lactate (Roche Diagnostics, Švajčiarsko) a najvyššiu validitu vyšetrenia sme dosahovali pri hladine laktátu na úrovni 5,6 mmol/l.
Ďalším hodnoteným hypoxickým markerom bola koncentrácia fetálneho EPO v UV. Validita vyšetrenia bola dobrá (AUC >0,7), senzitivita 100,0 %, špecificita 66,7 %, PPH 34,8 % a NPH 100,0 %. Hraničnou hladinou predikcie pH UA <7,15 sa pri nami používanej metodike stanovenia javí koncentrácia EPO v UV=88,05 mIU/ml. Naše výsledky sú mierne odlišné od záverov Fahnensticha a spol. [6], ktorý udáva predikciu MAC pri koncentrácii EPO=50 mIU/ml v UV so senzitivitou 75 % a špecificitou 90 %.
Vyhodnotenie validity fetálneho proteínu S100B v UV bolo v našom súbore nesignifikantné. Senzitivita dosahovala 81,2 %, špecificita 50,0 %, PPH 22,4 % a NPH 93,7 %. Vysvetlenie týchto výsledkov možno postaviť na kinetike hladín proteínu S100B. K vzostupu dochádza po závažnom inzulte CNS [13], ktorý sme v našom súbore plodov nezaregistrovali, a ako bolo navyše preukázané, hladiny S100B v deň pôrodu nekorelujú so stavom novorodenca, elevácia nastáva s istou latenciou [14]. Švédski autori zaregistrovali signifikantnú eleváciu hladiny proteínu S100B pri pH v UA ≤7,05, resp. pri preterminálnom CTG alebo STAN zázname, z čoho vyvodzujú súvislosť medzi koncentráciami proteínu S100B, MAC, patologickým charakterom CTG a analýzy ST segmentu fetálneho elektrokardiogramu [19].
Záver
Z klinického, ako aj z forenzného hľadiska je nespochybniteľným dôkazom kvality manažmentu pôrodu metabolický stav plodu potvrdený postnatálnym rozborom metabolických parametrov z umbilikálnych ciev. Preto je nevyhnutné získať čo najviac parametrov kvantifikujúcich závažnosť prípadnej intrauterinnej hypoxie plodu. Vhodnými klinickými markermi sa na základe našich výsledkov javia okrem parametrov acidobázy aj laktát a EPO.
Poďakovanie
Táto práca bola podporená projektom “Dobudovanie Centra excelentnosti pre perinatologický výskum (CEPV II)”, ITMS: 26220120036, ktorý je spolufinancovaný zo zdrojov EÚ.
Doc. MUDr. Kamil Biringer, PhD.
Gynekologicko-pôrodnícka klinika
JLF UK a UNM
Kollárova 2
036 01 Martin
Slovensko
e-mail: biringer@jfmed.uniba.sk
Sources
1. ACOG Committee Opinion No. 348. Umbilical cord blood gas and acid-base analysis. Obstet Gynecol, 2006, 108, 5, p. 1319-1322.
2. Allen, RM., Bowling, FG., Oats, JJN. Determining the fetal scalp lactate level that indicates the need for intervention in labour. Aust N Z J Obstet Gyneacol, 2004, 44, 6, p. 549-552.
3. Borruto, F., Comparetto, C., Treisser, A. Prevention of cerebral palsy during labour: role of foetal lactate. Arch Gynecol Obstet, 2008, 278, 1, p. 17-22.
4. Borruto, F., Comparetto, C., Wegher, E., et al. Screening of foetal distress by assessment of umbilical cord lactate. Clin Exp Obstet Gynecol, 2006, 33, 4, p. 219-222.
5. Brand, F., Vayssiere, C., Liegeois, P., et al. Measurement of scalp blood lactate for evaluation of fetal wellbeing during labor. J Mat Fet Neonat Med, 2004, 16, suppl. 1, p. 39.
6. Fahnenstich, H., Dame, C., Allera, A., et al. Erythropoietin as a biochemical parameter for fetal hypoxia. Klin Pediatr, 1995, 207, 6, p. 326-330.
7. Gjerris, AC., Staer-Jensen, J., JŅrgensen, JS., et al. Umbilical cord blood lactate: A valuable tool in the assessment of fetal metabolic acidosis. Eur J Obstet Gynecol Reprod Biol, 2008, 139, 1, p. 16-20.
8. Jazayeri, A., Politz, L., Tsibris, JC., et al. Fetal erythropoietin levels in pregnancies complicated by meconium passage: does meconium suggest fetal hypoxia? Am J Obstet Gynecol, 2000, 183, 1, p. 188-190.
9. Kakuya, F., Shirai, M., Takase, M. et al. Effect of hypoxia on amniotic fluid erythropoietin levels in fetal rats. Biol Neonate, 1997, 72, 2, p. 118-124.
10. Krűger, K., Hallberg, B., Blennow, M., et al. Predictive value of fetal scalp blood lactate concentration and pH as marker for neurologic disability. Am J Obstet Gynecol, 1999, 181, 5Pt1, p. 1072-1078.
11. Kűhnert, M., Schmidt, S. Intrapartum management of nonreassuring fetal heart rate patterns: A randomized controlled trial of fetal pulse oximetry. Am J Obstet Gynecol, 2004, 191, 6, p. 1989-1995.
12. Martin, A., Gaillard, M., Miot, S., et al. Lactate measurements and acid-base balance in cord blood. J Gynecol Obstet Biol Reprod (Paris), 2003, 32, 8Pt1, p. 713-719.
13. Murabayashi, M., Minato, M., Okuhata, Y., et al. Kinetics of serum S100B in newborns with intracranial lesions. Pediatr Int, 2008, 50, 1, p. 17-22.
14. Nagdyman, N., Grimmer, I., Scholz, T., et al. Predictive value of brain specific proteins in serum for neurodevelopmental outcome after birth asphyxia. Pediatr Res, 2003, 54, 2, p. 270-275.
15. Nagdyman, N., Kömen, W., Ko, HK., et al. Early biochemical indicators of hypoxic–ischemic encephalopathy after birth asphyxia. Pediatr Res, 2001, 49, 4, p. 502-506.
16. Nordström, L., Achanna, S., Naka, K., et al. Lactate increase in mother and fetus during the second stage of labour. BJOG, 2001, 108, 3, p. 263-268.
17. Roemer, VM., Beyer, B. Outcome measures in perinatal medicine - pH or BE. The thresholds of these parameters in term infants. Z Geburtshilfe Neonatol, 2008, 212, 4, p. 136-146.
18. Rosén, KG., Amer-Wahlin, I., Luzietti, R., et al. Fetal ECG waveform analysis. Best Pract Res Clin Obstet Gynaecol, 2004, 18, 3, p. 485-514.
19. Stuart, A., Edvinsson, L., Källen, K., et al. Fetal electrocardiographic monitoring during labor in relation to cord blood levels of the brain-injury marker protein S-100. J Perinat Med, 2008, 36, 2, p. 136-141.
20. Sundström, AK., Rosén, D., Rosén, KG. Fetal surveillance. Goteborg: Neoventa Medical AB, 2000, p. 25-30.
21. Teramo, K., Kari, MA., Eronen, M., et al. High amniotic fluid erythropoietin levels are associated with an increased frequency of fetal and neonatal morbidity in type 1 diabetic pregnancies. Diabetology, 2004, 47, 10, p.1 695-1703.
22. Thorkelsson, T., Bjarnason, AO., Hardardottir, H., et al. The effects of normal vaginal delivery on oxygen transport to the fetus. Laeknabladid, 2008, 94, 9, p. 583-588.
23. Widness, JA., Teramo, KA., Clemons, GK., et al. Temporal response of immunoreactive erythropoietin to acute hypoxemia in fetal sheep. Pediatr Res, 1986, 20, 1, p. 15-19.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2011 Issue 4
Most read in this issue
- Trikuspidální regurgitace u plodu
- Aplikace metody SNP array v prenatální diagnostice
- Transabdominální ultrazvukové vyšetření v gynekologii
- Současná klasifikace zhoubných nádorů v onkogynekologii – část I

