Současná klasifikace zhoubných nádorů v onkogynekologii – část II
Current classification of malignant tumours in gynecological oncology – part II
Objective:
Review of new staging systems for gynaecological cancers and their impact on prognosis and planning treatment.
Design:
Review article.
Setting:
Department of Gynaecology and Obstetrics, First Faculty of Medicine and University Hospital Na Bulovce, Charles University, Prague; Department of Radiotherapeutic Oncology, First Faculty of Medicine and University Hospital Na Bulovce, Charles University, Prague; Department of Pathology, University Hospital Na Bulovce, Prague.
Results:
Every staging system should have 3 basic characteristics: it must be valid, reliable, and practical. Over the years, these staging classifications - with the exception of cervical cancer and gestational trophoblastic neoplasia - have shifted from a clinical to a surgical-pathological basis. Changes based on new findings were proposed in 2008 by the FIGO Committee on Gynecologic Oncology, approved in September 2008 by the FIGO Executive Board, and published in 2009. The greatest changes were made in the new staging system for carcinoma of the vulva and others in the new staging systems for carcinoma of the cervix and carcinoma of the endometrium. A new stanging system was also created for uterina sarcomas, based on the criteria used in other soft tissue sarcomas. A clinical staging system for carcinoma of cervix continues because surgical staging cannot be employed worldwide (especially in third world countries). Stage 0 has been deleted from the staging of all tumours, since it is pre-invasive lesion and it is not an invasive tumour. In the revised staging system for carcinoma of the endometrium, four fundamental changes have occurred, which will be discussed. Carcinosarcoma is still staged identically to carcinoma of the endometrium. A completely new staging system was created for adenosarcomas, along with an almost identical staging system for leiomyosarcoma and endometrial stromal sarcoma. The staging system for carcinoma of ovary and Fallopian tube remains without changes.
Conclusion:
Since medical research and practice in the field of oncology have shown explosive growth, the staging of some of the gynaecological cancers did not give a good spread of prognostic groupings. Therefore, revised FIGO and TNM staging system has been structured to represent major prognostic factors in predicting patients’ outcomes and lending order to the complex dynamic behavior of gynaecological cancers. The purpose of good staging system is to offer a classification of the extent of gynaecological cancer in order to provide a method of conveying one’s clinical experience to others for the comparison of treatment methods.
Key words:
staging, gynaecological oncology, FIGO, TNM.
:
B. Sehnal 1; D. Driák 1
; E. Kmoníčková 2; M. Dvorská 1; M. Hósová 3; K. Citterbart 1; M. Halaška 1; D. Kolařík 1
:
Gynekologicko-porodnická klinika, 1. LF UK a FN Na Bulovce, Praha, přednosta prof. MUDr. M. Halaška, DrSc.
1; Ústav radiační onkologie, 1. LF UK a FN Na Bulovce, Praha, přednostka prof. MUDr. J. Abrahámová, DrSc.
2; Patologicko-anatomické oddělení, 1. LF UK a FN Na Bulovce, Praha, primářka MUDr. K. Benková
3
:
Ceska Gynekol 2011; 76(5): 360-366
Cíl studie:
Přehled nového stagingu u gynekologických karcinomů a jeho vliv na prognózu a plánování léčby.
Typ studie:
Souhrnný přehled.
Název a sídlo pracoviště:
Gynekologicko-porodnická klinika, 1. LF UK a FN Na Bulovce, Praha; Ústav radiační onkologie, 1. LF UK a FN Na Bulovce, Praha; Patologicko-anatomické oddělení, FN Na Bulovce, Praha.
Metodika a výsledky:
Každý stagingový systém by měl mít 3 základní charakteristiky – měl by být odůvodněný (na základě poznatků evidence-based medicine), solidní (důvěryhodný) a praktický (snadno uplatnitelný v praxi). Během let se tyto stagingové systémy upravovaly a s výjimkou cervikálního karcinomu a trofoblastické nemoci se přesunuly z klinické na chirurgickou (patologicko-anatomickou) základnu. Na základě nových poznatků byly výborem FIGO (FIGO Committee on Gynecologic Oncology) v roce 2008 navrženy a následně FIGO Executive Board v září 2008 odsouhlaseny některé změny, které byly publikovány v roce 2009. Největší změny byly provedeny u karcinomu vulvy, další u karcinomu děložního hrdla a karcinomu endometria, nově byl vypracován stagingový systém pro sarkomy dělohy založený na pravidlech platných pro sarkomy jiných měkkých tkání.
U karcinomu děložního hrdla zůstal stagingový systém založen na klinickém vyšetření, protože chirurgický staging lymfatických uzlin nemůže být uplatňován celosvětově (zvláště v rozvojových zemích). Stadium 0 bylo zrušeno u všech tumorů, protože jde o prekancerózu a nikoliv o invazivní nádor. U přepracovaného stagingového sytému karcinomu endometria nastaly čtyři zásadní změny. Karcinosarkom je klasifikován stejně jako karcinom endometria. Zcela nově byl vytvořen stagingový systém pro adenosarkom a téměř identický pro endometriální stromální sarkom a leiomyosarkom. Stagingový systém pro karcinom ovaria a tuby zůstal beze změny.
Závěr:
Vzhledem k tomu, že lékařský výzkum a zkušenost na poli onkologie se ubírá prudce vpřed, klasifikace některých gynekologických malignit nezahrnovala správné rozřazení do skupin se stejnou prognózou. Proto přepracovaný FIGO a TNM stagingový systém je strukturován tak, aby zahrnul hlavní prognostické faktory vyjadřující prognózu pacienta a vyjádřil ucelenou povahu chování gynekologických karcinomů. Účelem dobrého stagingového systému je poskytnout klasifikaci šíření zhoubného nádoru vycházející z klinické zkušenosti, aby bylo možno srovnat účinnost léčby.
Klíčová slova:
staging, onkogynekologie, FIGO, TNM.
PŘEPRACOVANÝ STAGING PRO KARCINOM ENDOMETRIA
Histologicky jsou nejčastějšími maligními nádory těla děložního karcinomy endometria, incidence karcinomu endometria se v ČR dlouhodobě ročně pohybuje kolem 30 případů na 100 tisíc žen a rok. Téměř 75 % pacientek je diagnostikováno ve stadiu I [7].
Zcela první stagingový systém byl čistě klinický, a protože poměrně dosti pacientek bylo vyššího věku, byla vytvořena subkategorie pro pacientky, které nemohly být operovány z anesteziologicko-interních důvodů. V roce 1971 byla navržena nová klasifikace používající klinický staging v souvislosti s prognostickým faktorem udávajícím grading tumoru. V 70. a na začátku 80. let několik prací zhodnotilo šíření karcinomu endometria do pánevních a paraaortálních lymfatických uzlin. Přestože tato data se postupně shromažďovala již od 50. let, až v 80. letech se postižení lymfatických uzlin začalo vztahovat ke stadiu nemoci. Studie, které proběhly na souborech několika set pacientek, zjistily, že až u 25 % pacientek, které byly zařazeny do stadia I, se tumor šířil mimo děložní tělo. Postižení lymfatických uzlin bylo tím častější, čím měl tumor vyšší grading a čím hlubší měl invazi do myometria.
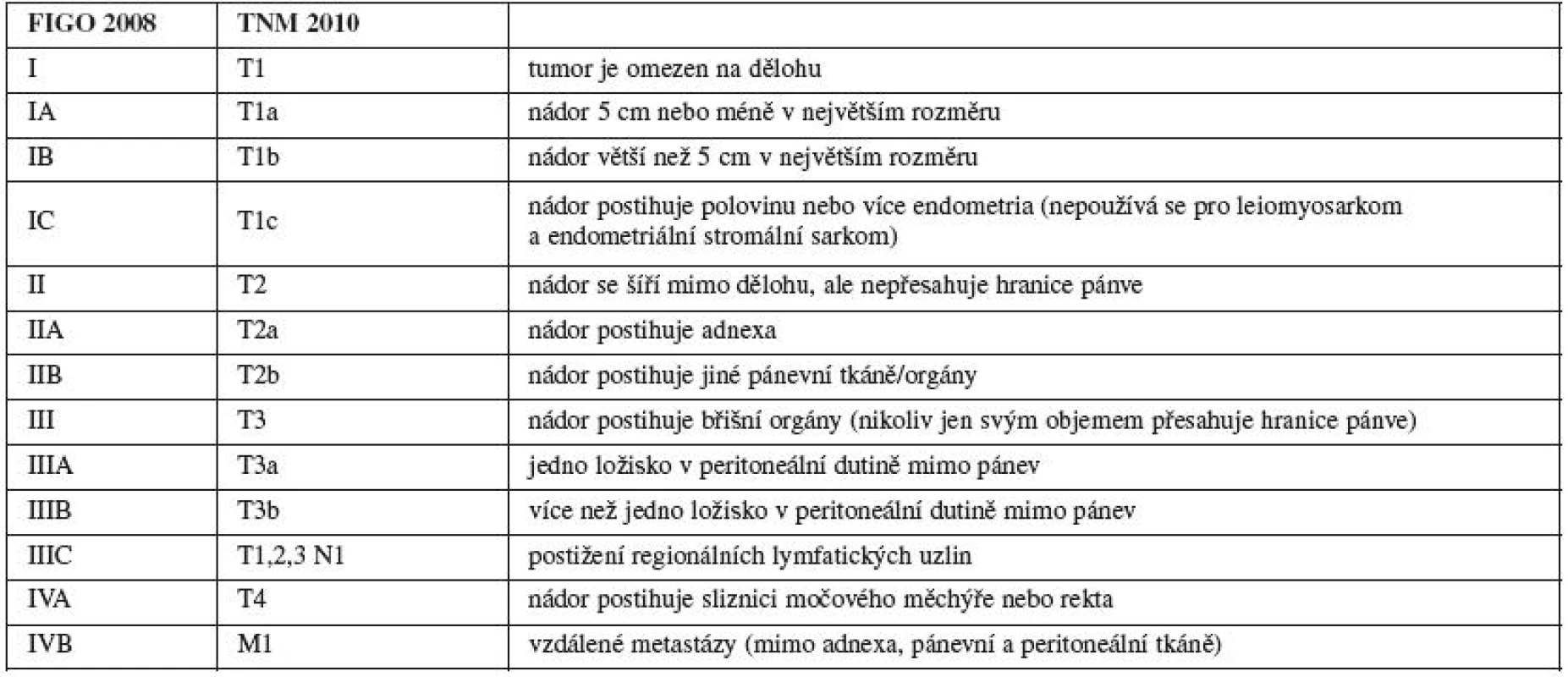
Jako výsledek těchto studií v roce 1988 Výbor FIGO pro onkogynekologii (FIGO Committee on Gynecologic Oncology) rozhodl, že staging karcinomu endometria bude čistě chirurgický (patologickoanatomický). Ačkoli studie GOG hodnotily invazi do myometria ve čtyřech stupních (bez invaze, do 1/3, do 2/3, více než 2/3), Výbor FIGO pro onkogynekologii rozhodl rozdělit stadium I na tři stupně (IA bez invaze, IB invaze do jedné poloviny, IC invaze více než do poloviny). Pro metastázy do lymfatických uzlin bylo určeno stadium IIIC. Staging se tedy změnil významně a tento chirurgický staging se poměrně brzy rutinně rozšířil celosvětově. Následující studie, které již používaly tento typ stagingu, referovaly o pětiletém přežívání 93,4 % u stadia IA G1, 91,6 % pro stadium IB G1, 91,3 % u stadia IA G2, a 93,4 % pro stadium IB G2 [9]. Tyto výsledky, které nejsou signifikantně významné, vedly výbor k myšlence, že některá tato stadia se mohou sloučit. Tyto domněnky vyústily k revizi stagingu karcinomu endometria přijatého v roce 1988.
V nově vytvořeném stagingu pro karcinom endometria se stadium IA a IB spojilo do stadia IA (invaze max. do 1/2 myometria), nově stadium IB odpovídá dřívějšímu stadiu IC, které nyní zaniklo. Invaze do glandulárních buněk děložního hrdla je dnes považována za stadium I, proto stadium II (invaze do stromatu děložního hrdla) zůstává bez dalších substadií. Pozitivní cytologie laváže z peritoneální dutiny se uvádí samostatně a již není součástí stagingu. Vzhledem k tomu, že při postižení suprapelvických lymfatických uzlin je prognóza signifikantně horší než při postižení jen uzlin pánevních, bylo stadium IIIC rozčleněno na stadium IIIC1 pro postižení pánevních lymfatických uzlin a na stadium IIIC2 pro postižení suprapánevních lymfatických uzlin. Změny ve stagingu karcinomu endometria byly přijaty FIGO v roce 2008 a poté následovaly obdobné změny i v TNM systému (tab. 1). Přestože změny u stagingu karcinomu endometria jsou nejmenší, jsou mimořádně významné. Změny vychází z dat poskytnutých FIGO za posledních 20 let a byly potvrzeny dalšími publikacemi. Nová klasifikace zpracovaná pod vedením dr. Williama Creasmana lépe definuje prognózu a riziko jednotlivých stadií [9].
PŘEPRACOVANÝ STAGING KARCINOMU DĚLOŽNÍHO HRDLA
Incidence karcinomu děložního hrdla dlouhodobě patří v ČR mezi nejvyšší v Evropě, ročně se diagnostikuje kolem 20 případů na 100 tisíc žen. Záchyt onemocnění ve stadiu I osciluje v posledních letech kolem 40 % všech případů, ročně na toto onemocnění umírá téměř 400 žen [7].
Staging karcinomu děložního hrdla prošel ve svém vývoji 8 revizemi, poslední v roce 2008. Prakticky všechny změny se týkaly stadia I [10] a jeho rozdělení do dalších substadií včetně kritéria Společnosti onkogynekologů (Society of Gynecologic Oncologists’) definující mikroinvazi hloubkou 3 mm [43]. Změny v poslední revizi postihly stadium II [34]. Komentář ke změnám ve stagingu karcinomu děložního hrdla připravili dr. Franco Odicino a prof. Sergio Pecorelli.
Velmi diskutovanou otázkou po mnoho let jsou výhody a nevýhody chirurgického versus klinického stagingu. Při postižení lymfatických uzlin se prognóza onemocnění výrazně zhoršuje, zvláště u časnějších stadií [2, 4, 14, 22, 39]. Klinický staging je méně přesný než chirurgický, i když přesnost zobrazovacích metod se neustále zlepšuje [1, 19, 20, 29]. Navzdory pokroku v zobrazovacích technikách a přes výsledky studií pojednávajících o invazivním postižení lymfatických uzlin, Výbor FIGO pro onkogynekologii se rozhodl nezařadit automaticky chirurgické posouzení lymfatických uzlin do stagingu [4, 15, 16, 24, 30, 42]. Karcinom děložního hrdla je ve většině zemí diagnostikován až při šíření v pánvi a z toho vychází i staging FIGO. Chirurgický staging nemůže být uplatněn plošně, zvláště v ekonomicky nerozvinutých zemích, kde je nádor častěji diagnostikován v pokročilejších stadiích a kde možnosti chirurgické léčby jsou omezené. Výbor FIGO zcela podporuje použití zobrazovacích technik pro zhodnocení šíření a velikosti postižení. Použití zobrazovacích metod k posouzení velikosti primárního tumoru je doporučeno, ale není povinné. Nicméně ze studií vyplývá, že pokud se provede staging chirurgický, většinou je diagnostikováno vyšší stadium než při stagingu klinickém [30]. Srovnání mezi klinickým stagingem FIGO a chirurgickým stagingem TNM u pacientů léčených zkušenými onkochirurgy ukazuje nepřesnost klinického vyšetření převážně u pacientů ve stadiích IB2, IIA a IIB [5, 31, 32].
Pokud je tumor řešitelný chirurgicky, je vhodný staging chirurgický. Posouzení velikosti primárního tumoru je obtížné u lokálně pokročilých tumorů, u pozdějších stadií a u pacientek, pro které není vhodné primární chirurgické řešení. Tato skupina pacientek tvoří převážnou většinu pacientek diagnostikovaných s karcinomem děložního hrdla v rozvojových zemích. Výbor FIGO pro onkogynekologii souhlasí s některými nespornými výhodami chirurgického stagingu, ale pro výše uvedené argumenty zůstává karcinom děložního hrdla klinicky klasifikovaným onemocněním. Diskuse o stagingu nemoci, která může být léčena se stejnou efektivitou jinými než chirurgickými přístupy, stále pokračuje s neutuchající intenzitou [33].
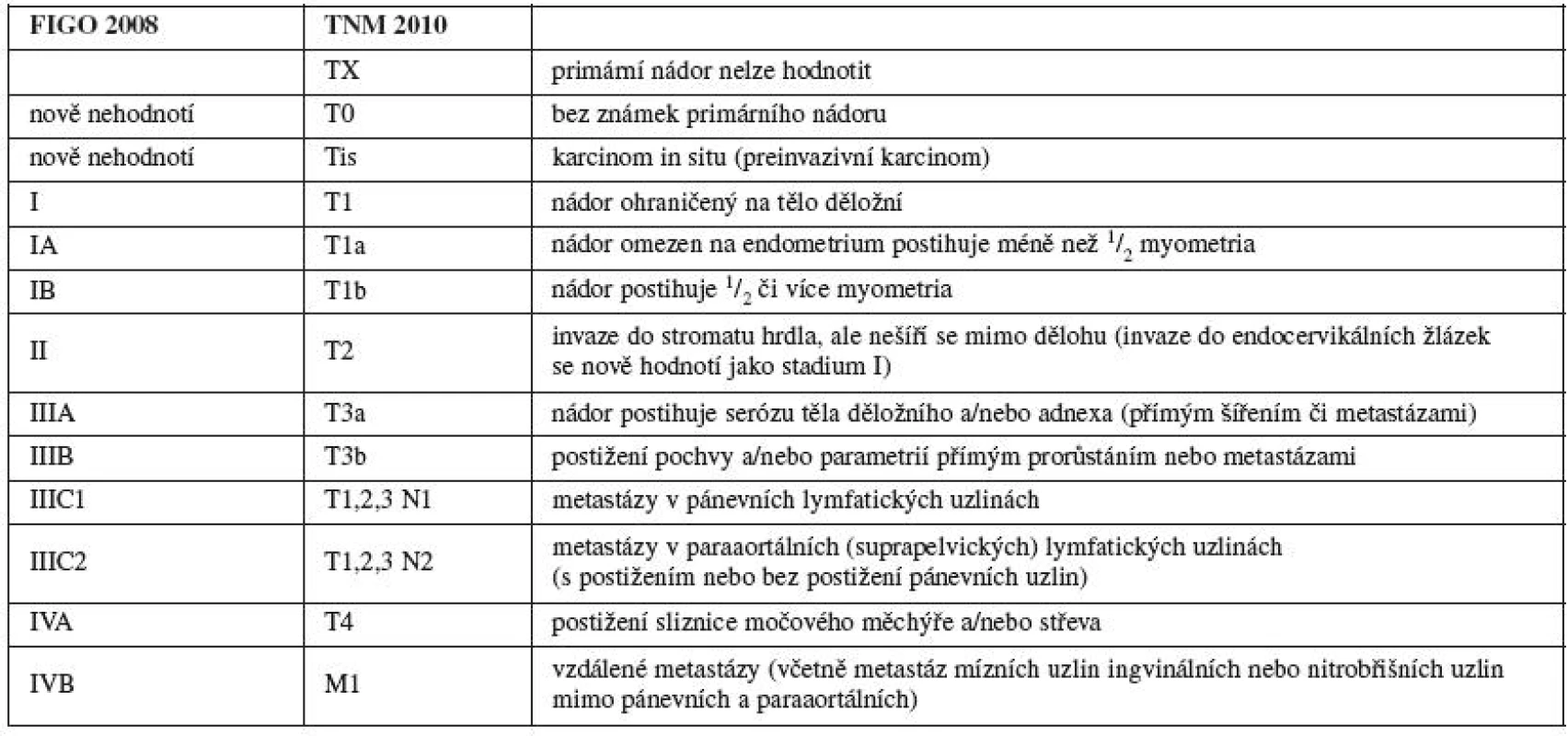
Jako u ostatních nádorů se FIGO rozhodla zrušit stadium 0, protože jde o preinvazivní lézi. Časná (minimální) stromální invaze by měla být hodnocena jako stadium IA1. Při provedení 50–100 řezů konizátu pro CIN III se v některých případech najdou mikročepy invaze přecházející bazální membránu. Tato mikroinvaze nemusí být diagnostikována při provedení 10–15 řezů, což je obvyklý standard. Pacientky jsou léčeny konizací nebo neradikální hysterektomií, což nevadí, protože provedení konizace u mikroinvaze má stejná výstupní prognostická data. Tyto velmi malé léze – patologicky hodnoceny jako časná stromální invaze (ESI – early stromal invasion) – reprezentují přibližně 80 % případů stadia IA1 a mají tendenci zkreslovat prognostická data tohoto stadia [6]. Rozhodnutí nepřepracovávat stadium IA, zvláště stadium IA1, vychází z obtížnosti dosažení a interpretace relevantních patologických nálezů v různě vyvinutých zemích světa. Další podstatný problém spočívá v definici multifokality, jak ji měřit a jak kombinovat a sčítat nálezy z různých míst děložního hrdla.
Několik prací v literatuře a údaje analyzované z oficiálního časopisu FIGO Annual Report opakovaně ukazují, že stejně veliké tumory ve stadiu IIA a ve stadiu IB1 mají podobnou prognózu [11, 18, 22, 32, 35, 37]. Proto definice stadia IIA byla rozdělena na další – IIA1 (největší rozměr tumoru je menší nebo roven 4 cm s infiltrací méně než horních dvou třetin pochvy) a IIA2 (největší rozměr tumoru je větší než 4 cm s infiltrací méně než horních dvou třetin pochvy). To je rozdíl oproti stadiu IIB, protože v literatuře nejsou dostupná data podporující podobnou rozměrovou definici tohoto substadia. Rozhodnutí nedělit substadia IIB a IIIB podle postižení jednoho nebo obou parametrií je mimo jiné založeno na faktu, že léčba je v obou případech identická a toto dělení by nemělo vliv na management léčby onemocnění. Přítomnost lymfovaskulární invaze (LVSI-lymphovascular space invasion) nebyla do stagingu cervikálního karcinomu zahrnuta, ale přítomnost LVSI by měla být v histolopatologickém popisu nádoru uvedena.
Mikroinvaze a invazivní adenokarcinom by měly být klasifikovány jako dlaždicobuněčný karcinom děložního hrdla. U stadia IA by hloubka invaze neměla být více než 5 mm od báze epitelu (povrchového či žlázového), ze kterého vznikla. Hloubka invaze se definuje jako vzdálenost od epitelo-stromální junkce přilehlé, nejpovrchověji uložené epiteliální papily k nejhlubšímu místu invaze nádoru. Hloubka invaze by měla být uváděna v mm. Každá makroskopicky detekovatelná léze (i s minimální invazí) by měla být hodnocena jako stadium IB (T1b). Šíření do paraaortálních lymfatických uzlin se hodnotí jako M1 (FIGO IVB). Karcinom pochvy, který se objeví déle než za 5 let po léčbě cervikálního karcinomu s kompletní remisí, je třeba diagnostikovat jako primární vaginální karcinom a nikoli jako recidivu cervikálního karcinomu. Ačkoliv staging karcinomu děložního hrdla prošel v minulosti důkladnou revizí, diskuse je stále otevřená a nejvíce se točí kolem problému, zda karcinom děložního hrdla klasifikovat na základě vyšetření klinického, nebo patologickoanatomického (chirurgického). Nový FIGO staging karcinomu hrdla platí od roku 2009 a nový TNM systém od roku 2010 (tab. 2).
PŘEPRACOVANÝ STAGING PRO SARKOMY DĚLOHY
Sarkomy (z řeckého sarcos = maso) jsou maligní tumory mezenchymálního původu. Děložní sarkomy jsou vzácné tumory, které tvoří přibližně 1 % ženských malignit a 3–7 % děložních zhoubných tumorů [28]. V roce 2003 bylo v ČR diagnostikováno 51 děložních sarkomů, tj. 1 případ na 100 tisíc žen a rok [7]. Představují kontroverzní kapitolu hlavně s ohledem na jejich histogenezi, klasifikaci a chování. Ačkoliv agresivní růst většiny typů je velmi dobře prostudován, jejich vzácný výskyt, histopatologická různorodost a odlišná biologická povaha způsobuje, že se doposud nepodařilo nalézt shodu v přesné definici rizikových faktorů a definovat optimální terapii [13]. Vzhledem k raritě těchto nádorů pro ně neexistoval specifický stagingový systém, FIGO dosud používal modifikovaný systém pro karcinom endometria z roku 1988, přestože oba nádory jsou zcela rozdílné. Nyní byl pro děložní sarkomy vytvořen zcela nový staging FIGO, který lépe odráží jejich zvláštní biologické chování.
Základní rozdělení děložních sarkomů je podle místa původu: stromální sarkomy z endometria (15-25 %) a leiomyosarkomy z myometria a cév (30-40 %). Kromě čistých forem se vyskytují i nádory smíšené, které obsahují také epiteliální elementy – karcinosarkomy (30 40 %) a přesněji neurčené nediferencované sarkomy (5-15 % případů).
Karcinosarkom, nazývaný též maligní smíšený mülleriánský nádor (MMMT – malignant mixed mullerian tumor), je bifázický tumor složený ze zřetelně oddělených maligních epiteliálních a mezenchymálních struktur s incidencí 0,82 na 100 tisíc žen a rok. Maligní epiteliální komponenta se může jevit glandulární, skvamózní nebo vzhledu nediferencovaného karcinomu. Sarkomatózní komponenta je buď homologní (leiomyosarkom, stromální sarkom, nediferencovaný sarkom), nebo heterologní s ložisky rabdomyosarkomu, chondrosarkomu, osteosarkomu a/nebo liposarkomu. Ženy s karcinosarkomy mají mnoho společných charakteristik s populací pacientek s karcinomem endometria. V současné době byl karcinosarkom reklasifikován na dediferencovanou nebo metaplastickou formu endometriálního adenokarcinomu, přestože se tento tumor chová výrazně agresivněji než běžný endometriální karcinom. Pod tímto názvem je zařazen do klasifikace nemocí WHO z roku 2003 [40] a je takto uveden i v Blausteinově Patologii ženského pohlavního traktu [27]. Nejdůležitějším prognostickým faktorem u karcinosarkomu je chirurgické stadium onemocnění, hlavně extrauterinní šíření a hloubka invaze. Lymfovaskulární invaze je spojena se signifikantně vyšší pravděpodobností metastázování. V GOG studii (n=301) bylo multivariační analýzou prokázáno jako signifikantní prognostický faktor postižení adnex, postižení lymfatických uzlin, histologický typ (heterologní vs. homologní) a grade. Proto stagingový systém pro karcinosarkom zůstává identický se stagingovým systémem pro karcinom endometria.
Vzácný mülleriánský adenosarkom má lepší prognózu než karcinosarkom. Je to smíšený tumor nízkého maligního potenciálu se složkou benigního žlázového epitelu a nízce diferencovaného sarkomu, obvykle stromálního typu [8]. Heterologní mezenchymální součásti obvykle složky rabdomyosarkomu, se zjišťují v 10–15 % případů. Typicky se stroma soustřeďuje kolem žlázek a tvoří periglandulární manžety. Mülleriánské adenosarkomy s velkým objemem sarkomatózní složky a s myometriální invazí recidivují ve 25–30 % případů během 5 let od stanovení diagnózy, nejčastěji v pochvě nebo v pánvi [8]. Velký objem sarkomatózní složky (čistý sarkom bez žlázové komponenty) znamená postižení minimálně 25 % objemu nádoru a vyskytuje se u 8–54 % děložních adenosarkomů [8]. Invaze do myometria je nalezena přibližně v 15 % případů, hluboká invaze se objevuje jen v 5 % [8].
Děložní tumory charakterizované podle WHO dediferenciací buněk hladké svaloviny jsou diagnostikovány jako leiomyosarkomy. Jejich diagnostika je založena na přítomnosti dvou ze tří následujících charakteristik: střední až výrazná jaderná atypie, mitotický index je větší nebo roven 10 mitózám (MFs) na 10 zorných polí (high-power-fields HPFs); a/nebo přítomností nekrózy buněk [3, 40]. Ve většině případů se diagnostikuje retrospektivně po hysterektomii pro myom [7]. Typicky tvoří solitární nádory, které tvoří intramurální nádorovou masu, svým vzhledem připomínající rybí maso. Jejich velikost se pohybuje v průměru okolo 8 cm. Metastázy v lymfatických uzlinách byly nalezeny v 6,6 % a v 11 % ve dvou souborech pacientek s leiomyosarkomem, které podstoupily lymfadenektomii [13, 24]. V prvním souboru bylo pětileté přežití 26 % u pacientek s pozitivními lymfatickými uzlinami ve srovnání s pětiletým přežitím 64,2 % u pacientek bez pozitivních uzlin [24].
Někdy jsou histologické rysy nedostatečné k hodnocení malignity či benignity, v případech s hraničním mikroskopickým kritériem malignity se používá označení tumor z hladké svaloviny nejasného maligního potenciálu (STUMP – smooth muscle tumor of uncertain malignant potential) [3, 40]. Jejich léčba je stejná jako u leiomyomů, ale na rozdíl od nich je doporučována přísnější dispenzarizace.
Endometriální stromální sarkomy jsou složeny z buněk, které se podobají stromálním buňkám, ale které invadují do myometria a často do jeho vaskulárních štěrbin [40]. Jsou klasifikovány jako neinvazivní (endometriální stromální uzel) a invazivní (nízko diferencované endometriální stromální sarkomy). Klasicky jsou endometriální stromální sarkomy děleny v závislosti na počtu mitóz na low-grade (LGSS) a high-grade subkategorii (HGSS).
LGSS jsou pomalu rostoucí nádory s tendencí ke vzniku pozdních recidiv s dlouhým disease-free intervalem. Vykazují jen střední atypie buněk, nekróza buněk je vzácná. LGSS jsou málo aktivní nádory s velmi dobrou prognózou dlouhodobého přežití bez ohledu na recidivy a metastázy [21].
HGSS je charakteristický nedostatečnou dediferenciací hladké svaloviny nebo endometriálního stromatu, vykazuje invazi do myometria, těžké buněčné pleiomorfismy, vysokou mitotickou aktivitu (více než 10 mitóz na deset zorných polí) a nekrózy buněk. Histologický vzhled tohoto nádoru je více podobný mezenchymálním elementům karcinosarkomu než typickému endometriálnímu stromálnímu tumoru [40]. Vzhledem k tomu, že prognóza HGSS je podobně jako u pacientek s jinými high-grade děložními sarkomy nebo heterologními sarkomy špatná, bylo v poslední době navrženo opustit termín HGSS a k jejich označení používat termín nediferencovaný sarkom.
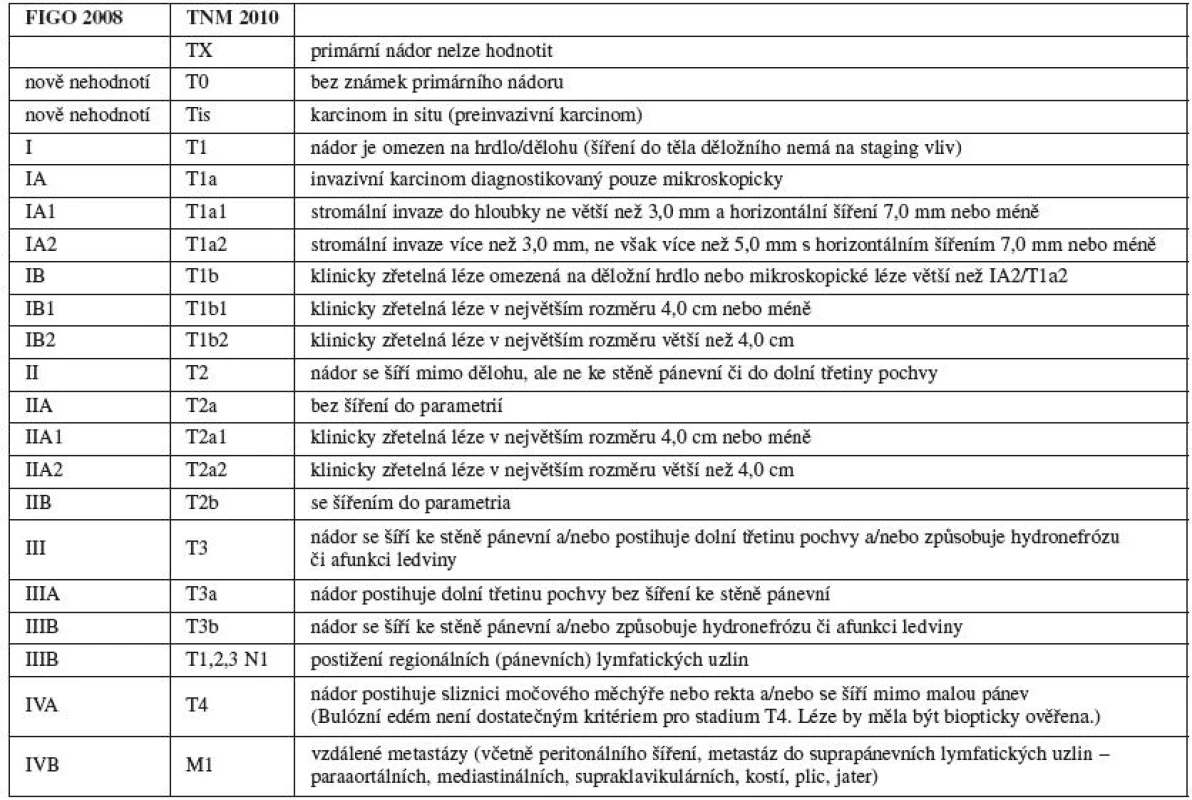
Prognóza pacientek s děložními sarkomy se v poslední době nemění: pětileté přežití se pohybuje v různých studiích od 17,5 % do 54,7 % [25]. Jedna práce z poslední doby uvádí, že ze sta pacientek přežilo dva roky 62 %, pět let 51 % a deset let 38 % pacientek. Stadium nemoci, věk pacientky, parita ani velikost tumoru nemá zásadní vliv na celkové přežití (OS – overall survival), jak prokázala jedna z metaanalýz [13, 25]. Proto stagingový systém pro sarkomy dělohy byl vypracován na základě poznatků o chování sarkomů jiných lokalizací (tab. 3). Regionální lymfatické uzliny pro sarkomy dělohy jsou uzliny pánevní (obturatorní, vnitřní ilické, společné a zevní ilické, parametriální, sakrální) a uzliny paraaortální. Stadium IC (T1c) se nepoužívá pro leiomyosarkom a endometriální stromální sarkom. Karcinosarkomy by se měly klasifikovat jako karcinom endometria.
Ani sebelepší zhodnocení histologických preparátů neumožňuje zlepšit předpověď chování děložních sarkomů a přesnost prognózy. Imunohistochemické studie vybraných onkoproteinů podobně jako molekulární analýza nerandomizovaných translokací, které se často objevují u low-grade endometriálních stromálních sarkomů, nepochybně povede k přesnější klasifikaci děložních sarkomů spojené se zlepšením stanovení prognózy [38].
ZÁVĚR
Nový stagingový systém je strukturován tak, aby zahrnul hlavní prognostické faktory ovlivňující chování gynekologických zhoubných nádorů. Účel stagingového systému je poskytnout klasifikaci šíření tumoru vycházející z klinické zkušenosti, aby jednotlivým stadiím odpovídaly určité modality terapie. Změny ve stagingových systémech FIGO byly převzaty v určité modifikované formě do stagingového systému TNM, aby oba systémy byly co nejvíce identické. Vzhledem k vývoji diagnostických i terapeutických možností ve všech oblastech medicíny je nutné v průběhu doby tyto stagingové systémy upřesňovat.
MUDr. Borek Sehnal
Gynekologicko-porodnická klinika
FN Na Bulovce
Budínova 2
180 00 Praha 8
Sources
1. Amendola, MA., Hricak, H., Mitchell, DG., et al. Utilization of diagnostic studies in the pretreatment evaluation of invasive cervical cancer in the United States: results of intergroup protocol ACRIN 6651/GOG 183. J Clin Oncol, 2005, 23, 30, p. 7454–7459.
2. Aoki, Y., Sasaki, M., Watanabe, M., et al. High-risk group in nodepositive patients with stage IB, IIA, and IIB cervical carcinoma after radical hysterectomy and postoperative pelvic irradiation. Gynecol Oncol, 2000, 77, 2, p. 305–309.
3. Bell, SW., Kempson, RL., Hendricson, MR. Problematic uterine smooth muscle neoplasms. A clinicopathologic study of 213 cases. Am J Surg Pathol, 1994, 18, 6, p. 535–558.
4. Benedetti-Panici, P., Maneschi, F., D’Andrea, G., et al. Early cervical carcinoma: the natural history of lymph node involvement redefined on the basis of thorough parametrectomy and giant section study. Cancer, 2000, 88, 10, p. 2267–2274.
5. Boyle, P., la Vecchia, C.,Walker, A. Annual report on the results of treatment in gynecological cancer. twenty-fourth volume. J Epidemiol Biostat, 2001, 6, 1, p. 1–184.
6. Burghardt, E., Ostör, A., Fox, H. The new FIGO definition of cervical cancer stage IA: a critique. Gynecol Oncol, 1997, 65, 1, p. 1–5.
7. Cibula, D., Petruželka, L., et al. Onkogynekologie, 1. vyd. Praha: Grada, 2009, s. 393, 457, 489-494.
8. Clement, PB., Scully, RE. Mullerian adenosarcoma of the uterus: a clinicopathologic analysis of 100 cases with a review of the literature. Hum Pathol, 1990, 21, 4, p. 363-381.
9. Creasman, W. Revised FIGO staging for carcinoma of the endometrium. Int J Gynaecol Obstet, 2009, 105, p. 109.
10. de Oliveira, CF., Mota, F. Cervical cancer – pre-therapeutic investigations and clinical staging versus surgical staging. CME J Gynecol Oncol, 2001, 6, p. 246-256.
11. Delgado, G., Bundy, B., Zaino, R., et al. Prospective surgicalpathological study of disease-free interval in patients with stage IB squamous cell carcinoma of the cervix. A Gynecologic Oncology Group Study. Gynecol Oncol, 1990, 38, 3, p. 352–357.
12. Gallardo, A., Prat, J. Mullerian adenosarcoma of the uterus: A clinicopathologic and immunohistochemical study of 55 cases challenging the existence of adenofibroma. Am J Surg Pathol, 2009, 33, 2, p. 278–288.
13. Giuntoli, II RL., Metzinger, DS., DiMarco, CS., et al. Retrospective review of 208 patients eith leiomyosarcoma of the uterus: prognostic indicators, surgical management, and adjuvant therapy. Gynecol Oncol, 2003, 89, 3, p. 460-469.
14. Graflund, M., Sorbe, B., Karlsson, M. Immunohistochemical expression of p53, bcl-2, and p21(WAF1/CIP1) in early cervical carcinoma: correlation with clinical outcome. Int J Gynecol Cancer, 2002, 12, 3, p. 290–298.
15. Grigsby, PW., Siegel, BA., Dehdashti, F. Lymph node staging by positron emission tomography in patients with carcinoma of the cervix. J Clin Oncol, 2001, 19, 17, p. 3745–3749.
16. Grigsby, PW. 4th International Cervical Cancer Conference: update on PET and cervical cancer. Gynecol Oncol, 2005, 99, 3, suppl. 1, p. 173–175.
17. Hong, JH., Tsai, CS., Lai, CH., et al. Risk stratification of patients with advanced squamous cell carcinoma of cervix treated by radiotherapy alone. Int J Radiat Oncol Biol Phys, 2005, 63, 2, p. 492–499.
18. Horn, LC., Fischer, U., Raptis, G., et al. Tumor size is of prognostic value in surgically treated FIGO stage II cervical cancer. Gynecol Oncol, 2007, 107, 2, p. 310–315.
19. Hricak, H., Gatsonis, C., Coakley, FV., et al. Early invasive cervical cancer: CT and MR imaging in preoperative evaluation – ACRIN/GOG comparative study of diagnostic performace and interobserver variability. Radiology, 2003, 224, 3, p. 623–625.
20. Hricak, H. First open trial of the American College of Radiology Imaging Network: proper imaging approach for invasive cervical cancer. Radiology, 2002, 225, 3, p. 634–635.
21. Chang, KL., Crabtree, GS., Lim-Tan, SK., et al. Primary uterine endometrial stromal neoplasms. A clinicalpathologic study of 117 cases. Am J Surg Pathol, 1990, 14, 5, p. 415–438.
22. Cheng, X., Cai, S., Li, Z., et al. The prognosis of women with stage IB1-IIB node-positive cervical carcinoma after radical surgery. World J Surg Oncol, 2004, 18, 2, p. 47.
23. Kapp, DS., Shin, JY., Chan, JK. Prognostic factor and survival in 1396 patients with uterine leiomyosarcomas: emphasis on impact of lymphadenectomy and oophorectomy. Cancer, 2008, 112, 4, p. 820–830.
24. Kawagoe, T., Kashimura, M., Matsuura, Y., et al. Clinical significance of tumor size in stage IB and II carcinoma of the uterine cervix. Int J Gynecol Cancer, 1999, 9, 5, p. 421–426.
25. Koivisto-Korander, R., Butzow, R., Koivisto, AM., Leminen, A. Clinical outcome and prognostic factors in 100 cases of uterine sarcomas: experience in Helsinki University Central Hospital 1990-2001. Gynecol Oncol, 2008, 111, 1, p. 74–81.
26. Kurihara, S., Oda, Y., Ohishi, Y., et al. Endometrial stromal sarcomas and related high-grade sarcomas: immunohistochemical and molecular genetic study of 31 cases. Am J Surg Pathol, 2008, 32, 8, p. 1228–1238.
27. Kurman, RJ. Blaustein’s pathology of the female genital tract. 5. ed. New York: Springer Verlag, 2002, p. 1391.
28. Major, FJ., Blessing, JA., Silverberg, SG., et al. Prognostic factors in early stage uterine sarcoma: A Gynecologic Oncology Group study. Cancer, 1993, 71, suppl. 4, p. 1702–1709.
29. Mitchell, DG., Snyder, B., Coakley, F., et al. Early invasive cervical cancer: tumor delineation by magnetic resonance imaging, computed tomography, and clinical examination, verified by pathologic results, in the ACRIN 6651/GOG 183 Intergroup Study. J Clin Oncol, 2006, 24, 36, p. 5687–5694.
30. Narayan, K., McKenzie, AF., Hicks, RJ., et al. Relation between FIGO stage, primary tumor volume, and presence of lymph node metastases in cervical cancer patients referred for radiotherapy. Int J Gynecol Cancer, 2003, 13, 5, p. 657–663.
31. Pecorelli, S. 25th Annual report on the results of treatment in gynecological cancer. Int J Gynecol Obstet, 2003, 83, suppl. 1, p. 230.
32. Pecorelli, S. 26th Annual report on the results of treatment in gynecological cancer. Int J Gynecol Obstet, 2006, 95, suppl. 1, p. 258.
33. Pecorelli, S., Zigliani, L., Odicino, F. Revised FIGO staging for carcinoma of the cervix. Int J Gynaecol Obstet, 2009, 105, p. 107–108.
34. Pecorelli, S. Revised FIGO staging for carcinoma of the vulva, cervix, and endometrium. Int J Gynaecol Obstet, 2009, 105, p. 103–104.
35. Perez, CA., Grigsby, PW., Chao, KS., et al. Tumor size, irradiation dose, and long-term outcome of carcinoma of uterine cervix. Int J Radiat Oncol Biol Phys, 1998, 41, 2, p. 307–317.
36. Pettersson, F. Annual report on the results of treatment in gynecological cancer. FIGO, 1991, Twenty-first volume.
37. Piver, MS., Chung, WS. Prognostic significance of cervical lesion size and pelvic node metastases in cervical carcinoma. Obstet Gynecol, 1975, 46, 5, p. 507–510.
38. Prat, J. FIGO staging for uterine sarcomas. Int J Gynaecol Obstet, 2009, 104, 3, p. 177–178.
39. Sakuragi, N., Satoh, C., Takeda, N., et al. Incidence and distribution pattern of pelvic and paraaortic lymph node metastasis in patients with Stages IB, IIA, and IIB cervical carcinoma treated with radical hysterectomy. Cancer, 1999, 85, 7, p. 547–554.
40. Tavassoli, FA., Devilee, P. World Health Organization Classification of Tumours. Pathology and genetics of tumours of the breast and female genital organs. 1st ed. Lyon: IARC Press, 2003.
41. TNM klasifikace zhoubných novotvarů. 7. vyd. Chichester, UK: Wiley-Blackwell, 2009, česká verze 2011, s. 167–179.
42. Togashi, K., Morikawa, K., Kataoka, ML, Konishi, J. Cervical cancer. J Magn Reson Imaging, 1998, 8, 2, p. 391–397.
43. Tropé, C., Kristensen, G., Onsrud, M., Bosze, P. Controversies in cervical cancer staging. CME J. Gynecol Oncol, 2001, 6, p. 240–245.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2011 Issue 5
Most read in this issue
- Fetal hypotrophy dopplerometry
- Current classification of malignant tumours in gynecological oncology – part II
- Single embryo transfer – possibilities and limits
- Perineal audit: reasons for more than one thousand episiotomies