Hypersenzitivní reakce po podání karboplatiny a paklitaxelu – naše pětileté zkušenosti
Hypersensitivity reactions to carboplatinand paclitaxel – our five-years experiences
Objective:
To analyze hypersensitivity reactions to carboplatin and paclitaxel in patients treated with systemic administration of chemotherapy (carboplatin and/or paclitaxel).
Design:
Retrospective study.
Setting:
Department of Obstetrics and Gynecology, Charles University in Prague, Faculty of Medicine and University Hospital Hradec Kralove.
Methods:
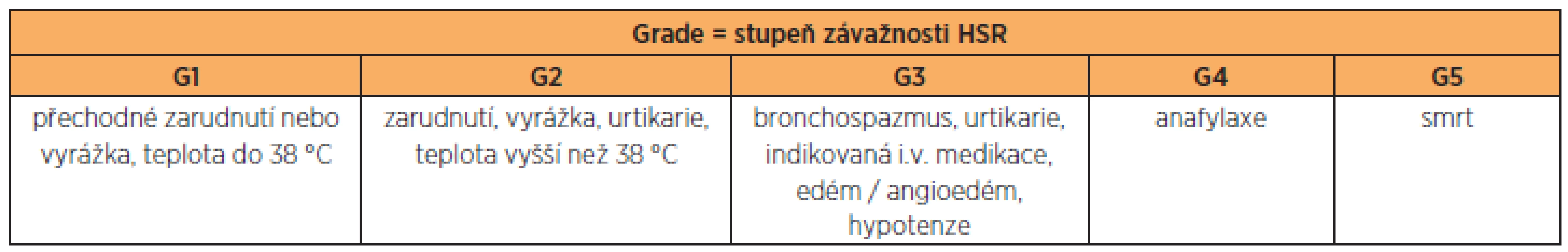
One hundred-forty patients treated with systemic administration of chemotherapy were enrolled to our study between years 2008 and 2012. The presence and the grade [grade (G) 1–5; 1 = moderate, 5 = death] of hypersensitivity reactions (HSRs) were evaluated, as well as the influence of some clinical parameters on development of HSR.
Results:
In total 29 HSRs in 21 patients were analyzed. To carboplatin were reported 19 (66%) HSRs: 13 (45%) HSRs of G1–G3 and 6 (21%) HSRs of G4. To paclitaxel were reported 10 (34%) HSRs: 9 (31%) HSRs of G1–G3 and 1 (3%) HSR of G4. The number of administered cycles of carboplatin to develop G1–G4 resp. G1–G3 HSR was higher in comparison with number of cycles to develop HSR of the same grade to paclitaxel(p = 0.001, resp. p = 0.01).
Conclusion:
HSR to carboplatin is unlike paclitaxel affected by the number of administered cycles. This fact should be included in the clinical management of patients treated with intravenous chemotherapy using carboplatin.
Keywords:
chemotherapy – allergic reaction – ovarian cancer
:
A. Řezáč 1; P. Jílek 2; V. Řezáčová 3; P. Škapinec 1; I. Sedláková 1; J. Tošner 1; J. Špaček 1
:
Gynekologicko-porodnická klinika LF UK a FN, Hradec Králové, přednosta doc. MUDr. J. Špaček, Ph. D., IFEPAG
1; Katedra biologických a lékařských věd, Farmaceutická fakulta LF UK, Hradec Králové, vedoucí katedry doc. PharmDr. P. Nachtigal, Ph. D.
2; Ústav klinické imunologie a alergologie FN, Hradec Králové, přednosta prof. RNDr. J. Krejsek, CSc.
3
:
Ceska Gynekol 2013; 78(6): 514-521
:
Original Article
Cíl studie:
Analyzovat hypersenzitivní reakce (HSR) na karboplatinu a paklitaxel u pacientek léčených systémovou chemoterapií karboplatinou a/nebo paklitaxelem.
Typ studie:
Retrospektivní studie.
Název a sídlo pracoviště:
Porodnicko-gynekologická klinika (PGK) LF UK a FN Hradec Králové.
Metodika:
Do studie bylo zahrnuto 140 pacientek léčených v onkologickém stacionáři PGK v období let 2008–2012 systémovou chemoterapií. Hodnotili jsme přítomnost, závažnost HSR [grade (G) 1–5;1 = nejmírnější, 5 = nejzávažnější] a vliv některých klinických faktorů na vznik HSR.
Výsledky:
V našem souboru bylo zaznamenáno29 HSR u 21 pacientek. Na karboplatinu bylo 19(66 %) HRS, z toho 13 (45 %) bylo G1–G3 a 6 (21 %) bylo G4. Na paklitaxel to bylo 10 (34 %) HSR, z toho9 (31 %) G1–G3 a 1 (3 %) G4. Počet podaných cyklů u HSR na karboplatinu závažnosti G1–G4 a G1–G3 byl vyšší než u stejných HSR na paklitaxel (p = 0,001 a p = 0,01).
Závěr:
HSR na karboplatinu je na rozdíl od paklitaxelu ovlivněna počtem podaných cyklů. Tento fakt by měl být zahrnut do klinického managementu pacientek léčených systémovou chemoterapií karboplatinou.
Klíčová slova:
chemoterapie – alergická reakce – karcinom ovaria
ÚVOD
Téměř všechny systémové léčebné přípravky využívané k nádorové terapii jsou spjaty s možným vznikem hypersenzitivní reakce (HSR). Její klinické projevy jsou velmi variabilní: od mírných a středních reakcí (vyrážka, zarudnutí, svědění, nevolnost, dušnost) až po těžké HSR zahrnující bronchospazmus, hypotenzi, edém, srdeční zástavu a v některých případech i smrt. Závažné a prudké reakce jsou velkým problémem, nejenom vzhledem k akutnímu ohrožení pacientky na životě, ale také k nutnosti změnit podávané cytostatikum na jiné, často méně účinné. Přesný mechanismus vzniku HSR se liší u jednotlivých cytostatických přípravků a často je nejasný.
Většina reakcí vzniká na podkladě hypersenzitivní reakce I. typu zprostředkovaná IgE protilátkami [7]. Při prvních kontaktech s cytostatikem může dojít k tzv. senzibilizaci a k vzniku IgE protilátek specifických pro cizorodou část antigenu, tedy pro cytostatikum. Protilátky IgE se vážou na Fcε receptory mastocytů a bazofilů. Při následném kontaktu dochází k přemostění těchto receptorů cytostatikem (alergenem) a k uvolnění mediátorů zánětu (histamin, serotonin, prostaglandiny a leukotrieny). Následkem je nadměrná bronchokonstrikce, vazodilatace, mukózní sekrece končící až hypovolemickým šokem s hypotenzí a plicní hypertenzí.
Hypersenzitivní reakce II. typu je zprostředkovaná IgG protilátkami vázajícími se na cytostatikem změněnou membránu erytrocytů, leukocytů, destiček či hematopoetických prekurzorů, způsobující jejich destrukci na podkladě ADCC (antibody-dependent cell-mediated cytotoxicity).
Hypersenzitivní reakce III. typu je zprostředkovaná nadměrným vznikem imunokomplexů patologicky se ukládajících v cévách. Následkem vznikají vaskulitidy, glomerulonefritidy, endokarditidy atd.
Hypersenzitivní reakce IV. typu, často označovaná jako oddálená přecitlivělost, je zprostředkovaná buňkami. Může se na ní podílet aktivace monocytů, eozinofilů, pomocných resp. cytotoxických T-lymfocytů a nebo neutrofilů [12, 25, 27]. V některých případech nelze vyloučit ani vliv idiosynkrazie (neimunologická HSR), kdy některé léky či jejich metabolity případně nosiči mají schopnost se přímo vázat na mastocyty a bazofily a způsobit jejich degranulaci. U HSR vzniklé tímto mechanismem není nutná předchozí senzibilizace, ale klinicky ji nelze odlišit od HSR I. typu zprostředkované IgE protilátkami [2, 30]. Podobným mechanismem některé léky či jejich deriváty působí jako superantigeny masivně uvolňující prozánětlivé cytokiny z lymfocytů T. Při tomto mechanismu dochází k opožděné HSR, chybí zde projevy laryngospazmu, vyrážky i hypotenze a vyskytuje se zimnice, horečka a nevolnost [23].
Běžně využívaná léčba ovariálního karcinomu je založena na sloučeninách platiny (karboplatina a cisplatina), často v kombinaci s paklitaxelem (PACLI). Karboplatina (CBDCA) a cisplatina patří mezi léky s tzv. alkylačním mechanismem účinku bránící kopírování a přepisu nukleových kyselin nádorových buněk. Alkylující látky mohou modifikovat i bílkoviny pacienta, které následně fungují jako antigeny (bílkovina je dostatečně velká molekula fungující jako nosič cizorodé struktury karboplatiny resp. cisplatiny), které mohou být rozeznány buňkami imunitního systému reagujícími tvorbou protilátek. CBDCA (druhá generace sloučenin platiny) se vzhledem k jejím nižším nežádoucím účinkům (neurotoxicita, nefrotoxicita a její lepší snášenlivost), využívá častěji než cisplatina (první generace sloučenin platiny) [3]. Pacientky, u kterých se po první linii léčby CBDCA dosáhlo kompletní remise a relaps onemocnění byl zachycen po minimálně šesti měsících od ukončené léčby, zůstává léčba založená na CBDCA metodou první volby. Využití CBDCA v následných liniích léčby je limitováno rizikem vzniku systémové alergické reakce. Na riziko vzniku HSR má vliv počet předchozích podaných cyklů (PC), celková dávka CBDCA a délka intervalu bez platiny (PFI; platina free interval) [16, 26, 30].
Cílem práce je popsat a analyzovat HSR na CBDCA a PACLI na Porodnické a gynekologické klinice Fakultní nemocnice Hradec Králové v období let 2008–2012.
METODIKA
Retrospektivní hodnocení pacientek léčených v onkologickém stacionáři Porodnické a gynekologické kliniky Fakultní nemocnice Hradec Králové v období let 2008–2012 systémovou chemoterapií pro karcinom ovaria, karcinom tuby, primární karcinom peritonea. Do souboru jsme zahrnuli jen pacientky, u kterých byla součástí chemoterapie buď CBDCA, a/nebo PACLI. Pacientky léčené jinými cytostatiky nebyly do našeho souboru zahrnuty. Využívané léčebné linie byly CBDCA v monoterapii nebo v kombinaci s PACLI či gemcitabinem popřípadě PACLI v monoterapii. U pacientek jsme retrospektivně hodnotili přítomnost HSR na podané cytostatikum a její závažnost (tab. 1). Hodnotili jsme význam počtu podaných cyklů (PC) a linií (PL) CDBCA a/nebo PACLI na vznik G1–G3 resp. G4 HSR, zabývali jsme se významem velikostí celkové dávky (CD) cytostatika v době HSR a významem délky doby od senzibilizace pacientek CBDCA a/nebo PACLI do jejich dalšího podání na vznik G1–G3 resp.G4 HSR (AFI–Allergy Free Interval). HSR jsme rozdělili na 4 skupiny: podle cytostatika, na které reakce proběhly (CBDCA a PACLI) a podle závažnosti průběhu reakcí (G1–G3 a G4). Do statistického hodnocení jsme vždy zahrnuli jen první reakci G1–G3 CBDCA a/nebo PACLI a první reakci G4 na CBDCA a/nebo PACLI. Více HSR se stejnou závažností (G1–G3 nebo G4) na stejné cytostatikum (CBDCA a PACLI) nebylo do statistického souboru zařazeno.
Statistická analýza byla provedena pomocí software MedCalc (MedCalc Software, Belgie). K nalýze PC, PL, AFI a CD mezi jednotlivými skupinami HSR byl použit nepárový Wilcoxonův test po stanovení normality dat. Hodnoty p < 0,05 byly považovány za statisticky významné.
VÝSLEDKY
Do našeho souboru jsme zahrnuli 140 pacientek, u kterých byla součástí chemoterapie buď CBDCA, a/nebo PACLI. Celkem 20 pacientek bylo léčeno monoterapií CBDCA, 13 pacientek monoterapií PACLI a 107 pacientek bylo léčeno i CBDCA i PACLI. Z celkového počtu 140 pacientek byla u 21 (14 %) z nich zaznamenána HSR. Celkem se u nich vyskytlo 58 HSR. Na CBDCA 40 (69 %), z toho 34 (59 %) G1–G3 a 6 (10 %) G4. Na PACLI 18 (31 %) z toho 17 (29 %) G1–G3 a 1 (2 %) G4 (tab. 2).
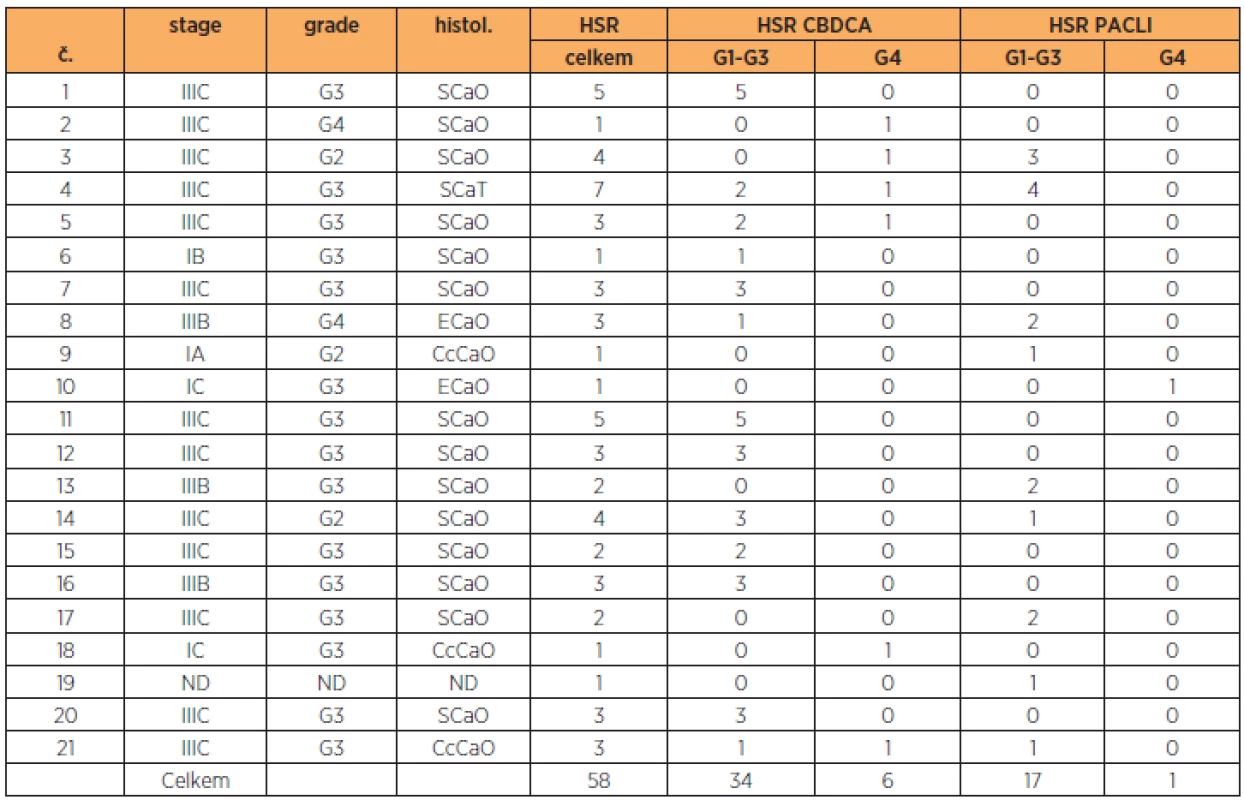
Vzhledem ke stanoveným vstupním kritériím (zahrnutí jen první reakce G1–G3 na CBDCA a/nebo PACLI a první reakce G4 na CBDCA a/nebo PACLI) bylo do analýz zahrnuto celkem 29 HSR u 21 pacientek. Na CBDCA bylo 19 (66 %) HRS, z toho 13 (45 %) bylo G1–G3 a 6 (21 %) bylo G4. Na PACLI bylo 10 (34 %) HSR, z toho z toho 9 (31 %) G1–G3 a 1 (3 %) G4. (tab. 3, 4). Žádná pacientka v daném období v důsledku HSR na PGK nezemřela.
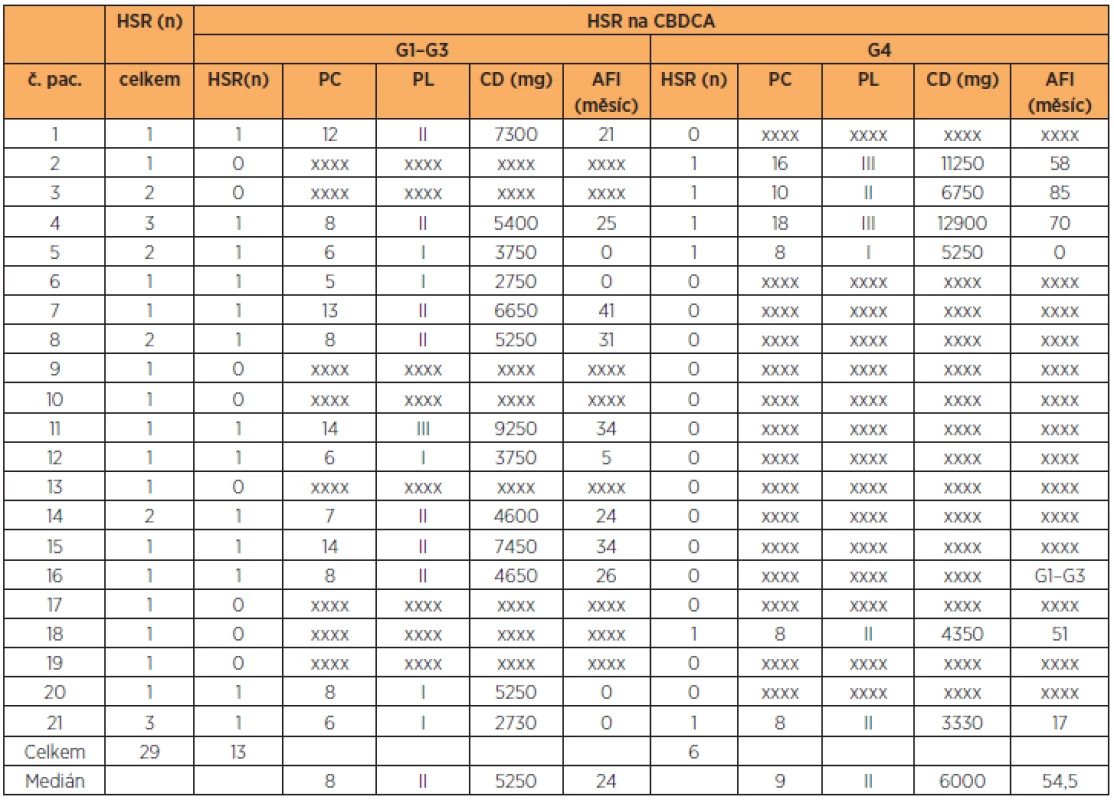
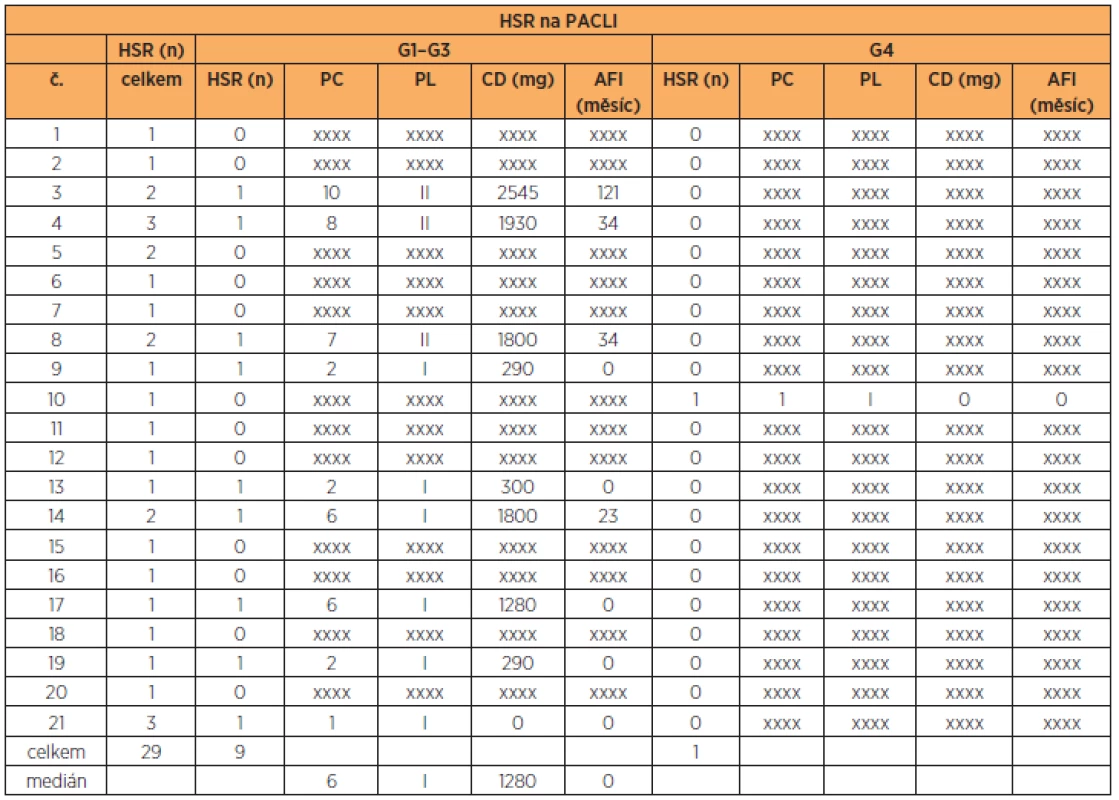
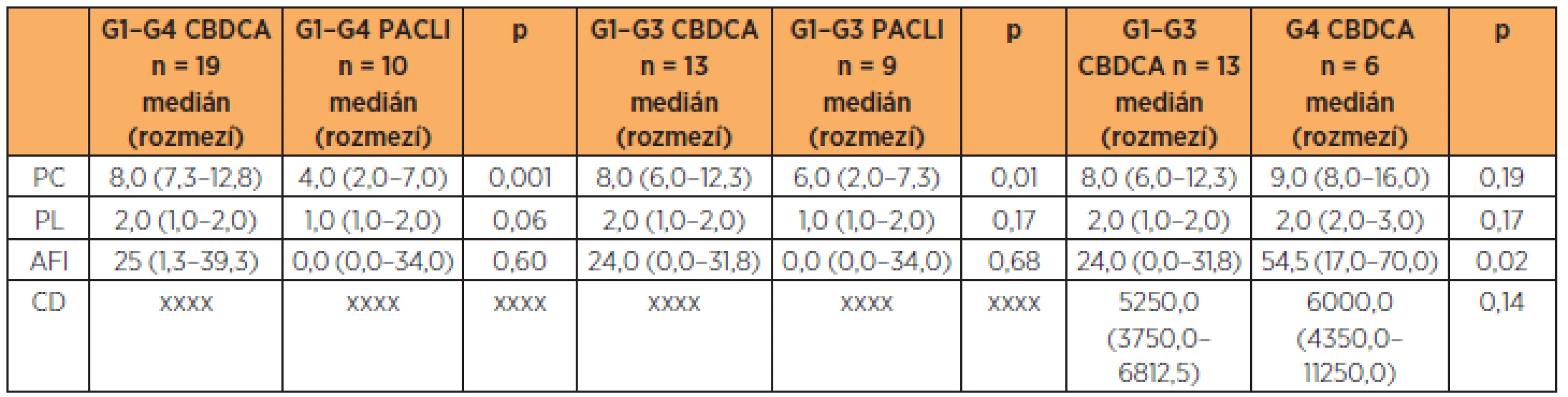
Počet podaných cyklů CBDCA při G1–G4 HSR resp. G1–G3 HSR reakci byl vyšší (p = 0,001, resp. p = 0,01) v porovnání s počtem podaných cyklů u PACLI. Nebyl rozdíl v PL u CBDCA při G1–G4 HSR v porovnání s PACLI (p = 0,059). Nebyl nalezen rozdíl v AFI hodnotě mezi CBDCA a PACLI. U léčby CBDCA byl vyšší AFI u HSR G4 než G1–G3 (p = 0,02). (tab. 5)
DISKUSE
Mezi nejčastěji využívaná cytostatika v léčbě primárního, ale i recidivujícího karcinomu vaječníku patří CBDCA a PACLI, které se podávají buď v monoterapii, nebo v kombinaci. Systémové podávání těchto preparátů je doprovázeno řadou známých nežádoucích účinků a také je limitováno rizikem vzniku HSR, jejichž následkem je často modifikace léčby (snížení optimální dávky, nutnost hospitalizace, změna léčebného schématu, nebo dokonce přerušení aplikace). V našem souboru 140 pacientek bylo u 21 pacientek (15 %) zaznamenáno celkem 29 hypersenzitivních reakcí. Pokud bylo zaznamenáno více HSR na jedno cytostatikum se stejnou závažností reakce (G1–G3 nebo G4) byly tyto reakce v naší práci vedeny jako jedna HSR.
Ze 127 (91 %) pacientek léčených CBDCA se u 19 (15 %) z nich vyskytla HSR na CBDCA. U 62 % resp. 83 % (z G1–G3 resp. G4 HSR) pacientek s HSR na CBDCA vznikla HSR v průběhu II., resp. III. linie. U šesti pacientek (5 s G1–G3 HSR a 1 s G4 HSR) vznikla HSR v průběhu I. linie, ale vždy nejdříve v 5. cyklu podání (průměrně v 6. cyklu). Tento fakt je v souladu s tvrzením, že na riziko vzniku HSR má vliv počet předchozích podaných cyklů a linií CBDCA [20, 28, 30]. Markman a spol. prokázali až 30% riziko rozvinutí HSR po podání více než 7 cyklů CBDCA [16]. V našem souboru pacientek byl počet podaných cyklů CBDCA při G1–G4 HSR resp. G1–G3 HSR významně vyšší (p = 0,001, resp. p = 0,01) v porovnání s počtem podaných cyklů na PACLI. Na hranici významnosti (p = 0,059) vyšel vyšší počet podaných linií CBDCA při G1–G4 HSR v porovnání s PL na PACLI. Tento výsledek je ovlivněn relativně malým souborem pacientek. Dále Koshiba a spol. prokázali, že podání více než 5000 mg resp. 8000 mg a zároveň více než 9 resp. 15 cyklů CBDCA signifikantně zvyšuje incidenci HSR resp. závažné HSR [11]. Schwartz a spol. zmiňují i vliv PFI (Platina Free Intervalu) [26]. Termín PFI je ale často v onkogynekologii využíván při hodnocení účinnosti léčby, popř. jako prognostický faktor onemocnění. V tomto kontextu PFI odpovídá intervalu od poslední aplikace platiny po relaps onemocnění. Pojem PFI je tedy při hodnocení HSR zavádějící (mezi první a další linií karboplatiny je často vmezeřena linie s využitím jiného cytostatika). Proto jsme pro účely naší práce zavedli termín AFI (allergy free interval), který odpovídá intervalu od první senzibilizace pacienta s cytostatikem po hypersenzitivní reakci na dané cytostatikum nezávisle na ostatních liniích léčby, dosažení remise či progrese onemocnění. V souladu s prací Schwartze a spol. jsme i v našem souboru pacientek prokázali vliv AFI na riziko vzniku HSR, kdy pacientky s G4 HSR na CBDCA měly výrazně vyšší AFI v porovnání s pacientkami s G1–G3 HSR na CBDCA (54,5 vs. 14 měsíců; p = 0,017).
U 10 z 13 pacientek s prodělanou lehkou až střední formou HSR na CBDCA se v následujících cyklech linie i v průběhu dalších linií léčby karboplatinou zachovalo původní cytostatikum. U většiny z nich se v dalších cyklech léčby HSR G1–G3 na CBDCA opakovaly, často však s mírnějším průběhem. Pokud by se u těchto pacientek přistoupilo k desenzibilizačním protokolům, mohlo by se zabránit vzniku jakékoli závažné reakce [1, 6]. Bylo publikováno několik desenzibilizačních protokolů, ke kterým je možné přistoupit po mírné až středně závažné HSR na CBDCA, u které se předpokládá IgE zprostředkovaný mechanismus vzniku. Pro diagnostiku HSR prvního typu slouží kožní testy (prick test / intradermální test). Metoda pro hodnocení specifického IgE není komerčně dostupná [19]. Dalšími možnými metodami využitelnými pro diagnostiku HSR I. typu na CBDCA jsou „Basotest“ popřípadě BTT (Test Blastické Transformace), kterým jsme schopni zaznamenat i HSR IV. typu, když se po inkubaci periferní krve pacientky s daným cytostatikem hodnotí míra aktivace (degranulace) bazofilů resp. míra proliferace lymfocytů [8, 9, 29]. Výhodou těchto metod v porovnání s kožními testy je, že jde o in vitro testy a pacient jimi není zatížen. Dále také umožňují odlišit pa-cienty s falešně negativním výsledkem kožních testů (např. u imunosuprimovaných pacientů). Nevýhodou těchto testů je jejich cena a nedostupnost, kdy jen některá pracoviště splňují podmínky pro práci s cytostatiky. Z tohoto důvodu jsou kožní testy stále nejpoužívanější diagnostickou metodou. Některé práce doporučují provádět kožní testy preventivně před každým léčebným cyklem karboplatinou, a tím se pokusit zabránit vzniku jakékoliv HSR (mírné i závažné) [13, 14, 18, 30, 31]. Desenzibilizační protokoly jsou několikakrokové přístupy vyžadující umístění pacientky na jednotku intenzivní péče s přiřazenou sestrou, s dostupnými záchrannými léky (epinefrin, antihistaminika, bronchodilatátory a kyslík) a týmem lékařů (imunolog/alergolog, gynekolog, intenzivista) u lůžka pro zajištění okamžitého zahájení záchranných kroků při případné anafylaktické reakci [4, 13, 15, 21, 22]. Tento desenzibilizační přístup není z výše uvedených důvodů dostupný na všech pracovištích. Další možností, jak zabránit vzniku závažné HSR reakci, je změnit léčbu po zaznamenání G1–G3 HSR např. z CBDCA na cisplatinu. Vzhledem k riziku zkřížené alergické reakce se však doporučuje pacientku vyšetřit kožními testy na cisplatinu a případnou zkříženou reakci vyloučit [5, 14]. Aplikace cisplatiny je však spojována s větším výskytem nežádoucích účinků, a pacientky ji celkově hůře snášejí než CBDCA [3]. Na našem pracovišti se desenzibilizační protokoly standardně neprováděly. Kožní testy byly vyšetřeny jen u pacientek s prodělanou závažnou HSR. Pacientkám s výskytem mírných až středních HSR jsme neindikovali vyšetření kožních testů a po rozšířené premedikaci jsme je nadále léčili původním cytostatikem. Ke změně léčebného cytostatika jsme přistoupili až v případě výskytu závažné HSR, která se u pacientek s předchozím výskytem HSR na CBDCA vyskytla jen u tří pacientek. U těchto pacientek s G4 HSR reakcí na CBDCA jsme indikovali léčbu cisplatinou, lipozomální doxorubicinem nebo PACLI.
U pacientek se zvýšeným rizikem HSR (několikanásobné podání CBDCA v anamnéze), typicky před podáním 2. cyklu II. linie by bylo vhodné provést kožní testy a při případné pozitivitě přistoupit k desenzibilizačnímu protokolu, tím pacientce zvýšit pravděpodobnost dosažení léčebné dávky cytostatika a zároveň zabránit vzniku závažné HSR. U tří pacientek se vyskytla závažná HSR reakce bez zaznamenané předchozí mírnější HSR reakce na CBDCA. Preventivním vyšetřováním kožních testů před podáním každého léčebného cyklu karboplatinou by se dalo těmto závažným HSR zabránit [13, 14, 18, 31].
Ze 120 (86 %) pacientek léčených PACLI se u 10 (8 %) z nich vyskytla HSR na PACLI. Na rozdíl od G1–G3 HSR na CBDCA vznikají G1–G3 HSR na PACLI často v průběhu první linie, a dokonce i během prvního podání. Tyto HSR se tedy nedají předvídat. V souladu s ostatními pracemi jsme naše pacientky s G1–G3 HSR na PACLI v anamnéze, po podání rozšířené premedikace, nadále tímto cytostatikem léčili [10, 24]. U dvou pa-cientek tato premedikace nebyla úspěšná a následně jsme museli přistoupit ke změně léčebného schématu. Závažná anafylaktická HSR po podání PACLI proběhla během prvního cyklu první linie, a to již v průběhu několika minut. Tento fakt odpovídá možnému předpokládanému mechanismu vzniku HSR na PACLI, který zřejmě není zprostředkován IgE protilátkami, ale kombinují se zde imunologické i neimunologické (idiosynkrazie) mechanismy vzniku. Jeden ze zvažovaných mechanismů je schopnost léku či jeho metabolitu vázat se přímo na mastocyty a bazofily, a způsobit tak jejich degranulaci bez účasti IgE protilátek. U HSR vzniklé tímto mechanismem není nutná předchozí senzibilizace, ale klinicky ji nelze odlišit od hypersenzitivní reakce I. typu. [30, 2]. Polovina z našich pacientek se zaznamenanou HSR na PACLI mělo v anamnéze HSR i na CBDCA. Na tomto faktu se zřejmě nepodílí zkřížená reaktivita CBDCA a PACLI, ale zvažuje se spíše role celkového nastavení imunitního systému konkrétní pacientky se sklony k atopické reaktivitě [1, 17].
ZÁVĚR
Výskyt HSR reakcí na CBDCA není vzácný. Většina těchto reakcí však probíhá s mírnými příznaky, které jsou dočasným zastavením infuze a následnou medikací zvládnutelné a v konečném důsledku nemusí mít vliv na léčebné schéma pacientek. Výskyt závažných HSR reakcí jsou výrazně vzácnější. Právě na riziku vzniku závažné HSR na CBDCA se podílí převážně počet podaných cyklů a interval doby od začátku léčby CBDCA po její další zahájení. HSR po podání PACLI se nedají předvídat, vznikají nezávisle na počtu podaných cyklů i celkové dávky. Zároveň pro tyto reakce neexistuje účinná diagnostická metoda. Proto by se mělo dbát zvýšené opatrnosti u všech pacientek, kterým je PACLI podáván.
Poděkování
Marianovi Kacerovskému za kritické čtení manuskriptu.
Tato práce vznikla za podpory grantuIGA MZ ČR: NT 14107.
MUDr. Adam Řezáč
Gynekologicko-porodnická klinika
FN Hradec Králové
Sokolská 581
500 05Hradec Králové
e-mail: adam.rezac@fnhk.cz
Sources
1. Adkinson, NF. Drug allergy, allergy: principles practice, sixth ed., 2003, p. 1679–1694.
2. Ardavanis, A., Tryfonopoulos, D., Yiotis, I., et al. Non-allergic nature of docetaxel-induced acute hypersenzitivity reactions. Anticancer Drugs, 2004, 6, 15, p. 581–585.
3. Bois, A., Lück, HJ., Meier, W., et al. A randomized clinical trial of cisplatin/PACLI versus carboplatin/PACLI as first-line treatment of ovarian cancer. J Natl Cancer Inst, 2003, 17, 95, p. 1320–1329.
4. Castells, MC., Tennant, NM., Sloane, DE., et al. Hypersensitivity reactions to chemotherapy: Outcomes and safety of rapid desensitization in 413 cases. Clin Immunol, 2008, 122, p. 574–580.
5. Dizon, DS., Sabbatini, PJ., Aghajanian, C., et al. Analysis of patients with epithelial ovarian cancer or fallopian tube carcinoma retreated with cisplatin after the development of a carboplatin allergy. Gynec Oncol, 2002, 3, 84 p. 378–382.
6. Goldberg, A., Confino-Cohen, R., Fishman, A., et al. A modified prolonged desensitization protocol in carboplatin allergy.J Allergy Clin Immunol, 1996, 98, p. 841–843.
7. González, ID., Saez, RS., Rodilla, EM., et al. Hypersensitivity reactions to chemotherapy drugs. Alergol Immunol Clin, 2000, 15, p. 161–181.
8. Halloy, JC. Use of Basophil activation test in a case of oxaliplatin hypersenzitivity. J Aller Ther, 2011, 1, 2, p. 2–3.
9. Iwamoto, T., Yuta, A., Tabata, T., et al. Evaluation of basophil CD203c as a predictor of carboplatin–related hypersenzitivityreaction in patiens with gynecologic cancer. Biol Pharm Bull, 2012, 9, 35, p. 1487–1495.
10. Kintzel, PE. Prophylaxis for PACLI hypersenzitivity reactions. Ann Pharmacother, 2001, 9, 35, p. 1114–1117.
11. Koshiba, H., Hosokawa, K., Kubo, A., et al. Carboplatin-related hypersensitivity reactions in Japanese patients with gynecologic malignancies. Int J Gynecol Cancer, 2009, 6, 19, p. 1153.
12. Krejsek, J., Kopecký, O. Klinická imunologie. Hradec Kráolové: Nucleus HK, 2004, s. 649–679.
13. Lee, CW., Matulonis, UA., Castells, MC. Carboplatin hypersenzitivity: a 6-h 12-step protokol effective in 35 desensitizations in patiens with gynecological malignancies and mast cell/IgE - mediated reactions. Gynec Oncol, 2004, 2, 95, p. 370–376.
14. Leguy-Seguin, V., Jolimoy, G., Coudert, B., et al. Diagnostic and predictive value of skin testing in platinum salt hypersenzitivity. J Allergy Clin Immunol, 2007, 119, p. 726–730.
15. Markman, M., Hsieh, F., Zanotti, K. et al. Initial experience with a novel desensitization strategy for carboplatin-associated hypersensitivity reactions: carboplatin-hypersensitivity reactions. J Cancer Res Clin Oncol, 2004, 1, 130, p. 25–28.
16. Markman, M., Kennedy, A., Webster, K., et al. Clinical features of hypersensitivity reactions to carboplatin. J Clin Oncol, 1999, 17, p. 1141–1145.
17. Markman, M., Kennedy, A., Webster, K., et al. PACLI-associated hypersensitivity reactions: experience of the gynecologic oncology program of the Cleveland Clinic Cancer Center.J Clin Oncol, 2000, 1, 18, p. 102–105.
18. Markman, M., Zanotti, K., Peterson, G., et al. Expanded experience with an intradermal skin test to predict for the presence or absence of carboplatin hypersenzitivity. J Clin Oncol, 2003, 24, 21, p. 4611–4614.
19. Pagani, M., Venemalm, L., Bonnadona, P., et al. An experimental biological test to diagnose hypersenzitivity reactions to carboplatin: New horizont for an old problem. Jpn J Clin Oncol, 2012, 42, 4, p. 347–350.
20. Polyzos, A., Tsavaris, N., Kosmas, C., et al. Hypersensitivity reactions to carboplatin administration are common but not always severe: A 10-year experience. Oncology, 2001, 61, p. 129–133.
21. Robinson, JB., Singh, D., Bodurka-Bevers, DC., et al. Hypersenzitivity reactions and the utility of oral and intravenous desensitization in patiens with gynecologic malignancies. Gynecol Oncol, 2001, 82, p. 550–558.
22. Rose, PG., Fusco, N., Smrekar, M., et al. Successful administration of carboplatin in patients with clinically documented carboplatin hypersenzitivity. Gynecol Oncol, 2003, 89, p. 429–433.
23. Santini, D., Tonini, G., Salermo, A., et al. Idiosyncratic reaction after oxaliplatin infusion. Ann Oncol, 2001, 12, p. 132–133.
24. Shepherd, GM. Hypersensitivity reactions to chemothera-peutic drugs. Clin Rev in Allergy and Immunology, 2003, 24, p. 253–262.
25. Schnyder, B., Pichler, WJ. Mechanisms of drug-induced allergy. Mayo Clin. Proc., 2009, 3, 84, p. 268–272.
26. Schwartz, JR., Bandera, C., Bradley, A., et al. Does the platinum-free interval predict the incidence or severity of hypersenzitivity reactions to carboplatin? The exprience from Women and infants´ Hospital. Gynecol Oncol, 2007, 1, 105, p. 81–83.
27. Solesky, R., Khan, DA. Drug allergy: an updated practice parameter. Ann Allergy, Asthma Immunol, 2010, 105, p. 1–76.
28. Thomas, RR., Quinn, MG., Schuler, B., et al. Hypersensitivity and idiosyncratic reactions to oxaliplatin. Cancer, 2003, 97, p. 2301–2307.
29. Tran, NP., Katcher, J., Rohman, E., et al. Vancomycin hypersenzitivity diagnosed by lymfocyte blast transforamation. Pediatrics, 2011, p. 3.
30. Zanotti, KM., Markman, M. Prevention and management of antineoplastic-induced hypersenzitivity reactions. Drug Saf, 2001, 24, p. 767–779.
31. Zanotti, KM., Rybicki, LA., Kennedy, AW., et al. Carboplatin skin testing: a skin-testing protokol for predicting hypersenzitivity to karboplatin chemotherapy. J Clin Oncol, 2001, 12, 19, p. 3126–3129.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2013 Issue 6
Most read in this issue
- Approach to preterm birth on the threshold of viability (the 22-25 week) of gestation
- Management of preterm prelabor rupture of membranes with respect to the inflammatory complications – our experiences
- Hypersensitivity reactions to carboplatinand paclitaxel – our five-years experiences
- The effect of mode of delivery on woman’s sexuality
