Imunologický princip rozvoje erytrocytární aloimunizace těhotné ženy, hemolytické nemoci plodu a prevence RhD aloimunizace u RhD negativních žen
Immunological principle of development of red blood cell alloimmunization in pregnancy, hemolytic disease of the fetus and prevention of RhD alloimmunization in RhD negative women
Design: Review article.
Setting: Department of Obstetrics and Gynecology, Palacky University Olomouc, Faculty of Medicine and Dentistry, University Hospital Olomouc.
Methods, results: Every person exposed to a foreign red blood cell antigen (erythrocyte antigen) develops an antibody. If the contact with a foreign erythrocyte antigen occurs during pregnancy, the erythrocyte alloimmunization of the pregnant woman develops and, due to antibodies crossing through the placenta also Haemolytic disease of the foetus and newborn (HDFN) can occur. Antibodies are made by pregnant woman's immune system and their quantity and quality depend on many factors. Their function is to eliminate foetal "foreign" erythrocytes. Ways of elimination of antibody-labelled foetal erythrocytes are the same in the bloodstream of pregnant women and foetuses/newborns and their principle is type II hypersensitivity (cytotoxic), according to the Coombs and Gell classification. Severe forms of HDFN can lead to increased perinatal morbidity and mortality. Prevention of the development of RhD alloimmunization and severe forms of HDFN is based on the administration of polyclonal immunoglobulin (Ig) G anti-D in all potentially sensitizing events. It is assumed that the mechanism of anti-D IgG action is based on the rapid removal of the antigen by antibody overflow, and on antibody mediated immune suppression (AMIS). However, the exact immunological principle is not fully known yet.
Conclusion: This article describes the development of irregular antibodies, methods of foetal erythrocytes destruction and the mechanism of prevention of anti-D immunoglobulin from the immunological point of view.
Keywords:
erythrocyte (red blood cell) alloimmunization – hemolytic disease of the fetus and newborn – antigen "D" – antibody anti-D – type II hypersensitivity – antibody IgG – antibody IgM – RhD alloimmunization – polyclonal immunoglobulin IgG anti-D – AMIS
Authors:
L. Roubalová
; M. Lubušký
Authors‘ workplace:
Porodnicko‑gynekologická klinika, Lékařská fakulta Univerzity Palackého, Fakultní nemocnice, Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D.
Published in:
Ceska Gynekol 2020; 85(6): 408-416
Category:
Review Article
Overview
Typ studie: Systematický přehledový článek.
Název a sídlo pracoviště: Porodnicko-gynekologická klinika, Lékařská fakulta Univerzity Palackého v Olomouci, Fakultní nemocnice Olomouc.
Metodika, výsledky: Každý člověk, je-li vystaven cizímu antigenu červené krevní buňky (erytrocytární antigen), který sám nevlastní, si vytváří protilátku. Dojde-li ke kontaktu s cizím erytrocytárním antigenem v průběhu těhotenství, rozvíjí se erytrocytární aloimunizace těhotné ženy a vlivem pronikání vytvořených protilátek přes placentu i hemolytická nemoc plodu a novorozence (hemolytic disease of the fetus and newborn, HDFN). Protilátky jsou vytvářeny imunitním systémem těhotné ženy a jejich množství a kvalita závisí na mnoha faktorech. Jejich funkcí je eliminace fetálních „cizích“ erytrocytů. Způsoby eliminace protilátkami označených fetálních erytrocytů jsou v krevním oběhu těhotné ženy i plodu/novorozence stejné a jejich principem je imunopatologická reakce II. typu, podle klasifikace Coombse a Gella, neboli též cytotoxická. Závažné formy HDFN mohou vést k zvýšené perinatální morbiditě i mortalitě. Prevence rozvoje RhD aloimunizace a rozvoje závažné formy HDFN je založena na podávání polyklonálního imunoglobulinu (Ig) G anti-D při všech potenciálně senzibilizujících událostech. Předpokládaný mechanismus účinku IgG anti-D je založen na rychlém odstranění antigenu přebytkem protilátky a na protilátkami zprostředkované imunitní supresi (antibody mediated immune suppression, AMIS). Přesný imunologický princip, ale zatím není zcela znám.
Závěr: Tento článek popisuje tvorbu nepravidelných protilátek, způsoby eliminace fetálních erytrocytů a princip prevence podáváním antiD imunoglobulinu z imunologického pohledu.
Klíčová slova:
erytrocytární aloimunizace – hemolytická nemoc plodu a novorozence – antigen „D“ – protilátka anti-D – imunopatologická reakce II. typu – protilátka IgG – protilátka IgM – RhD aloimunizace – polyklonální imunoglobulin IgG anti-D – AMIS
ÚVOD
Každý člověk, je-li vystaven cizímu antigenu červené krevní buňky (erytrocytární antigen), který sám nevlastní, si vytváří protilátku. Rozvíjí se „erytrocytární aloimunizace“.
Ke kontaktu s cizím erytrocytárním antigenem může dojít po podání krevní transfuze nebo následkem fetomaternální hemoragie (FMH) v průběhu těhotenství a/nebo při porodu. Vzácně může dojít k maternofetální hemoragii a rozvoji erytrocytární aloimunizace plodu („syndrom babičky“).
Pokud si žena vytvoří antierytrocytární aloprotilátky, pak mohou v průběhu těhotenství pronikat placentou do krevního oběhu plodu a navázat se na antigenně komplementární fetální erytrocyty, které jsou následně destruovány v retikulo-endoteliálním systému plodu. Rozvíjí se „hemolytická nemoc plodu a novorozence“ (hemolytic disease of the fetus and newborn, HDFN).
Dojde-li k primárnímu kontaktu imunitního systému těhotné ženy s inkompatibilním erytrocytárním antigenem plodu, rozvíjí se erytrocytární aloimunizace těhotné ženy, ale k rozvoji závažné formy HDFN dochází ve stávajícím těhotenství jen vzácně. Závažnou formou hemolytické nemoci jsou většinou ohroženy antigenně inkompatibilní plody a novorozenci až v následujících těhotenstvích.
Není-li preexistující erytrocytární aloimunizace u těhotné ženy diagnostikována a hemolytické onemocnění plodu nebo novorozence není léčeno, může vést k závažné perinatální morbiditě i mortalitě.
Dojde-li ke kontaktu s cizím erytrocytárním antigenem v průběhu těhotenství, rozvíjí se erytrocytární aloimunizace těhotné ženy a vlivem pronikání protilátek přes placentu HDFN.
IMUNOLOGICKÝ PRINCIP ERYTROCYTÁRNÍ ALOIMUNIZACE A HEMOLYTICKÉ NEMOCI PLODU
Nejvýznamnější krevně skupinový systém AB0 je tvořen dvěma hlavními antigeny “A“ a “B“, které jsou přítomny na erytrocytech. Mimo to jsou v plazmě přítomny pravidelné (přirozené) antierytrocytární protilátky anti-A a/nebo anti-B (aglutininy) proti antigenům, které nejsou obsaženy ve vlastním fenotypu. Jejich název vychází ze schopnosti aglutinovat (shlukovat) „cizí“ buňky, a tím je ničit. Hlavní funkcí je chránit erytrocyty před nežádoucí vazbou na cizí buňky, především viry a bakterie. Z imunologického pohledu je důležité, že tyto aglutininy jsou protilátkami třídy IgM. Existují i protilátky třídy IgG a IgA, ale ty se většinou vytvářejí až po kontaktu s cizím inkompatibilním erytrocytárním antigenem (transfuze krve, fetomaternální hemoragie). Protilátky IgM se tedy velkou mírou podílejí na procesu eliminace cizích erytrocytů cestou intravaskulární hemolýzy. Protilátka IgM je velká, je to pentamer a nemůže procházet přes placentu do krevního oběhu plodu, kde by mohla mít fatální následky (obr. 1).
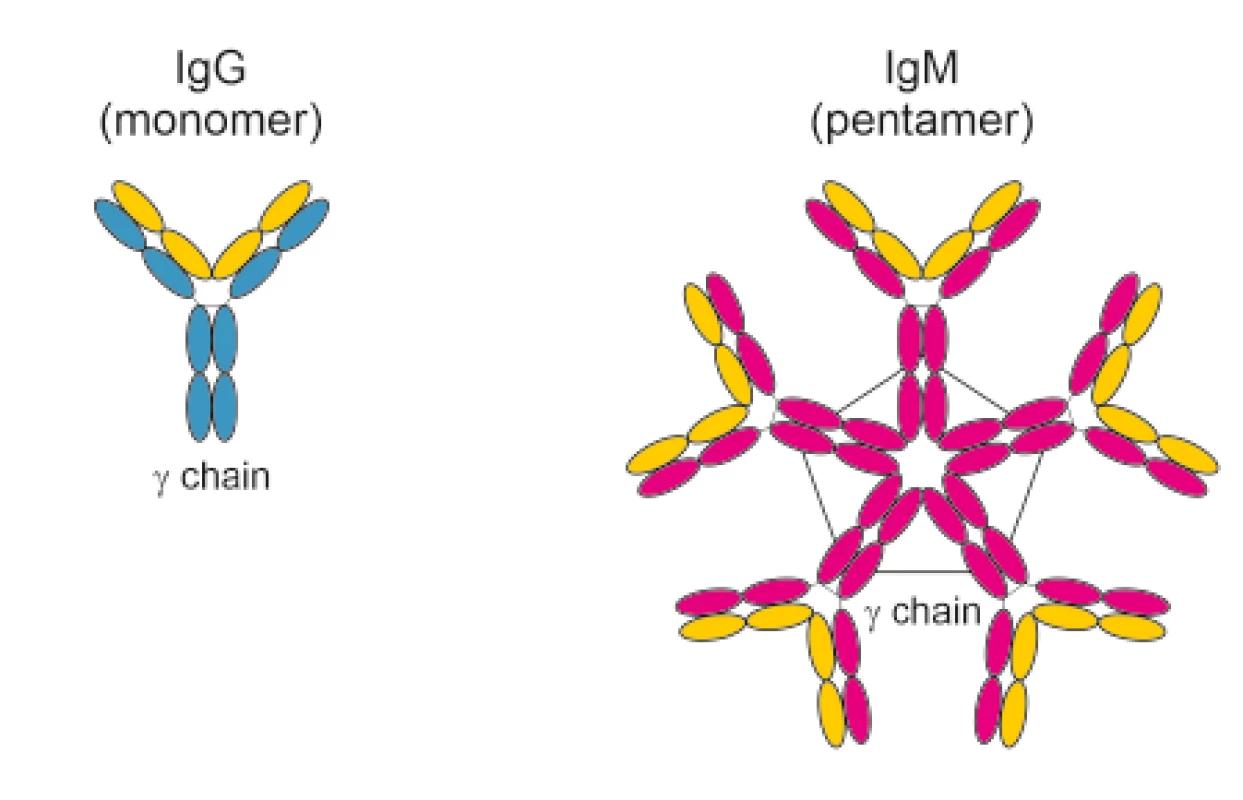
V případě jiných krevně skupinových systémů (Rh, Kell atd.) je situace zcela odlišná. Žádné pravidelné (přirozené) antierytrocytární protilátky (aglutininy) se netvoří a nejsou v plazmě přítomny. Mohou vzniknout pouze po předchozím kontaktu s cizími inkompatibilními erytrocytárními antigeny. Pokud se do krevního oběhu těhotné ženy dostane fetální erytrocyt s inkompatibilním antigenem, je imunitním systémem těhotné ženy vyhodnocen jako „cizí“, který je potřeba zničit.
Reakce imunitního systému na přítomnost inkompatibilních antigenů jiných krevně skupinových systémů než AB0 je stejná, ale pro přehlednost je dále popsána pro antigen “D“ systému Rh.
Vzhledem k tomu, že v organismu RhD negativní těhotné ženy žádné pravidelné (přirozené) anti-D aglutininy neexistují, potkávají se s RhD pozitivními fetálními erytrocyty jako první buňky přirozené imunity, které jsou k nim vnímavé – buňky monocytomakrofágového systému a dendritické buňky. Makrofágy mají schopnost přímé destrukce erytrocytů a společně s monocyty a dendritickými buňkami umí prezentovat „cizí antigeny = fetální erytrocyty“ lymfocytům T a B. Společně jsou nazývány „antigen prezentující buňky“ (antigen presenting cells, APC). Tyto buňky se navážou na fetální erytrocyty a část těchto imunokomplexů je ihned destruována makrofágy a část je APC předložena lymfocytům T a B. Lymfocyty B se následně přeměňují na plazmatické buňky, které začínají produkovat protilátky [8]. Rozvíjí se „erytrocytární aloimunizace“.
Při prvním setkání s antigenem (primární odpověď) se tvoří protilátky třídy IgM, které fungují jako první obranná linie, aby bylo dostatek času na tvorbu protilátek třídy IgG (sekundární odpověď). Vytvořené protilátky, které jsou především podtřídy IgG1 a IgG3, mají několikanásobně vyšší afinitu k antigenu “D“ než protilátky IgM a ve velmi krátkém časovém úseku dojde k jejich navázání na fetální erytrocyty [22].
Předložením antigenu “D“ lymfocytům T a B je zajištěno, že dojde k tvorbě paměťových lymfocytů. V následujícím těhotenství, pokud dojde znovu k průniku RhD pozitivních erytrocytů do krevního oběhu RhD aloimunizované RhD negativní těhotné ženy, je na základě paměťových lymfocytů spuštěna mnohem rychlejší a efektivnější tvorba specifických protilátek anti-D, a to především třídy IgG. Protilátek třídy IgM se v každém následujícím těhotenství tvoří menší množství, a proto je téměř veškerá protilátková odpověď ve třídě IgG. Protilátky třídy IgG jsou na rozdíl od protilátek třídy IgM monomery (malé), a proto bez problémů procházejí placentou do krevního oběhu plodu [8]. Rozvíjí se „Hemolytická nemoc plodu a novorozence“ (hemolytic disease of the fetus and newborn, HDFN) (obr. 1).
Zpožděná tvorba specifických protilátek anti-D třídy IgG při prvním kontaktu s antigenem “D“ je příčinou, proč v těhotenství, kdy dojde k rozvoji erytrocytární aloimunizace těhotné ženy, dochází současně k rozvoji závažné formy HDFN jen vzácně. Protilátky třídy IgG se nevytvoří včas a v dostatečném množství, aby mohly ohrozit plod. Naopak v dalším těhotenství, je-li plod RhD pozitivní, zajistí paměťové lymfocyty v krevním oběhu RhD negativní těhotné ženy produkci dostatečného množství specifických protilátek anti-D třídy IgG, které volně prochází placentou do krevního oběhu plodu a mohou způsobit HDFN [8].
Žádná protilátka však nemá schopnost přímé destrukce antigenu, slouží především k označení a zviditelnění (opsonizaci) imunokomplexu (erytrocyt s antigenem “D“ a navázanou protilátkou IgG anti-D) pro buňky imunitního systému, které schopnost destrukce mají [8]. Způsoby eliminace protilátkami označených fetálních erytrocytů jsou v krevním oběhu těhotné ženy i plodu/novorozence stejné. Nicméně v krevním oběhu těhotné ženy dochází k destrukci cizích (fetálních) erytrocytů, naproti tomu v krevním oběhu plodu/novorozence dochází k destrukci vlastních (fetálních) erytrocytů.
Množství fetálních erytrocytů, které pronikají do krevního oběhu těhotné ženy, je většinou malé, takže jejich eliminace není pro těhotnou ženu nijak nebezpečná. Naopak pro plod/novorozence může představovat destrukce vlastních erytrocytů velké riziko a vždy vede k rozvoji HDFN.
Závažnost HDFN závisí na mnoha faktorech. Mezi nejdůležitější patří koncentrace a typ podtřídy protilátky, její specifita a avidita. Množství protilátky, které přechází přes placentu, je individuální a pro dané těhotenství jedinečné [5].
Existuje mnoho vědeckých studií, které se snažily určit ohrožující titr protilátek („kritický titr“). Stanovit přesnou hodnotu je obtížné. V klinické praxi je za kritický titr považován jakýkoli titr jednoznačně identifikované preexistující klinicky významné aloprotilátky. Obecně ale platí, že s každým dalším těhotenstvím se zvyšuje produkce protilátky mateřským organismem, a tudíž i množství, které přechází přes placentu. Většina protilátek jsou podtřídy IgG1 a IgG3. Mohou se tvořit izolovaně, ale nejčastěji se jedná o jejich kombinaci. Protilátky IgG1 mají větší afinitu k antigenu “D“ a jsou spojeny se závažnějšími formami hemolytického onemocnění plodu. Jejich koncentrace má i prognostický význam na závažnost onemocnění. Naproti tomu protilátky IgG3 zase vykazují mnohem silnější vazbu Fc receptoru protilátky na makrofágy a jsou spojovány se závažnějšími formami hemolytického onemocnění novorozence [16, 24].
Specifita protilátky je daná jejími vlastnostmi, tedy mírou glykosylace, resp. fukosylace. Dá se říci, že čím méně je protilátka fukosylovaná, tím více ztrácí schopnost vyvolat odpovídající imunitní odpověď. Protože se jedná o posttranslační úpravu, může se schopnost fukosylace protilátek významným způsobem měnit i v průběhu života. To může být příčinou, proč u jedné těhotné ženy může být v různých těhotenstvích neočekávaný významný rozdíl mezi závažností HDFN [7, 10].
Velmi také záleží na síle exprese cílového antigenu na erytrocytech plodu. Rh systém je velmi komplexní a polymorfní. Frekvence výskytu Rh antigenů se může lišit podle dané populace. Samotný antigen “D“je soubor 30 různých epitopů na povrchu membrány. Existuje tedy řada kvalitativně (variantní antigen “D“) a kvantitativně (slabé antigeny “D“) odlišných forem RhD proteinu, tedy antigenu [3]. Přestože obecně je antigen “D“ vysoce imunogenní, na základě typu cílového antigenu se může imunitní odpověď lišit.
Dále se na míře závažnosti HDFN podílí gestační stáří plodu v období, kdy hladina protilátek dosáhne kritických hodnot, (ne)přítomnosti blokujících protilátek v séru matky a v neposlední řadě schopnost retikuloendotelového systému plodu destruovat senzibilizované erytrocyty [5].
IMUNOLOGICKÝ PRINCIP ELIMINACE ERYTROCYTŮ
Imunologickým principem destrukce erytrocytů s antigenem “D“ při kontaktu s protilátkou anti-D je imunopatologická reakce II. typu, podle klasifikace Coombse a Gella, neboli též cytotoxická. Tento typ reakce je zprostředkován protilátkami třídy IgM nebo IgG, zacílenými na membránové antigeny [8]. Po navázání protilátky na komplementární receptor na povrchu erytrocytu (antigen “D“), dojde k jejich „označení a zviditelnění“ (opsonizaci) pro složky imunitního systému. Vlastní erytrocyty, které jsou složkami imunitního systému tolerovány, se po opsonizaci stávají cizími antigeny a jsou destruovány.
Při destrukci fetálních erytrocytů se uplatňují následující mechanismy.
1. Fagocytóza
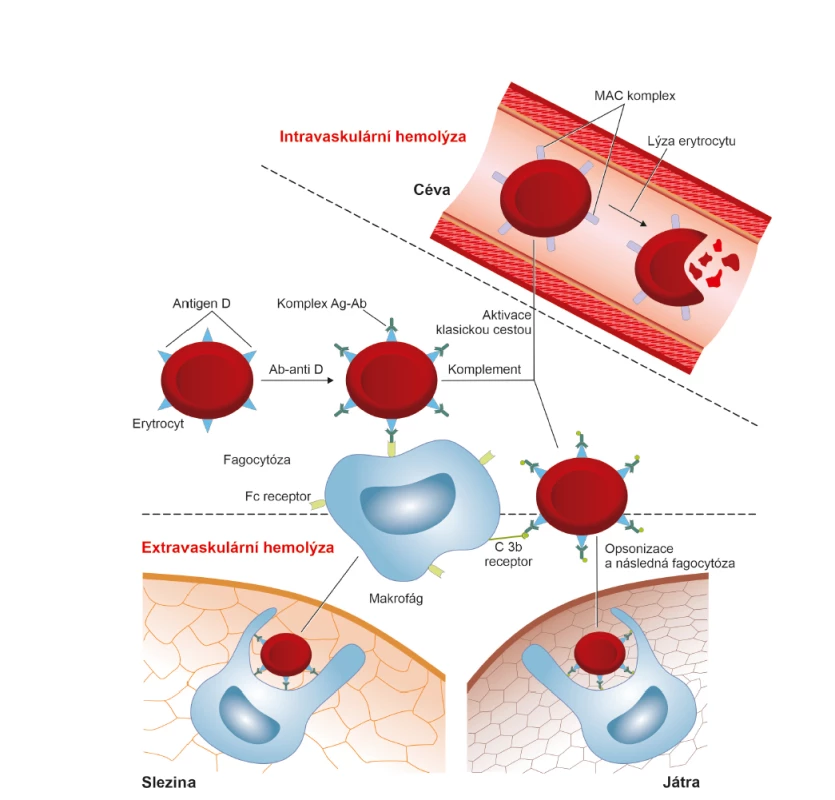
Fagocytóza je schopnost buněk rozpoznat v organismu cizorodou částici, navázat se na ni a pohltit ji. Při reakci II. typu se nejvíce uplatňují specializované buňky se schopností fagocytózy – makrogáfy a monocyty. Protilátka třídy IgG obsahuje šest typů Fc receptorů, které jsou velmi silným vazebným místem pro makrofágy a monocyty [8, 13]. Vzniklý imunokomplex (erytrocyt s antigenem “D“ a navázanou protilátkou IgG anti-D) je při průchodu slezinou a játry vychytáván přes Fc receptor monocyty a makrofágy a destruován. Uvolněný hemoglobin je odbouráván přes bilirubin. Tato destrukce erytrocytů tedy probíhá uvnitř buněk. Jedná se o tzv. extravaskulární hemolýzu, která je bezpečná a probíhá především ve slezině [12] (obr. 2, 5).
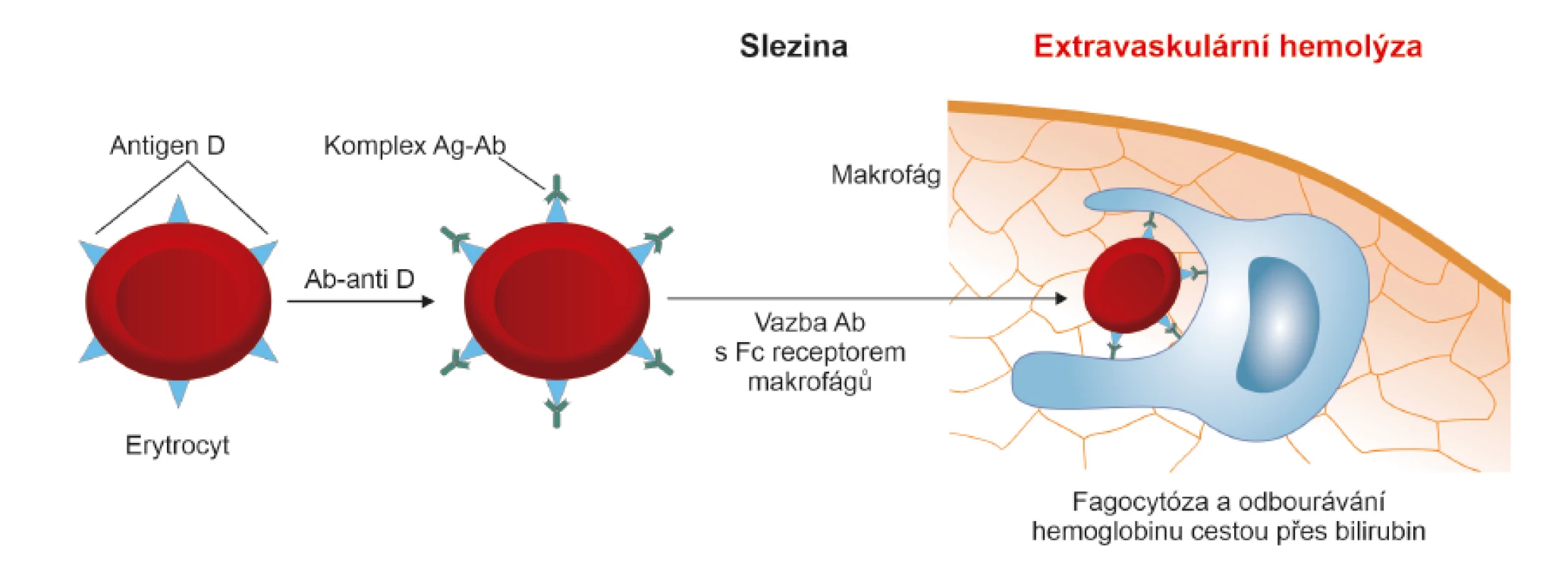
Ag – antigen; Ab (antibody) = Ig (imunoglobulin) – protilátka; Ab/Ig anti-D – protilátka proti antigenu “D“; Fc receptor – krystalizovatelný fragment
protilátky IgG, který působí jako receptor pro různé buňky imunitního systému
2. Cytotoxicita zprostředkovaná komplementem (aktivace komplementu klasickou cestou)
Komplement je soustava sérových a membránových glykoproteinů označovaných jako složky C1 – C9, které mají schopnost opsonizace a lýzy buněk. Jedná se o proces, při kterém je buňka nesoucí antigen rozložena a destruována [8]. Pokud je destrukce erytrocytů způsobena komplementem, děje se tak v krevním řečišti a výsledkem je nebezpečná intravaskulární hemolýza [12].
Vazba protilátky anti-D na antigen “D“ indukuje konformační změny na protilátce a odkryje Fc oblast protilátky, která obsahuje vazebné místo pro C1 složku komplementu. Dochází k aktivaci komplementu tzv. klasickou cestou. Postupná aktivace všech složek komplementu až po složku C9 vede k narušení membrány erytrocytu tvorbou MAC (membrane attack complex, MAC) a k lýze buňky [8, 13]. Jak již bylo uvedeno, tento způsob eliminace erytrocytů je pro organismus nebezpečný, protože jejím výsledkem je převážně intravaskulární hemolýza. Destrukci erytrocytů cestou komplementu není jednoduché navodit. Uplatňuje se především při AB0 inkompatibilitě. Protože však množství fetálních erytrocytů pronikajících do krevního oběhu těhotné ženy je malé, není tato intravaskulární hemolýza pro těhotnou ženu nebezpečná. V případě inkompatibilní krevní transfuze je lýza buněk tak masivní, že se vždy jedná o závažný, život ohrožující stav.
Lýzu navozují především protilátky třídy IgM a pouze některé podtřídy protilátek třídy IgG. Podtřídy IgG3 a IgG1 mohou aktivovat komplement, zatímco IgG2 a IgG4 ho aktivují jen zřídka. Příčinou je počet vazebných míst pro složku C1. Každá C1 molekula se musí vázat nejméně na dvě Fc oblasti protilátky. Na povrchu erytrocytu je negativní náboj, čímž je zajištěno, že se erytrocyty od sebe navzájem odpuzují. Aby došlo k aktivaci minimálně 2 Fc oblastí, musí se vzdálenost mezi erytrocyty přemostit. Toho je schopna pouze velká molekula protilátky IgM, která má nejméně tři vazebná místa pro Fc oblast. Molekula IgG je příliš malá a k aktivaci komplementu klasickou cestou je tudíž zapotřebí, aby koncentrace IgG protilátky byla velmi vysoká. K lýze erytrocytu stačí 1 molekula IgM, ale nejméně 1000 molekul IgG a to ještě správné podtřídy [9] (obr. 3, 5).
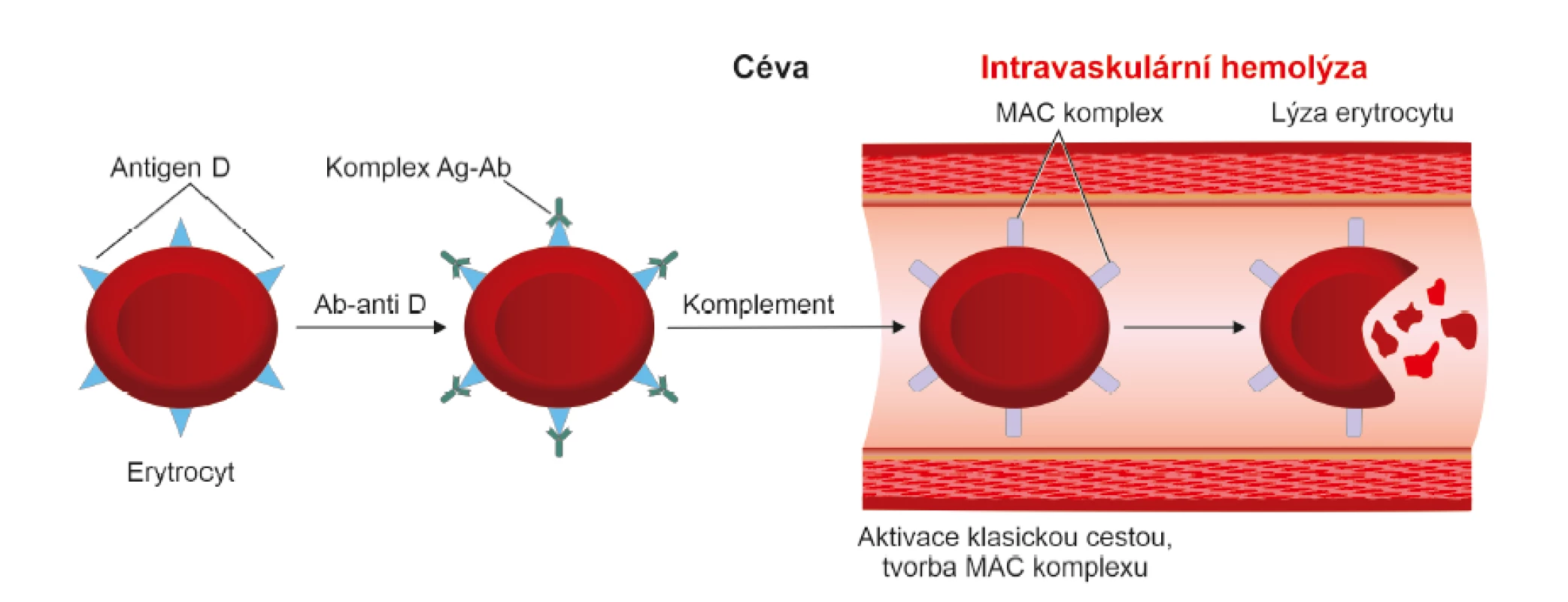
Ag – antigen; Ab (antibody) = Ig (imunoglobulin) – protilátka; Ab/Ig anti-D – protilátka proti antigenu “D“; MAC (membrane attack complex)–
terminální produkt komplementové kaskády, který atakuje membránu buňky a způsobuje její lýzu
3. Opsonizace pomocí komplementu
Mnohem více než lytická se uplatňuje opsonizační schopnost komplementu. Aktivace komplementu proběhne až po složku C3 a pak se imunokomplex (erytrocyt s antigenem “D“ a navázanou protilátkou IgG anti-D) transportuje do jater, kde se přes složku C3b váže na makrofágy. Bezpečná extravaskulární hemolýza probíhá v tomto případě v játrech. Pokud v játrech nedojde k úplné fagocytóze, mění se tvar erytrocytů na sférocyty a ty jsou odstraňovány opět ve slezině [12] (obr. 4, 5).
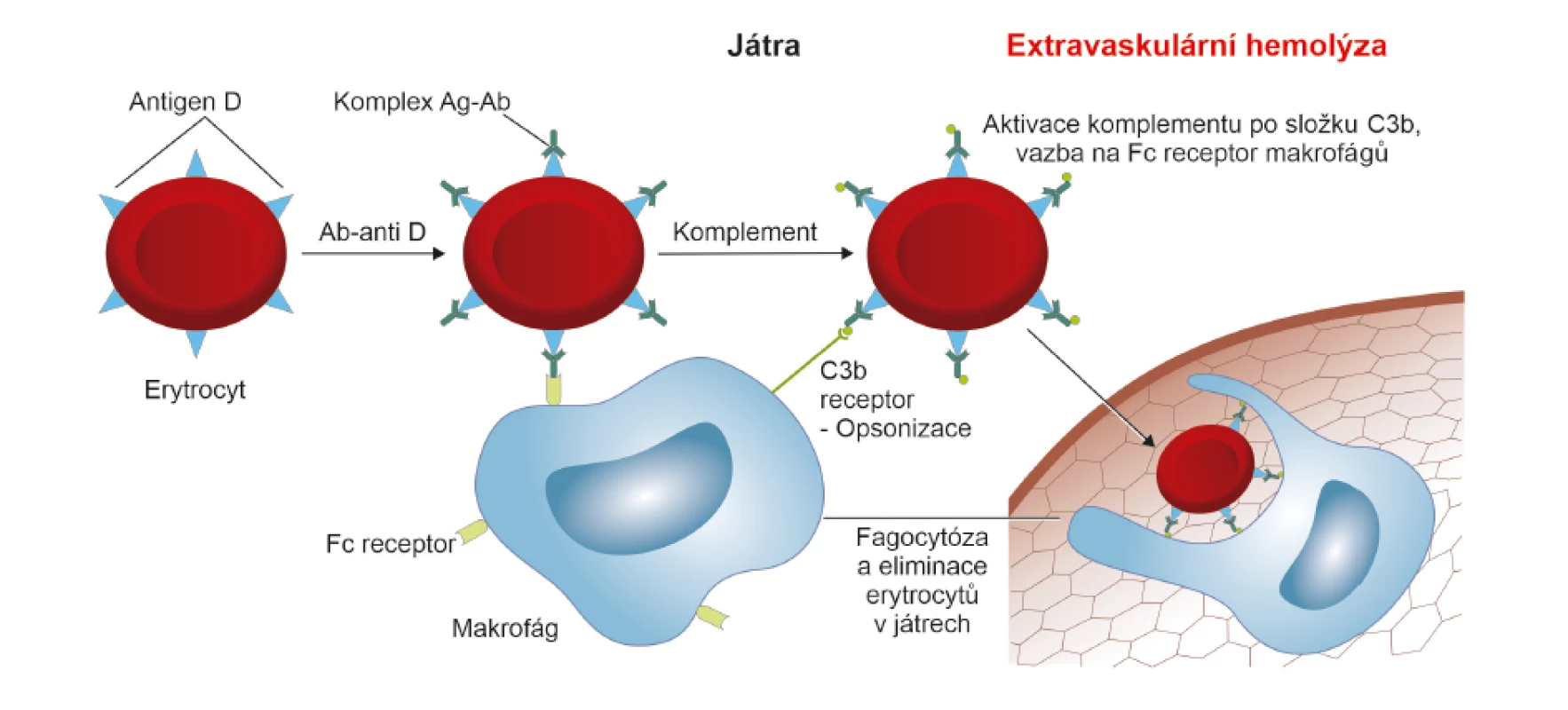
Ag – antigen; Ab (antibody) = Ig (imunoglobulin) – protilátka; Ab/Ig anti-D – protilátka proti antigenu “D“; C3 – složka komplementu, která
je během aktivace komplementové kaskády štěpena na složku C3a a C3b; C3b – fragment C3 složky komplementu, který slouží jako opsonin a
uplatňuje se při aktivaci komplementu jak klasickou, tak alternativní cestou; Fc receptor – krystalizovatelný fragment protilátky IgG, který působí
jako receptor pro různé buňky imunitního systému
IMUNOLOGICKÝ PRINCIP PREVENCE RHD ALOIMUNIZACE U RHD NEGATIVNÍCH ŽEN
Prevence RhD aloimunizace RhD negativních žen je založena na podávání polyklonálního imunoglobulinu (Ig) G anti-D při všech potenciálně senzibilizujících událostech [18].
Antigen “D“ je vysoce imunogenní, což znamená, že v organimu RhD negativních jedinců velmi rychle vyvolává významnou protilátkovou odpověď. Podstata prevence spočívá v zamezení vytvoření protilátek anti-D (vlastní/autologní aniterytrocytární aloprotilátky = rozvoj „erytrocytární aloimunizace“), resp. v rychlém odstranění antigenu “D“ podáním vysokých dávek IgG anti-D (cizí/heterologní antierytrocytární protilátka).
Podané cizí/heterologní protilátky by měly rychle eliminovat RhD pozitivní fetální erytrocyty z krve RhD negativní těhotné ženy, a tím zabránit tvorbě vlastních/autologních aloprotilátek anti-D s následnou tvorbou paměťových lymfocytů. Na rozdíl od vlastních/autologních aloprotilátek anti-D, podaná cizí/heterologní protilátka anti-D nevede k tvorbě paměťových lymfocytů, a tudíž nemůže u RhD negativní ženy v následujícím těhotenství způsobit rozvoj HDFN.
Předpokládaný mechanismus účinku vysokých koncentrací IgG anti-D byl založen na dvou různých jevech [2].
Výskyt HDFN je prokazatelně nižší v případech ABO inkompatibility mezi těhotnou ženou a plodem. Přítomné pravidelné (přirozené) antierytrocytární protilátky (aglutininy) anti-A/B zničí inkompatibilní erytrocyty dříve, než může dojít k vyvolání protilátkové odpovědi proti antigenu “D“.
Antigen specifické IgG protilátky mají schopnost inhibovat činnost imunitního systému a bránit mu v tvorbě nových protilátek, a především v tvorbě paměťových lymfocytů. Tento jev byl prokázán na celé řadě zvířecích modelů a nazývá se protilátkami zprostředkovaná imunitní suprese (antibody mediated immune suppression, – AMIS).
Podávání IgG anti-D při prevenci rozvoje RhD aloimunizace je vysoce účinné. V současné době se k prevenci používá polyklonální IgG anti-D, respektive směs protilátek podtřídy IgG1 a IgG3. Léčivé přípravky IgG anti-D se připravují z plazmy lidských dárců (převážně mužů) imunizovaných antigenem “D“, tudíž jsou dostupné v omezeném množství. Navíc, podání těchto přípravků je spojeno s rizikem přenosu infekčních chorob [20]. Na základě uvedených předpokladů mechanismu účinku IgG anti-D byla vytvořena celá řada rekombinantních monoklonálních nebo polyklonálních IgG anti-D. Bohužel se ukázalo, že nevyvolávají adekvátní imunitní odpověď. V mnoha případech nedošlo k očekávané supresi, ale naopak dokonce k zesílení imunitní odpovědi a rychlejší tvorbě protilátek [1, 14, 21, 23]. Původní předpoklad, že podstata prevence spočívá pouze v rychlém odstranění inkompatibilního antigenu přebytkem protilátek, není tedy zcela správný. Přesný mechanismus účinku ale stále není znám.
Během posledních let bylo na zvířecích modelech testováno několik mechanismů inhibičního účinku AMIS. Jako nejpravděpodobnější se jeví rychlá clearance fetálních erytrocytů, maskování antigenu stérickou zábranou receptorů B-buněk, inhibice reakce B-buněk blokací Fcy receptoru a přímá modulace antigenu [2, 19].
Hypotéza rychlého odstranění (clearence) antigenu
Podle této teorie je pomocí protilátky anti-D urychlen proces fagocytózy, a tím jsou fetální erytrocyty z cirkulace odstraněny dříve, než jsou rozpoznány imunitním systémem těhotné ženy. Erytrocyty opsonizované protilátkou IgG anti-D aktivují Fc receptor na efektorových buňkách a navodí fagocytózu. Zvýšená lýza komplementem se zde neuplatňuje, protože anti-D protilátky v malé koncentraci neaktivují komplement klasickou cestou. Slabinou této hypotézy je skutečnost, že dříve než dojde k odstranění antigenu makrofágy, může být antigen „vyčištěn“ dendritickými buňkami, které naopak vyvolávají imunitní protilátkovou odpověď.
Hypotéza inhibice FcγRIIB receptoru na B lymfocytech
Imunitní reakce se aktivně účastní také B lymfocyty. Jednak vyhledávají imunokomplexy, vážou se na ně, a především po aktivaci specifického receptoru dochází k tvorbě specifických anti-D protilátek. Vazba na imunokomplex probíhá přes receptory FcγR na povrchu B lymfocytů. Hypotéza inhibice je založena faktu, že vzniklý imunokomplex, působí na receptor FcγRIIB inhibičním signálem, a tím zabrání aktivaci B lymfocytů a následné tvorbě protilátek. V modelovém experimentu na myších bylo však prokázáno, že receptor FcγRIIB není pro účinek AMIS nezbytný. Protože v lidském organismu existují molekuly podobné Fc receptorům (FcR-like molecules,FCRL) předpokládá se, že inhibice B lymfocytů probíhá přes některý z nich [4].
Hypotéza sterické zábrany
Tato hypotéza vychází z předpokladu, že navázáním protilátky IgG se zamaskují antigenní epitopy na povrchu erytrocytu, a tím brání jejich rozpoznání a navázání přes specifický receptor na B lymfocytech, čímž nedojde k jejich aktivaci.
Hypotéza modulace antigenu
Modulace antigenu spočívá ve ztrátě nebo supresi cílového antigenu pomocí velkého množství protilátky. Této schopnosti se využívá především při protinádorové antigenně specifické terapii. Výzkumy na myších modelech ukázaly, že pro tento způsob modulace je zapotřebí protilátek, které rozeznávají různé epitopy a současně je potřeba aktivace C3 složky komplementu [17, 19].
Za primární mechanismus je stále považována clearence antigenu. Nedávné práce ale ukázaly, že inhibice proběhla i po přímé modulaci antigenu nezávisle na odstranění erytrocytů. Nicméně, všechny pokusy byly prováděny na inkompatibilních erytrocytech nesoucích pouze jeden antigen. Je otázkou, zda by modulace antigenu fungovala i pokud by na povrchu bylo exprimováno více antigenů současně. Teorii rychlé clearence antigenu stále podporuje nízká míra aloimunizace v případě AB0 inkompatibility.
Další studie ukázaly, že AMIS nemusí být antigenně specifická. Například u mužů, kteří byli senzibilizování erytrocyty s antigeny “D“ a “K“, došlo při jejich pasivní imunizaci pouze imunoglobulinem anti-K potlačení senzibilizace antigenem “D“. K potlačení patrně dochází díky aktivaci adaptivní imunitní odpovědi na cizí antigen indukované protilátkou a nezáleží, proti kterému antigenu byla protilátka podána.
Princip, pochopení a navození AMIS je komplexním problémem. Zatímco účinek protilátky anti-D má tendenci korelovat s rychlým odstraněním (clearence) antigenu, pouze clearance antigenu není jediným mechanismem pro vysvětlení prevence D aloimunizace. Na myších modelech bylo prokázáno, že se do AMIS zapojuje mnoho různých imunitních mechanismů [6, 15].
I přes intenzivní výzkum to nevypadá, že by v blízké budoucnosti byly vytvořeny účinné rekombinantní protilátky anti-D (monoklonální nebo směs polyklonálních), které by nahradily aktuálně používané polyklonální protilátky anti-D připravované z plazmy senzibilizovaných lidských dárců. Vzhledem k tomu, že již existuje možnost neinvazivního stanovení RHD genotypu plodu z volné fetální DNA cirkulující v periferní krvi těhotné ženy, měl by být IgG anti-D podáván pouze RhD negativním ženám, je-li u plodu přítomen komplementární antigen “D“.
prof. MUDr. Marek Ľubušký, Ph.D., MHA
Centrum fetální medicíny
Porodnicko-gynekologická klinika
Univerzita Palackého v Olomouci, Lékařská fakulta Fakultní nemocnice Olomouc
I. P. Pavlova 6
775 20 Olomouc
www.lubusky.com
e-mail: marek@lubusky.com
Sources
1. Belkina, EV., et al. Monoclonal immunoglobulin anti-D for prevention of hemolytic disease of the new-born. Transfus Clin Biol, 1996, 28 p.
2. Brinc, D., Lazarus, AH. Mechanisms of anti-D action in the prevention of hemolytic disease of the fetus and newborn. Hematology Am Soc Hematol Educ Program, 2009, p. 185–191. doi:10.1182/asheducation-2009.1.185.
3. Castillo, B., Dasgupta, A., Klein, K., et al. Transfusion medicine for pathologists 1st Ed. A Comprehensive Review for Board Preparation, Certification, and Clinical Practice, Elsevier, 2018.
4. Davis, RS., Ehrhardt, GR., Leu, CM., et al. An extended family of Fc receptor relatives. Eur J Immunol, 2005, 35, p. 674–680.
5. Hájek, Z., Čech, E., Maršál, K., a kol. Porodnictví, 3. zcela přepracované a doplněné vydání, Praha: Grada, 2014.
6. Hendrickson, JE., Delaney, M. Hemolytic disease of the fetus and newborn: modern practice and future investigations. Transfus Med Rev, 2016, 30(4), p. 159–164.
7. Higel, F., Seidl, A., Sorgel, F., Friess, W. N-glycosylation heterogeneity and the influence on structure, function and pharmacokinetics of monoclonal antibodies and fc Psion proteins. Eur J Pharm Biopharm, 2016, 100, p. 94–100.
8. Hořejší, V., Bartůňková, J. Základy imunologie 4. vydání. Praha: Triton 2009.
9. https://biology.estranky.cz/clanky/imunologie/komplement.html.
10. Kapur, R., Kustiawan, I., Vestrheim, A., et al. A prominent lack of IgG1-fc fucosylation of platelet alloantibodies in pregnancy. Blood, 2014, 123, p. 471–480.
11. Karlsson, MC., Wernersson, S., Diaz de Stahl, T., et al. Efficient IgG-mediated suppression of primary antibody responses in Fcgamma receptor-deficient mice. Proc Natl Acad Sci U S A, 1999, 96, p. 2244–2249.
12. Kittnar, O., et al. Lékařská fyziologie. 1. vydání. Praha: Grada, 2011.
13. Krejsek, J., Andýs, C., Krčmová, I. Imunologie člověka, Hradec Králové: Garamon, s.r.o., 2016.
14. Kumpel, BM. Efficacy of RhD monoclonal antibodies in clinical trials as replacement therapy for prophylactic anti-D immunoglobulin: more questions than answers. Vox Sang,.2007, 93, p. 99–111.
15. Kumpel, BM., Elson, CJ. Mechanism of anti-D-mediated immune suppression-a paradox awaiting resolution? Trends Immunol, 2001, 22(1), p. 26–31. doi:10.1016/s1471-4906(00)01801-9.
16. Lambin, P., Debbia, M., Puillandre, P., Brossard, Y. IgG1 and IgG3 anti-D in maternal serum and on the RBCs of infants suffering fromHDN: relationship with the severity of the disease. Transfusion, 2002, 42, p. 1537–1546.
17. Liu, J., Santhanakrishnan, M., Natarajan, P., et al. Antigen modulation as a potential mechanism of anti-KEL immunoprophylaxis in mice. Blood. 2016, 128(26), p. 3159–3168. doi:10.1182/blood-2016-06-724732.
18. Lubušký, M., Procházka, M., Šimetka, O., Holusková, I. Doporučení k provádění prevence RhD aloimunizace u RhD negativních žen. Doporučený postup ČGPS ČLS JEP. Čes. Gynek., 2013, 78(2), s. 132–133. (Guideline for prevention of RhD alloimmunization in RhD negative women).
19. Maier, CL., Mener, A., Patel, SR., et al. Antibody-mediated immune suppression by antigen modulation is antigen-specific. Blood Adv, 2018, 2(21), p. 2986–3000.
20. Payam Khaja Pasha, R., Shokri, F. Immunologic basis and immunoprophylaxis of RhD induced hemolytic disease of the newborn (HDN). Iran J Immunol, 2008, 5(4), p. 189–200.
21. Thomson, A., et al. Clearance of Rh D positive red cells with monoclonal anti-D. Lancet, 1990, 336, p. 1147–1150
22. Urbaniak, SJ. Alloimmunity to RhD in humans. Transfus Clin Biol, 2006, 13(1–2), p. 19–22.
23. Urbaniak, SJ., et al. Assessment of in vivo function of IgG1 and IgG3 monoclonal anti-D by clearance of Tc99 labelled autologous Rhesus D positive red blood cells. Transfusion, 1998, 38(Suppl.), 33 p.
24. Velkova, E. Correlation between the amount of anti-D antibodies and IgG subclasses with severity of haemolytic disease of foetus and newborn. Open Access Maced J Med Sci, 2015, 3(2), p. 293–297.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2020 Issue 6
Most read in this issue
- Idiopatický polyhydramnion
- Totální laparoskopická hysterektomie – klinické srovnání metody s využitím dvou typu děložních manipulátorů
- Dienogest v léčbě endometriózy
-
Význam doplnění cytologického screeningu karcinomu děložního hrdla o HPV DNA test a třídění nálezu imunocytochemickým barvením p16/Ki67 u žen ve věku 35 a 45 let
Analýza dat studie LIBUŠE
