Kaskádové molekulárně genetické vyšetření u potracených plodů
Stepwise molecular-genetic examination in aborted fetuses
Objective: The evaluation of quantitative fluorescence PCR (QF-PCR) and single nucleotide polymorphism array (SNP array) analysis for the identification of chromosomal abnormalities in products of conception (POC). Materials and methods: A total of 1,094 POC samples were processed at Gennet in the years 2018–2020. Chromosomal aneuploidies were tested by QF-PCR using a Omnibor set (STR markers 13, 18, 21, X a Y), SAB-I set (STR markers 2, 7, 15, 16, 22), SAB-II set (from November 2019, STR markers 4, 6, 14) followed by SNP array analysis (Illumina) on samples with a negative QF-PCR result. All POC samples were tested for maternal contamination. Results: After exclusion of maternal contamination (32% samples) the total number of 742 POC samples were tested by QF-PCR. Chromosomal aneuploidies were found in 273 POC samples (36.8%). Then, 469 QF-PCR negative POC samples were tested by SNP array analysis. Normal female/male profile was confirmed in 402 samples (85.7%) and chromosomal aneuploidies and chromosomal aberrations (deletion/duplication > 10 Mb) in 51 samples (10.9%). Microdeletion/microduplication was found in 16 POC samples (3.4%), two were classified as pathogenic variants and 14 as variants of unknown significance. In a group of women > 35 years of age, statistically significant increase of the chromosomal abnormalities was confirmed. No statistically significant difference between the in vitro fertilization group and the group of spontaneous conception was found. Conclusion: The application of the molecular work-up based on the stepwise use of QF-PCR and SNP array clarifies the cause of the abortion in 43% POC samples. The overall detection rate in the I. trimester was 50.4%.
Keywords:
Aneuploidy – aborted fetus – QF-PCR – SNP-array – chromosomal aberration
Authors:
Trková M.; Prokopcová L.; Bakardjieva-Mihaylova V.; Němec M.; Borgulová I.; Vilímová Z.; Dohnalová L.; Bečvářová V.; Bittóová M.; Horáček J.; Stejskal D.; Koudová M.
Authors‘ workplace:
Centrum lékařské genetiky a reprodukční medicíny, Gennet s. r. o. Praha
Published in:
Ceska Gynekol 2022; 87(2): 104-110
Category:
Original Article
doi:
https://doi.org/10.48095/cccg2022104
Overview
Cíl studie: Zhodnocení kaskádového vyšetření metodami kvantitativní fluorescenční PCR (QF-PCR – quantitative fluorescence PCR) a SNP array (single nucleotide polymorphism array) při identifikaci chromozomálních abnormalit u potracených plodů. Soubor a metodika: V průběhu let 2018–2020 bylo v laboratořích Gennetu zpracováno 1 094 vzorků potracených plodů. Standardní schéma kaskádového vyšetření zahrnovalo screening základních aneuploidií metodou QF-PCR setem Omnibor (STR markery 13, 18, 21, X a Y), setem SAB-nadstavba I (STR markery 2, 7, 15, 16, 22), setem SAB-nadstavba II (od listopadu 2019, STR markery 4, 6, 14) a následně vyšetření metodou SNP array (Illumina). U všech vzorků bylo provedeno ověření/vyloučení maternální kontaminace. Výsledky: Po vyloučení maternální kontaminace (32 % vzorků) bylo metodou QF-PCR vyšetřeno 742 vzorků, 469 (63,2 %) z nich mělo negativní nález a 273 (36,8 %) patologický nález. Vzorky 469 plodů s negativním QF-PCR nálezem byly následně vyšetřeny metodou SNP array. Normální ženský/mužský profil byl potvrzen u 402 plodů (85,7 %), chromozomální aneuploidie a velké chromozomální aberace (delece/duplikace > 10 Mb) u 51 vzorků (10,9 %). U 16 (3,4 %) vyšetřených plodů byla nalezena mikrodelece nebo mikroduplikace, ve dvou případech se jednalo o patogenní mikrodelece a ve 14 o variantu nejasného významu bez přímé souvislosti s abortem. Byl potvrzen statisticky významný vyšší záchyt chromozomálních aberací u plodů žen s věkem > 35 let. Mezi skupinami vyšetřených abortů u gravidit po spontánní koncepci a po in vitro fertilizaci nebyl prokázán statisticky významný rozdíl. Závěr: Kaskádovým vyšetřením metodami QF-PCR a SNP array byla objasněna genetická příčina u 43 % všech vyšetřených abortů. Záchyt chromozomálních abnormalit u časných abortů v I. trimestru byl 50,4 %.
Klíčová slova:
abort – QF-PCR – SNP-array – chromozomální aberace – aneuploidie
Úvod
Přibližně 10–15 % klinicky rozpoznaných těhotenství končí abortem a asi 1 % párů je postiženo opakovanými těhotenskými ztrátami [1]. Etiologie abortu je multifaktoriální, podílejí se na ní endokrinologické, genetické nebo imunologické faktory, vrozené vývojové vady, infekční onemocnění, systémová onemocnění matky, drogy a jiné [2]. Chromozomální anomálie plodu patří mezi nejčastější příčiny abortu v I. trimestru [3]. Zlatým standardem pro vyšetření tkání plodu bylo stanovení karyotypu. Limitacemi této technologie jsou malé rozlišení, obtížná kultivace tkáně z abortu a maternální kontaminace. S rozvojem nových technologií se pro vyšetření abortů začaly používat metody kvantitativní fluorescenční PCR (QF-PCR – quantitative fluorescence PCR) a metody celogenomového screeningu – array nebo NGS. V laboratořích Gennetu se přistoupilo ke kaskádovému vyšetření tkáně potraceného plodu: vyšetření základních aneuploidií metodou QF-PCR s následným vyšetřením vzorků s negativním výsledkem metodou SNP array (single nucleotide polymorphism array). S podobným metodickým přístupem se úspěšně vyšetřují plody v rámci prenatální diagnostiky [4].
Soubor a metodika
Od 1. 1. 2018 do 31. 12. 2020 bylo v molekulárně genetické laboratoři přijato 1 094 vzorků produktů konceptu: 869 vzorků plodů I. trimestru, 153 vzorků plodů II. trimestru a u 72 vzorků nebyla informace uvedena. Spontánní koncepce byla uvedena u 653 plodů s průměrným věkem žen 33,3 let. Použití některé z technik in vitro fertilizace (IVF) bylo uvedeno u 369 plodů, průměrný věk žen v této skupině byl 34,9 let. Přehled přijatých vzorků je uveden v tab 1.
Tab. 1. Overview of received samples of the concept product in the years 2018–2020.
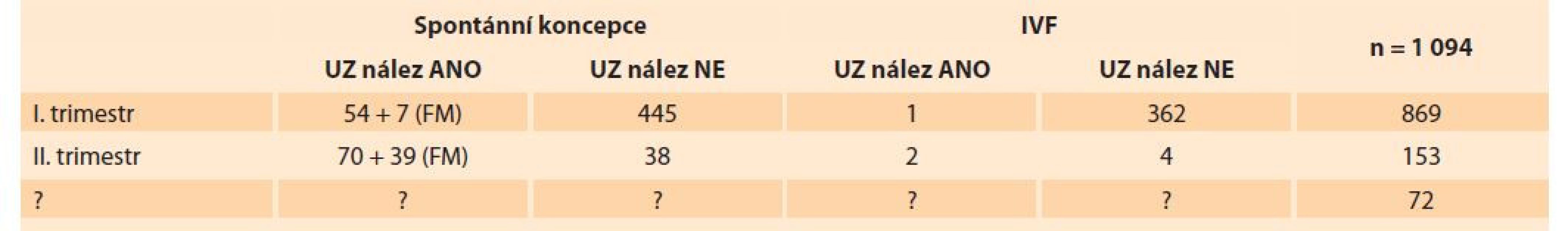
Materiál (tkáň plodu, choriové klky) byl dodáván ve fyziologickém roztoku, současně byla odebrána periferní krev matky; u všech vzorků bylo provedeno porovnání DNA tkáně plodu a DNA periferní krve matky pro vyloučení maternální kontaminace. Izolace DNA byla provedena kitem QIAamp DNA Mini Kit (QIAGEN). Standardní schéma vyšetření všech přijatých vzorků potracených plodů zahrnovalo nejdříve screening základních aneuploidií metodou QF-PCR setem Omnibor (STR markery pro chromozomy 13, 18, 21, X a Y), nadstavbovým setem SAB-nadstavba I (STR markery pro chromozomy 2, 7, 15, 16, 22), nadstavbovým setem SAB-nadstavba II (od listopadu 2019, STR markery pro chromozomy 4, 6, 14) a následně vyšetření metodou SNP array (Infinium Global Screening Array-24, Illumina Inc., San Diego, CA). Kaskádového vyšetření DNA izolované z potracených plodů je zobrazeno ve schématu 1. Statistické hodnocení bylo provedeno Fisherovým exaktním testem (GraphPad).
Scheme 1. Stepwise DNA examination in pregnancy losses.

Výsledky
V průběhu let 2018–2020 byla izolována DNA z 1 094 vzorků potracených plodů. U všech vzorků bylo provedeno ověření původu biologického materiálu porovnáním haplotypu DNA potraceného plodu a periferní krve matky. U 352 vzorků (32 %) byla prokázána kontaminace maternální tkání (305 vzorků I. trimestru, pět vzorků II. trimestru a 42 vzorků bez informace o stáří gravidity) a další vyšetření nebylo provedeno. U 17 vzorků nebylo provedeno kompletní kaskádové vyšetření z důvodu nízké koncentrace izolované DNA, a proto nebyly zahrnuty do kompletní statistiky.
QF-PCR
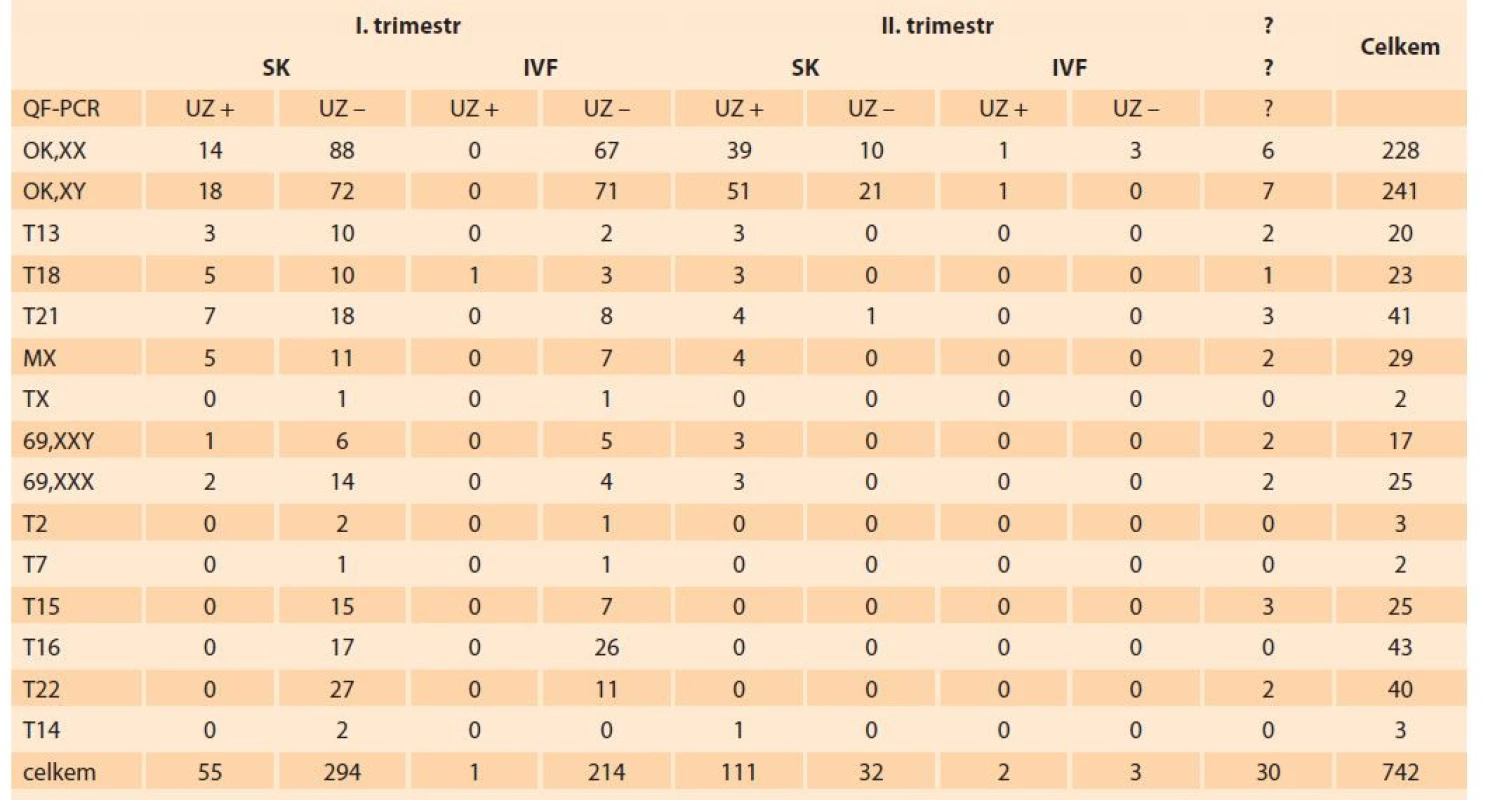
Metodou QF-PCR (Omnibor, SAB-nadstavba I a II) bylo vyšetřeno 742 vzorků, 469 z nich mělo negativní nález (63 %) a 273 patologický nález (37 %). U vzorků plodů I. trimestru (564) po spontánní koncepci (349) a po IVF (215) bylo nalezeno 234 aneuploidií (41,5 %). Ve skupině vzorků po spontánní koncepci (349) byl záchyt 23 aneuploidií z 55 plodů s ultrazvukovým (UZ) nálezem (41,8 %) a 134 aneuploidií z 294 plodů bez UZ nálezu (46 %). Ve skupině vzorků po IVF (215) byl záchyt jedné aneuploidie u plodu s UZ nálezem a 76 u plodů bez UZ nálezu (35,8 %). U vzorků plodů II. trimestru (148) po spontánní koncepci (143) a po IVF (5) bylo nalezeno 22 aneuploidií (14,9 %). Ve skupině vzorků po spontánní koncepci byl záchyt 21 aneuploidií ze 111 plodů s UZ nálezem (18,9 %) a jeden u plodu z 32 bez UZ nálezu (3,1 %). Ve skupině vzorků po IVF nebyly patologie metodou QF-PCR nalezeny. Nejčastějšími nalezenými aneuploidiemi byly trisomie chromozomů 16, 21, 22, 13, 18, 15, monosomie X a triploidie. Ve skupině vzorků plodů bez informací o stáří gravidity (30) bylo nalezeno 17 aneuploidií.
SNP array
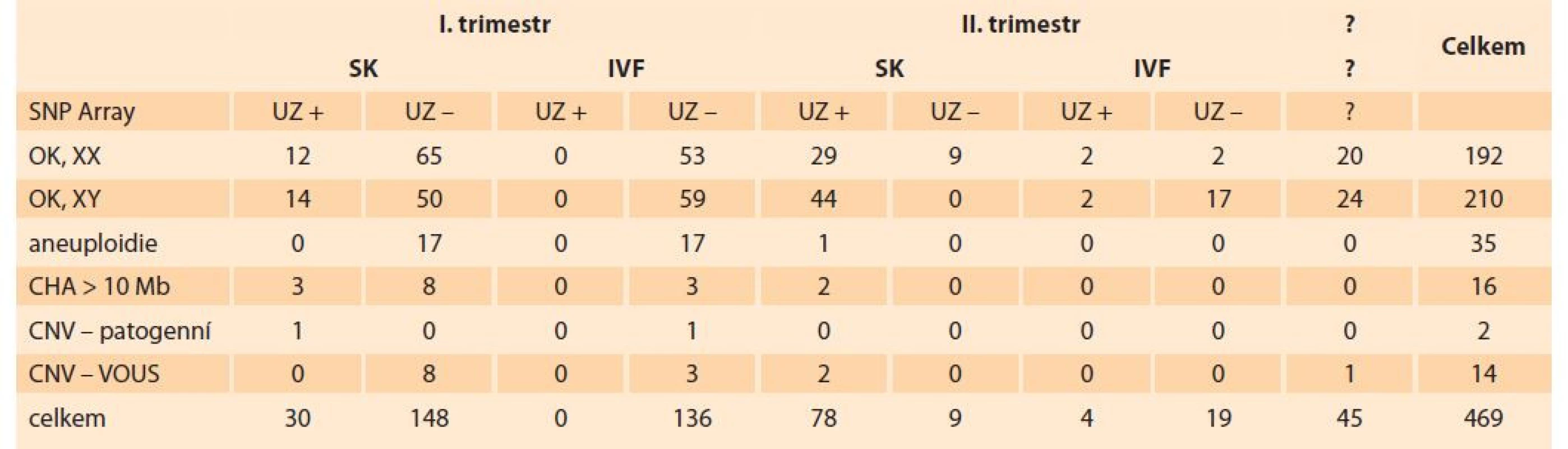
Metodou SNP array bylo následně vyšetřeno 469 plodů s negativním nálezem z QF-PCR. Normální ženský/mužský profil byl potvrzen u 402 plodů (85,7 %), chromozomální aneuploidie a velké chromozomální aberace (delece/duplikace > 10 Mb) byly nalezeny u 51 vzorků (10,9 %). U 16 vyšetřovaných plodů byla nalezena mikrodelece nebo mikroduplikace (3,4 %), ve dvou případech se jednalo o patogenní mikrodelece a ve 14 o variantu nejasného významu bez přímé souvislosti s abortem.
Aneuploidie a strukturní chromozomální aberace
Celkově bylo kaskádovým vyšetřením abortů zachyceno 326 patogenních chromozomálních odchylek (43,9 %), u časných abortů v I. trimestru je záchyt 50,4 %. Přehledně jsou výsledky vyšetření metodami QF-PCR a SNP array uvedeny v tab. 2, 3 a grafu 1. Nejčastěji zachycenou aneuploidií u abortů byly trisomie 16, trisomie 21, trisomie 22, monosomie X, trisomie 13, trisomie 18 a triploidie. Všechny zmíněné chromozomy jsou v setech QF-PCR vyšetření. Vyšetřením SNP array bylo nalezeno 16 velkých strukturních aberací. V sedmi případech se jednalo o terminální deleci/duplikaci dvou různých chromozomů a u devíti plodů byla potvrzena delece nebo duplikace většího rozsahu (> 10 Mb). Bylo nalezeno 16 mikrodelecí/mikroduplikací, dvě z nich byly hodnoceny jako jednoznačně patogenní aberace se souvislostí s abortem. Jako varianty nejasného významu bez jasné souvislosti s abortem bylo hodnoceno 14 mikrodelecí/mikroduplikací s neúplnou penetrancí.
Tab. 2. Overview of the results of the examination of aborted fetuses by QF-PCR.
Tab. 3. Overview of results of the examination of aborted fetuses by the SNP array method.
Graph 1. Age of women with miscarriages.

Věk
Byly vyšetřeny aborty žen ve věkovém rozmezí od 19 do 48 let. Zastoupení jednotlivých věkových skupin je na grafu 2. Žen s věkem < 35 let bylo 415, patologický nález byl u 155 plodů (37,3 %). Žen s věkem 35 let a více jsme vyšetřili 327, patologický nález byl u 187 plodů (57,2 %). Byl potvrzen statisticky významný vyšší záchyt patologií u plodů žen s věkem > 35 let (p = 0,0001). Zastoupení početních a strukturních odchylek v jednotlivých věkových skupinách je znázorněno na grafu 3 a 4.
Graph 2. Chromosomal aneuploidies in miscarriages.

Graph 3. Aneuploidies and structural chromosomal aberrations in age subgroups.

Graph 4. Frequency of chromosomal abnormalities in age subgroups.

Spontánní koncepce vs. IVF
Kaskádovým vyšetřením bylo vyšetřeno 220 plodů pro některé z technik IVF (bez provedeného screeningu aneuploidií v rámci preimplantačního testování), u 98 z nich byl prokázán patologický výsledek (44,5 %). Ze 492 plodů po spontánní koncepci byl patogenní nález u 211 (42,9 %). Nebyl prokázán statisticky významný rozdíl záchytu patologií mezi těmito skupinami (p = 0,4166).
I. trimestr vs. II. trimestr
Celkem bylo vyšetřeno 564 plodů po abortu v I. trimestru, u 284 z nich byl prokázán patologický nález (50,4 %). Ze 148 plodů v II. trimestru byl nález u 25 z nich (16,9 %). Statisticky významný vyšší záchyt chromozomálních odchylek byl prokázán u plodů v I. trimestru (p = 0,0001). UZ nález byl přítomen převážně u plodů ve II. trimestru, v této skupině byl celkově nižší záchyt patogenních chromozomálních odchylek. Statisticky významný vyšší záchyt patologií byl prokázán u časných abortů v I. trimestru i u plodů bez UZ nálezu (p = 0,0009).
Diskuze
Zjištění příčiny abortu je důležité pro plánování dalšího těhotenství. Ačkoli příčiny mohou být různé, chromozomální abnormality jsou nejčastější příčinou abortů v I. trimestru [5]. Proto je vyšetření chromozomů u potraceného plodu jedním ze základních diagnostických přístupů. V současné době je stanovení karyotypu nahrazováno metodami molekulární genetiky, především technikami celogenomového screeningu chromozomů.
V této studii jsme pro vyšetření tkáně plodu použili kombinaci metod QF-PCR a SNP array. V prvním kole byly setem Omnibor vyšetřeny aneuploidie chromozomů 13, 18, 21, X a Y, čímž bylo zachyceno 51,3 % všech aneuploidií, nadstavbovým setem SAB-nadstavba I (chromozomy 2, 7, 15, 16, 22) bylo nalezeno dalších 37,0 % aneuploidií a setem SAB – nadstavba II (chromozomy 4, 6, 14) 4,9 % aneuploidií. Méně časté aneuploidie ostatních chromozomů (chromozomy 3, 5, 8, 9, 12, 17 a 20) byly identifikovány celogenomovým screeningem metodou SNP array (6,8 % aneuploidií). Trisomie celých chromozomů byly detekovány u všech chromozomů, vyjma 1, 10, 11 a 19. Nejpočetnějším nálezem byla trisomie chromozomu 16 (43) a i jiné studie potvrzují, že se jedná o jednu z nejčastějších příčin těhotenských ztrát [6]. Větší podíl chromozomálních aberací byl nalezen u plodů v I. trimestru, většina chromozomálních aneuploidií není totiž slučitelná s vývojem životaschopného plodu (s výjimkami trisomie chromozomů 21, 18, 13 a monosomie chromozomu X). Na abortu ve II. trimestru se více podílejí další faktory [7].
Metodou SNP array byly navíc identifikovány velké strukturní chromozomální změny. U sedmi plodů byla nalezena delece jednoho a duplikace jiného chromozomu, což je typický obraz nebalancované sestavy chromozomů, pokud je jeden z rodičů nosičem balancované chromozomální translokace. U čtyř z těchto sedmi párů byl vyšetřením karyotypu potvrzen nosič balancované chromozomální translokace, u tří párů nemáme další informace. U devíti plodů byla potvrzena delece nebo duplikace většího rozsahu (> 10 Mb), v pěti případech z těchto devíti byl prokázán de novo výskyt, o čtyřech případech nemáme další informace. Metodou SNP array jsme zachytili i delece a duplikace, které by nebylo možné identifikovat v karyotypu: 2krát se jednalo o jednoznačně patogenní deleci související s abortem. V obou případech se jednalo o parciální deleci krátkého raménka chromozomu 8 (5 Mb a 4 Mb velká delece), kdy byly zasaženy geny související s vývojem srdce a centrální nervové soustavy. SNP array zachytila i mikrodelece a mikroduplikace posouzené jako varianty nejasného významu (14 případů), bez jasné souvislosti s abortem, ale s možnými konsekvencemi pro plánování další gravidity (mikrodeleční nebo mikroduplikační syndromy s neúplnou penetrancí a variabilní expresivitou).
Podíl chromozomálních abnormalit u potracených plodů je asociován s věkem matky a zvyšuje se od 10 % u plodů matek starých 20 let po 75 % záchytu u matek starých 40 let [8,9]. V našem souboru jsme porovnali frekvence patologických nálezů v jednotlivých věkových skupinách (graf 3, 4) a potvrdili jsme tuto premisu: ve věkové skupině 20–24 let byl záchyt < 30 %, ve věkových skupinách > 40 let pak podíl patologických nálezů přesáhl 60 %. Vyšší záchyt chromozomálních odchylek u potracených plodů žen > 35 let jsme potvrdili i statisticky.
U 712 vyšetřených abortů jsme měli informace, zda se jednalo o spontánní koncepci, či umělé oplození. Průměrný věk žen po spontánní koncepci byl 33 let (492 aborty), průměrný věk žen po IVF byl 35 let (220 abortů). Mezi těmito dvěma skupinami nebyl prokázán statisticky významný rozdíl v podílu chromozomálních odchylek u vyšetřených plodů. Publikované studie dokumentují asociaci vyššího záchytu chromozomálních aneuploidií s věkem ženy, nikoli s technikami IVF [10].
V této studii jsme prokázali vysoce efektivní a ekonomicky optimální přístup kombinací metod QF-PCR a SNP array. Ve shodě s publikovanou literaturou [1,3,5] byla celkově kaskádovým vyšetřením objasněna genetická příčina u 43,9 % abortů, u časných abortů v I. trimestru byl záchyt 50,4 %.
Doručeno/Submitted: 29. 12. 2021
Přijato/Accepted: 4. 1. 2022
RNDr. Marie Trková, Ph.D.
Centrum lékařské genetiky a reprodukční medicíny
Gennet s. r. o., Kostelní 292/9
170 00 Praha 7
Sources
1. Rai R, Regan L. Recurrent miscarriage. Lancet 2006; 368 (9535): 601–611. doi: 10.1016/ S0140-6736 (06) 69204-4.
2. Larsen EC, Christiansen OB, Kolte AM et al. New insights into mechanisms behind miscarriage. BMC Med 2013; 11 : 154. doi: 10.1186/1741 - 7015-11-154.
3. Menasha J, Levy B, Hirschhorn K et al. incidence and spectrum of chromosome abnormalities in spontaneous abortions: new insights from 12-year study. Genet Med 2005; 7 (4): 251–263. doi: 10.1097/01.gim.0000160075.967 07.04.
4. Trková M, Putzová M, Bečvářová V et al. Implementation of arrays in first trimester prenatal diagnosis. Ceska Gynekol 2015; 80 (3): 176–180.
5. Massalska D, Zimowski JG, Bijok J et al. First trimester pregnancy loss: clinical implication of genetic testing. J Obstet Gynaecol Res 2017; 43 (1): 23–29. doi: 10.1111/jog.13179.
6. Choi TY, Lee HM, Park WK et al. Spontaneous abortion and recurrent miscarriage: a comparison of cytogenetic diagnosis in 250 cases. Obstet Gynecol Sci 2014; 57 (6): 518–525.
7. Christiansen OB, Steffensen R, Nielsen HS et al. Multifactorial etiology of recurrent miscarriage and its scientific and clinical implications. Gynecol Obstet Invest 2002; 66 (4): 257–267. doi: 10.1159/000149575.
8. Andersen AM, Wohlfahrt J, Christens P et al. Maternal age and fetal loss: population based register linkage study. BMJ 2000; 320 (7251): 1708–1712. doi: 10.1136/bmj.320.7251. 1708.
9. Grande M, Borrell A, Garcia-Posada R et al. The effect of maternal age on chromosomal anomaly rate and spectrum in recurrent miscarriage. Hum Reprod 2012; 27 (10): 3109–3117. doi: 10.1093/humrep/des251.
10. Kushnir VA, Frattarelli JL. Aneuploidy in abortuses following IVF and ICSI. J Assist Reprod Genet 2009; 26 (2–3): 93–97. doi: 10.1007/ s10815-009-9292-z.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2022 Issue 2
Most read in this issue
- Hymenální atrezie – vzácná kongenitální anomálie s rizikem pozdního stanovení diagnózy
- Aktuální data o účinnosti profylaktické HPV vakcinace v primární prevenci cervikálních lézí
- Asistovaná reprodukce u mužů s Klinefelterovým syndromem
- Materská mortalita v Slovenskej republike v rokoch 2007–2018
