Faktory zvyšující riziko malignity při nálezu endometriálního polypu v ultrazvukovém obraze
Ultrasound finding of endometrial polyp and factors increasing risk of malignancy
This article presents a comprehensive review of factors that increase the risk of malignancy in ultrasound findings of an endometrial polyp. We collected original studies, reviews, and meta-analyses that dealt with the topic of endometrial polyps and the risk of developing endometrial cancer. Each presumed risk factor was analysed individually. According to searched studies, abnormal uterine bleeding, old age, and body mass index are valid risk factors for developing endometrial cancer in endometrial polyps. Lynch syndrome patients are also in a high-risk group for endometrial cancer. On the other hand, the number of polyps, their size, diabetes mellitus, hypertension, and positive family history are factors with inconclusive results. There are either not enough data or different results among several studies.
Keywords:
Endometrial carcinoma – risk factors – abnormal uterine bleeding – tamoxifen – endometrial polyp – polyp size
Authors:
M. Koblížková 1
; P. Bretová 1; Michal Felsinger 1
; Luboš Minář 1
; Markéta Bednaříková 2
; Vít Weinberger 1
Authors‘ workplace:
Gynekologicko-porodnická klinika LF MU a FN Brno
1; Interní hematologická a onkologická klinika LF MU a FN Brno
2
Published in:
Ceska Gynekol 2024; 89(1): 44-51
Category:
doi:
https://doi.org/10.48095/cccg202444
Overview
Cílem článku je přinést ucelený přehled rizikových faktorů a jejich vztahu ke vzniku malignity endometria při ultrazvukovém nálezu endometriálního polypu. Přehledová práce byla vytvořená systematickým sběrem a tříděním původních prací, review a metaanalýz se vztahem k problematice endometriálních polypů a riziku přítomnosti malignity. Každý jednotlivý předpokládaný rizikový faktor byl samostatně podroben rozboru literatury. V případě abnormálního děložního krvácení, vyššího věku pacientky a hodnoty indexu tělesné hmotnosti se výsledky studií poměrně jednotně shodují na vysokém riziku přítomnosti malignity v děložním polypu. Vysoké riziko mají také pacientky s Lynchovým syndromem. Co se týče potenciálních rizikových faktorů, jako je počet a velikost polypu, diabetes, hypertenze či pozitivní rodinná anamnéza, není dostatek dat k jasnému závěru a/nebo se publikované výsledky liší.
Klíčová slova:
karcinom endometria – rizikové faktory – tamoxifen – endometriální polyp – velikost polypu – abnormální děložní krvácení
Úvod
Endometriální polyp vzniká lokálním růstem endometriální tkáně skládající se ze žlázek, stromatu a cév endometria, které jsou pokryty epiteliální tkání. Jejich velikost se pohybuje od pár milimetrů do několika centimetrů. V děložní dutině se mohou nacházet jednotlivě i ve větším počtu [1]. Endometriální polyp je nejčastějším benigním pre- i postmenopauzálním patologickým nálezem v dutině děložní. Polypy mohou být klinicky symptomatické i asymptomatické. Dle studie IETA3 (International Endometrial Tumor Analysis) publikované v roce 2022 byla u 1 745 asymptomatických pacientek (bez přítomnosti postmenopauzálního krvácení nebo krvácení mimo cyklus) incidence nálezu endometriálního polypu 58,9 % (66 % premenopauzální, 52 % postmenopauzální) [2]. Základní prebioptickou diagnostickou metodou je transvaginální ultrazvuk (TVS). V případě rozhodnutí o chirurgické léčbě endometriálních polypů je zlatým standardem jejich resekce za pomoci operačního hysteroskopu [3].
Dosud prokázanými rizikovými faktory pro vznik endometriálních polypů jsou vysoký věk, hypertenze, obezita, syndrom polycystických ovarií, pozdní menopauza, užívání tamoxifenu a další stavy spojené s hyperestrinizmem (časná menarche, pozdní menopauza, nulliparita), zatížená rodinná anamnéza a genetická predispozice [3–5]. Tyto faktory se shodují s rizikovými faktory vzniku karcinomu endometria. Endometriální karcinom (EC) je nejčastější gynekologicko-onkologické onemocnění v rozvinutých zemích [5]. V ČR byla v roce 2021 incidence onemocnění 35/100 000 osob [6]. V závislosti na jednotlivých rizikových faktorech a jejich kombinaci se prevalence vzniku EC u premenopauzálních i postmenopauzálních žen v souvislosti s výskytem polypu pohybuje v rozmezí 0,5–3 % [7–9]. Ve studii Garudi et al. zaměřené na pacientky s ultrazvukovým nálezem endometriálního polypu byla provedena hysteroskopická polypektomie u 1 519 pacientek. Nález polypu bez atypií byl u 92,4 % (1 404) pacientek. V 1,1 % (17) případů byl nález atypického polypu s atypickou hyperplazií a v 1,0 % (15) případů nález EC [3].
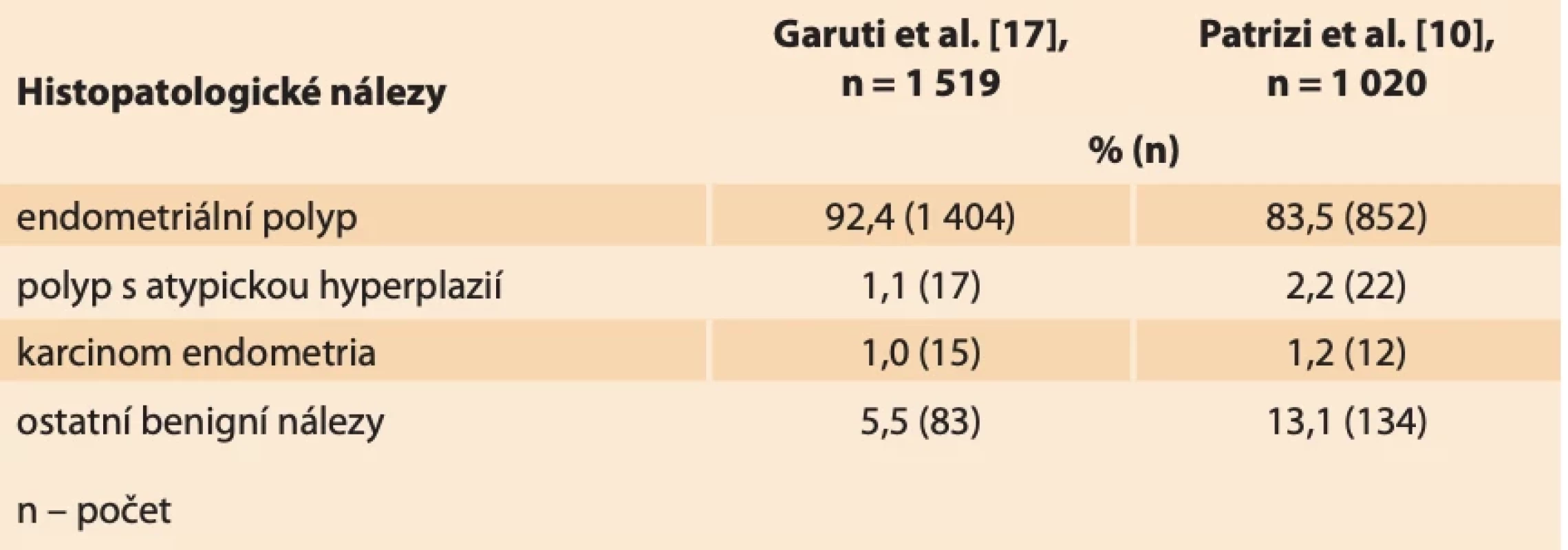
V roce 2022 byla uskutečněna rozsáhlá studie Patrizi et al., kdy byla provedena hysteroskopie 1 020 pacientkám s abnormálním ultrazvukovým nálezem v dutině děložní. Jednalo se o pacientky premenopauzální (403) i postmenopauzální (617). U premenopauzálních pacientek byl potvrzen v 90,0 % (399) benigní nález, kterým byl nejčastěji (v 77,4 %) endometriální polyp. EC se u dané skupiny nevyskytl, v 1 % byl nález atypické hyperplazie. V případech postmenopauzálních pacientek se benigní nález vyskytl u 95,1 % (587), kdy endometriální polyp byl přítomen v 87,5 % případů (540). EC se našel v 1,9 % (12) případů, atypická hyperplazie v 2,9 % (18) případů (tab. 1) [10].
Diagnóza benigního polypu je stanovena definitivním histologickým vyšetřením. Jedná se ovšem o invazivní metodu, která má svoje limity a rizika. U některých pacientek není technicky možné provedení biopsie z dutiny děložní, u některých je samotný výkon z důvodů vážných komorbidit kontraindikovaný. V určitém procentu bude operační zákrok nevýtěžný, neboť nebude získáno adekvátní množství materiálu pro histologické vyšetření, a přitom obraz patologické léze v dutině děložní bude perzistovat. V těchto specifických případech přistupujeme k nálezu konzervativně a snažíme se provádět pravidelná ultrazvuková vyšetření, jejichž cílem bude odhalit změnu v ultrazvukovém obraze a dát ji do korelace s případnými klinickými projevy pacientky [11].
Cílem článku je přinést ucelený přehled o možných rizikových faktorech vzniku malignity v endometriálním polypu a jejich významnosti. Kromě epidemiologických rizikových faktorů zmíníme i rizikové ultrazvukové charakteristiky, které byly definovány v rámci terminologie IETA (International Endometrial Tumor Analysis) [2,12,13]. Jedná se o kritické informace, které slouží k adekvátní informovanosti pacientky, pomohou lékaři v dalším diagnosticko-terapeutickém přístupu a ve stanovení adekvátního, na míru šitého postupu.
Metodika
Jedná se o přehledový článek. K vyhledání publikací byly použity databáze MEDLINE (PubMed) a EMBASE (ELSEVIER) za užití klíčových hesel pro vyhledávání: endometrial polyp* AND risk* AND (malignan* OR cancer OR carcinom*), polyp* AND endometrial* (malignan* OR cancer OR carcinom*), risk factor* AND endometrial (malignan* OR cancer OR carcinom*), tamoxifen AND endometrial (malignan* OR cancer OR carcinom*). Použity byly jednak původní práce, retrospektivní a prospektivní studie a také review a metaanalýzy. Ze sesbíraných článků byly vyřazeny kazuistiky (tab. 2).
Rizikové faktory
Ultrazvukové charakteristiky
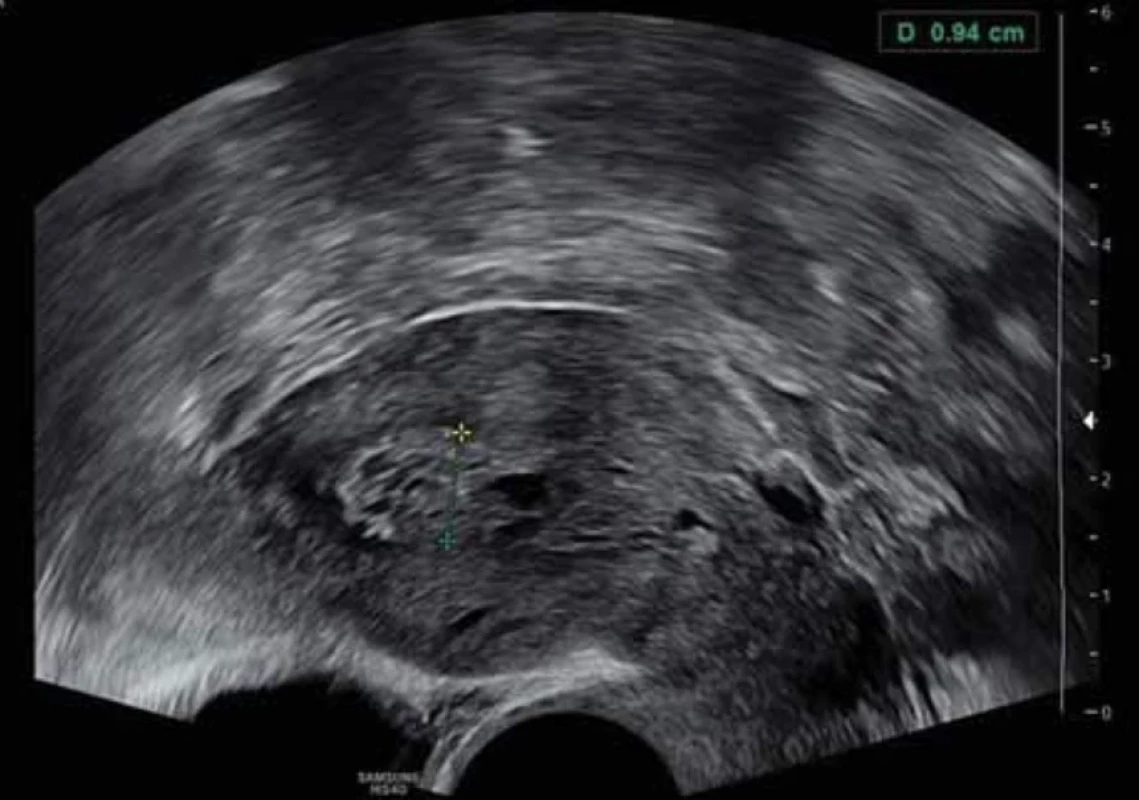
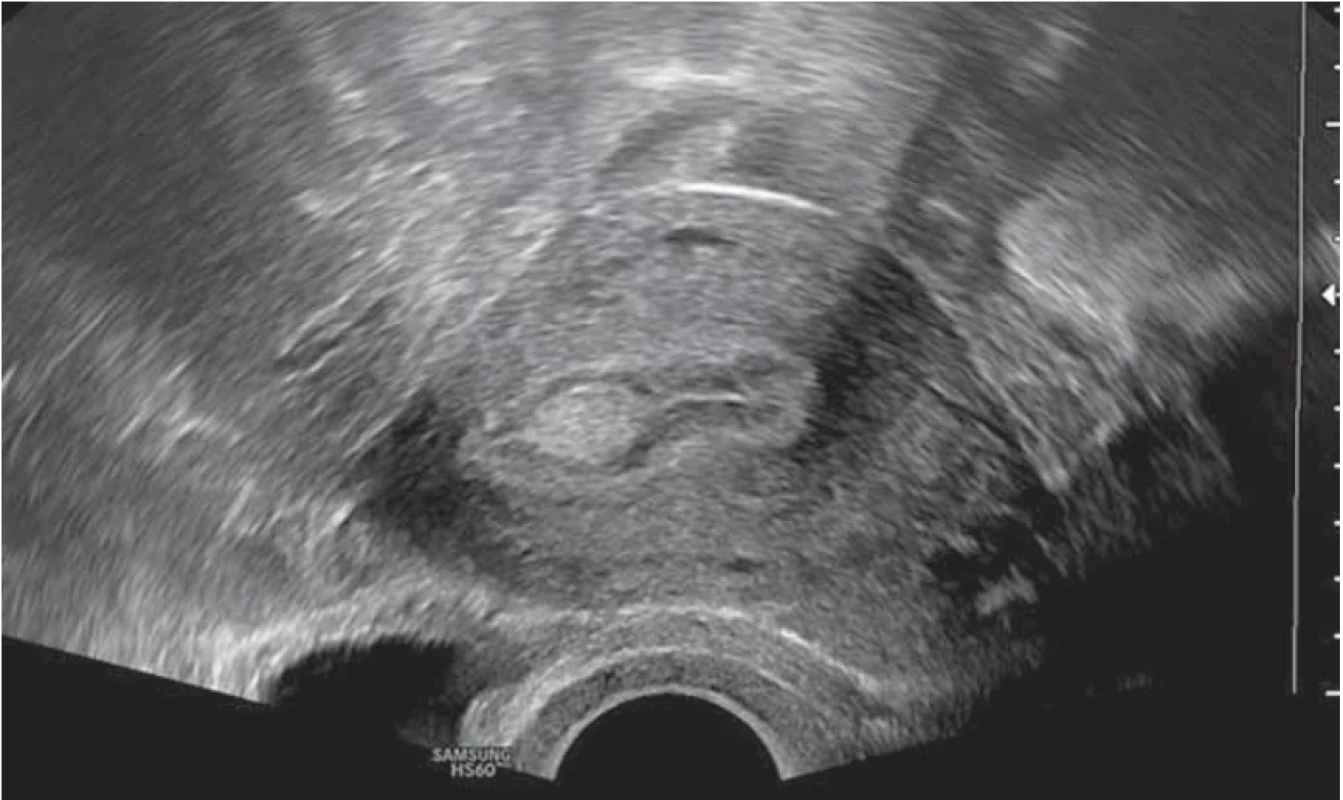
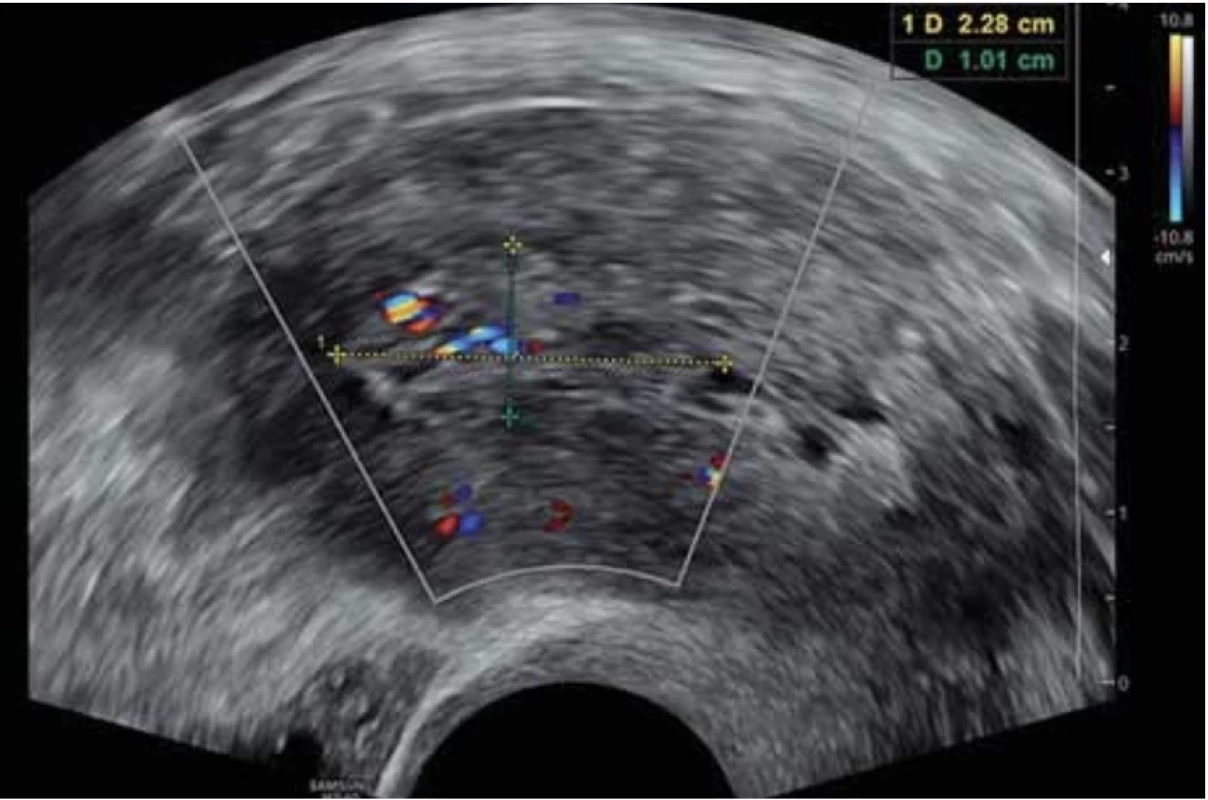
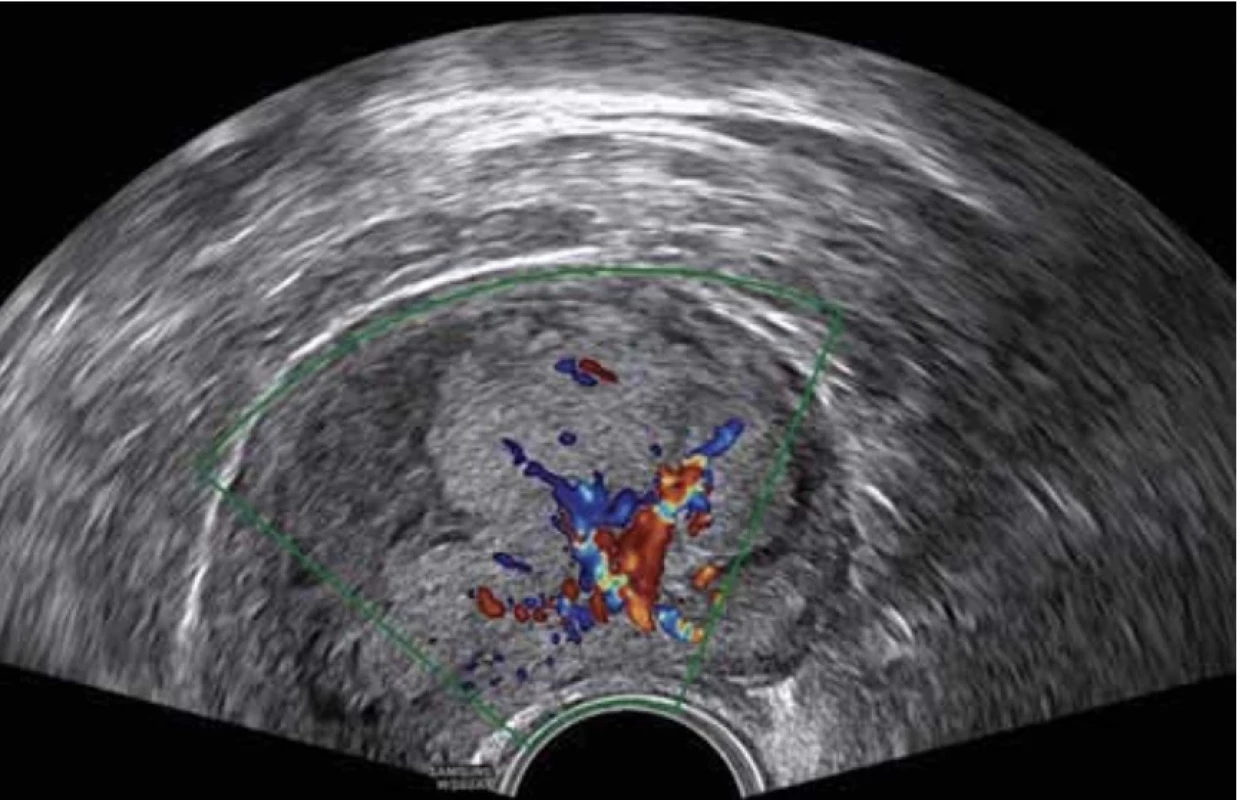
Vyšetření TVS zlepšilo naši schopnost správně diagnostikovat intrauterinní abnormality a nastavit odpovídající terapii. V roce 2010 publikovala IETA konsenzus sjednocující názvosloví a definice užívané při popisu endometria a děložní dutiny za použití zobrazovacích metod – ultrazvukové sonografie, color flow dopplerovského měření a sonohysterografie [12]. Endometriální polyp je popisován při užití TVS jako lokalizovaný, ostře ohraničený, hyperechogenní nebo smíšeně echogenní útvar s cystickou strukturou (častěji v případě postmenopauzálních žen: 48 %, obr. 1), anebo bez přítomnosti cyst (více u žen premenopauzálních: 64 %, obr. 2). V případě postmenopauzálních žen se nezobrazuje střední linie (87 %). Kromě jednoho případu měly všechny polypy cévní zásobení tvořeno jednoudominantní zásobující cévou (obr. 3). Celkem 71 % polypů při zobrazení pomocí sonohysterografie mělo pendulující charakter [13]. Novější studie Heremans et al. potvrzuje charakteristiky typické pro nález polypu uvedené v předchozí studii. Většina endometriálních polypů má přítomnu jednu dominantní zásobující cévu s dalším větvením, nebo bez něj. Při porovnání post- a premenopauzálních žen byl výskyt polypů u postmenopauzálních žen spojen s vyšším výskytem tekutiny v děložní dutině, cystickým endometriem a nižším color score. Pokud srovnáme případy s abnormálním děložním krvácením a bez něj, mají u asymptomatických žen polypy typicky smíšeně echogenní charakter, světlý okraj, pravidelnou hranici endometria s myometriem, dominantní zásobující cévu bez větvení a nižší color score (tab. 3, 4) [2].
![Ultrazvukové charakteristiky endometriálních polypů u pacientek s abnormálním děložním krvácením dle Van den Bosch et al. [13]. Výsledky uvedeny jako: % (%CI). // Ultrasound characteristics of endometrial polyps in patients with abnormal uterine bleeding according to Van den Bosch et al. [13]. Results reported as: % (%CI).](https://www.cs-gynekologie.cz/media/cache/resolve/media_object_image_small/media/image/acce0911160fa74c1d71540313cc6c59.png)
![Ultrazvukové nálezy endometriálních polypů u pacientek bez přítomnosti abnormálního děložního krvácením dle Heremans et al. [2]. // Ultrasound findings of endometrial polyps in patients without abnormal uterine bleeding according to Heremans et al. [2].](https://www.cs-gynekologie.cz/media/cache/resolve/media_object_image_small/media/image/c51f3ee15ce867efe08564104fbf0269.png)
V dostupné literatuře a dosud publikovaných pracích IETA group zabývajících se terminologií a popisem ultrazvukových nálezů není jasně definován popis EC v polypu. V hodnocení se proto vychází z charakteristik obrazu karcinomu endometria (obr. 4), kde je endometrium zesíleno (11–26 mm) s heterogenní echogenitou, nelze odlišit středovou linii a je nepřehledná endomyometriální junkce. Při vyšetření pomocí dopplerovského zobrazení je vysoké color score (3–4) s velkým množstvím cév větvených z jednoho nebo více vstupních míst [9].
Velikost polypu
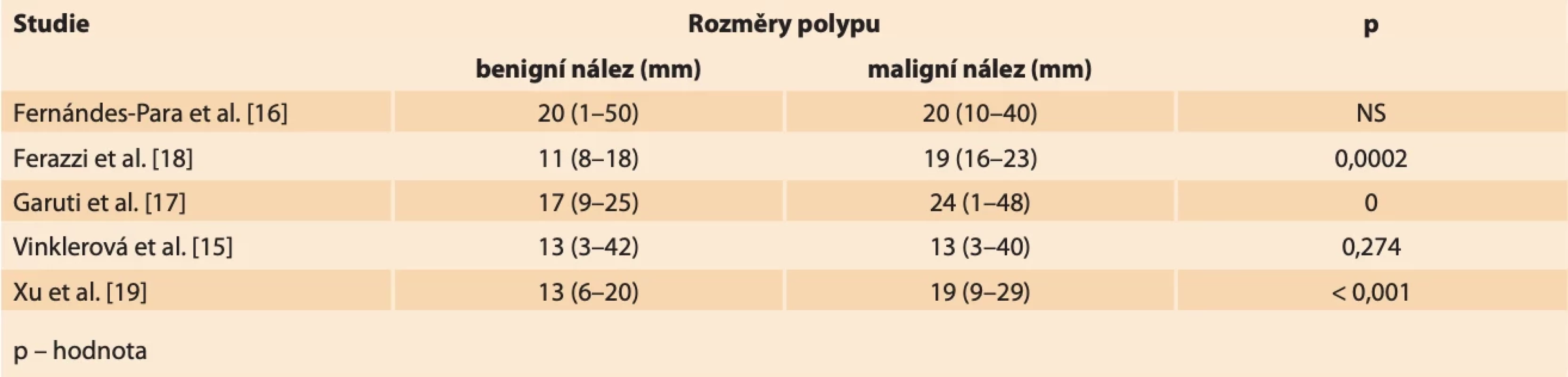
Rozměry endometriálních polypů se obecně pohybují od několika milimetrů až po velmi objemné nálezy vyplňující dutinu děložní a případně i utlačující okolní myometrium. V menší práci z našeho pracoviště jsme neshledali signifikantní rozdíl mezi velikostí benigního a maligního polypu (medián největšího rozměru polypu v obou skupinách 13 mm; p = 0,274), což je v souladu i s některými dalšími studiemi, kde autoři nenachází vhodný cut-off velikosti polypu v UZ obraze pro diagnostiku karcinomu [14,15]. Fernández-Para et al. dokonce prokázali, že největší riziko malignity v polypu je při velikosti od 2 do 3 cm a s dalším růstem velikosti pak riziko klesá [16]. Další autoři se snaží definovat statisticky významné rozdíly v rozměrech benigních a maligních nálezů, nicméně nenachází společný konsenzus. Garuti et al. uvádějí průměrnou velikost polypů s nálezem atypické histologie 24,5 mm v porovnání s polypy s normálním histologickým nálezem, kde se velikost pohybuje okolo 17,3 mm [17]. Retrospektivní multicentrická studie Ferrazzi et al. uvádí rozměr polypu 18 mm a více jako statisticky významný faktor pro výskyt abnormální histologie polypu [18]. Xu et al. popisují průměrný rozměr benigních polypů 13,4 ± 7 mm. Průměrné rozměry maligních polypů udávají 19,1 ± 10 mm (tab. 5) [19].
Věk
Endometriální polypy se u žen vyskytují ve všech věkových skupinách [20]. Zatímco pro premenopauzální ženy je výskyt polypu spíše spojen s reprodukčními problémy a malignita se objevuje vzácně (1,1 %), postmenopauzální status ženy se stává významným rizikem možného maligního zvratu (4,9 %) [21]. Analýza databáze 1 011 pacientek publikovaná Wethington et al. pracovala se skupinou, kde průměrný věk výskytu polypu byl 52 let. Endometriální karcinom nebo atypická hyperplazie, vzniklé v souvislosti s polypem, se diagnostikovaly u 18 žen, přičemž 15 (83 %) z nich bylo starších 50 let. Pokud tato data vztáhneme k celé kohortě zkoumaných pacientek, výskyt atypické hyperplazie a karcinomu endometria je u žen < 50 let 0,7 %, zatímco u žen > 50 let bylo detekováno 5,1 % případů [1]. Podle Bel et al. je významná věková hranice rizika vzniku malignity 59 let. Při dosažení tohoto věku se riziko rapidně zvyšuje, ale dále již s narůstajícím věkem nestoupá. A zatímco u pacientek mladších 59 let nebyl prokázán vztah abnormálního děložního krvácení s vyšším rizikem vzniku malignity, u žen po 59. roku je s preexistujícím postmenopauzálním děložním krvácením spojeno až 12,3% riziko maligního zvratu [14]. Autor Wong et al. ve své 5leté retrospektivní studii uvádějí významný faktor pro maligní zvrat věkovou skupinu > 60 let [9]. Retrospektivní studie Xu et al. sesbírala data 16 020 pacientek (2001–2018). Závěrem studie byl poznatek, že věk jako rizikový faktor u pacientek s benigním a maligním nálezem polypu není statisticky signifikantní, nicméně pacientky s benigním nálezem byly průměrně mladší (41,9 ± 11,5 let) oproti pacientkám s maligním nálezem (53,3 ± 11,6 let) [19].
Abnormální děložní krvácení
Abnormální děložní krvácení, zejména silné a nepravidelné menstruační a postmenopauzální krvácení, patří mezi „red flags“ symptomy možného děložního nebo cervikálního karcinomu [22]. U postmenopauzálních žen s krvácením je v závislosti na věku a dalších rizikových faktorech riziko přítomnosti karcinomu endometria až 10 % [23]. Endometriální polypy bez přítomnosti malignity nacházíme u 10–30 % žen s abnormálním děložním krvácením [24]. Dle systematické review Lee et al. je přítomnost endometriální malignity v polypu u 4,5 % žen s děložním krvácením a pouze u 1,5 % asymptomatických pacientek [25]. Již dříve zmíněná publikace Wethington et al. uvádí výskyt atypické hyperplazie a EC v 18 případech. U 11 pacientek se projevilo atypické vaginální krvácení (u čtyř nebyla symptomatologie uvedena). Vztaženo na celou kohortu – atypická hyperplazie a EC asociovaný s přítomností polypu se vyskytly ve 2,2 % pacientek s krvácením v porovnání s 1,2 % pacientek bez děložního krvácení [1]. Velká metaanalýza 51 studií s více než 35 tisíci pacientkami autorů Uglietti et al. popisuje zvýšené riziko karcinomu u symptomatických pacientek (5,1 %) oproti asymptomatickým (1,9 %; p < 0,001), ale s velkými rozdíly mezi jednotlivými publikacemi [21]. Nově publikovaná retrospektivní studie Xu et al. popisuje incidenci abnormálního děložního krvácení ve skupině s benigním nálezem polypu významně nižší (35,1 %) v porovnání s maligním nálezem v terénu polypu (82,2 %) [19].
Rodinná anamnéza
Rodinná anamnéza je nutnou součástí každého vyšetření pacientky. Týká se kompletních údajů o zdravotním stavu pacienta, o morbiditě a mortalitě v rodině. Některé studie uvedené v metaanalýze Win et al. prezentují zvýšené riziko vzniku endometriální malignity u pacientek s postiženou alespoň jednou prvostupňovou příbuznou (matka, sestra, dcera), ale konkrétní hodnota rizika se v rámci studií liší. Ke vztahu endometriální polyp – endometriální malignita – rodinná anamnéza se studie vůbec nevyjadřují [26]. Bel et al. ve své retrospektivní studii uvádějí, že rodinná anamnéza se zaměřením na prvostupňové příbuzné se jeví statisticky nesignifikantní. Pouze v kombinaci s dalšími faktory (studie neuvádí konkrétní případy) se stává statisticky významnou [14].
Důležitou kapitolou jsou pacientky s Lynchovým syndromem. Jedná se o autozomálně dominantně dědičné onemocnění způsobené mutacemi mistmatch repair genů DNA zárodečných buněk. Se stanovením této diagnózy souvisí zvýšené riziko pro rozvoj nádorových onemocnění nejčastěji v oblasti kolorektální a endometriální oblasti [27]. Pacientky s Lynchovým syndromem mají celoživotní riziko vzniku endometriálního karcinomu 40–60 % [28]. V častých případech bývá diagnóza Lynchova syndromu stanovena právě až na základě výskytu malignity. EC je nejčastější extraintestinální karcinom vznikající v souvislosti s tímto syndromem [29]. V prospektivní observační studii Manchansa et al. prováděli ultrazvukové a hysteroskopické sledování 69 pacientek s Lynchovým syndromem s cílem porovnat obě metody a jejich výtěžnost za pomoci histopatologické verifikace. U šesti žen (10 %) byl nález endometriálního polypu, z nichž pouze u jedné pacientky byl v polypu nalezen adenokarcinom [30]. Pacientky s Lynchovým syndromem jsou jediná skupina žen, kde je dle evropských guidelines doporučený UZ screening se zaměřením na patologii endometria i v případě absence abnormálního krvácení. Transvaginální ultrazvuk (preferenčně expertním sonografistou) by měl být proveden jednou ročně a od 35 let by měly pacientky podstoupit jednou za 1 rok nebo jednou za 2 roky biopsii endometria pipelou nebo hysteroskopií. Při abnormálním děložním krvácení je namístě provedení biopsie i mimo tento interval [31].
Diabetes mellitus 2. typu a index tělesné hmotnosti
Diabetes mellitus 2. typu je systémové metabolické onemocnění, jehož incidence v posledních desetiletích narůstá. Společně s obezitouse řadí mezi civilizační choroby a rizikové faktory pro vznik nádorových onemocnění [32]. Ve studii Giardano et al. uvádějí, že většina pacientek s maligním endometriálním polypem měla některý z rizikových faktorů pro rozvoj endometriálního karcinomu – hypertenze, obezita, estrogenní hormonální terapie. Není však uvedeno, kolik pacientek s nálezem benigního polypu také patřilo do rizikové skupiny pro jeden nebo více přítomných rizikových faktorů [33]. Studie Ghoubara et al. sledující rizikové faktory malignizace polypu u krvácejících postmenopauzálních žen došla k závěru, že diabetes u těchto pacientek nepatří k významnému rizikovému faktoru [34]. Observační studiePatrizi et al. sledující celkem 1 020 pacientek popisuje celkem 34 pacientek s atypickou hyperplazií nebo karcinomem endometria. U 26 z nich (89 %) byl při hysteroskopickém vyšetření nalezen polyp. Následné histologické došetření potvrdilo atypický nález u deseti polypů (30,3 %). Z celkového počtu pacientek s atypickou hyperplazií nebo karcinomem endometria bylo osm (24 %) sledováno pro diabetes mellitus. Pacientky s benigním nálezem (986) měly diagnostikovaný polyp v 758 případech (92 %). Léčeno pro diabetes mellitus bylo 77 pacientek (8 %) [10].
Garuti et al. ve své studii definují cut-off BMI (index tělesné hmotnosti) 25,3 kg/m2 jako hodnotu, od které se další nárůst BMI stává signifikantním rizikovým faktorem přítomnosti EC [17]. Elfayomy et al. v prospektivní observační studii uvádějí obezitu až s BMI > 30 kg/m2jako statisticky významnou [35]. Tuto hodnotu (BMI ≥ 30 kg/m2) jako významný rizikový faktor potvrzují Wong et al. ve své 5leté retrospektivní studii [9]. Podle již zmíněné observační studie Patrizi et al. sledující 1 020 pacientek narůstá riziko pro vznik maligní léze s rostoucím BMI, nicméně statisticky významným se stává až při překročení hodnoty BMI ≥ 40 kg/m2 [10]. V prospektivní studii Ghoubara et al. sledující ženy s postmenopauzálním krvácením docházejí k závěru, že BMI se stává signifikantním rizikovým faktorem při překročení hodnoty 32,5 kg/m2 [34].
Užívání tamoxifenu
Tamoxifen, antagonista nesteroidních receptorů, je nejčastěji užívaný lék pro hormonální léčbu estrogen receptor pozitivního karcinomu prsu [36]. V některých studiích je uváděno užívání tamoxifenu jako rizikový faktor vzniku objemných endometriálních benigních polypů [37], nicméně na užívání tamoxifenu a jeho vliv na vznik malignity v terénu endometriálního polypu není dosud jednotný konsenzus. Některé starší práce řadí užívání tamoxifenu mezi rizikové faktory, jako např. francouzské review autora Mbatsogo, které uvádí maligní transformaci u 4,6 % endometriálních polypů pacientek podstupujících léčbu tamoxifenem pro karcinom prsu [38]. Novější studie se kloní spíše ke statistické nevýznamnosti užívání tamoxifenu. Při sledování postmenopauzálního krvácení u žen s endometriálními polypy uvádějí Ghoubara et al. ve své prospektivní práci užívání tamoxifenu jako nevýznamné [34]. Ve studii Garuti et al. užívalo 2,5 % z celkového počtu pacientek tamoxifen (38/1 481). Garudi et al. docházejí k závěru, že vliv užívání tamoxifenu se jeví pro riziko vzniku endometriálního karcinomu na podkladě polypu jako statisticky nevýznamné [17]. Yela et al. ve své retrospektivní studii probíhající 5 let (2010–2015) pozoruje 675 žen užívajících tamoxifen při nálezu endometriálního polypu. Dle výsledků studie není užívání tamoxifenu faktor spojený s větší prevalencí endometriální malignity u těchto žen [39].
Závěr
Tento článek přináší ucelený přehled a rozbor předpokládaných rizikových faktorů, které mohou přispívat k malignímu zvratu při ultrazvukovém nálezu endometriálního polypu. Názory na některé faktory se v jednotlivých studiích liší. V případě rozměru polypu jsoupoznatky studií velmi rozdílné a v posledních letech se této problematice nevěnuje mnoho pozornosti. Informace o rodinné anamnéze se sledovaly jen v malém množství studií, a je tedy pouze omezené množství dat. Jako významná se předpokládá pozitivní anamnéza v případě prvostupňových příbuzných. I zde není jednoznačně prokázána míra významnosti a ovlivnění dalšími faktory, proto nelze vyvodit jasné závěry. Výjimkou jsou pacientky s Lynchovým syndromem, což je významný rizikový faktor, a pacientky je potřeba pečlivě dispenzarizovat. Dalším faktorem, kde panuje nejednotný názor, je přítomnost diabetes mellitus. Jen málo studií přistupuje k diabetu jako k jednotlivému faktoru. Většinou je posuzován multifaktoriálně spolu s dalšími interními komorbiditami přítomnými u pacientek, jako např. hypertenze a obezita. Pokud bychom chtěli riziko blíže specifikovat, bylo by potřeba se těmto faktorům věnovat jednotlivě a získat větší množství dat. V případě abnormálního děložního krvácení se výsledky studií poměrně jednotně shodují na přítomnosti významného rizika endometriálního karcinomu v terénu polypu. Jako rizikové potvrzují studie i vyšší věk pacientky a vyšší hodnoty BMI. v žádném z těchto dvou případů však není jasně definována jednotná cut-off hodnota.
Doručeno/Submitted: 14. 9. 2023
Přijato/Accepted: 18. 9. 2023
MUDr. Petra Bretová
Gynekologicko-porodnická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
Bretova.Petra@fnbrno.cz
Sources
1. Wethington SL, Herzog TJ, Burke WM et al. Risk and predictors of malignancy in women with endometrial polyps. Ann Surg Oncol 2011; 18 (13): 3819–3823. doi: 10.1245/s10434-011-1815-z.
2. Heremans R, Van den Bosch T, Valentin L et al. Ultrasound features of endometrial pathology in women without abnormal uterine bleeding: results from the International Endometrial Tumor Analysis study (IETA3). Ultrasound Obstet Gynecol 2022; 60 (2): 243–255. doi: 10.1002/uog.24910.
3. American Association of Gynecologic Laparoscopists. AAGL practice report: practice guidelines for the diagnosis and management of endometrial polyps. J Minim Invasive Gynecol 2011; 19 (1): 3–10. doi: 10.1016/j.jmig.2011.09.003.
4. Vitale SG, Haimovich S, Lagana AS et al. Endometrial polyps. An evidence-based diagnosis and management guide. Eur J Obstet Gynecol Reprod Biol 2021; 260: 70–77. doi: 10.1016/j.ejogrb.2021.03.017.
5. Colombo N, Creutzberg C, Amant F et al. ESMO-ESGO-ESTRO Consensus Conference on Endometrial Cancer: diagnosis, treatment and follow-up. Ann Oncol 2016; 27 (1): 16–41. doi: 10.1093/annonc/mdv484.
6. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice. 2023 [online]. Dostupné z: https: //svod.cz/report.php?diag=C54,C55.
7. Clark TJ, Stevenson H. Endometrial polyps and Abnormal Uterine Bleeding (AUB-P): what is the relationship, how are they diagnosed and how are they treated. Best Pract Res Clin Obstet Gynaecol 2017; 40: 89–104. doi: 10.1016/ j.bpobgyn.2016.09.005.
8. Uglietti A, Mazzei C, Deminico N et al. Endometrial polyps detected at ultrasound and rate of malignancy. Arch Gynecol Obstet 2014; 289 (4): 839–843. doi: 10.1007/s00404-013-3037-z.
9. Wong CL, So PL. Prevalence and risk factors for malignancy in hysteroscopy-resected endometrial polyps. Int J Gynecol Obstet 2021; 155 (3): 433–441. doi: 10.1002/ijgo.13656.
10. Patrizi L, Ticconi C, Borelli B et al. Clinical significance of endometrial abnormalities: an observational study on 1020 women undergoing hysteroscopic surgery. BMC Womens Health 2022; 22 (1): 106. doi: 10.1186/s12905-022-01682-5.
11. Wong M, Thanatsis N, Nardelli F et al. Risk of pre-malignancy or malignancy in postmenopausal endometrial polyps: a CHAID decision tree analysis. Diagnostics (Basel) 2021; 11 (6): 1094. doi: 10.3390/diagnostics11061094.
12. Leone FP, Timmerman D, Bourne T et al. Terms, definitions and measurements to describe the sonographic features of the endometrium and intrauterine lesions: a consensus opinion from the International Endometrial Tumor Analysis (IETA) group. Ultrasound Obstet Gynecol 2010; 35 (1): 103–112. doi: 10.1002/uog.7487.
13. Van Den Bosch T, Verbakel JY, Velantin L et al. Typical ultrasound features of various endometrial pathologies described using International Endometrial Tumor Analysis (IETA) terminology in women with abnormal uterine bleeding. Ultrasound Obstet Gynecol 2021; 57 (1): 164–172. doi: 10.1002/uog.22109.
14. Bel S, Bilard C, Godet J et al. Risk of malignancy on suspicion of polyps in menopausal women. Eur J Obstet Gynecol Reprod Biol 2017; 216: 138–142. doi: 10.1016/j.ejogrb.2017.07.013.
15. Vinklerová P, Felsinger M, Frydová S et al. Je nález hyperplazie či polypu děložní dutiny automatickou indikací k biopsii? Ceska Gynekol 2020; 85 (2): 84–93.
16. Fernández-Parra J, Rodríguez OA, López CS et al. Hysteroscopic evaluation of endometrial polyps. Int J Gynaecol Obstet 2016; 95 (2): 144–148. doi: 10.1016/j.ijgo.2006.07.007.
17. Garuti G, Luerti M, Leone FP et al. Prevalence and predictors of atypical histology in endometrial polyps removed by hysteroscopy: A secondary analysis from the SICMIG hysteroscopy trial. Facts Views Vis Obgyn 2019; 11 (2): 127–134.
18. Ferrazzi E, Zupi E, Leone FP et al. How often are endometrial polyps malignant in asymptomatic postmenopausal women? A multicenter study. Am J Obstet Gynecol 2009; 200 (3): 235.e1–235.e6. doi: 10.1016/j.ajog.2008.09.876.
19. Xu J, Rao X, Lu W et al. Noninvasive predictor for premalignant and cancerous lesions in endometrial polyps diagnosed by ultrasound. Front Oncol 2022; 11: 812033. doi: 10.3389/fonc.2021.812033.
20. Mansour T, Chowdhury YS. Endometrial Polyp. StatPearls Publishing. 2022 [online]. Available from: http: //www.ncbi.nlm.nih.gov/books/NBK557824/.
21. Uglietti A, Buggio L, Farella M et al. The risk of malignancy in uterine polyps: a systematic review and meta-analysis. Eur J Obstet Gynecol Reprod Biol 2019; 237: 48–56. doi: 10.1016/j.ejogrb.2019.04.009.
22. Kolhe S. Management of abnormal uterine bleeding – focus on ambulatory hysteroscopy. Int J Womens Health 2018; 10: 127–136. doi: 10.2147/IJWH.S98579.
23. Smith-Bindman R, Weiss E, Feldstein V. How thick is too thick? When endometrial thickness should prompt biopsy in postmenopausal women without vaginal bleeding. Ultrasound Obstet Gynecol 2004; 24 (5): 558–565. doi: 10.1002/uog.1704.
24. Ricciardi E, Vecchione A, Matci R et al. Clinical factors and malignancy in endometrial polyps. Analysis of 1,027 cases. Eur J Obstet Gynecol Reprod Biol 2014; 183: 121–124. doi: 10.1016/j.ejogrb.2014.10.021.
25. Lee SC, Kaunitz AM, Sanchez-Ramos L et al. The oncogenic potential of endometrial polyps: a systematic review and meta-analysis. Obstet Gynecol 2010; 116 (5): 1197–1205. doi: 10.1097/AOG.0b013e3181f74864.
26. Win AK, Reece JC, Ryan S. Family history and risk of endometrial cancer: a systematic review and meta-analysis. Obstet Gynecol 2015; 125 (1): 89–98. doi: 10.1097/AOG.0000000000000563.
27. Yokoyama T, Takehara K, Sugimoto N et al. Lynch syndrome-associated endometrial carcinoma with MLH1 germline mutation and MLH1 promoter hypermethylation: a case report and literature review. BMC Cancer 2018; 18 (1): 576. doi: 10.1186/s12885-018-4489-0.
28. Zhao S, Chen L, Zang Y et al. Endometrial cancer in Lynch syndrome. Int J Cancer 2022; 150 (1): 7–17. doi: 10.1002/ijc.33763.
29. Tafe LJ, Riggs ER, Tsongalis GJ. Lynch syndrome presenting as endometrial cancer. Clin Chem 2014; 60 (1): 111–121. doi: 10.1373/ clinchem.2013.206888.
30. Manchanda R, Saridogan E, Abdelraheim A et al. Annual outpatient hysteroscopy and endometrial sampling (OHES) in HNPCC/Lynch syndrome (LS). Arch Gynecol Obstet 2012; 286 (6): 1555–1562. doi: 10.1007/s00404-012-2492-2.
31. Concin N, Matias-Guiu X, Vergote I et al. ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma. Int J Gynecol Cancer 2021; 31 (1): 12–39. doi: 10.1136/ijgc-2020-002230.
32. Češka R et al. Diabetes mellitus. In: Češka R et al (eds). Interna. 3. vydání. Praha: Triton 2020: 238–267.
33. Giordano G, Gnetti L, Merisio C et al. Postmenopausal status, hypertension and obesity as risk factors for malignant transformation in endometrial polyps. Maturitas 2007; 56 (2): 190–197. doi: 10.1016/j.maturitas.2006.08.002.
34. Ghoubara A, Sundar S, Ewies A. Predictors of malignancy in endometrial polyps: study of 421 women with postmenopausal bleeding. Climacteric 2018; 21 (1): 82–87. doi: 10.1080/13697137.2017.1410783.
35. Elfayomy AK, Soliman BS. Risk factors associated with the malignant changes of symptomatic and asymptomatic endometrial polyps in premenopausal women. J Obstet Gynaecol India 2015; 65 (3): 186–192. doi: 10.1007/s13224-014-0576-6.
36. Lee M, Piao J, Jeon MJ. Risk factors associated with endometrial pathology in premenopausal breast cancer patients treated with tamoxifen. Yonsei Med J 2020; 61 (4): 317–322. doi: 10.3349/ymj.2020.61.4.317.
37. Jeon J, Kim SE, Lee DY et al. Factors associated with endometrial pathology during tamoxifen therapy in women with breast cancer: a retrospective analysis of 821 biopsies. Breast Cancer Res Treat 2020; 179 (1): 125–130. doi: 10.1007/s10549-019-05448-w.
38. Mbatsogo BA, Bouëdec BL, Michy T et al. Endometrial cancers arising in polyps associated with tamoxifen use. Gynecol Obstet Fertil 2005; 33 (12): 975–979. doi: 10.1016/j.gyobfe.2005.10.021.
39. Yela DA, Ikejiri TA, Machado CR et al. Tamoxifen use as a malignancy risk factor in postmenopausal women with endometrial polyps. Menopause 2019; 26 (8): 863–866. doi: 10.1097/GME.0000000000001340.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2024 Issue 1
Most read in this issue
- Ultrasound finding of endometrial polyp and factors increasing risk of malignancy
- Importance of vaginal packing after laparoscopic sacrocolpopexy – retrospective study
- Diagnostika a léčba endometriózy
- Female orgasm, reproduction and couple relationships
