Výskyt vybraných geneticky podmíněných trombofilních markerů u pacientek podstupujících léčbu neplodnosti
The occurence of genetic trombophilic markers in patients evaluated for infertility
Objective:
To assess and compare the frequency of selected gene mutations of thrombophilic markers (FV Leiden, FII prothrombin G20210A and MTHFR C677T) in patients with primary and secondary infertility.
Design:
Retrospective study.
Setting:
Institute of normal anatomy, Faculty of Medicine and Dentistry, Palacky University Olomouc.
Methods:
The study included 92 patients with primary infertility and 89 patients with secondary infertility. Indications for examination of these mutations were following: a positive family or personal history, a positive obstetrical history or a repeated failure of assisted reproduction treatment.
Results:
According to our anticipation, women with the secondary infertility were significantly older(p < 0.0005) than those with primary infertility. No mutations of genes of examined thrombophilic markers (FV, FII and MTHFR), either alone or in combination, were found in only 8.7 % patients with primary infertility and in 5.6 % patients with secondary infertility. Significantly higher frequency of factor Leiden(p < 0.02) was observed in women with secondary infertility. There were no significant differences in the frequency of detected mutations of the remaining factors.
Conclusion:
Based on our findings we suggest that the assessment of selected gene mutations of thrombophilic markers should be a part of the diagnostic algorithm in patients with positive history for thrombophilic disorders.
Keywords:
inherited thrombophilia – female infertility – IVF and ET
Autoři:
R. Filipčíková 1; J. Březinová 1,2; I. Oborná 3,4; Z. Blažková 1; V. Krčová 5; L. Slavík 5; J. Úlehlová 5; A. Hluší 5; M. Bezdičková 1
Působiště autorů:
Ústav normální anatomie FN a LF UP, Olomouc, přednosta doc. MUDr. S. Laichman, CSc.
1; Arleta, Centrum reprodukčního zdraví s. r. o., Kostelec nad Orlicí, vedoucí lékař MUDr. J. Doležal
2; Porodnicko-gynekologická klinika FN a LF UP, Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D.
3; Fertimed s. r. o., Olomouc, vedoucí lékař doc. MUDr. A. Sobek, CSc.
4; Hemato-onkologická klinika FN a LF UP, Olomouc, přednosta prof. MUDr. K. Indrák, DrSc.
5
Vyšlo v časopise:
Ceska Gynekol 2013; 78(1): 73-77
Souhrn
Cíl studie:
Zjistit a porovnat výskyt vybraných geneticky podmíněných trombofilních markerů (FV Leiden, FII protrombin G20210A, MTHFR C677T) u pacientek s primární a sekundární příčinou neplodnosti.
Typ studie:
Retrospektivní studie.
Název a sídlo pracoviště:
Ústav normální anatomie FN a LF UP Olomouc.
Metodika:
Do hodnoceného souboru bylo zařazeno 92 pacientek s primární a 89 se sekundární příčinou neplodnosti. Indikací k vyšetřování trombofilních markerů byla pozitivní rodinná nebo osobní anamnéza, pozitivní porodnická anamnéza nebo opakované selhání léčby neplodnosti.
Výsledky:
Podle očekávání byly ženy se sekundární příčinou neplodnosti statisticky významně starší(p < 0,0005). Žádná mutace pro vyšetřované geny trombofilních markerů (FV, FII, MTHFR) samostatně nebo v kombinaci nebyla nalezena u 8,7 % pacientek s primární a 5,6 % pacientek se sekundární příčinou neplodnosti. Významně vyšší frekvence výskytu leidenského faktoru (p < 0,02) byla nalezena u žen se sekundární příčinou neplodnosti, ve výskytu mutací zbývajících faktorů nebyl nalezen mezi oběma skupinami významný rozdíl.
Závěr:
Na základě zjištěných výsledků se domníváme, že vyšetřování geneticky podmíněných trombofilních markerů by mělo být součástí vyšetřovacího algoritmu u pacientek s pozitivní anamnézou.
Klíčová slova:
geneticky podmíněná trombofilie – ženská neplodnost – IVF a ET
ÚVOD
Úspěšnost metod asistované reprodukce (AR) je ovlivněna řadou dílčích kroků. Biologickým věkem pacientky, výběrem optimálního stimulačního protokolu, kvalitního embrya nebo embryí k embryotransferu, technikou přenosu embryí, ale také nastavením mateřského organismu k implantaci, průběhu těhotenství a porodu novorozence. Velmi dobře je známa také spojitost vrozené trombofilie s opakovanými spontánními těhotenskými ztrátami (AB), intrauterinní růstovou retardací plodu (IUGR), intrauterinním odumřením plodu, s rozvojem preeklampsie, HELLP syndromem nebo s abrupcí placenty, ale i s rizikem předčasného porodu [14, 20].
Mechanismus, kterým trombofilní stav může způsobit selhání implantace po IVF nebo těhotenské ztráty po spontánní koncepci, není dosud zcela objasněn. Předpokládá se, že invaze syncytiotrofoblastu do maternálních cév může způsobovat lokální trombózy v místě implantace. Protože vývoj intervilózních prostor probíhá pouze prvních 11 až 12 týdnů gestace, mohou být tímto způsobem vysvětlovány prvotrimestrální těhotenské ztráty [1, 25]. Podobně hyperkoagulace v místě implantace může vést k poruše placentace [1]. Kolár [13] popisuje silný pro-trombogenní účinek mikropartikul pocházejících převážně z cévního endotelu a z buněk trofoblastu. Zvýšená hladina PAI-1 podporuje jejich tvorbu, a tak dále zvyšuje jejich prokoagulační aktivitu, a může tak dojít k dysfunkci endotelu.
V kavkazské populaci, ke které se řadíme, je mutace faktoru V Leiden nejčastější genetický faktor způsobující trombózu a frekvence jeho výskytu kolísá mezi 2–15 %. Mutace faktoru II protrombin se vyskytuje ve 2–3 % a v 10–40 % je popsán výskyt polymorfismu MTHFR [8, 15, 22, 24]. Vyšší trombotické riziko představují homozygotní jedinci s mutací v genech FV Leiden a protrombinu FII, stejně jako jejich kombinace v heterozygotní formě.
V poslední době je výskyt tromboembolických komplikací dáván také do souvislosti s metodami asistované reprodukce [16, 17, 26]. U pacientek léčených metodami IVF a ET Máraet al. [18] uvádí výskyt tromboembolické nemoci (TEN) v 0,11 % (tři případy na 2748 cyklů IVF a ET) a Grandone et al. [9] 0,5 % (4 případy na 747 cyklů). U všech pacientek s TEN byl prokázán výskyt kombinace více trombofilních markerů.
Vrozenými koagulačními faktory může být ovlivněna reakce na typ použitého stimulačního protokolu, na luteální suplementaci pomocí hCG, vzniklé těhotenství nebo naopak opakovaný neúspěch a selhání implantace po přenosu embryí [1]. Změny hemostázy v důsledku vzestupu hladin estrogenů mohou také zvýšit riziko vzniku a rozvoje tzv. ovariálního hyperstimulačního syndromu (OHSS), zejména u pacientek se syndromem polycystických ovarií (PCO). U 85 % pacientek s těžkým stupněm OHSS popsal Dulitzky et al. [5] výskyt kombinace trombofilních markerů. Vzhledem ke známé spojitosti výskytu syndromu PCO a vyšší pravděpodobnosti vzniku OHSS a s ním spojených komplikací, bylo navrženo vyšetření základních trombofilních markerů u pacientek s těžkým OHSS v anamnéze [7]. V poslední době se výrazněji diskutuje také o otázce vyšetřování trombofilních markerů u pacientek s opakovaným selháním léčby metodami asistované reprodukce [2, 23].
Cílem naší práce bylo retrospektivní zhodnocení výskytu vybraných geneticky podmíněných trombofilních markerů u pacientek s primární a sekundární příčinou neplodnosti přicházejících do center asistované reprodukce.
SOUBOR A METODIKA
Do souboru bylo zahrnuto 92 pacientek s primární a 89 pacientek se sekundární neplodností. Indikací k vyšetřování trombofilních markerů byla u primárních sterilit pozitivní rodinná nebo osobní anamnéza TEN, dále např. výskyt nádorových onemocnění, centrální mozková příhoda a autoimunitní choroby. U sekundární sterility byla kromě výše uvedeného zohledněna i pozitivní porodnická anamnéza, zejména opakované těhotenské ztráty. Dále byl zjišťován výskyt růstové retardace plodu, porodu mrtvého plodu, preeklampsie, HELLP syndromu nebo předčasného odloučení placenty.
Z vrozených trombofilních stavů jsme ve vyšetřovaném souboru vyhodnotili výskyt mutace genů pro FV Leiden, mutace protrombinu G20210A a polymorfismus mutace MTHFR (metylen-tetrahydrofolát-reduktáza) C677T v homo- a heterozygotní formě. Tyto markery byly vyšetřovány v laboratoři Hemato-onkologické kliniky FNOL pomocí TC Genotyping kitu pro trombofilie. Kit je určen pro detekci heterozygotních a homozygotních bodových mutací tří rozdílných genů (faktoru V, faktoru II, MTHFR). Stanovení se skládá ze tří kroků: DNA extrakce, DNA amplifikace metodou PCR a analýzy produktů PCR gelovou elektroforézou.
Statistické zpracování bylo provedeno pomocí softwarových systémů pro analýzu dat STATISTICA (StatSoft ČR s.r.o. (2007) verze 8.0. www.statsoft.cz) a SPSS v. 12.0. S ohledem na typ dat byl použit dvouvýběrový t-test a test pro porovnání dvou poměrů. Při všech výpočtech byla uvažována 5% hladina významnosti.
VÝSLEDKY
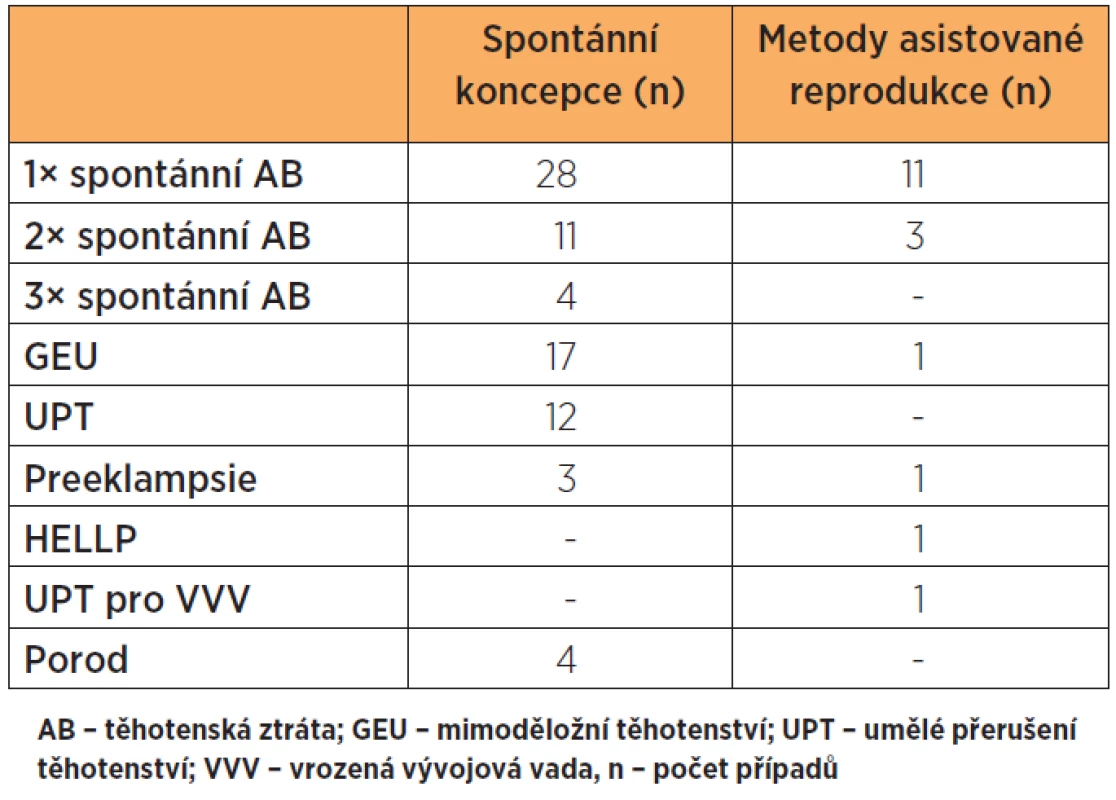
Příčina neplodnosti (92 žen s primární a 89 žen se sekundární neplodností) byla stanovena při vstupním vyšetření. Tabulka 1 uvádí frekvenci těhotenských ztrát u žen se sekundární neplodností i s ohledem na typ koncepce.
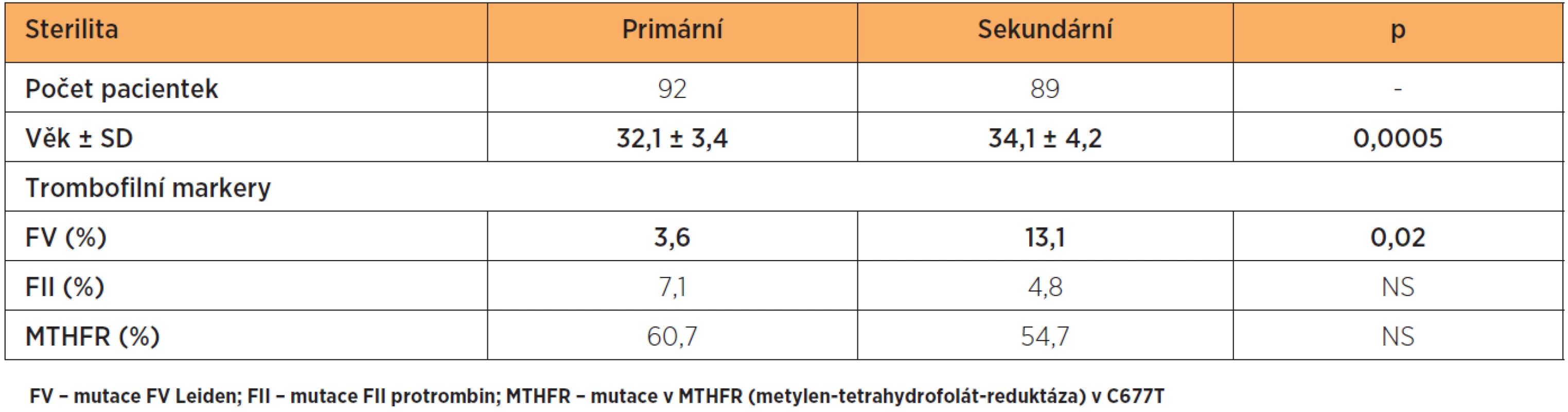
Věk a výskyt mutací FV, FII a MTHFR u obou souborů pacientek je uveden v tabulce 2. Z celkového počtu 92 žen s primární sterilitou nebyly prokázány sledované vrozené trombofilie jen u 8 (8,7 %) pacientek a z 89 žen se sekundární neplodností u 5 (5,6 %). U žen se sekundární příčinou neplodnosti byla zjištěna signifikantně vyšší frekvence výskytu FV Leiden (p < 0,02) a byly i signifikantně starší (p < 0,0005).
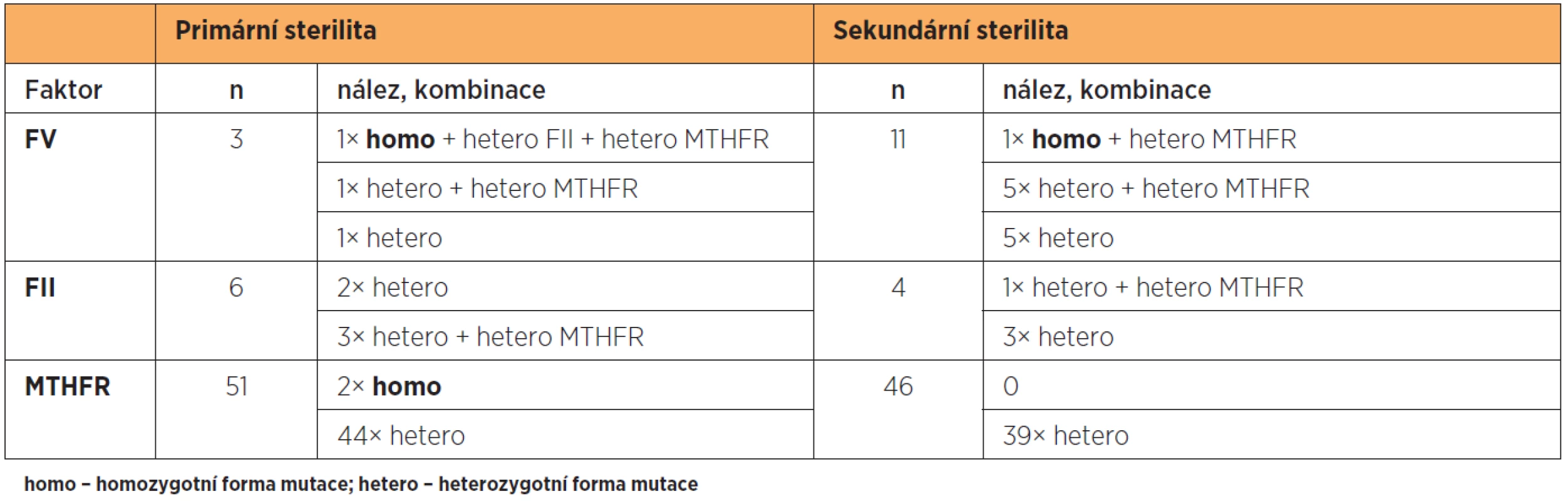
Výskyt mutací jednotlivých markerů v homo- nebo heterozygotní formě samostatně nebo v kombinaci je uveden v tabulce 3.
DISKUSE
Do center asistované reprodukce přicházejí páry, které mají problémy nejen s početím potomka, ale i s úspěšným donošením těhotenství. Také opakovaný neúspěch léčby metodami AR se dává do souvislostí s možným vlivem zejména geneticky podmíněných trombofilních markerů.
Byl nalezen vysoký výskyt mutace FV Leiden, a to 13 % u sekundárních a 4 % u primárních sterilit(p < 0,02). Mutace pro F II protrombin byla zjištěna u 5 % sekundárních a u 7 % primárních sterilit. Výskyt polymorfismu mutace MTHFR byl v obou skupinách vyšší, než se uvádí pro kavkazskou populaci (55 % u sekundárních a 61 % u primárních sterilit).
Z dalších možných rizikových trombofilních markerů se ve vztahu k neplodnosti diskutuje o mutaci PAI-1 (4G/5G). Zvýšené hladiny PAI-1 spojené s touto mutací nalézáme např. u kardiovaskulárních onemocnění, diabetu a obezity [21]. Vyšší hladina PAI-1 u žen s PCO, způsobená mimo jiné inzulinovou rezistencí, zpomaluje fibrinolýzu, a tak zvyšuje riziko potratu [28]. Signifikantně vyšší výskyt mutace PAI-1 byl také prokázán u žen s opakovanými časnými těhotenskými ztrátami [12], stejně jako souvislost mezi mutací PAI-1 a preeklampsií [4].
Porovnání s literárními údaji je však obtížné vzhledem k závažnosti vlivu jednotlivých vrozených markerů, z nichž nejzávažnější jsou FV Leiden a FII protrombin v homozygotní formě a jejich kombinace v heterozygotní formě. U pacientek opakovaně podstupujících IVF byl různými zahraničními autory popsán výskyt vrozených trombofilních markerů mezi 44–90 % [1, 3, 6, 9, 11, 23, 25, 27]. Azem et al. [1] uváděli průkazně vyšší výskyt geneticky podmíněných markerů (44 %) u skupiny pacientek s opakovanými selháními cyklů IVF a ET v porovnání se souborem žen, které otěhotněly spontánně (18 %). Podobně Qublan et al. [23] zachytili průkazně vyšší výskyt vrozených trombofilních markerů u žen se 3 a více neúspěšnými cykly IVF v porovnání se ženami, které otěhotněly spontánně (69 % vs. 25 %). Dzandzhgava et al. [6] zjistili průkazně vyšší výskyt vrozených trombofilií v souboru žen s nevysvětlitelnou příčinou neplodnosti (90 %) ve srovnání s kontrolní skupinou těhotných žen (26 %). Coulam et al. [3] zaznamenali významně vyšší výskyt vrozených trombofilií u žen s opakovaným implantačním selháním (74 %) ve srovnání s kontrolní skupinou (20 %). Na druhé straně Martinelli et al. [19] průkazný rozdíl ve výskytu mutací v souboru žen podstupujících léčbu IVF a ET nenalezli. Naše výsledky jsou ve shodě s pozorováním Hajšmanové et al. [10], kteří hodnotili obdobnou populaci.
Z výše uvedených prací jednoznačně vyplývá význam podrobně odebrané osobní i rodinné anamnézy se zaměřením na rizikové faktory u žen léčených pro neplodnost. Při odebírání anamnézy by se měla věnovat pozornost zejména výskytu trombotických stavů, diabetu, onemocnění srdce a cév, štítné žlázy, autoimunitních onemocnění, těhotenských ztrát, předčasného odloučení placenty, růstové retardace plodu nebo porodu mrtvého dítěte.
ZÁVĚR
Na základě zjištěného vyššího výskytu sledovaných mutací se domníváme, že by jejich vyšetřování mělo být indikováno u všech pacientek před IVF a ET s pozitivní osobní anamnézou, opakovanými těhotenskými ztrátami či opakovaným selháním implantace i přes jejich ekonomickou náročnost.
Poděkování
Autoři článku děkují Mgr. Lence Radové, Ph.D., za statistické zpracování použitých dat, doc. ing. Heleně Fingerové, CSc., za cenné rady a pomoc při zpracování a analýze dat.
Podpořeno projekty: CEZ reg.č. J 14/98: 151 100 006, 166 011 02; a výzkumným záměrem MSM 6198959205.
Mgr. Radka Filipčíková, Ph. D.
Ústav normální anatomie LF UP a FN
Hněvotínská 3
779 00 Olomouc
e-mail: radka.filipcikova@upol.cz
Zdroje
1. Azem, F., Many, A., Yovel, I., et al. Increased rates of trombophilia in women with repeated IVF failures. Hum Reprod, 2004, 19, p. 368–370.
2. Bohlmann, MK. Effects and effectiveness of heparin in assisted reproduction. J Reprod Immunol, 2011, 90, p. 82–90.
3. Coulam, CB., Jeyendran, RS., Fischel, LA., et al. Multiple thrombophilic gene mutations are risk factors for implantation failure. Reprod Biomed Online, 2006, 12, p. 322–327.
4. D‘Elia, AV., Fabbro, D., Driul, L., et al. Plasminogen activator inhibitor-1 gene polymorphisms in pre-eclampsia. Semin Thromb Hemost, 2011, 37, p. 97–105.
5. Dulitzky, M., Cohen, SB., Inbal, A., et al. Increased prevalence of trombophilia among women with severe ovarian hyperstimulation syndrome. Fertil Steril, 2002, 77, p. 463–467.
6. Dzandzhgava, ZG., Bitsadze, VO. IVF failures: maternal thrombophilia as a possible cause. Georgian Med News, 2005, 124–125, p. 23–26.
7. Fábregues, F., Tassies, D., Reverter, JC., et al. Prevalence of thrombophilia in women with severe ovarian hyperstimulation syndrome and cost-effectiveness of screening. Fertil Steril, 2004, 81, p. 989–995.
8. Gaillyová, R., Čech, Z., Vilémová, M., et al. Vrozené trombofilie a cytogenetické nálezy u pacientů s opakovanými fetálními ztrátami. Prakt Gyn, 2005, 9, s. 9–12.
9. Grandone, E., Margaglione, M., Colaizzo, D., et al. Genetic susceptibility to pregnancy-related venous thromboembolism: roles of factor V Leiden, prothrombin G20210A, and methylenetetrahydrofolate reductase C677T mutations. Am J Obstet Gynec, 1998, 179, p. 1324–1328.
10. Hajšmanová, Z., Šlechtová, J., Šigutová, P., et al. Průběh těhotenství při dlouhodobém podávání nízkomolekulárního heparinu pro opakované těhotenské ztráty. Čes Gynek, 2008, 73, s. 278–283.
11. Hellgren, M., Svensson, PJ., Dahlbäck, B. Resistance to activated protein C as a basis for venous thromboembolism associated with pregnancy and oral contraceptives. Am J Obstet Gynecol, 1995, 173, p. 210–213.
12. Ivanov, P., Komsa-Penkova, R., Ivanov, I., et al. Plasminogen activator inhibitor type 1 activity in women with unexplained very early recurrent pregnancy loss. Akush Ginekol, 2010, 49, p. 3–8.
13. Kolár, J. Mikropartikuly – mikročástice s důležitými regulačními funkciami. In vitro diagnostika, 2011, 17, s. 16–22.
14. Kupferminc, MJ., Eldor, A, Steinman, N., et al. Increased frequency of genetic thrombophilia in women with complications of pregnancy. N Engl J Med, 1999, 340, p. 9–13.
15. Kvasnička, J. Trombofilie a trombotické stavy v klinické praxi. Praha: Grada Publiching a.s., 2003.
16. Lox, C., Caňez, M., Prien, S. The influence of hyperestrogenism during in vitro fertilization on the fibrinolytic mechanism. Int J Fertil Womens Med, 1998, 43, p. 34–39.
17. Magnani, B., Tsen, I., Datta, S., Bader, A. In vitro fertilization. Do short-term changes in estrogen levels produce increased fibrinolysis? Am J Clin Pathol, 1999, 112, p. 485–491.
18. Mára, M., Korytová, D., Řežábek, K., et al. Tromboembolické komplikace u pacientek z programu IVF – ET: Retrospektivní klinická studie. Čes Gynek, 2004, 69, s. 312–316.
19. Martinelli, I., Taioli, E., Ragni, G., et al. Embryo implantation after assisted reproductive procedures and maternal trombophilia. Haematologica, 2003, 88, p. 789–793.
20. Pabinger, I. Thrombophilia and its impact on pregnancy. Thromb Res, 2009, 123 (Suppl. 3), S16–S21.
21. Pastucha, D. Obesity, hypertension and insulin resistance in childhood – a pilot study. Biomed pap med Fac Univ Palacky Olomouc Czech Repub, 2010, 154, p. 245–249.
22. Poul, H. Trombofilní stavy významné v patogenezi žilní tromboembolické nemoci. Vnitř lék, 2006, 52 (Suppl 1), s. 17–25.
23. Qublan, HS., Eid, SS,, Ababneh, A., et al. Acquired and inherited trombophilia: implication in recurrent IVF and embryo transfer failure. Hum Reprod, 2006, 21, p. 2694–2698.
24. Raušová, E., Hadačová, I, Macek, M. Hereditární trombofilie – jeden z modelů molekulární medicíny. Klin Biochem Metab, 2005, 13, s. 68–76.
25. Simur, A., Ozdemir, S., Acar, H., et al. Repeated in vitro fertilization failure and its relation with trombophilia. Gynecol Obstet Invest, 2009, 67, p. 109–112.
26. Szymański, W., Walentowicz, M., Kotschy, M. Tissue-type plasminogen activator (T-PA) and plasminogen activator inhibitor (PAI-1) in human follicular fluid during gonadotropin-induced ovulation. Ginekol Pol, 2003, 74, p. 1386–1391.
27. Tan, JZ. Thrombophilia in pregnancy. Ann Acad Med Singapore, 2002, 31, p. 328–334.
28. Tsanadis, G., Vartholomatos, G., Korkontzelos, I., et al. Polycystic ovarian syndrome and trombophilia. Hum Reprod, 2002, 17, p. 314–319.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2013 Číslo 1
Nejčtenější v tomto čísle
- Vliv délky kultivace embryí s pomalým nástupem dělení na úspěšnost IVF
- Sakrospinální fixace prolabovaného poševního pahýlu po hysterektomii sec. Miyazaki – dlouhodobé výsledky
- Erytrocytární aloimunizace těhotných žen, klinický význam a laboratorní diagnostika
- Problematika krvácivých chorob v porodnictví
