Význam genetiky v diagnostike moly hydatidózy
Importance of the genetics in the diagnostics of hydatidiform mole
Objective: To summarize the possibilities of the genetic analysis of hydatidiform moles and point out its perspectives in the diagnostics of this disease.
Design: Review.
Setting: Institute of Medical Biology, Genetics and Clinical Genetics, Faculty of Medicine, Comenius University in Bratislava, Slovak Republic.
Methods: Analysis of published literature data from the internet databases PubMed, ScienceDirect, Scopus and printed literature from the period 1963–2019.
Results: This review refers on karyotyping, flow cytometry, FISH (Fluorescent in Situ Hybridization), VNTR-RFLP analysis (Variable Number of Tandem Repeats-Restriction Fragment Length Polymorphism), VNTR-PCR analysis (Variable Number of Tandem Repeats-Polymerase Chain Reaction) and STR (Short Tandem Repeat) genotyping of hydatidiform moles. The article summarizes possible application of these methods in the differential diagnostics of molar pregnancy (partial and complete hydatidiform moles) and nonmolar hydropic abortions.
Conclusion: Genetic analyses offer precise identification of types of molar pregnancies when histopathological diagnosis is not clear during early stages of pathology.
Keywords:
gestational trophoblastic disease – hydatidiform moles – DNA diagnostics
Autoři:
Lajos Gergely 1
; H. Gbelcová 1; Vanda Repiská 1
; Ľudovít Danihel 2; M. Korbeľ 3; Petra Priščáková 1
Působiště autorů:
Ústav lekárskej biológie, genetiky a klinickej genetiky, Lekárska fakulta UK a UNB, Bratislava, prednosta, doc. MUDr. D. Böhmer, PhD.
1; Ústav patologickej anatómie, Lekárska fakulta UK a UNB Bratislava, prednosta prof. MUDr. Ľ. Danihel, PhD.
2; I. gynekologicko-pôrodnícka klinika, Lekárska fakulta UK a UNB, Bratislava, prednosta prof. MUDr., M. Borovský, CSc.
3
Vyšlo v časopise:
Ceska Gynekol 2020; 85(4): 275-281
Kategorie:
Přehledový článek
Souhrn
Cieľ štúdie: Zhrnúť možnosti genetickej analýzy moly hydatidózy a poukázať na perspektívy v diagnostike tejto choroby.
Typ štúdie: Prehľadový článok.
Názov a sídlo pracoviska: Ústav lekárskej biológie, genetiky a klinickej genetiky, Lekárska fakulta UK a UNB, Bratislava, Slovenská republika.
Metodika: Prehľad publikovaných literárnych údajov z internetových databáz PubMed, ScienceDirect, Scopus a tlačenej literatúry z obdobia 1963–2019.
Výsledky: Článok prináša informácie o význame karyotypizácie, prietokovej cytometrie, FISH (Fluorescent in Situ Hybridization), VNTR-RFLP analýze (Variable Number of Tandem Repeats-Restriction Fragment Lenght Polymorphism), VNTR-PCR analýze (Variable Number of Tandem Repeats-Polymerase Chain Reaction) a STR (Short Tandem Repeat) genotypizácii moly hydatidózy. Sumarizuje možnosti využitia týchto metód v diferenciálnej diagnostike molárnej gravidity (parciálnej a kompletnej moly hydatidózy) a nonmolárneho hydropického abortu.
Záver: Metódy genetickej analýzy umožňujú identifikáciu molárnych gravidít aj v prípadoch, keď vo včasných štádiách gravidity nie je histopatologický obraz jednoznačný.
Klíčová slova:
gestačná trofoblastová choroba – mola hydatidóza – DNA diagnostika
ÚVOD
Mola hydatidóza (MH) je charakterizovaná rôzne výraznou hyperpláziou trofoblastu na povrchu klkov. MH vznikne genetickou poruchou v čase oplodnenia. K molárnym tehotenstvám sa radí kompletná mola hydatidóza (KMH), parciálna mola hydatidóza (PMH) a invazívna mola [16]. KMH a PMH sú benígne formy gestačnej trofoblastovej choroby (gestational trophoblastic disease – GTD), ktoré v 80 % regredujú po evakuácii dutiny maternice. KMH aj PMH môže prejsť do malígnej formy – gestačnej trofoblastovej neoplázie (gestational trophoblastic neoplasia – GTN) [1, 2, 32].
V roku 1912 bol B. Aschnerom objavený ľudský choriový gonadotropín (hCG). Zavedenie monoklonálnych protilátok proti hCG prinieslo identifikáciu rozličných podjednotiek a degradačných forem hCG. Tým sa výrazne zlepšili možnosti včasnej diagnostiky gravidity a jej abnormalít, vrátane MH a iných foriem GTD, pri ktorých môžu byť hladiny hCG významne zvýšené [3, 11].
Od prvého ultrazvukového opisu molárnej gravidity v roku 1963 [23] došlo k výrazným pokrokom v ultrazvukových zobrazovacích technikách a v systéme prenatálnej starostlivosti, čím sa diagnostika MH posunula do I. trimestra gravidity [20].
Aj napriek týmto pokrokom, absencia úplne vyvinutého histopatologického obrazu môže komplikovať stanovenie presnej diagnózy KMH/PMH [5]. Metódy molekulovej genetiky môžu významne pomôcť nie len v diferenciálnej diagnostike KMH a PMH, ale aj v diferenciálnej diagnostike KMH, PMH a hydropicky zmeneného nonmolárneho potratu, napr. digynickej monoandrickej triploidie, trizómií a potratu inej príčiny [28, 29].
ETIOPATOGENÉZA A GENETIKA MH
Hippokrates približne 400 rokov pred Kristom prvý opísal hydatidiformnú molu ako „vodnatieľku uteru“ a vysvetľoval to ako konzumpciu znečistenej vody tehotnou ženou. Wiliam Smelie v roku 1752 prvý použil popis hydatidóznej moly ako „strapec hrozna“ [2]. Až v roku 1977 Kajii a Ohama opísali androgénny pôvod hydatidóznej moly [18]. Základom vzniku MH je porucha mechanizmu oplodnenia, pri ktorej v zygote dôjde k prevahe otcovského genetického materiálu (obr. 1). Kompletná mola hydatidóza má diandrický agynický diploidný genóm, čo znamená, že obe sady chromozómov pochádzajú od otca, a ani jedna nie je od matky. Kvôli absencii chromozómovej sady matky plod v prípade KMH nevzniká. Homozygotná (monospermická) kompletná mola (80 % prípadov) vzniká oplodnením vajíčka (bez genómu) jednou spermiou, ktorej genóm sa následne reduplikuje. Heterozygotná (dispermická) kompletná mola (20 % prípadov) vzniká oplodnením vajíčka dvomi spermiami, pričom sa v zygote nenachádza materský genóm. Kompozícia pohlavných chromozómov je väčšinou XX a menej často XY [17].
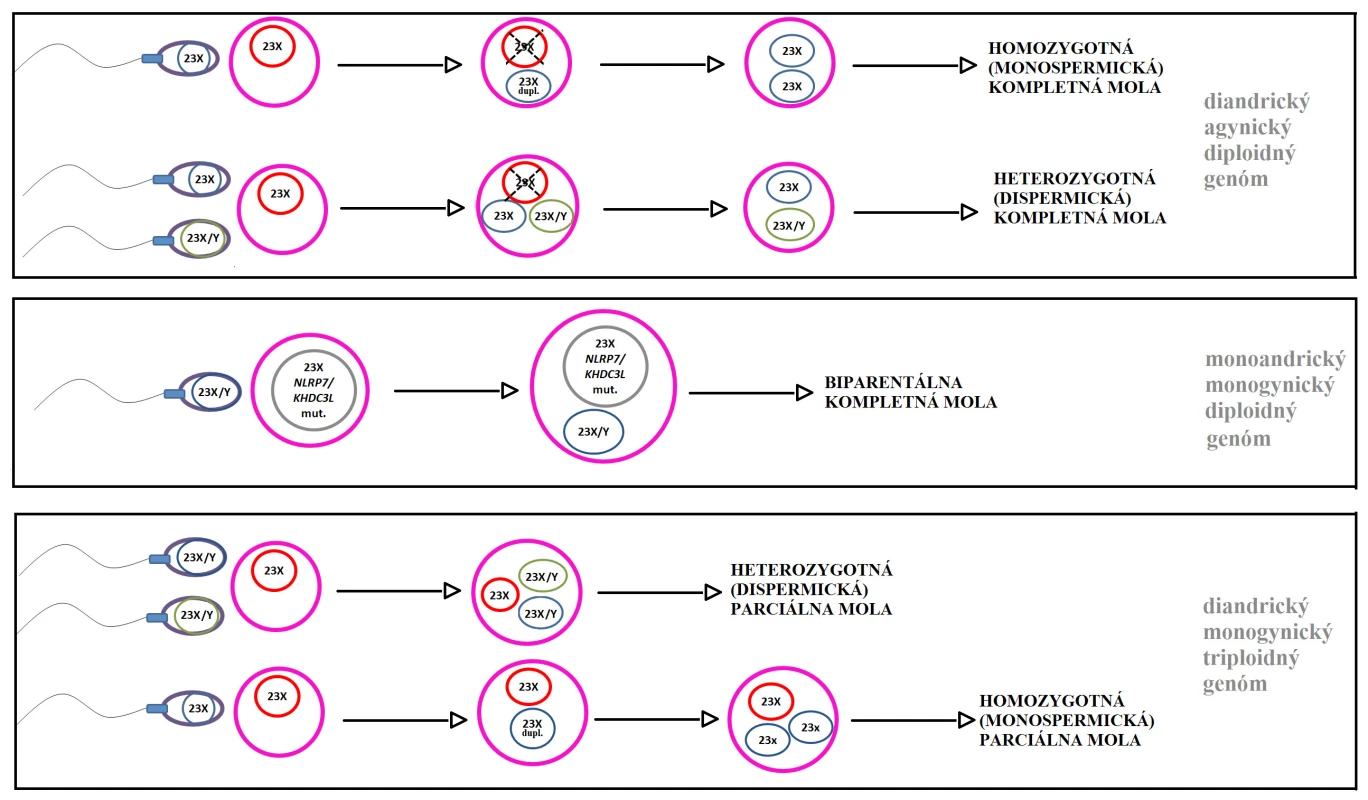
Parciálna hydatidózna mola má diandrický monogynický triploidný genóm, ktorý obsahuje dve sady chromozómov od otca a jednu sadu od matky (obr. 1). Heterozygotná (dispermická) parciálna mola (viac ako 90 % prípadov) vzniká oplodnením vajíčka dvomi spermiami. Ak je vajíčko oplodnené jednou spermiou, ktorej genóm sa endoreduplikuje, ide o homozygotnú (monospermickú) parciálnu molu (do 10 % prípadov). Kompozícia pohlavných chromozómov je najčastejšie XXY a XXX [4, 17].
V procese embryogenézy sú otcovské chromozómy zodpovedné za vývoj placenty a materské za vývoj embrya prostredníctvom genomického impritingu. Pri imprintingu v placente sa dosiahne utlmenie expresie niektorých génov modifikáciou histónov, kým iné gény ostanú aktívne. Na otcovských chromozómoch sú aktívne hlavne gény pre rastové faktory, ako gén pre inzulínu podobný rastový faktor 2 (IGF2), a inaktívne sú tumorsupresorové gény ako CDKN1C kódujúci p57 (KIP2). Tento jav koreluje s teóriou paternálneho rozdielu záujmov (paternal conflict of interest), ktorého základom je rozdielny podiel genómu otca a matky pri vývoji embrya [14, 33].
HISTOPATOLOGICKÝ OBRAZ MH
Histopatologický obraz MH sa odvíja od týždňa gestácie, v ktorej je diagnostikovaná. V diferenciálnej diagnostike MH sa okrem základného histopatologického vyšetrenia využíva imunohistochemické vyšetrenie. Najčastejšie sa používajú protilátky proti p57, hCG, PLAP (placentálna alkalická fosfatáza), alfa inhibín a hPL (ľudský placentárny laktogén) [12, 16, 29].
Klasická KMH (diagnostikovaná v II. trimestri gravidity) je tvorená uniformnou populáciou choriových klkov, ktoré sú všetky výrazne hydropicky degenerované. Stróma je avaskulárna, s prítomnosťou centrálnych cisterien. Na povrchu klkov je výrazná cirkumferentná hyperplázia buniek trofoblastu. Plod nie je prítomný. V cytotrofoblaste klkov imunohistochemickým vyšetrením nie je možné detekovať p57. V povrchovom trofoblaste je výrazná expresia hCG. Skorá forma KMH (early complete mole), diagnostikovaná v I. trimestri gravidity, je charakterizovaná laločnatým až karfiolovitým povrchom choriových klkov. Stróma klkov je bunečnatá, s občasnými jemnými vaskulárnymi lúmenmi a prítomný je karyorektický jadrový detritus. Na povrchu klkov je rôzne výrazná cirkumferentná hyperplázia trofoblastu. Pri imunohistochemickom vyšetrení je vyšetrenie s protilátkami proti p57 negatívne [12, 15, 16].
Parciálna hydatidózna mola je tvorená dvojakou populáciou choriových klkov. Kým jedna časť klkov nevykazuje výraznejšie morfologické zmeny, druhá časť klkov je hydropicky degenerovaná s rôzne výraznou hyperpláziou trofoblastu na povrchu, ale zmeny nie sú také výrazné ako pri KMH. Pri imunohistochemickom vyšetrení je pozitivita vyšetrenia s protilátkami proti p57 v cytotrofoblaste klkov a je výrazná expresia PLAP v povrchovom trofoblaste. Plod môže byť prítomný, môže/nemusí mať početné vývojové malformácie (nie sú špecifické pre PMH). Zvyčajne dochádza k jeho potratu do 20. týždňa gestácie, a ak sa aj plod narodí živý, po pôrode umiera [5, 9, 15, 16]. Skorá forma PMH sa vyznačuje taktiež zmiešanou populáciou klkov, aj keď morfologické zmeny nie sú tak výrazné. Pri imunohistochemickom vyšetrení dominuje taktiež pozitivita p57 v cytotrofoblaste klkov a výrazná expresia PLAP v povrchovom trofoblaste [16, 21].
RIZIKOVÉ FAKTORY A EPIDEMIOLÓGIA MH
Rizikové faktory MH sú extrémne nízky/vysoký vek ženy pri otehotnení (pod 15 alebo nad 40 rokov), nižší socioekonomický status, znížený obsah tukov v strave (vplyv v tukoch rozpustných vitamínov), znížená konzumácia mäsa a karoténu, nedostatok vitamínu A a folátov (účasť týchto vitamínov v procese vývoja oocytu). Rizikovú skupinu tvoria aj ženy s predchádzajúcou molárnou graviditou – riziko opakovania sa zvyšuje na 1 % [5, 9]. Po dvoch molárnych graviditách je riziko tretej molárnej gravidity 15–20 % a neznižuje sa ani zmenou partnera [32].
Presná incidencia MH nie je úplne známa a má širokú variabilitu v rôznych geografických oblastiach. Podieľa sa na tom kvalita histopatologického hodnotenia (komplikovaná diagnostika hlavne PMH a včasných foriem MH), dostupnosť genetickej diagnostiky, kvalita epidemiologických a demografických dát (nemocničné/populačné štúdie), ale aj nutričné a genetické faktory. Incidencia v Európe je udávaná približne jeden prípad MH na 1000 tehotností, zatiaľ čo v Ázii je vyššia [5, 22]. Etiológia je jednoznačná v prípade familiárnej rekurentnej hydatidóznej moly (FRHM), ktorá má autozomálne recesívnu dedičnosť. Tvorí približne 1 % všetkých prípadov MH. Je spôsobená mutáciou génov NLRP7 a KHDC3L. Jedná sa o gény, ktorých úloha v rozvoji ochorenia nie je úplne jasná. Predpokladá sa, že sa podieľajú na genomickom imprintingu oocytu. Typické sú biparentálne kompletné moly, ktoré sú diploidné, majú jednu sadu chromozómov od otca a jednu od matky, ale gény na chromozómoch od matky sú aberantne imprintované (obr. 1). Prevaha paternálneho imprintignu vedie k vytvoreniu fenotypu KMH [13, 17, 25, 26, 30].
KLINICKÁ DIAGNOSTIKA MH
Zvyčajne najčastejšou klinickou manifestáciou KMH aj PMH v I. trimestri gravidity je krvácanie.
V minulosti popisované symptómy a komplikácie, ako je anémia, nadmerné zväčšenie uteru, hypereméza, preeklampsia, hypertyreoidizmus, či ARDS (acute respiratory distress syndrome) a extrémne zväčšenie uteru, sú v súčasnosti (v ekonomicky vyspelých krajinách s dobrou kvalitou prenatálnej starostlivosti) pozorované už len veľmi zriedkavo. Zmeny v klinickom obraze súvisia s ultrazvukovou diagnostikou v skorej gravidite. Preto aj charakteristické ultrazvukové obrazy („klasická KMH“) popisované v minulosti ako „snehová búrka“ alebo „švajčiarsky syr = ementál“ bez prítomnosti plodu a s ovariálnymi cystami, sú dnes len zriedkavo viditeľné v prvých mesiacoch gravidity. Ultrazvukový obraz KMH v I. trimestri pripomína zadržaný potrat (missed abortion), alebo sa zobrazuje heterogénna masa v mierne zväčšenom utere, ale niekedy môže mať aj rozvinutý charakter „klasickej KMH“. Ultrazvuková diagnostika PMH v I. trimestri je zaťažená vysokou falošnou pozitivitou a rovnako aj negativitou pre širokú variabilitu obrazov. Dominuje nehomogénny vzhľad choriového tkaniva, jeho výraznejšia šírka, fokálne mikrocystické zmeny, subchoriálny echo negatívny priestor, nepravidelnosti gestačného vaku, abnormálny žĺtkový vak, embryo môže byť prítomné (bez alebo s kongenitálnymi malformáciami), cystická reakcia ovárií zvyčajne nie je prítomná (ale zriedkavo môže byť). V II. trimestri môže mať časť placenty normálny vzhľad a časť vykazuje obraz molárnej degenerácie, plod je prítomný (môže/nemusí mať kongenitálne malformácie, intrauterinnú rastovú reštrikciu), môžu byť abnormality v množstve plodovej vody. Definitívnu diagnózu PMH však potvrdí až histologické vyšetrenie kompletne evakuovaného materiálu z dutiny uteru [20, 32].
Hladiny hCG nemusia byť nápomocné v diagnostike molárnej gravidity v skorých štádiách, pretože ich variabilita môže byť široká. Liečba je evakuácia dutiny maternice metódou vákuumaspirácie, doplnená o kyretáž. Dôležitá je dispenzarizácia pacientok po evakuácii molárnej gravidity, pretože približne u 15 % žien s KMH a u 0,5 % s PMH sa v ďalšom priebehu vyvinie malígna forma (invazívna mola, choriokarcinóm) s potrebou chemoterapie alebo chirurgickej liečby [20, 32].
DIAGNOSTICKÉ DILEMY
Diagnostické problémy sú diferenciácia KMH, PMH a hydropického potratu, diferenciácia PMH od spontánneho potratu spôsobeného inou príčinou, diferenciácia monogynickej diandrickej triploidie (parciálna mola) od digynickej monoandrickej triploidie (digynická triploidia nie je asociovaná s molárnymi zmenami) a diagnostika skorých, neúplne vyvinutých patológií. Z týchto dôvodov sa môže stať, že MH nie je diagnostikovaná a pacientka nie je adekvátne sledovaná alebo naopak je falošne pozitívne diagnostikovaná a pacientka je zbytočne stresovaná neindikovanou observáciou [28, 29].
Inou diagnostickou dilemou v skorej tehotnosti môže byť viacplodová gravidita, pri ktorej ide o koexistenciu KMH, zriedkavejšie PMH s normálnym plodom. Incidencia takejto gravidity je zriedkavá – 1 prípad na 20 000 až 100 000 tehotností, pričom 40 % prípadov končí pôrodom zdravého dieťaťa a 16 % prechádza do malignity [31, 32].
GENETICKÁ DIAGNOSTIKA MOLÁRNEJ GRAVIDITY A JEJ PERSPEKTÍVY
Metódy genetickej analýzy poskytujú riešenia histopatologických diagnostických dilem molárnej gravidity. Využívané metódy sú prietoková cytometria, karyotypizácia, FISH (Fluorescent in Situ Hybridization), VNTR-RFLP analýza (Variable Number of Tandem Repeats-Restriction Fragment Lenght Polymorphism), VNTR-PCR analýza (Variable Number of Tandem Repeats-Polymerase Chain Reaction) a STR (Short Tandem Repeat) genotypizácia. Analýza VNTR-RFLP, VNTR-PCR a STR genotypizácia umožňuje rýchlu identifikáciu materských a otcovských alel vo vzorke.Prietokovou cytometriou, karyotypizáciou a FISH je možné určiť ploidiu (počet chromozómových sád). Týmito metódami je možné rozlíšiť PMH od diploidného spontánneho potratu spôsobeného inou príčinou a od KMH, ale nie je možné rozlíšiť KMH od nonmolárneho spontánneho potratu a monogynickú diandrickú triploidiu (PMH) od digynickej monoandrickej triploidie. Nevýhodou metód, obzvlášť karyotypizácie, je potreba kultivácie buniek [10, 28].
VNTR sú tandemové opakovania určitej sekvencie (od 16 do 64 bázových párov), najčastejšie v nekódujúcich oblastiach genómu. Opakujúca sa sekvencia je zhodná vo všetkých alelách, ale počet opakovaní, teda aj veľkosť lokusu, sa medzi jednotlivými alelami v populácii líši. Alelová a genotypová variabilita je v populácií vysoká. Kombináciou viacerých VNTR lokusov, sa dajú jedinci s vysokou presnosťou identifikovať a navzájom odlíšiť, preto táto metóda mala uplatnenie dlhé roky vo forenznej medicíne. Analýza VNTR sa dá vykonať buď pomocou RFLP (lokus sa štiepi špecifickou reštrikčnou endonukleázou) alebo PCR (lokus sa amplifikuje). Na separáciu štiepených alebo amplifikovaných produktov na základe dĺžky analyzovaných alel sa najčastejšie využíva agarózová gélová elektroforéza. Analýza umožní porovnať profily DNA matky (izolácia DNA z leukocytov v krvi alebo z endometria), DNA choriových klkov a prípadne aj DNA otca (izolácia DNA z leukocytov v krvi) (obr. 2). Diagnostickú hodnotu majú tzv. informatívne lokusy, v ktorých matka a otec majú rôzne alely, čím sa dá určiť prispievanie oboch rodičov ku genómu analyzovanej vzorky materiálu. Najčastejšie sa v praxi využíva malý počet lokusov (2 alebo 3). Ak sú však rodičia zhodní vo viacerých vyšetrovaných lokusoch, analýza neprinesie očakávaný benefit. Významnou výhodou VNTR analýzy je vysoká presnosť, spoľahlivosť, rýchlosť a finančná dostupnosť [6, 27].

Najpresnejšou a najpraktickejšou metódou diagnostiky moly hydatidózy je STR genotypizácia. STR sú tandemové opakovania (repetície), pri ktorých opakujúca sa sekvencia má veľkosť od 1 do 6 bázových párov. Alely sa od seba navzájom líšia počtom opakovaní tandemovej repetície a majú vysokú variabilitu v populácii. Z toho vyplýva vysoký počet heterozygotov v populácii a malá šanca zhody genotypov medzi jedincami. Vo forenznej medicíne sa využíva identifikácia 13 STR lokusov, a preto je skoro 100% šanca, že daný jedinec má unikátnu kombináciu alel. STR sa identifikujú pomocou multiplexnej PCR (v jednej reakcii sa amplifikuje viacero lokusov súčasne), produkty sa následne separujú pomocou polyakrylamidovej gélovej elektroforézy, a tým sa naraz určuje genotyp pre všetky využívané lokusy. Nakoľko sa analyzuje veľký počet lokusov a možných alel, vždy sa nájde dosť informatívnych lokusov pre presnú diagnózu. Najmodernejšie metódy STR genotypizácie využívajú kombináciu multiplexnej PCR s fluoresenčne značenými primermi a kapilárnu elektroforézu genetickým analyzátorom. Alely sa zobrazia na elektroforetograme ako úzke píky a dajú sa ľahko navzájom porovnať. Na elektroforetograme os x zodpovedá veľkosti fragmentov a os y intenzite fluorescencie detegovanej genetickým analyzátorom. AmpFlSTR Identifiler je rozšírený kit pre STR genotypizáciu, využíva 15 STR lokusov. Jedná sa o opakovanie tetranukleotidov, z ktorých trinásť je súčasťou CODIS-u (Combined DNA Index System). Vyšetruje sa ním aj lokus pre amelogenín, ktorý umožňuje určiť pohlavie (má rozličnú veľkosť na X a Y chromozóme). Táto metóda je veľmi presná, rýchla a finančne dostupná. Identifikuje všetky typy hydatidóznej moly s výnimkou kompletnej biparentálnej moly, ktorá je zriedkavá a má rovnaký genotyp STR lokusov ako zdravý plod. Na diagnostiku kompletnej biparentálnej moly je potrebné klinické, histopatologické a imunohistochemické vyšetrenie, ktoré ju identifikuje ako KMH a následne ju genetická analýza odlíši od diandrickej agynickej kompletnej moly [4, 24].
Pre molekulárno-genetické vyšetrenia je dôležitá čistota vzoriek, bunky choriových klkov nesmú byť kontaminované bunkami matky. Preto sa odporúča získanie buniek pomocou mikrodisekcií z histologických preparátov [4].
GENETICKÁ ANALÝZA FAMILIÁRNEJ REKURENTNEJ MOLY HYDATIDÓZY
Rekurentná mola hydatidóza (RMH) je často spôsobená germinatívnymi mutáciami v géne NLRP7 a zriedkavejšie v KHDC3L. NLRP7 je majoritným génom a je mutovaný v 48–80 % prípadov RMH. Zatiaľ bolo opísaných 70 patogénnych variantov. KHDC3L je minoritným génom, je mutovaný u 10–14 % pacientok s RHM, ktoré sú bez NLRP7 mutácií. Bolo opísaných 6 patogénnych variantov. Dôvodom pre analýzu týchto génov je opakovaná molárna gravidita u pacientky, familiárny výskyt, prípadne diagnóza biparentálnej kompletnej moly. Vyšetruje sa DNA získaná z leukocytov z periférnej krvi pacientok. U pacientok, ktoré sú aspoň v jednom z tých génov homozygotné (prípadne zložené heterozygotky = majú dve rôzne patologické alely tohto istého génu) pre patologickú alelu, sú zdravé gravidity zriedkavé. Ak ženy s takouto genetickou výbavou plánujú tehotnosť, zatiaľ jedinou cestou je umelé oplodnenie darovanými oocytmi od zdravej ženy, nakoľko oocyty pacientky sú aberantné [1, 25, 26].
MOŽNOSTI POSÚDENIA RIZIKA MALIGNIZÁCIE MOLY HYDATITÓZY
Molekulárna diagnostika ponúka možnosť identifikácie pacientok s vyšším rizikom malignizácie. V kombinácii s inými faktormi by mohla prispieť k identifikácii pacientok, ktoré by si vyžadovali prísnejšiu dispenzarizáciu resp. vypracovanie striktných kritérií pre ich dispenzarizáciu. V literatúre sa už dávnejšie uvádza, že heterozygotné kompletné moly majú významne vyššie riziko malignizácie ako homozygotné [19]. V slovenskej populácii bolo toto riziko osemnásobne vyššie [27]. Štúdie poukázali na to, že bunkové procesy, hlavne apoptóza a profily expresie niektorých génov sú odlišné u MH s následnou malignizáciou [8]. Potenciálnym budúcim markerom následnej malignizácie MH je aj proteín syncytín-1 a jeho kódujúci gén (ERVW-1).
ZÁVER
Výhodou molekulárno-genetických metód je možnosť vyšetrenia histologicky spracovaného a analyzovaného materiálu.
Metódy genetickej analýzy umožňujú diferenciáciu KMH, PMH, hydropického abortu a abortu inej príčiny aj v prípadoch, keď histopatologický obraz – najčastejšie vo včasných štádiách gravidity – nie je jednoznačný. Ďalej umožňuje identifikáciu pacientok s vyšším rizikom malignizácie KMH a diagnostiku FRHM.
Táto práca vznikla vďaka podpore Ministerstva zdravotníctva Slovenskej republiky (MZSR 2018/40-LFUK-14), ako aj Ministerstva školstva, vedy, výskumu a športu Slovenskej republiky (VEGA 1/0168/18).
Lajos Gergely
Ústav lekárskej biológie, genetiky a klinickej genetiky
Lekárska fakulta UK a UNB
Sasinkova 4
811 08 Bratislava
Slovenská republika
Zdroje
1. Akoury, E., Gupta, N., Bagga, R., et al. Live births in women with recurrent hydatidiform mole and two NLRP7 mutations. Reprod Biomed Online, 2015, 31, 1, p. 120–124.
2. Al-Talib, A. Molar pregnancy. Eur J Pharm Med Res, 2018, 5(6), p. 167–171.
3. Balachandran, K., Salawu, A., Ghorani, E., et al. When to stop human chorionic gonadotrophin (hCG) surveillance after treatment with chemotherapy for gestational trophoblastic neoplasia (GTN): A national analysis on over 4,000 patients. Gynecol Oncol, 2019, 155, 1, p. 8–12.
4. Banet, N., DeScipio, C., Murphy, KM., et al. Characteristics of hydatidiform moles: analysis of a prospective series with p57 immunohistochemistry and molecular genotyping. Mod Pathol, 2014, 27, 2, p. 238–254.
5. Barber, EL., Soper, JT. Gestational Trophoblastic Disease. In: Philip J. DiSaia, William T. Creasman, Robert S Mannel, D. Scott McMeekin, David G Mutch, eds. Clinical gynecologic oncology. 9th ed. Canada: Elsevier, 2017, p. 163–189.e5.
6. Blanco, A., Blanco, G. The genetic information (I). In Blanco, A., Blanco, G. Medical biochemistry, Canada: Academic press, 2017, p. 465–492.
7. Bolze, PA., Patrier, S., Cheynet, V., et al. Expression patterns of ERVWE1/Syncytin-1 and other placentally expressed human endogenous retroviruses along the malignant transformation process of hydatidiform moles. Placenta, 2016, 39, p. 116–124.
8. Braga, A., Maesta, I., Rocha Soares, R., et al. Apoptotic index for prediction of post molar gestational trophoblastic neoplasia. Am J Obstet Gynecol, 2016, 215, 3, p. 336.e1–336.e12.
9. Candelier, JJ. The hydatidiform mole. Cell Adh Migr, 2016, 10, 1–2, p. 226–235.
10. Carey, L., Nash, BM., Wright, DC. Molecular genetic studies of complete hydatidiform moles. Transl Pediatr, 2015, 4, 2, p. 181–188.
11. Cole, LA., Butler, SA., Khanlian, SA., et al. Gestational trophoblastic diseases: 2. Hyperglycosylated hCG as a reliable marker of active neoplasia. Gynecol Oncol, 2006, 102, p. 151–159.
12. Čierna, Z., Palkovič, M., Danihel Ľ. ml., et al. Expresia markeru p57 v diferenciálnej diagnostike kompletnej a parciálnej moly – korelácia s DNA analýzou. Čes-slov Patol, 2012, 48, 4, s. 218–221.
13. Fallahian, M., Sebire, NJ., Savage, PM., et al. Mutations in NLRP7 and KHDC3L confer a complete hydatidiform mole phenotype on digynic triploid conceptions. Hum Mutat, 2013, 34, 2, p. 301–308.
14. Fisher, RA., Sebire, NJ. Gestational trophoblastic disease, biology and pathology of trophoblast, Moffett, Loke, McClaren, eds. Publisher: Cambridge University Press. 2005. p. 74–110.
15. Heller, DS. Update on the pathology of gestational trophoblastic disease. APMIS, 2018, 126, 7, p. 647–654. doi:10.1111/apm.12786.
16. Hui, P., Baergen, R., Cheung, A., et al. Gestational trophoblastic disease. In: Kurman, R., Carcangiu, ML., Herrington, S., Young, R., eds. WHO Classification of Tumours of Female Reproductive Organs. 4th ed. Lyon, France: International Agency for Research on Cancer, 2014. p. 156–187.
17. Hui, P. Gestational trophoblastic disease. Diagnostic and Molecular Genetic Pathology. New York: Humana Press, 2012, p. 205.
18. Kajii, T., Ohama, K. Androgenetic origin of hydatidiform mole. Nature, 1977, 268, p. 633–634.
19. Wake, N., Seki, T., Fujita, H. Malignant potential of homozygous and heterozygous complete moles. Cancer Res, 1984, 44, 3, p. 1226–1230.
20. Korbeľ, M., Nižňanská, Z., Redecha, M. Kompletná a parciálna mola hydatidóza – etiopatogenéza, diagnostika, liečba a dispenzarizácia. Gynekol prax, 2007, 5, 2, s. 106–112.
21. Kubelka-Sabit K., Jasar D., Filipovski V., et al. Molecular and histological characteristics of early triploid and partial molar pregnancies. Pol J Pathol, 2017, 68(2), p. 138–143. doi:10.5114/ pjp.2017.69689.
22. Lurain, JR. Gestational trophoblastic disease I: epidemiology, pathology, clinical presentation and diagnosis of gestational trophoblastic disease, and management of hydatidiform mole. Am J Obstet Gynecol, 2010, 203, 6, p. 531–539.
23. MacVicar, J., Donald, I. Sonar in the diagnosis of early pregnancy and its complications. J Obstet Gynaecol Br Commonw, 1963, 70, p. 387–395.
24. McMahon, K., Paciorkowski, AR., Walters-Sen, LC., et al. Neurogenetics in the Genome Era. In Swaiman, K., Ashwal, S., Ferriero, D. et al. Swaiman’s pediatric neurology. Canada: Elsevier, 2017, p. 257–267.
25. Moein-Vaziri, N., Fallahi, J., Namavar-Jahromi, B., et al. Clinical and genetic-epigenetic aspects of recurrent hydatidiform mole: A review of literature. Taiwan J Obstet Gynecol, 2018, 57, 1, p. 1–6.
26. Nguyen, NMP., Khawajkie, Y., Mechtouf, N., et al. The genetics of recurrent hydatidiform moles: new insights and lessons from a comprehensive analysis of 113 patients. Mod Pathol, 2018, 31, 7, p. 1116–1130.
27. Repiska, V., Vojtassak, J., Korbel, M., et al. DNA analysis of gestational trophoblastic disease. Čes Gynek, 2003, 68, 6, s. 442–448.
28. Ronnett, BM. Hydatidiform moles: Ancillarytechniques to refine diagnosis. Arch Pathol Lab Med, 2018, 142, 12, p. 1485–1502.
29. Samadder, A., Kar, R. Utility of p57 immunohistochemistry in differentiating between complete mole, partial mole & non-molar or hydropic abortus. Indian J Med Res, 2017, 145, 1, p. 133–137.
30. Sanchez-Delgado, M., Martin-Trujillo, A., Tayama, C., et al. Absence of maternal methylation in biparental hydatidiform moles from women with NLRP7 maternal effect mutations reveals widespread placenta-specific imprinting. PLoS Genet, 2015, 11, 11, e1005644.
31. Sebire, NJ., Foskett M., Paradinas FJ., et al. Outcome of twin pregnancies with complete hydatidiform mole and healthy cotwin. Lancet, 2002, 22, 359(9324), p. 2165–2166.
32. Seckl, MJN., Sebire, J., Fisher, RA., et al. Gestational trophoblastic disease: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 2013, 24, 6, p. vi39–vi50.
33. Vojtaššák, J., Vojtaššák, B. Genetické aspekty gestačných trofoblastových tumorov. Gynekol prax, 2014, 12, 3, s. 145–149.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2020 Číslo 4
Nejčtenější v tomto čísle
- Defekt v jizvě po SC – signifikace, diagnostika, terapie
- Jak dále ve screeningu karcinomu děložního hrdla?
- Metody asistované reprodukce – aktuální stav a perspektivy
- Výhody cvičenia v prenatálnom a postnatálnom období
