Asistovaná reprodukce u mužů s Klinefelterovým syndromem
Assisted reproduction in patients with Klinefelter syndrome
Objective: The goal of this article is to present the current knowledge of Klinefelter syndrome and its impact on male reproductive function as well as the current treatment options. Methods: PubMed/Medline, WoS and Scopus were searched for articles indexed until November 2021. Text: Klinefelter syndrome is a chromosomal aberration with an additional X chromosome in males. This may adversely affect testicular growth and spermatogenesis, thus resulting in male infertility. Recently, new knowledge has appeared about the treatment of male infertility. Conclusion: Interdisciplinary approach enables early diagnosis and treatment of patients with Klinefelter syndrome. Assisted reproductive technology is essential for infertility treatment in patients with Klinefelter syndrome.
Keywords:
genetic testing – assisted reproduction – Aneuploidy – disorders of spermatogenesis – male sterility – Klinefelter syndrome
Autoři:
K. Crha 1
; M Ješeta 1
; Radovan Pilka 2
; M. Kašík 3
; L. Mekiňová 1
; Jan Vodička 2
; Tomáš Crha 1
Působiště autorů:
Gynekologicko-porodnická klinika LF MU a FN Brno
1; Porodnicko-gynekologická klinika LF UP a FN Olomouc
2; Urologická klinika LF MU a FN Brno
3
Vyšlo v časopise:
Ceska Gynekol 2022; 87(2): 133-136
Kategorie:
Přehledový článek
doi:
https://doi.org/10.48095/cccg2022133
Souhrn
Cíl studie: Cílem práce je shrnutí současných poznatků o možnostech léčby poruch plodnosti u pacientů s Klinefelterovým syndromem. Metodika: Rešerše literatury publikované v databázích WoS, Scopus, PubMed/Medline do listopadu 2021. Text: Klinefelterův syndrom je chromozomální aberací způsobenou přítomností nadpočetného chromozomu X u muže. K významným klinickým aspektům patří mužská sterilita podmíněná těžkou poruchou spermatogeneze. V současné době přibývá nových poznatků o možnostech léčby poruch plodnosti u mužů s tímto onemocněním. Závěr: Mezioborová spolupráce umožňuje včasnou diagnostiku a léčbu Klinefelterova syndromu. Asistovaná reprodukce má nezastupitelnou úlohu pro léčbu poruch plodnosti pacientů s Klinefelterovým syndromem.
Klíčová slova:
asistovaná reprodukce – genetické vyšetření – aneuploidie – poruchy spermatogeneze – mužská sterilita – Klinefelterův syndrom
Úvod
Klinefelterův syndrom (KS – Klinefelter syndrome) je u mužů nejčastější chromozomální abnormalitou – 47,XXY [1]. Klinické projevy mohou být značně variabilní. K typickým projevům patří drobná varlata, těžké poruchy spermatogeneze, nízká hladina androgenů a vysoká hladina gonadotropinů [2]. Tyto patologie se mohou projevovat v průběhu života různým způsobem. Do centra asistované reprodukce přichází tito muži většinou až v dospělosti při neúspěšné snaze o početí dítěte. V některých případech je KS diagnostikován teprve genetickým vyšetřením indikovaným pro azoospermii nebo těžkou patologii spermatu. V současné době přibývá nových poznatků o KS, který zvyšuje morbiditu i mortalitu těchto mužů [3]. Je proto důležité KS zavčas diagnostikovat a zajistit adekvátní péči. Cílem této práce je prezentovat současné poznatky o KS, doporučení pro mezioborovou spolupráci a možnosti asistované reprodukce.
Etiologie
Nadpočetný X chromozom se dostává do buněk při poruše meiotického dělení oocytů nebo spermií, v některých případech může vzniknout také při časném postzygotickém mitotickém dělení. Asociace výskytu KS s věkem ženy bývá podmíněna chybami prvního meiotického dělení oocytu. Na fenotypických projevech KS se uplatňuje efekt většího množství genů nacházejících se na nadpočetných chromozomech X, které nebyly inaktivovány. K typickým patří gen SHOX, který podmiňuje disproporční vysokou postavu. Polymorfizmus genů pro androgenní receptor a folikostimulační hormony (FSH – follicle-stimulating hormone), které se nachází na X chromozomech, výrazně ovlivňují klinické projevy KS [4,5].
Prevalence
Při systematických studiích je prevalence většinou uváděna 1–2/1 000 mužů [6]. Zastoupení karyotypu 47,XXY je přibližně 80 %, varianty 48,XXXY, 49,XXXXY, 48,XXYY nebo mozaiky 47,XXY/46,XY tvoří přibližně 20 %. U mužů s celkovým počtem spermií nižším než 10 milionů byla prokázána prevalence 6 %, u mužů s neobstrukční azoospermií 10–15 %. Při preimplantačním genetickém testování (PGT – preimplantation genetic testing) byl karyotyp KS diagnostikován v 0,9 % se signifikantní korelací s věkem ženy. Tento rozdíl – 2 ‰ v populaci vs. 9 ‰ v preimplantačních blastocystách – může být způsoben také sníženou implantací aneuploidních embryí nebo časnými těhotenskými ztrátami [7].
Diagnostika
Diagnóza KS je stanovena vyšetřením karyotypu. Pro stanovení hormonální terapie hypogonadizmu je důležité také stanovení počtu repetic CAG v genu pro androgenní receptor (AR – androgen receptor), při vyšším počtu je menší senzitivita receptoru. Genetické vyšetření je indikováno na základě klinických projevů svědčících pro KS. Jejich přehled v jednotlivých obdobích života je uveden v tab. 1 [3].
Tab. 1. Symptoms of Klinefelter syndrome depending on age.

Prenatálně se stále častěji využívá metoda neinvazivního prenatálního testování (NIPT – non invasive prenatal testing) pro screening autozomálních trizomií. Pro detekci aneuploidií chromozomů X a Y není tento test považován za spolehlivý, byla prokázána tendence vyššího podílu falešně pozitivních výsledků. Pro diagnostiku KS není NIPT považován za diagnostický, je nutné cytogenetické vyšetření [8]. Při průkazu KS cytogenetickým vyšetřením je nutná konzultace genetika a informování rodičovského páru o klinických projevech KS a možnostech dalšího postupu.
Podle aktuálních studií je 51 % pacientů s KS diagnostikováno v dospělosti v souvislosti s reprodukčními potížemi, 16 % v pubertě, 10–12 % v dětství a 21 % prenatálně, což souvisí s prenatálním genetickým testováním [9].
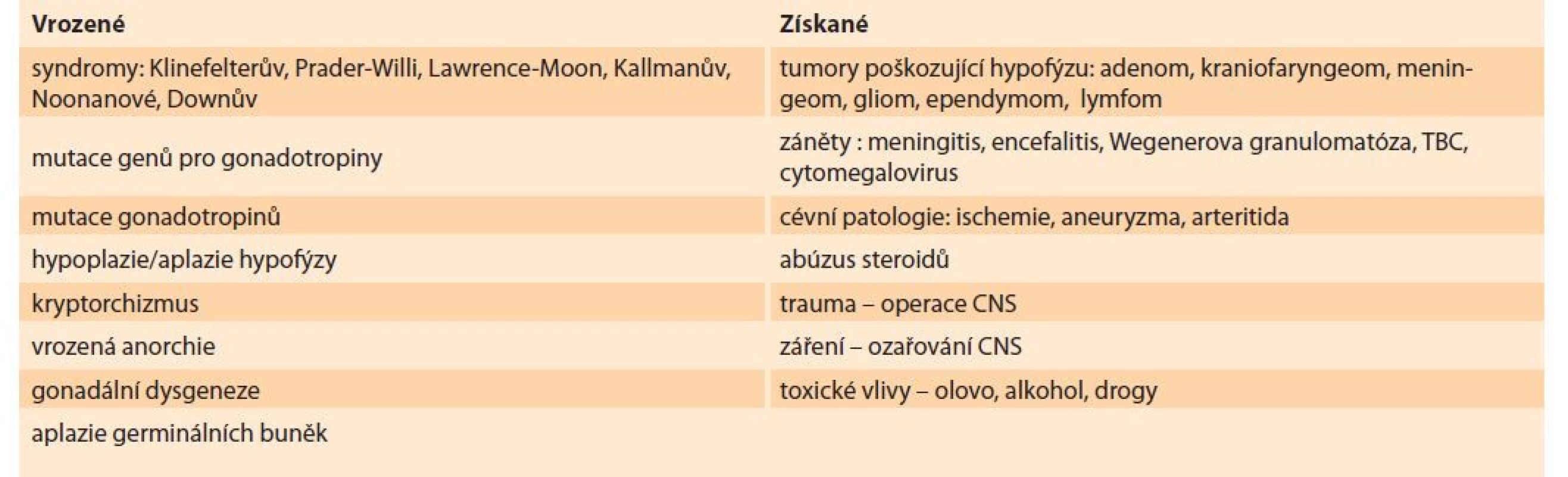
U chlapců a mužů s projevy hypogonadizmu je třeba provést správnou diferenciální diagnostiku a stanovit optimální terapii [10,11]. Stručný přehled vrozených a získaných příčin je uveden v tab. 2.
Tab. 2. Causes of hypogonadism in men.
Testikulární funkce
Testikulární degenerace a abnormální testikulární funkce se začíná rozvíjet již v prenatálním období. K jejím projevům patří kryptorchizmus. Pokud oboustranný kryptorchizmus přetrvává ve věku 24 měsíců, byl prokázán KS v 4,2 % případů [3]. Pro zachování testikulární funkce a především spermatogeneze je nezbytný sestup varlete do skrota. Orchidopexe by měla být provedena nejpozději do věku 24 měsíců stejně jako u kryptorchizmu bez diagnózy KS. Biopsie a kryokonzervace testikulární tkáně u prepubertálních chlapců není indikována [12,13]. Velikost testes je možné hodnotit ultrazvukovým vyšetřením.
Nástup puberty u chlapců s KS bývá v mezích normy, růst varlat je ale menší a po fázi růstu následuje jejich zmenšení. V průběhu puberty dochází k degeneraci zárodečných a Sertoliho buněk, k hyperplazii Leydigových buněk a fibrotizaci intersticia. V ojedinělých semenotvorných kanálcích může být spermatogeneze zachována. Při extrakci testikulárních spermií (TESE – testicular sperm extraction) prováděné ve věku 13–14 let byly spermie získány v 10 %, ve věku 19–30 let byly získány ve 45 %. Důležitým faktorem byla hladina testosteronu > 7,5 nmol/l a hladina luteinizačního hormonu (LH – luteinizing hormone) < 17,5 IU/l – v této skupině byla úspěšnost 54 %, při hladině testosteronu < 7,5 nmol/l spermie získány nebyly [14]. Obecně lze říct, že recentní vědecké studie popisují, že spermie lze nalézt pomocí TESE u přibližně poloviny pacientů s KS ve věku 16–30 let. Naproti tomu u chlapců mladších než 16 let byla úspěšnost metody TESE výrazně nižší (0–20 %) [12].
Infertilita
Pohyblivé spermie jsou přítomny v ejakulátu přibližně u 10 % mužů s KS. Při azoospermii může být ve varleti zachována fokální spermatogeneze, chirurgickým multifokálním odběrem TESE nebo mikrodisekční TESE je možné spermie získat u 30–60 % pacientů. S takto získanými spermiemi bylo dosaženo porodu dítěte přibližně v 16 % případů [15].
Možnost zachování reprodukce u mužů s KS je důležitou součástí komplexní a celoživotní péče o jedince s touto diagnózou. V dětství by měli být adekvátně informováni rodiče, v závislosti na tělesné a psychické kondici potom mladí muži s KS. Nezbytný je přísně individuální přístup, vhodná konzultace psychologa seznámeného s touto problematikou. Potřebná vyšetření a výkony zajišťují centra asistované reprodukce. Přehled doporučení je uveden v tab. 3.
Tab. 3. Overview of recommendations for the reproduction of men with Klinefelter syndrome.

Pro dosažení těhotenství je vzhledem k velmi nízkým počtům spermií zcela zásadní využití kvalitní kryokonzervace, dlouhodobého skladování [16], metody intracytoplazmatické injekce spermie (ICSI – intracytoplasmatic sperm injection) po standardním vyšetření partnerky a jejích reprodukčních funkcí [17]. K nejdůležitějším faktorům poruch plodnosti u ženy patří vyšší věk, nízká ovariální rezerva a endometrióza [18]. Nezbytná je také konzultace genetika, který posoudí rizika pro potomstvo a vhodná další vyšetření. V dřívějších studiích se předpokládalo, že pouze buňky 46,XY u mozaicistních KS pacientů 46,XY/47,XXY mohou produkovat zdravé spermie [19]. Nicméně u pacientů s KS 47,XXY bylo zjištěno, že mají pouze 2,67 % spermií s hyperhaploidií pohlavních chromozomů (1,22 % XX, 1,36 % XY a 0,09 % YY), což je sice v případě spermií XX a XY statisticky více než u zdravé populace, ale je to přesto poměrně malé procento [20]. Není jasné, zda jsou spermatogonie 47,XXY schopné kompletního meiotického dělení nebo ztratí nadpočetný chromozom X.
Debatována je také otázka, zda se fokusy zachované spermatogeneze věkem redukují, jasná data nebyla publikována [21]. Fertilita u mužů s KS koreluje s funkcí Leydigových buněk [14]. Spermatogeneze může být poškozena také v souvislosti s kouřením nebo expozicí jiným xenobiotikům [22].
Komplexní péče
Klinefeltertův syndrom ovlivňuje nepříznivě nejen plodnost, ale také psychiku, mentální funkce, kardiovaskulární systém, pevnost skeletu a řadu metabolických funkcí. V různých obdobích života se klinický obraz a význam těchto poruch mění (tab. 1). Péče o pacienty s KS by proto měla být komplexní od dětství do dospělosti [23]. Důležitým požadavkem je široká mezioborová spolupráce (endokrinolog, pediatr, psycholog, genetik, urolog, androlog, centrum asistované reprodukce, praktický lékař) a její návaznost v průběhu života. Optimální je stanovení a znalost doporučených postupů diagnostiky a léčby, které vychází z ověřených aktuálních poznatků [2,24].
Závěr
Nové poznatky o Klinefelterově syndromu umožňují jeho včasnou diagnostiku a potřebnou léčbu. Nezbytným předpokladem je mezioborová spolupráce vycházející z doporučených postupů, kdy asistovaná reprodukce má nezastupitelnou úlohu pro fertilitu pacientů s Klinefelterovým syndromem.
ORCID autorů
K. Crha 0000-0002-8043-5543
M. Ješeta 0000-0003-1778-3454
R. Pilka 0000-0001-8797-1894
M. Kašík 0000-0002-3064-4072
L. Mekiňová 0000-0002-1839-2802
J. Vodička 0000-0003-0446-4454
T. Crha 0000-0003-0980-8906
Doručeno/Submitted: 2. 3. 2022
Přijato/Accepted: 6. 3. 2022
doc. Ing. Michal Ješeta, Ph.D.
Gynekologicko-porodnická klinika
LF MU a FN Brno
Obilní trh 11
602 00 Brno
Zdroje
1. Morris JK, Alberman E, Scott C et al. Is the prevalence of Klinefelter syndrome increasing? Eur J Hum Genet 2008; 16 (2): 163–170. doi: 10.1038/sj.ejhg.5201956.
2. Kamischke A, Baumgardt A, Horst J et al. Clinical and diagnostic features of patients with suspected Klinefelter syndrome. J Androl 2003; 24 (1): 41–48.
3. Zitzmann M, Aksglaede L, Corona G et al. European academy of andrology guidelines on Klinefelter syndrome endorsing organization: European Society of Endocrinology. Andrology 2021; 9 (1): 145–167. doi: 10.1111/andr.12 909.
4. Lanfranco F, Kamischke A, Zitzmann M et al. Klinefelter‘s syndrome. Lancet 2004; 364 (9430): 273–283. doi: 10.1016/S0140-6736 (04) 166 78-6.
5. Tüttelmann F, Gromoll J. Novel genetic aspects of Klinefelter’s syndrome. Mol Hum Reprod 2010; 16 (6): 386–395. doi: 10.1093/molehr/gaq 019.
6. Nielsen J, Wohlert M. Chromosome abnormalities found among 34,910 newborn children: results from a 13-year incidence study in Arhus, Denmark. Hum Genet 1991; 87 (1): 81–83. doi: 10.1007/BF01213097.
7. Mazzilli R, Cimadomo D, Rienzi L et al. Prevalence of XXY karyotypes in human blastocysts: multicentre data from 7,549 trophectoderm biopsies obtained during preimplantation genetic testing cycles in IVF. Hum Reprod 2018; 33 (7): 1355–1363. doi: 10.1093/humrep/ dey110.
8. Gil MM, Accurti V, Santacruz B et al. Analysis of cell-free DNA in maternal blood in screening for aneuploidies: up-dated meta-analysis. Ultrasound Obstet Gynecol 2017; 50 (3): 302–314. doi: 10.1002/uog.17484.
9. Bojesen A, Juul S, Gravholt CH. Prenatal and postnatal prevalence of Klinefelter syndrome: a national registry study. J Clin Endocrinol Metab 2003; 88 (2): 622–626. doi: 10.1210/jc.2002-021491.
10. Hána V, Kosák M, Hána V jr et al. Male hypogonadism and its treatment. Cas Lek Cesk 2017; 156 (5): 258–265.
11. Ross JL, Kushner H, Kowal K et al. Androgen treatment effects on motor function, cognition, and behavior in boys with Klinefelter syndrome. J Pediatr 2017; 185 : 193–199. doi: 10.1016/j.jpeds.2017.02.036.
12. Franik S, Hoeijmakers K, D’Hauwers K et al. Klinefelter syndrome and fertility: sperm preservation should not be offered to children with Klinefelter syndrome. Hum Reprod 2016; 31 (9): 1952–1959. doi: 10.1093/humrep/dew179.
13. Gies I, Oates R, De Schepper J et al. Testicular biopsy and cryopreservation for fertility preservation of prepubertal boys with Klinefelter syndrome: a pro/con debate. Fertil Steril 2016; 105 (2): 249–255. doi: 10.1016/ j.fertnstert.2015.12.011.
14. Rohayem J, Fricke R, Czeloth K et al. Age and markers of Leydig cell function, but not of Sertoli cell function predict the success of sperm retrieval in adolescents and adults with Klinefelter’s syndrome. Andrology 2015; 3 (5): 868–875. doi: 10.1111/andr.12067.
15. Corona G, Minhas S, Giwercman A et al. Sperm recovery and ICSI outcomes in men with non-obstructive azoospermia: a systematic review and meta-analysis. Hum Reprod Update 2019; 25 (6): 733–757. doi: 10.1093/humupd/dmz028.
16. Ventruba P, Žáková J, Ješeta M et al. Kryokonzervace spermatu před gonadotoxickou léčbou ve Fakultní nemocnici Brno v letech 1995–2020. Ceska Gynekol 2021; 86 (3): 156–162. doi: 10.48095/cccg2021156.
17. Crha K, Ventruba P, Žáková J et al. The role of uterine microbiome and epithelial-mesenchymal transition in endometrial function. Med J Cell Biol 2019; 7 (3): 146–151. doi: 10.2478/acb-2019-0020.
18. Hudecek R, Kohlova B, Siskova I et al. Blocking of EphA2 on endometrial tumor cells reduces susceptibility to Vδ1 gamma-delta T-Cell-mediated killing. Front Immunol 2021; 12 : 752646. doi: 10.3389/fimmu.2021.752646.
19. Kjessler B. Karyotype, meiosis and spermatogenesis in a sample of men attending an infertility clinic. Monogr Hum Genet 1966; 2 : 1–93. doi: 10.1159/isbn.978-3-318-03994-8.
20. Guttenbach M, Michelmann HW, Hinneay B et al. Segregation of sex chromosomes into sperm nuclei in a man with 47,XXY Klinefelter’s karyotype: a FISH analysis. Hum Genet 1997; 99 (4): 474–477. doi: 10.1007/s004390050 391.
21. Deebel NA, Galdon G, Zarandi NP et al. Age--related presence of spermatogonia in patients with Klinefelter syndrome: a systematic review and meta-analysis. Hum Reprod Update 2020; 26 (1): 58–72. doi: 10.1093/humupd/dmz 038.
22. Ješeta M, Navrátilová J, Franzová K et al. Overview of the mechanisms of action of selected bisphenols and perfluoroalkyl chemicals on the male reproductive axes. Front Genet 2021; 12 : 692897. doi: 10.3389/fgene.2021.692897.
23. Mason KA, Schoelwer MJ, Rogol AD. Androgens during infancy, childhood, and adolescence: physiology and use in clinical practice. Endocr Rev 2020; 41 (3): bnaa003. doi: 10.1210/endrev/bnaa003.
24. Nieschlag E, Ferlin A, Gravholt CH et al. The Klinefelter syndrome: current management and research challenges. Andrology 2016; 4 (3): 545–549. doi: 10.1111/andr.12208.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2022 Číslo 2
Nejčtenější v tomto čísle
- Hymenální atrezie – vzácná kongenitální anomálie s rizikem pozdního stanovení diagnózy
- Aktuální data o účinnosti profylaktické HPV vakcinace v primární prevenci cervikálních lézí
- Asistovaná reprodukce u mužů s Klinefelterovým syndromem
- Materská mortalita v Slovenskej republike v rokoch 2007–2018
