Ischemizující metody léčby děložních myomů
Methods causing ischemia in uterine fibroids treatment
Objective:
To compare principle, advantages, disadvantages, and risks of conservative (i.e. uterus saving) methods of treatment of uterine fibroids, which are focused on elimination or reduction of their perfusion. To contribute to better understanding of this dynamic topic between gynecologists, especially in the field of appropriate indication criteria.
Design:
Review article.
Setting:
Department of Obstetrics and Gynecology, Charles University and General Faculty Hospital, Prague.
Methods:
Analysis of literature and our clinical experience.
Conclusions:
Within the last decade the spectrum of treatment of uterine fibroids has broaden with methods causing ischemia of fibroids. These include the minimally invasive surgical therapy (laparoscopic occlusion of uterine arteries /LUAO/ and Doppler assisted laparoscopic myolysis) and radiological catheterization treatment (uterine artery embolization, UAE). Compared to foreign countries where UEA is mainly used in perimenopausal women, we focus on the group of patients with further fertility plans. It is necessary to stress that in spite of the number of affirmative experiences with the new techniques of uterine fibroid treatment in both the indication groups (women with or without further fertility plans) these methods still remain an alternative to standard surgical treatment, because both myomectomy and hysterectomy can be performed by minimally invasive techniques in the majority of women. This review is also focused on the specific risks of the particular methods as well as on their mechanism of action which may dramatically differ despite of some analogies.
Key words:
fibroids, uterine artery embolization, laparoscopic myolysis, laparoscopic occlusion of uterine arteries.
Authors:
P. Horák 1; M. Mára 1; P. Dundr 2; K. Kubínová 1; L. Hašlík 1; D. Kužel 1
Authors‘ workplace:
Gynekologicko-porodnická klinika VFN a 1. LF UK, Praha, přednosta prof. MUDr. A. Martan, DrSc.
1; Patologický ústav VFN a 1. LF UK, Praha, přednosta prof. MUDr. C. Povýšil, DrSc.
2
Published in:
Ceska Gynekol 2009; 74(4): 262-268
Category:
Original Article
Overview
Cíl studie:
Srovnat princip, výhody, nevýhody a rizika konzervativních (dělohu šetřících) metod léčby děložních myomů, zaměřených na vyřazení nebo redukci jejich perfuze. Tím přispět k lepší orientaci gynekologů v této dynamicky se rozvíjející problematice, především v otázce vhodných indikačních kritérií.
Typ studie:
Přehledový článek.
Název a sídlo pracoviště:
Gynekologicko-porodnická klinika VFN a 1. LF UK, Praha.
Metodika:
Analýza dostupných literárních údajů a klinických zkušeností našeho pracoviště.
Závěry:
V posledním desetiletí se spektrum léčby děložních myomů rozšířilo o tzv. ischemizující metody. Řadíme k nim chirurgické výkony s minimální invazivitou (laparoskopická okluze uterinních arterií, tzv. LUAO a dopplerem asistovaná laparoskopická myolýza) a radiologickou léčbu katetrizační (embolizace uterinních tepen, UAE). Zatímco v zahraničí je zejména UAE častěji používána u žen perimenopauzálních, sami pokládáme za hlavní indikační skupinu ischemizující léčby pacientky s přáním zachování fertility. Přes řadu pozitivních zkušeností s novými technikami léčby myomů je nutné zdůraznit, že v obou indikačních skupinách (ženy s či bez reprodukčních plánů) zůstávají tyto metody jen alternativou k chirurgické léčbě standardní, mj. proto, že jak myomektomie, tak hysterektomie dnes lze u většiny žen provést miniinvazivní technikou. Tento přehled je dále zaměřen na specifická rizika jednotlivých metod a také na jejich mechanismus účinku, který se přes některé analogie poměrně výrazně liší.
Klíčová slova:
děložní myom, embolizace děložních tepen, laparoskopická myolýza, laparoskopická okluze děložních tepen.
ÚVOD
U moderních žen je dnes i u nás zřetelný trend oddalovat graviditu do pozdějšího věku. Tento jev má řadu sociálních, ekonomických, ale i medicínských dopadů, mj. zvyšující se incidenci děložních myomů, které pak mohou být příčinou sterility, infertility nebo závažných komplikací těhotenství a porodu. Proto je dnes konzervativní, dělohu šetřící léčba těchto nejčastějších benigních tumorů vnitřních rodidel tématem velmi aktuálním.
Jde-li o myomy objemné, progresivně rostoucí nebo symptomatické (krvácivé či tlakové obtíže, zatížená reprodukční anamnéza) a jsou-li vyčerpány možnosti farmakoterapie, jejíž účinnost je stále dosti limitovaná, je na místě uvažovat o léčbě chirurgické. Ta většinou spočívá, v závislosti na věku a reprodukčních plánech pacientek, v enukleaci myomu nebo hysterektomii. V současnosti je stále silnější přání pacientek o léčbu co nejméně invazivní, nejen ve vztahu k perioperační zátěži a rekonvalescenci, ale i ve smyslu možného zachování dělohy, resp. co nejmenší traumatizace zdravých tkání dělohy. Bylo popsáno mnoho nových metod, které dělohu nejen zachovávají a graviditu nevylučují, ale dokonce nenarušují zevní integritu stěny děložní, na rozdíl od myomektomie [13, 17, 20, 32, 38, 47, 63]. Tyto techniky jsou zaměřeny buď na tkáňovou destrukci myomu (laparoskopická elektromyolýza, radiofrekvenční ablace, kryomyolýza, ablace myomu fokusovaným ultrazvukem) [30] nebo na jeho cévní zásobení (UAE, LUAO, dopplerem asistovaná laparoskopická myolýza). Tuto druhou skupinu označujeme jako metody okluzivní či přesněji ischemizující. V tomto přehledu chceme porovnat jednotlivé způsoby ischemizující léčby myomů, a to proto, že mezi nimi existují podstatné rozdíly, které mohou hrát velkou roli při výběru vhodných pacientek.
PRINCIP JEDNOTLIVÝCH METOD
1. Embolizace děložních tepen
Embolizace děložních tepen (UAE) je miniinvazivním, katetrizačním, intraarteriálním výkonem, který indikuje gynekolog a provádí intervenční radiolog [36, 39]. Obvykle se zahajuje z pravého třísla punkcí arteria femoralis dextra a následuje postupné zavedení mikrokatétru do ascendentních větví obou (nejprve vlevo, pak vpravo) děložních tepen, optimálně až za odstup vaginální větve a. uterina. Embolizace, aby byla dostatečně efektivní, musí být provedena oboustranně, a to i u myomů lokalizovaných výrazně laterálně v hraně děložní. Za skiaskopické kontroly zde jsou do oběhu vpraveny speciální mikročástice o velikosti 500 až 1200 mikrometrů (většinou polyvinyl-alkoholové /PVA/ nebo tris-akryl gelatinové /TGMS/), které postupně okludují arterie a arterioly myomů, zatímco prokrvení ostatních (zdravých) tkání dělohy zůstává zachováno [29, 52]. Tato tzv. pseudopreference toku mikročástic do cév myomu, zajišťující selektivitu léčby, je daná nižším odporem cév tumoru oproti obvyklému cévnímu odporu ve zdravých tkáních. Výkon ukončujeme dosažením kompletního vyřazení dominantního myomu (či všech větších myomů) z perfuze a přitom ponecháním volného toku v hlavních kmenech a v cerviko-vaginálních větvích obou uterinních arterií – hovoříme o „limitované uterinní embolizaci“ [43]. Ta by měla být zárukou dostatečné perfuze zdravých tkání dělohy po zákroku, včetně perfuze placenty v případě gravidity.
Výkon, prováděný v lokální anestezii a po výkonu zajištěný opiátovou intravenózní, nazální nebo epidurální analgezií (profylaxe a léčba tzv. postembolizačního syndromu) obvykle trvá kolem 30 minut; podstatnější je však sledování tzv. skiaskopického času, kde se průměrné hodnoty pohybují kolem 10–15 minut [35]. Hospitalizace většinou nepřesahuje 1–2 dny a plný návrat k běžným činnostem 1 týden. Maxima efektu UAE, tzn. objemové redukce myomů o 30–60 % a vymizení či alespoň zmírnění klinických symptomů nemocné, lze očekávat do 6 měsíců [4, 36, 62]. Embolizace je většinou indikována u symptomatických žen s myomy, které již neplánují graviditu a nepřejí si radikální operační řešení, např. pro relativně nízký věk. U mladých žen plánujících těhotenství, kde by UAE byla z pohledu gynekologie a reprodukční medicíny na první pohled velmi atraktivní (absence přímého zásahu do stěny děložní a rizik chirurgického zákroku vůbec), je však její indikace kontroverzní pro přítomnost některých specifických komplikací a rizik (viz níže kapitolu o komplikacích).
2. Laparoskopická okluze děložních tepen
Laparoskopická okluze děložních tepen (LUAO) je na první pohled chirurgickou či přesněji laparoskopickou obdobou UAE (samozřejmě ji lze provést i z laparotomie). Kromě odlišného přístupu se však poměrně výrazně liší i vlastním mechanismem působení, možnými komplikacemi a částečně i ve výběru vhodných pacientek [16, 17, 20, 32, 42]. Výkon provádíme v celkové anestezii a jeho přibližná délka je 30–60 minut (podle erudice operatéra a technicko-anatomických podmínek). Oproti UAE pozorujeme nižší nároky na pooperační analgezii a obdobnou délku hospitalizace i pracovní neschopnosti [16, 17]. Při LUAO redukujeme cévní zásobení dělohy oboustranným přerušením hlavních kmenů děložních tepen (elektrokoagulací, stehem, klipem či pomocí harmonického skalpelu, tj. energií ultrazvukovou), v optimálním případě hned u jejich odstupu z vnitřní ilické tepny. Děloha je poté zásobena krví prostřednictvím větví z jiných tepenných kmenů a z kolaterál.
LUAO někdy kombinujeme s laparoskopickou myomektomií, protože snižuje riziko peroperačního a časného i pozdního pooperačního krvácení a snad i riziko pooperačních adhezí a recidiv nových myomů [32, 49, 50, 60]. Sami ji používáme zejména v případech vícečetných myomů, kdy větší, lépe dostupné myomy jsou laparoskopicky odstraněny a myomy menší a nevhodně (kaudálně) lokalizované ošetřujeme tímto ischemizujícím postupem. V posledních letech byla popsána účinnost i u pouze přechodné okluze děložních tepen z vaginálního přístupu, za asistence dopplerovské ultrasonografie a neuroaxiální anestezie [10, 31, 57]. Principem je mechanické uzavření obou hlavních kmenů uterinní arterie pomocí speciální svorky na dobu 6 hodin. Po odstranění svorky se krevní tok v uterinní arterii okamžitě obnoví.
Ať již je chirurgická okluze provedena jakkoli, je její efekt založen na poznatku, že nádorová tkáň leiomyomů je více než zdravé tkáně dělohy citlivější na byť i dočasnou ischémii. Požadovaným výsledkem, hodnoceným opět v několikaměsíčním odstupu od výkonu, je zmenšení myomu/ů a ústup specifických obtíží pacientky. Podle převahy literárních referencí je tato efektivita srovnatelná s UAE [16, 17, 21, 32].
3. Laparoskopická, dopplerem asistovaná myolýza
Klasická laparoskopická myolýza je miniinvazivní metoda, jejímž cílem je selektivní devitalizace myomu přímým působením vybrané energie (elektromyolýza, kryomyolýza, laser, radiofrekvence) pod optickou kontrolou laparoskopie [3, 7, 11]. Nepatří tak k výkonům ischemizujícím, ale ke tkáňově destrukčním metodám léčby myomů. Podle některých českých autorů je myolýzu možno zpřesnit, a její charakter tím pozměnit, peroperačním využitím vaginální dopplerovské ultrasonografie k navigaci operatéra na elektrokoagulaci hlavních cév vyživujících myom [5]. Cíl je zde obdobný jako u obou předchozích – objemová redukce myomu a s ním spojených symptomů. Na rozdíl od LUAO a hlavně UAE je tato varianta myolýzy více limitovaná velikostí a lokalizací myomu.
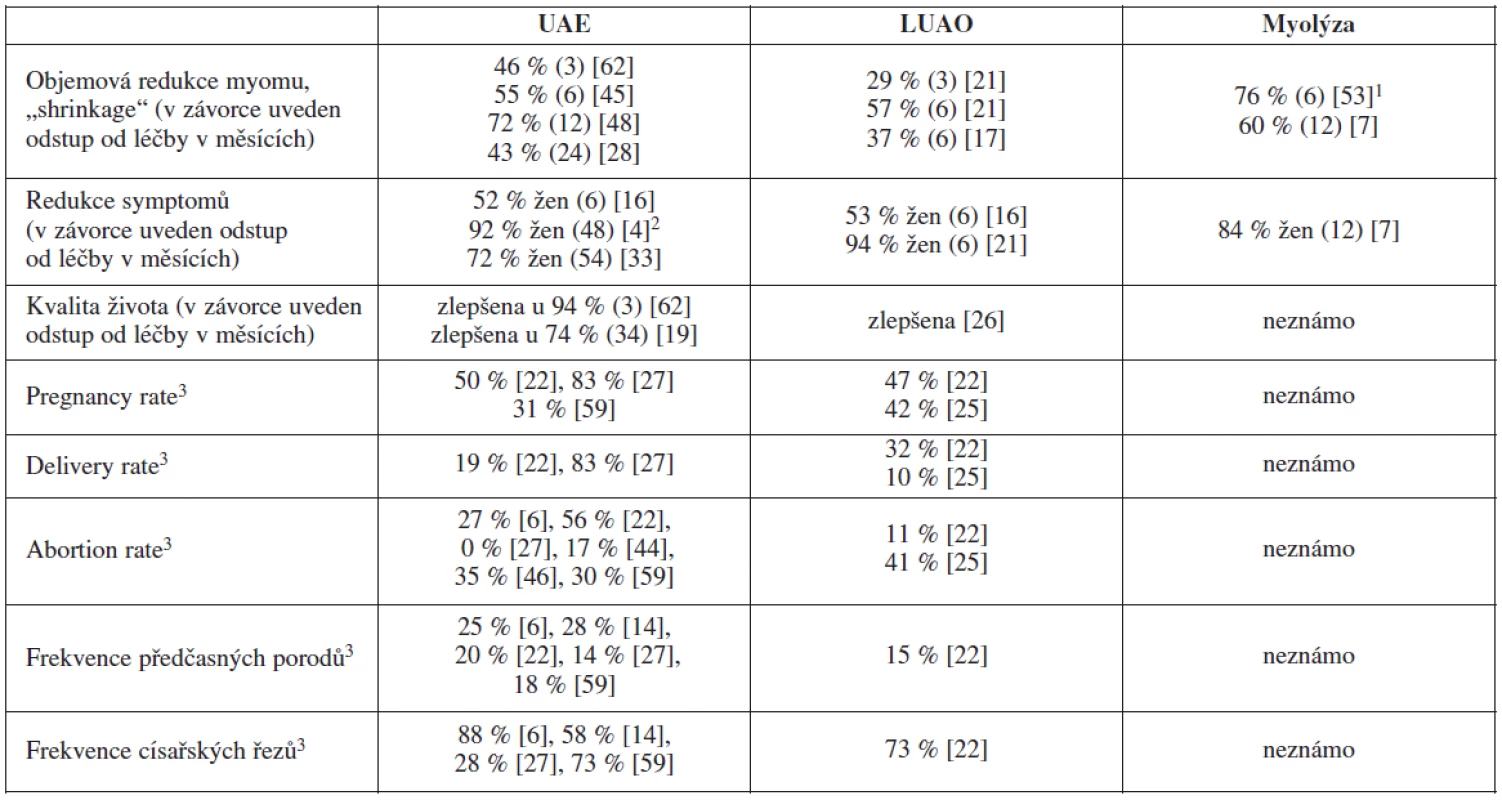
Dopplerem asistovaná elektromyolýza by měla vyvolat aseptickou nekrózu myomu s následným vyhojením fibrinovou, event. kalcifikovanou jizvou tak, aby nebyla výrazně narušena architektura a funkčnost okolního myometria. Nároky na anestezii, délku hospitalizace a rekonvalescence jsou přibližně stejné jako u LUAO. Tato metoda je, podle některých názorů, šetrnější alternativou k myomektomii a není kontraindikací pro plánovaní gravidity [5]. Srovnání klinických výsledků jednotlivých ischemizujících metod léčby myomů přináší tabulka 1.
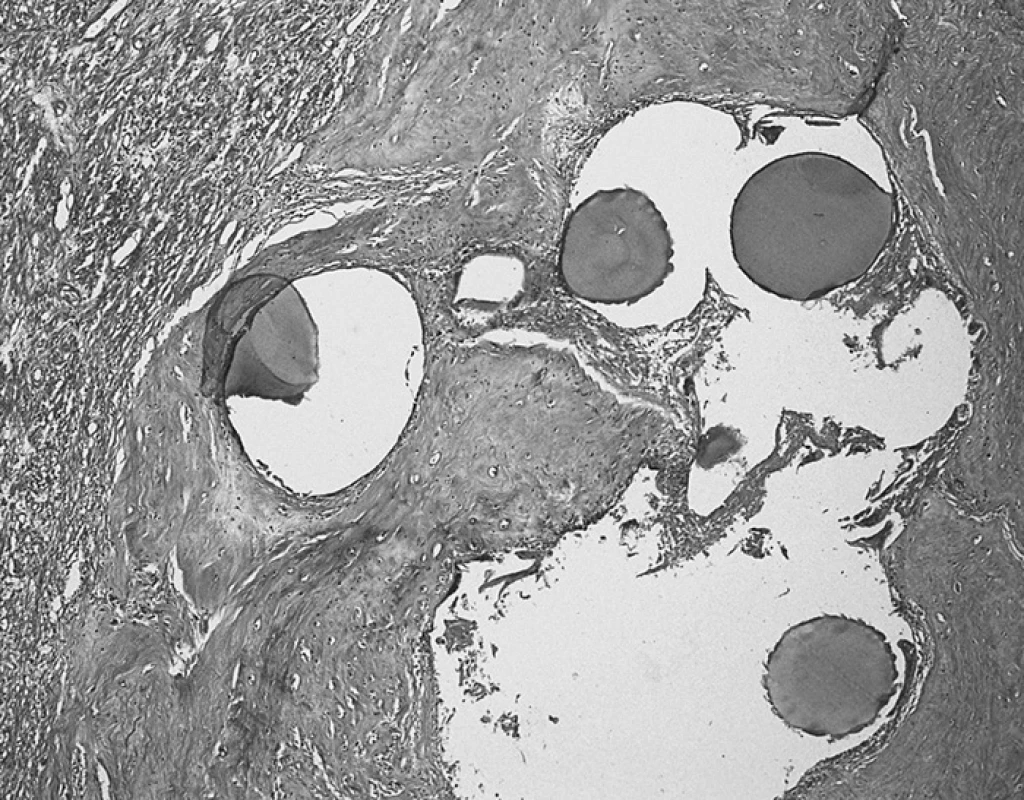
HISTOPATOLOGICKÉ NÁLEZY PO ISCHEMIZUJÍCÍ LÉČBĚ MYOMŮ
V důsledku ischemizující léčby se v leiomyomech vyskytuje spektrum regresivních změn, které se v určitých aspektech liší podle použité metody, do určité míry jsou však tyto změny shodné [8, 61]. Vzácně je jediným nálezem výrazný edém intersticia a jiné regresivní změny nejsou vyjádřeny. Obvykle je však typickým nálezem výskyt nekrózy různého typu a rozsahu. Většinou se jedná o tzv. hyalinní (ischemickou) nekrózu, charakterizovanou zonálním uspořádáním s oblastmi nekrózy v okolí s nespecifickou granulační tkání a hyalinizacemi. Hyalinní nekróza může být přítomna i dlouhou dobu po prodělaném zákroku, často se však po delším časovém úseku vyskytují i jiné regresivní změny, hlavně hyalinizace s dystrofickými kalcifikacemi. Další typ nekrózy, který se vyskytuje poměrně vzácně a obvykle v krátkém časovém úseku po léčbě, je koagulační nekróza. Ta je jednou z typických známek maligních nádorů, a proto je její přítomnost nutno hodnotit v kontextu prodělané terapie a dalších histologických rysů okolní vitální tkáně (jaderné atypie, mitózy). U neléčených leiomyocelulárních nádorů je však výskyt koagulačního typu nekrózy podle poslední WHO klasifikace nádorů známka malignity i bez přítomnosti dalších znaků hodnocených při stanovení biologického chování leiomyocelulárních nádorů [54]. Poslední typ nekrózy, se kterým se v souvislosti s terapií můžeme vzácněji setkat, je nekróza supurativní, pro niž je typický výskyt většího množství polymorfonukleárů.
V případě UAE je obvyklým nálezem přítomnost embolizačních částic, ať už intravaskulárně, ve stěně cév či volně ve tkáni (obr. 1). Morfologie se liší podle použitého typu materiálu. PVA částice jsou v barvení hematoxylin&eosin bazofilní, často fragmentují a po delším časovém odstupu od zákroku může být jejich identifikace obtížná. Oproti tomu TGMS jsou eozinofilní, nedochází k jejich fragmentaci a ve tkáni jsou obvykle snadno identifikovatelné i v delším odstupu od UAE [12].
Rozdíly mezi změnami leiomyomů léčených UAE, LUAO, resp. myolýzou jsou podle našich zkušeností spíše kvantitativní. Spektrum zastižených změn je stejné, avšak u laparoskopicky prováděných zákroků se častěji setkáváme s fibrotizací a hyalinizací a rozsah nekróz bývá menší, což však může souviset i s intervalem mezi ischemizací a následnou myomektomií. Podle literárních údajů se zdá, že na ischemických změnách se ve větší míře u LUAO podílí apoptóza než nekróza, zatímco v případě UAE je to naopak. Tento fakt zřejmě souvisí s prolongovanou hypoxií během operačního zákroku při ligaci arterií, která indukuje apoptózu [42].
ISCHEMIZUJÍCÍ LÉČBA MYOMŮ A ZOBRAZOVACÍ VYŠETŘENÍ
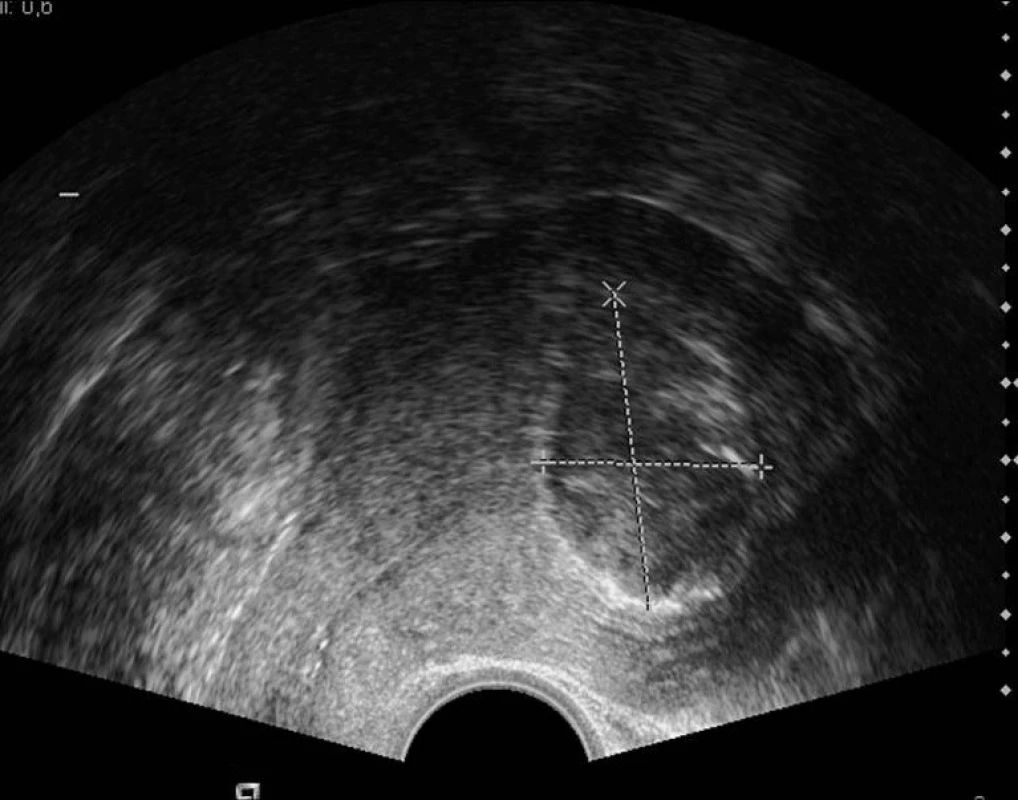
Tak jako u velké většiny jiných gynekologických onemocnění vnitřních rodidel je i v těchto specifických situacích nejčastěji používaný ultrazvuk. Nejen pro jeho dostupnost a ekonomickou nenáročnost, ale také proto, že je prováděn gynekologem a v optimálním případě lékařem se zkušenostmi s ischemizující léčbou myomů, který se spolupodílí na indikaci a případné operační léčbě. Některé popisy magnetické rezonance (MRI) malé pánve z per radiologů nejsou přínosné, přestože se jinak jedná o metodu suverénní ve zobrazování měkkých tkání (včetně dělohy), pokud se nejedná o radiologa s určitou gynekologickou erudicí, který o nálezech komunikuje s indikujícím gynekologem. Naproti tomu CT vyšetření není v této problematice ničím přínosné [2].
Podrobné ultrazvukové vyšetření malé pánve, zaměřené nejen na celkovou velikost dělohy a největší myom, ale na precizní popis všech zřetelných myomů (velikost, echostruktura, homogenita, uložení ve vztahu k myometriu, a zejména dutině děložní, topografická lokalizace, stupeň a charakter vaskularizace) je základem jak pro správnou indikaci pacientek s leiomyomy, tak pro jejich follow-up a hodnocení efektu či případného selhání léčby [37]. Ultrazvukový obraz optimálně ischemizovaného myomu je charakteristický ostrým ohraničením oproti okolnímu myometriu (obvykle vyšší echogenita myomu než okolí) a kompletním vyřazením z perfuze (obr. 2). V tomto hodnocení je většinou dostačující dopplerovské, ultrazvukové vyšetření, i když spolehlivějším ukazatelem kompletní ischémie je gadoliniovým kontrastem potencované MRI [29]; ta je též spolehlivějším (i když ne stoprocentním) vyšetřením v diferenciální diagnostice adenomyózy nebo sarkomu dělohy [40]. V literatuře již byly popsány kazuistiky sarkomů primárně hodnocených jako leiomyomy, které byly léčené některou ischemizující metodou [9, 23]. MRI bývá též využívána k periprocedurálnímu monitorování nebo k predikci objemové odpovědi UAE [18, 58].
KOMPLIKACE ISCHEMIZUJÍCÍCH METOD LÉČBY MYOMŮ
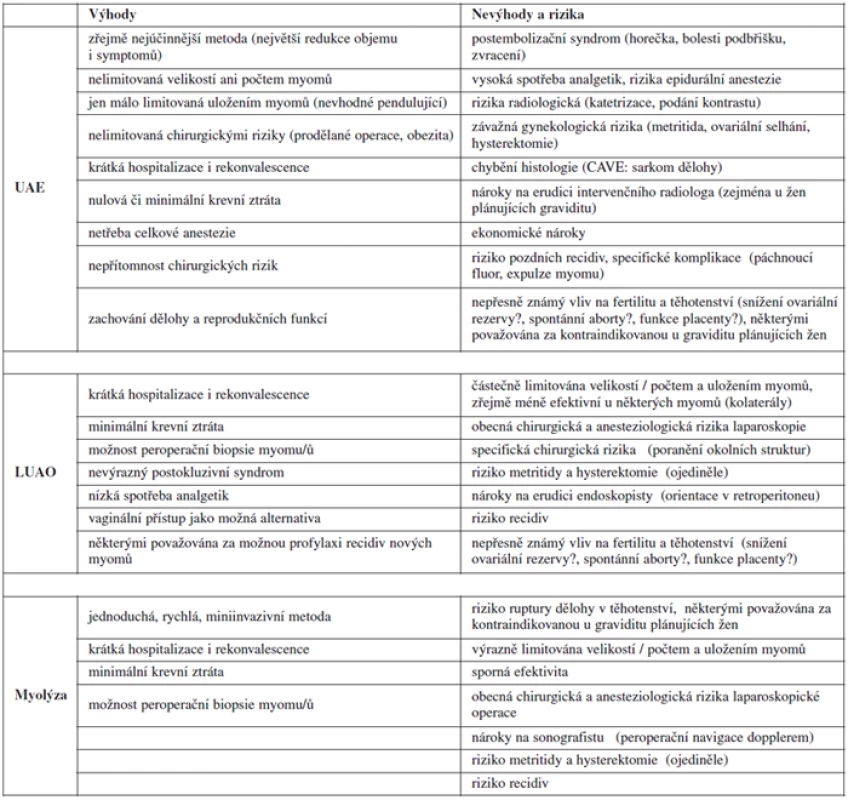
Komplikace je, tak jako u jiných intervencí, možné dělit na časné a pozdní. Časné komplikace jsou příhodami peroperačními (LUAO, myolýza) či periprocedurálními (UAE) nebo události na výkony navazující v nejbližších hodinách či dnech. Pozdní komplikace většinou souvisí se snahou pacientek o těhotenství – mezi ty nejfatálnější a nenapravitelné pro tuto skupinu žen patří nutnost hysterektomie (většinou z důvodu závažného postižení dělohy infekcí a/nebo nekrózou) či ztráta ovariálních funkcí. Zatímco některé komplikace jsou možné u všech popisovaných metod (např. hysterektomie nebo krvácení), jiné jsou specifické pouze pro jedinou z nich (např. sekundární amenorea po UAE nebo poranění obturatorního nervu či ureteru při LUAO). A zatímco časné komplikace jsou u tohoto typu léčby sice poměrně časté, avšak častěji nezávažné, řešitelné nebo reverzibilní, pozdní komplikace jsou vzácné, zato většinou závažnější (viz výše). Jednotlivé typy komplikací ischemizující léčby myomů jsou obsaženy v tabulce 2.
DISKUSE
Zavedením UAE do praxe intervenčních radiologů v polovině 90. let minulého století [47] byla gynekologům hozena pomyslná rukavice a ti se tak začali více zaobírat možnostmi dělohu šetřící léčby myomů. Tento tlak byl umocňován lačností pacientek (do jisté míry nehledě na jejich věk) po těchto alternativách. Vzniklo tak několik operačních postupů, z nichž převážná část je založena na minimální invazivitě, tedy na metodách endoskopických a vaginálních.
Po prvotním nadšení nad novinkami, rozšiřujícími spektrum naší léčby myomů, je dnes třeba střízlivě a co nejobjektivněji zhodnotit jejich skutečný přínos oproti jejich rizikům a to je možné jen na základě prospektivních, kontrolovaných studií. Jejich sestavení je však v případě děložních myomů nesnadné, neboť jde o velmi heterogenní skupinu žen, a tak je těchto studií zatím nemnoho [15, 16, 22, 24, 35, 51]. U pacientek, žádajících zachování fertility, by navíc hlavním hodnotícím kritériem úspěchu měly být výsledky reprodukční a takové studie samozřejmě nelze uzavřít během krátké doby. Při analýze jednotlivých metod a volbě vhodné léčby pro konkrétní pacientku tak většinou vycházíme z dosud publikovaných výsledků studií retrospektivních či nekontrolovaných, ze stále lepšího poznání principů ischemizujících metod léčby a v neposlední řadě z nemalých zkušeností našeho pracoviště, které se dlouhodobě a nejednostranně věnuje této problematice.
Dnes se zdá, že UAE je léčbou nejvíce potentní, ve smyslu zmenšení myomů i jejich symptomů, ale také nejvíce agresivní, což se v některých případech může negativně promítnout do dalších snah pacientky o graviditu. Zatímco ovariální a infekční komplikace vidíme u žen mladších než 40 let minimálně, poměrně často se setkáváme s přítomností devitalizovaného, tedy nekrotického myomu v dutině děložní, ať již ve formě menší, či větší prominence, narušující symetrii dutiny, nebo ve formě komunikace („píštěle“) mezi dutinou a intramurálním myomem [34, 41]. Tento fakt odpovídá vyšší frekvenci potratů, udávané v některých studiích [6, 22]. Je otázkou, zda sekundární chirurgická intervence, spočívající v šetrném odstranění nekrotického myomu a v rekonstrukci děložní stěny a dutiny, výrazně zlepší reprodukční prognózu těchto žen. Naše dosavadní zkušenosti toto naznačují a otevírají tak širší možnosti spolupráce reprodukčních chirurgů a intervenčních radiologů.
Moderní laparoskopické metody léčby myomů, jako je myomektomie (LM), LUAO nebo myolýza, popřípadě laparoskopicky asistovaná myomektomie (LAM), mohou embolizaci výrazně konkurovat v požadavcích na nízkou invazivitu léčby, krátkou hospitalizaci a rekonvalescenci. Hlavní výhodou UAE zůstávají její neomezené možnosti při léčbě myomů vícečetných nebo u pacientek s významnými chirurgickými riziky.
Nespornou výhodou ischemizujících technik je nenarušení integrity stěny děložní, a tedy minimalizace rizika děložní ruptury v graviditě. Je však otázkou, jak velké je toto riziko po adekvátně provedené a dobře zhojené myomektomii. I zde kupodivu chybí spolehlivá literární data a zdá se nám, že se o této komplikaci často mluví, ale její výskyt je ojedinělý. Navíc ruptury dělohy byly již popsány i po UAE, a zejména po myolýze [1, 55, 56].
Závěrem je třeba zmínit hlavní výhodu, kterou by měly obsahovat obě metody zasahující na úrovni uterinních arterií, tedy UAE a LUAO. Jde o jistou systémovost této léčby, která postihuje myomy nehledě na jejich počet a topografickou lokalizaci. Tyto parametry bývají hlavním limitem standardní chirurgické léčby, kde mnohočetná myomektomie nebo odstranění myomu z hůře přístupných částí dělohy, může být pro dělohu příliš traumatizující čili riziková. V ideálním případě by tyto postupy měly nejen zabránit budoucímu růstu myomů (včetně gravidity), ale i znamenat profylaxi jejich budoucího opětného výskytu.
MUDr. Petr Horák
Gynekologicko-porodnická klinika
1. LF UK a VFN
Apolinářská 18
128 00 Praha 2
Sources
1. Arcangeli, S., Pasquarette, MM. Gravid uterine rupture after myolysis. Obstet Gynecol, 1997, 89, p. 857.
2. Ascher, S., Silverman, P. Applications of computed tomography and gynecologic disease. Urol Radiol, 1991, 13, p. 26-18.
3. Bergamini, V., Ghezzi, F., Cromi, A., et al. Laparoscopic radiofrequency thermal ablation: a new approach to symptomatic uterine myomas. Am J Obstet Gynecol, 2005, 192, p. 768-773.
4. Broder, MS., Goodwin, S., Chen, G., et al. Comparison of long-terms outcomes of myomectomy and uterine artery embolization. Obstet Gynecol, 2002, 100, p. 864-868.
5. Břešťák, M. jr., Pohl, K. Ultrazvukem vedená cílená laparoskopická ischemizace uterinních leiomyomů. Čes Gynek, 2003, 68, s. 152-155.
6. Carpenter, TT., Walker, WJ. Pregnancy following uterine artery embolization for symptomatic fibroids: a series of 26 completed pregnancies. BJOG, 2005, 112, p. 321-325.
7. Ciavattini, A., Tsiroglou, D., Piccioni, M., et al. Laparoscopic cryomyolysis: an alternative to myomectomy in women with symptomatic fibroids. Surg Endosc, 2004, 18, p. 1785-1788.
8. Clarke, B., McCluggage, WG. Iatrogenic lesions and artefacts in gynaecological pathology. J Clin Pathol, 2009, 62, p. 104-112.
9. D’Angelo, A., Amso, NN., Wood, A. Uterine leiomyosarcoma discovered after uterine artery embolization. J Obstet Gynecol, 2003, 23, p. 686–587.
10. Dickner, SK., Cooper, JM., Diaz, D. A nonincisional, Doppler-guided transvaginal approach to uterine artery identification and control of uterine perfusion. J Am Assoc Gynecol Laparosc, 2004, 11, p. 55-58.
11. Donnez, J., Squifflet, J., Polet, R., et al. Laparoscopic myolysis. Hum Reprod Update, 2000, 6, p. 609-613.
12. Dundr, P., Mára, M., Mašková, J., et al. Pathological findings of uterine leiomyomas and adenomyosis following uterine artery embolization. Pathol Res Pract, 2006, 202, p. 721-729.
13. Exacoustos, C., Zupi, E., Marconi, D., et al. Ultrasound-assisted laparoscopic cryomyolysis: two - and three-dimensional findings before, during and after treatment. Ultrasound Obstet Gynecol, 2005, 25, p. 393-400.
14. Goldberg, J., Pereira, L., Berghella, V. Pregnancy after uterine artery embolization. Obstet Gynecol, 2002, 100, p. 869-872.
15. Goodwin, SC., Bradley, LD., Lipman, JC., et al. UAE versus Myomectomy Study Group. Uterine artery embolization versus myomectomy: a multicenter comparative study. Fertil Steril, 2006, 85, p. 14-21.
16. Hald, K., KlŅw, NE., Qvigstad, E., Istre, O. Laparoscopic occlusion compared with embolization of uterine vessels: a randomized controlled trial. Obstet Gynecol, 2007, 109, p. 20-27.
17. Hald, K., Langebrekke, A., KlŅw, NE., et al. Laparoscopic occlusion of uterine vessels for the treatment of symptomatic fibroids: Initial experience and comparison to uterine artery embolization. Am J Obstet Gynecol, 2004, 190, p. 37-43.
18. Harman, M., Zeteroglu, S., Arslan, H., et al. Predictive value of magnetic resonance imaging signal and contrast-enhancement characteristics on post-embolization volume reduction of uterine fibroids. Acta Radiol, 2006, 47, p. 427-435.
19. Hirzel, F., Hess, T., Zollikofer, C. Quality control and quality of life after uterine fibroid embolization: long-term results. Gynakol Geburtshilfliche Rundsch, 2008, 48, p. 84-93.
20. Holub, Z., Kliment, L. Laparoscopic ultrasonic dissection of uterine vessels in women with benign uterine pathologies. Clin Exp Obstet Gynecol, 2002, 29, p. 54-56.
21. Holub, Z., Lukáč, J., Kliment, L., et al. Short-term results from laparoscopic dissection of uterine vessels in women with symptomatic fibroids. Eur J Obstet Gynecol Reprod Biol, 2003, 110, p. 94-98.
22. Holub, Z., Mára, M., Kužel, D., et al. Pregnancy outcomes after uterine artery occlusion: prospective multicentric study. Fertil Steril, 2008, 90, p. 1886-1891.
23. Holub, Z., Rokyta, Z., Kliment, L. Laparoscopic uterine artery dissection in an undiagnosed endometrial stromal sarcoma. Case report. Eur J Gynaecol Oncol, 2005, 26, p. 111-112.
24. Hovsepian, DM., Ratts, VS., Rodriguez, M., et al. A prospective comparison of the impact of uterine artery embolization, myomectomy, and hysterectomy on ovarian function. J Vasc Interv Radiol, 2006, 17, p. 1111-1115.
25. Chen, YJ., Wang, PH., Yuan, CC., et al. Pregnancy following treatment of symptomatic myomas with laparoscopic bipolar coagulation of uterine vessels. Hum Reprod, 2002, 18, p. 1077–1081.
26. Istre, O. Uterine artery occlusion for the treatment of symptomatic fibroids: endoscopic, radiological and vaginal approach. Minim Invasive Ther Allied Technol, 2005, 14, p. 167-174.
27. Kim, MD., Kim, NK., Kim, HJ., Lee, MH. Pregnancy following uterine artery embolization with polyvinyl alcohol particles for patients with uterine fibroid or adenomyosis. Cardiovasc Intervent Radiol, 2005, 28, p. 611-615.
28. Kim, MD., Lee, HS., Lee, MH., et al. Long-term results of symptomatic fibroids treated with uterine artery embolization: In conjunction with MR evaluation. Eur J Radiol, 2009, v tisku.
29. Kroencke, TJ., Scheurig, C., Lampmann, LE., et al. Acrylamido polyvinyl alcohol microspheres for uterine artery embolization: 12-month clinical and MR imaging results. J Vasc Interv Radiol, 2008, 19, p. 47-57.
30. Kubínová, K., Mára, M., Horák, P., et al. Novinky a perspektivy v radiologické léčbě děložních myomů. Čes Gynek, 2009, v tisku.
31. Lichtinger, M., Herbert, S., Memmolo, A. Temporary, transvaginal occlusion of the uterine arteries: a feasibility and safety study. J Minim Invasive Gynecol, 2005, 12, p. 40-42.
32. Liu, WM. Laparoscopic bipolar coagulation of uterine vessels to treat symptomatic leiomyomas. J Am Assoc Gynecol Laparosc, 2000, 7, p. 125-129.
33. Lohle, PN., Voogt, MJ., De Vries, J., et al. Long-term outcome of uterine artery embolization for symptomatic uterine leiomyomas. J Vasc Interv Radiol, 2008, 19, p. 319-326.
34. Mára, M., Fučíková, Z., Kužel, D., et al. Hysteroscopy after uterine fibroid embolization in women of fertile age. J Obstet Gynaecol Res, 2007, 33, p. 316-324.
35. Mára, M., Fučíková, Z., Mašková, J., et al. Uterine fibroid embolization versus myomectomy in women wishing to preserve fertility: preliminary results of a randomized controlled trial. Eur J Obstet Gynecol Reprod Biol, 2006, 126, p. 226-233.
36. Mára, M., Mašková, J., Fučíková, Z., et al. Poznámky k embolizaci děložních myomů. Čes Gynek, 2007, 72, p. 58-64.
37. Mára, M. Zobrazovací metody v diagnostice děložních myomů. Mod Gynek Porod, 2007, 16, p. 714-718.
38. Marshburn, PB., Mattheus, ML., Hurst, BS. Uterine artery embolization as a treatment option for uterine myomas. Obstet Gynecol North Am, 2006, 33, p. 125-144.
39. Mašková, J., Drbohlav, P., Křivánek, J., et al. První výsledky léčby symptomatických děložních myomů intraarteriální embolizací. Čes Radiol, 2001, 55, p. 364-369.
40. Murase, E., Siegelman, ES., Outwater, EK., et al. Uterine leiomyomas: histopathologic features, MR imaging findings, differential diagnosis, and treatment. Radiographics, 1999, 19, p. 1179-1197.
41. Ogliari, KS., Mohallem, SV., Barrozo, P., Viscomi, F. A uterine cavity-myoma communication after uterine artery embolization: two case reports. Fertil Steril 2005, 83, p. 220-222.
42. Park, KH., Kim, JY., Shin, JS., et al. Treatment outcomes of uterine artery embolization and laparoscopic uterine artery ligation for uterine myoma. Yonsei Med J, 2003, 44, p. 694-702.
43. Pelage, JP., Le Dref, O., Beregi, JP., et al. Limited uterine artery embolization with tris-acryl gelatin microspheres for uterine fibroids. J Vasc Interv Radiol, 2003, 14, p. 15-20.
44. Pron, G., Mocarski, E., Bennet, J., et al. Pregnancy after uterine embolization for leiomyomata: the Ontario multicenter trial. Obstet Gynecol, 2005, 105, p. 67–76.
45. Ravina, JH., Aymard, A., Ciraru-Vigneron, N., et al. Uterine fibroids embolization: results about 454 cases. Gynecol Obstet Fertil, 2003, 31, p. 597-605.
46. Ravina, JH., Ciraru-Vigneron, N., Aymard, A., et al. Pregnancy after embolization of uterine myoma: report of 12 cases. Fertil Steril, 2000, 73, p. 1241–1243.
47. Ravina, JH., Herbreteau, D., Ciraru-Vigneron, N., et al. Arterial embolisation to treat uterine myomata. Lancet, 1995, 346, p. 671-672.
48. Richter, GM., Radeleff, B., Rumbach, S., et al. Uterine fibroid embolization with spheric micro-particles using flow guiding: safety, technical success and clinical results. Rofo, 2004, 176, p. 1648-1657.
49. Santos, LM., Frenna, V., Thoma, V., et al. Disseminated intravascular coagulation after laparoscopic multiple myomectomy with use of icodextrin: a case report. J Minim Invasive Gynecol, 2006, 13, p. 480-482.
50. Sapmaz, E., Celik, H., Altungul, A. Bilateral ascending uterine artery ligation vs. tourniquet use for hemostasis in cesarean myomectomy. A comparison. J Reprod Med. 2003, 48, p. 950-954.
51. Siskin, GP., Shlansky-Goldberg, RD., Goodwin, SC., et al. A prospective multicenter comparative study between myomectomy and uterine artery embolization with polyvinyl alcohol microspheres: long-term clinical outcomes in patients with symptomatic uterine fibroids. J Vasc Interv Radiol, 2006, 17, p. 1287-1295.
52. Spies, JB., Allison, S., Flick, P., et al. Spherical polyvinyl alcohol versus tris-acryl gelatin microspheres for uterine artery embolization for leiomyomas: results of a limited randomized comparative study. J Vasc Interv Radiol, 2005, 16, p. 1431-1437.
53. Szydlovska, I., Starczewski, A. Laparoscopic coagulation of uterine myomas with the use of unipolar electrode. Surg Laparosc Endosc Percutan Tech, 2007, 17, p. 99-103.
54. Tavassoli, FA., Devilee, P. (eds.) WHO Classification of tumours. Pathology and genetics tumours of the breast and female genital organs. IARC Press: Lyon 2004.
55. Vidal, L., Michel, ME., Gavillon, N., et al. Pregnancy after uterine-artery embolization for symptomatic fibroids: a case of placenta accreta with uterine rupture. J Gynecol Obstet Biol Reprod (Paris), 2008, 37, p. 811-814.
56. Vilos, GA., Daly, LJ., Tse, BM. Pregnancy outcome after laparoscopic electromyolysis. J Am Assoc Gynecol Laparosc, 1998, 5, p. 289-292.
57. Vilos, GA., Vilos, EC., Romano, W., et al. Temporary uterine artery occlusion for treatment of menorrhagia and uterine fibroids using an incisionless Doppler-guided transvaginal clamp. Hum Reprod, 2006, 21, p. 269-271.
58. Vin, AP., Rhee, TK., Ryu, RK., et al. Use of a combined MR imaging and interventional radiology suite for intraprocedural monitoring of uterine artery embolization. J Vasc Interv Radiol, 2007, 18, p. 1362-1367.
59. Walker, WJ., McDowell, SJ. Pregnancy after uterine artery embolization for leiomyomata: a series of 56 completed pregnancies. Am J Obstet Gynecol, 2006, 195, p. 1266-1271.
60. Wang, PH., Liu, WM., Fuh, JL., et al. Symptomatic myoma treated with laparoscopic uterine vessel occlusion and subsequent immediate myomectomy: which is the optimal surgical approach? Fertil Steril, 2009, v tisku.
61. Weichert, W., Denkert, C., Gauruder-Burmester, A., et al. Uterine arterial embolization with tris-acryl gelatin microspheres. A histopathologic evaluation Am J Surg Pathol, 2005, 29, p. 955-961.
62. Worthington-Kirsch, RL., Pophy, GL., Hutchins, FL. Uterine artery embolization for the management of leiomyomas: quality of life assessment and clinical response. Radiology, 1998, 208, p. 625-629.
63. Zupi, E., Sbracia, M., Marconi, D., et al. Myolysis of uterine fibroids: is there a role? Clin Obstet Gynecol, 2006, 49, p. 821-833.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2009 Issue 4
Most read in this issue
- Klinické zkušenosti s kombinovanou vaginální antikoncepcí NuvaRing v České republice
- Placenta adherens partim accreta – ojedinělé možnosti terapie
- Dlouhodobé léčebné výsledky vysoké zadní plastiky s plikací levátorů s použitím síťky Vypro II
- Vliv hodnoty CA125 a hemoglobinu na prognózu ovariálního karcinomu