Sledování hemokoagulačních změn v průběhu těhotenství žen s opakovaným potrácením v závislosti na podávání nízkomolekulárního heparinu
Monitoring of haemocoagulative changes during long-term doses of low molecular weight heparin during pregnancy
Objective:
The aim of study was to compare plasma levels of selected coagulation parameters in pregnant women with long-term administration of low molecular weight heparin (LMWH) versus cohort of healthy women LMWHs untreated.
Design:
Prospective study.
Setting:
Department of Haematology, Institute of Clinical Biochemistry and Haematology, Charles University and University Hospital, Plzen.
Methods:
We examined 67 pregnant women with recurrent fetal loss in previous pregnant history treated by long-term prophylactic administration of LMWH. Blood samples were collected before gestation and at 10th, 20th, 30th gestational weeks.
Results:
Pregnant women with own history of recurrent fetal loss treated by the long-term prophylactic dose of LMWHs during pregnancy have the same values of the coagulation parameters as the control cohort in spite of fact that the clinical efficacy of administered LMWHs is high.
Conclusion:
Our results suggest that heparin may act by many unknown different mechanisms, such as inhibition of complement binding or secretion of prostaglandins.
Key words:
recurrent fetal loss, pregnancy, haemostasis, low molecular weight heparin.
Authors:
P. Šigutová 1; Z. Hajšmanová 1; J. Šlechtová 1; I. Šubrt 2; L. Hradecký 3; Z. Ulčová-Gallová 3
Authors‘ workplace:
Ústav klinické biochemie a hematologie LF UK a FN Plzeň, přednosta prof. MUDr. J. Racek, DrSc., vedoucí pracoviště MUDr. J. Šlechtová
1; Ústav lékařské genetiky LF UK a FN Plzeň, přednosta MUDr. I. Šubrt
2; Gynekologicko-porodnická klinika LF UK a FN Plzeň, přednosta doc. MUDr. Z. Rokyta, CSc.
3
Published in:
Ceska Gynekol 2009; 74(5): 348-354
Overview
Cíl studie:
Práce porovnává vybrané koagulační parametry těhotných žen dlouhodobě léčených ve sledované graviditě preventivní dávkou nízkomolekulárního heparinu se zdravými těhotnými ženami bez heparinové prevence.
Typ studie:
Prospektivní studie.
Název a sídlo pracoviště:
Hematologický úsek, Ústav klinické biochemie a hematologie, Lékařská fakulta Univerzity Karlovy a Fakultní nemocnice Plzeň.
Metodika:
Sledovali jsme koagulační parametry 67 těhotných žen s opakovanými potraty v anamnéze, které byly dlouhodobě léčené ve sledované graviditě preventivní dávkou LMWH a porovnali jsme je se zdravými těhotnými ženami neléčenými LMWH. Ženy byly laboratorně vyšetřované před graviditou a v 10., 20., 30. týdnu gravidity.
Výsledky:
Ačkoliv klinicky je úspěšnost podávaného LMWH vysoká, koagulační parametry těhotných žen dlouhodobě léčených LMWH nebyly statisticky významně odlišné od souboru kontrolních gravidních žen heparinem neléčených.
Závěr:
Na úspěšném zakončení těhotenství u žen s předchozími opakovanými potraty či patologickým vývojem plodu se podávání heparinu pravděpodobně uplatňuje jinými mechanismy než koagulačními (např. přes komplementový systém nebo přes sekreci prostaglandinů).
Klíčová slova:
opakované potrácení, těhotenství, hemostáza, nízkomolekulární heparin.
ÚVOD
Fyziologické těhotenství je prokoagulační stav minimalizující krevní ztráty matky při porodu a zabezpečující vratkou rovnováhu mezi prokoagulačními, inhibičními a fibrinolytickými mechanismy. Trombofilie je rizikovým faktorem nejen pro organismus těhotné ženy, ale v posledních letech je spojována i s nepříznivou reprodukční anamnézou. Za těhotenské ztráty jsou považovány spontánní aborty v 8.-12. týdnu gestace, intrauterinní růstová retardace plodu (IUGR) nebo intrauterinní odumření plodu (IUFD). K pozdním těhotenským komplikacím patří abrupce placenty nebo rozvoj preeklampsie.
Opakované těhotenské ztráty jsou medicínským problémem, který ve světě postihuje 1–5 % žen fertilního věku a mají významný emocionální, sociální i ekonomický vliv. Protože příčina zatím není zcela fyziologicky objasněna, neexistuje ani kauzální terapie. V závěrech 8. konference Amerického kolegia plicních lékařů (ACCP) o antitrombotické a trombolytické léčbě je doporučeno screeningově vyšetřovat na vrozenou trombofilní dispozici ženy s opakovanými poruchami reprodukce, ale zároveň tento dokument nepřináší přesvědčivá data o přínosu antitrombotické léčby u těchto žen [1-7, 9-11, 14-19].
Domníváme se, že ke zvýšené potrácivosti u některých žen vedou nejen dosud známé vrozené trombofilní dispozice, ale i jiné faktory, např. vrozená nebo získaná inkompetence hrdla děložního, chromozomální aberace plodu, antifosfolipidový syndrom apod. Vycházeli jsme z hypotézy, že podávání LMWH v této indikaci trombofilního genetického předpokladu může redukcí hyperkoagulačního potenciálu přispět ke zdárnému průběhu těhotenství.
CÍL PRÁCE
Sledovali jsme změny hematologických parametrů před těhotenstvím, v průběhu gravidity v 10týdenních intervalech až do porodu u žen, jejichž vrozené (např. FV Leiden) hyperkoagulační tendence zůstávají během těhotenství neměnné. Dále jsme sledovali, zda dlouhodobé podávání heparinu ovlivňuje vývoj sledovaných laboratorních faktorů u potrácivých pacientek a porovnali s kontrolním souborem žen, kterým LMWH podáván nebyl.
Zaměřili jsme se na sledování stěžejních koagulačních parametrů – funkční aktivity plazmatického koagulačního faktoru VIII (F VIII), jejíž vzestup je přípravou na minimalizaci krevních ztrát při porodu a na von Willebrandův faktor (vWF) jako marker aktivace endotelu.
Dále jsme sledovali parametry přirozených inhibitorů koagulace – funkční aktivitu antitrombinu (AT), jejíž deficit má za následek rezistenci na heparin. Dalším cílovým systémem byl systém aktivovaného proteinu C (APC) s jeho stěžejními složkami, trombomodulinem, proteinem C a proteinem S.
Přestože je z literatury známo, že některé, zejména fibrinolytické parametry se prudce mění až ke konci těhotenství, nebylo technicky možno zajistit odběr vzorků až těsně před porodem, kdy zejména ženy ze vzdálených lokalit odmítaly dojíždět na náběry krve těsně před předpokládaným termínem porodu.
SOUBOR A METODIKA
Pacientky a kontrolní skupina
Do studie jsme zařadili celkem 78 žen ve fertilním věku, z nichž 67 tvoří analyzovaný soubor žen, kterým byl podáván LMWH. Kontrolní soubor zahrnuje 11 žen.
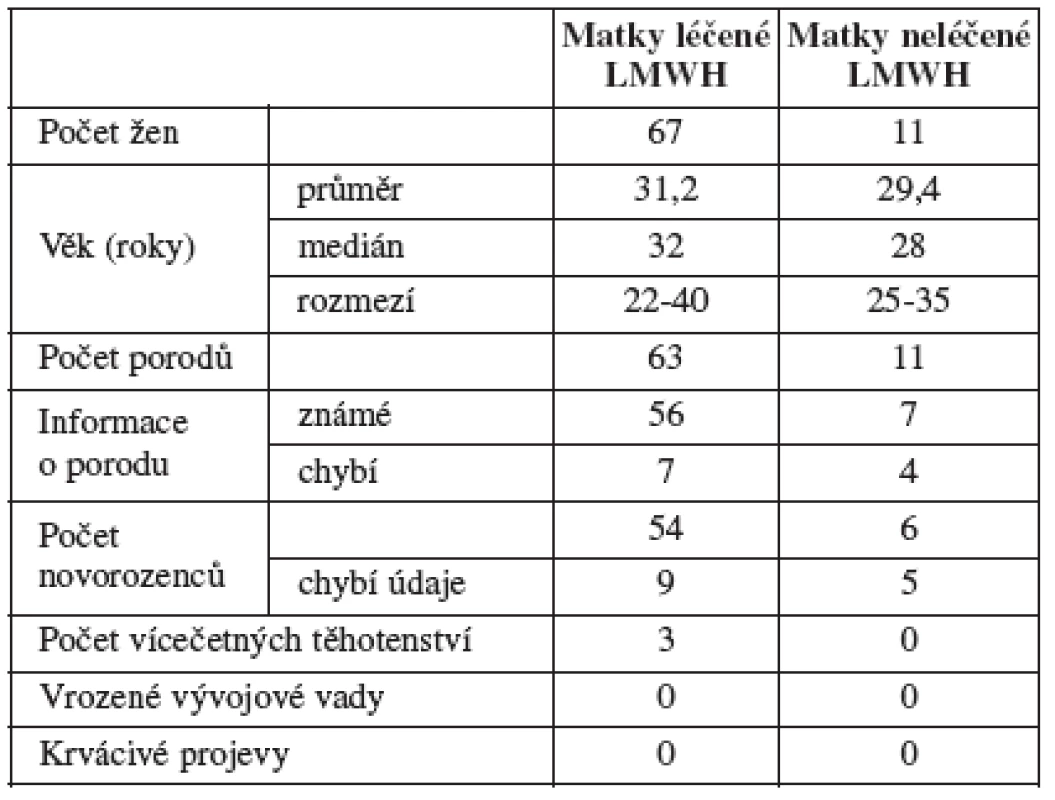
Soubor hodnocených žen tvoří pacientky, u nichž uplynulo 280 dnů od zjištění gravidity, a jejich novorozenci (tab. 1). Ženy ve studii měly v anamnéze opakované (dvě a více) neúspěšně probíhající gravidity a ve sledované graviditě jim byl podáván LMWH.
LMWH byl podáván:
- ženám s opakovanými ztrátami plodu (více než 2 aborty v osobní anamnéze),
- ženám s osobní anamnézou prodělané ataky tromboembolické nemoci (flebotrombózy nebo plicní embolizace), ať idiopatické, nebo v možné souvislosti s prokázanou vrozenou trombofilní dispozicí (FV Leiden, mutace v genu pro protrombin FIIG20210A atd.),
- ženám s primární nebo sekundární sterilitou, které otěhotněly metodou IVF.
Kontrolní soubor tvoří zdravé, fertilní, těhotné ženy, u nichž dlouhodobá prevence LMWH nebyla hematologem indikovaná.
Schéma podávání LMWH
Dávka LMWH byla vždy adjustována na hmotnost pacientky a účinnost preventivní dávky byla kontrolována laboratorně stanovením aktivity anti-Xa spektrofotometricky metodou chromogenního substrátu, která se pro preventivní dávku LMWH pohybuje v rozmezí 0,2-0,4 IU/ml.
Standardně byl pro prevenci TEN používán nadroparin (Fraxiparine), v případě intolerance např. pro kožní alergickou reakci byl volen enoxaparin (Clexane). Délka aplikace úzce souvisela s účelem prevence. Ženám, které otěhotněly asistovanou reprodukcí, byl LMWH podáván kontinuálně od okamžiku inseminace nebo embryotransferu až do 12. týdne z gynekologické indikace, dále do porodu a 10 dnů po porodu z hematologické indikace. Ženy opakovaně potrácející, ale bez anamnézy prodělané ataky TEN a bez prokázané závažné trombofilní tendence, dostávaly LMWH od okamžiku sonograficky prokázané gravidity a prevence byla ukončována 10. den po porodu. Pouze ženy s prodělanou atakou TEN a/nebo se závažnou vrozenou trombofilní dispozicídostávaly prevenci LMWH od okamžiku diagnostiky těhotenství až do konce šestinedělí.
Ženy s antifosfolipidovým syndromem byly léčeny navíc prednisonem v dávce 2,5 mg denně a kyselinou acetylosalicylovou v dávce 100 mg 2krát týdně.
Schéma náběrů
Vzorky žilní krve pro laboratorní testy jsme odebírali vždy nalačno za standardních podmínek na hematologické ambulanci Ústavu klinické biochemie a hematologie FN v Plzni do zkumavek Vacuette s citrátem sodným v poměru 1:9. Pro jednodušší interpretaci výsledků jsme zvolili následující schéma.
„Náběr 0“ je vstupní náběr krve u netěhotných žen v době, kdy plánovaly koncepci. Celkem 30 žen původně plánovaných do studie dosud neotěhotnělo a u tohoto náběru skončilo.
„Náběr 1“ byl proveden v období od zjištění gravidity do 10. gestačního týdne.
„Náběr 2“ byl proveden v období od 11. do 20. týdne gestace.
„Náběr 3“ byl proveden v období od 21. do 30. týdne.
„Náběr 4“ byl proveden v období od 31. týdne do porodu.
Sledované laboratorní parametry
Vzorky byly doručeny do laboratoře ve zvláštním režimu do 20 minut od náběru a po centrifugaci 2 × 10 minut při 2500 g (4000 ot/min) byly z plazmy ihned vyšetřeny tyto screeningové koagulační parametry: aktivovaný parciální tromboplastinový čas, protrombinový čas, trombinový čas, fibrinogen, antitrombin. Pro stanovení krevního obrazu na analyzátoru Coulter LH 750 (Beckman Coulter, USA) byly použity zkumavky s K3EDTA. Tyto základní testy sloužily k detekci a vyloučení případných poruch hemostázy (např. deficitu koagulačních faktorů nebo trombocytopenie) ještě před zařazením žen do studie. Další plazma byla šokově zamrazena v mikrozkumavkách a skladována v hlubokomrazícím boxu při teplotě -70 st.C maximálně 6 měsíců.
Kromě výše uvedených screeningových parametrů jsme sledovali plazmatické koncentrace D-dimerů (STA-Liatest D-Di Stago, Francie), koagulační aktivitu F VIII (F VIII Deficite Substrate Plasma Helena BioSciences, Velká Británie), funkční aktivitu proteinu C (Coamatic Protein C, Chromogenix IL, USA) a proteinu S (Staclot Protein S, Diagnostica Stago, Francie), antigen von Willebrandova faktoru (HemosIL von Willebrand Factor Antigen IL), funkční aktivitu plazminogenu (Coamatic Plasminogen Chromogenix IL), funkční aktivitu alfa2-antiplazminu (Coamatic Plasmin Inhibitor Chromogenix IL), funkční aktivitu a antigen PAI-1 (Stachrom PAI Diagnostica Stago, Francie resp. Elitest-PAI-1 Hyphen, Francie), antigen trombomodulinu (Imubind Thrombomodulin ELISA American Diagnostica, USA) a antigent-PA (Coaliza t-PA Chromogenix IL). Postupovali jsme podle standardních operačních postupů naší laboratoře.
K laboratornímu stanovení hemostázy jsme použili koagulometry Sysmex 1500 (výrobce TOA, Japonsko), ACL Advance (Instrumentation Laboratory, USA) a STA-R (Stago Francie). Testy ELISA byly stanoveny na přístroji Reader 530 (Organon Teknika – Anthos Labtec Instruments, Rakousko).
Statistické vyhodnocení
Pro hodnocení všech parametrů byly použity základní statistické metody (průměr, medián, směrodatná odchylka), Wilcoxonův test párový a nepárový, Kruskalův-Wallisův test (analýza rozptylu). Jako statisticky významné byly hodnoceny rozdíly na 5% hladině a menší.
Statistické zpracování provedl RNDr. Ing. František Šefrna, FN Plzeň.
VÝSLEDKY
Výsledky studie jsme zpracovali do tabulek 2, 3, 4.
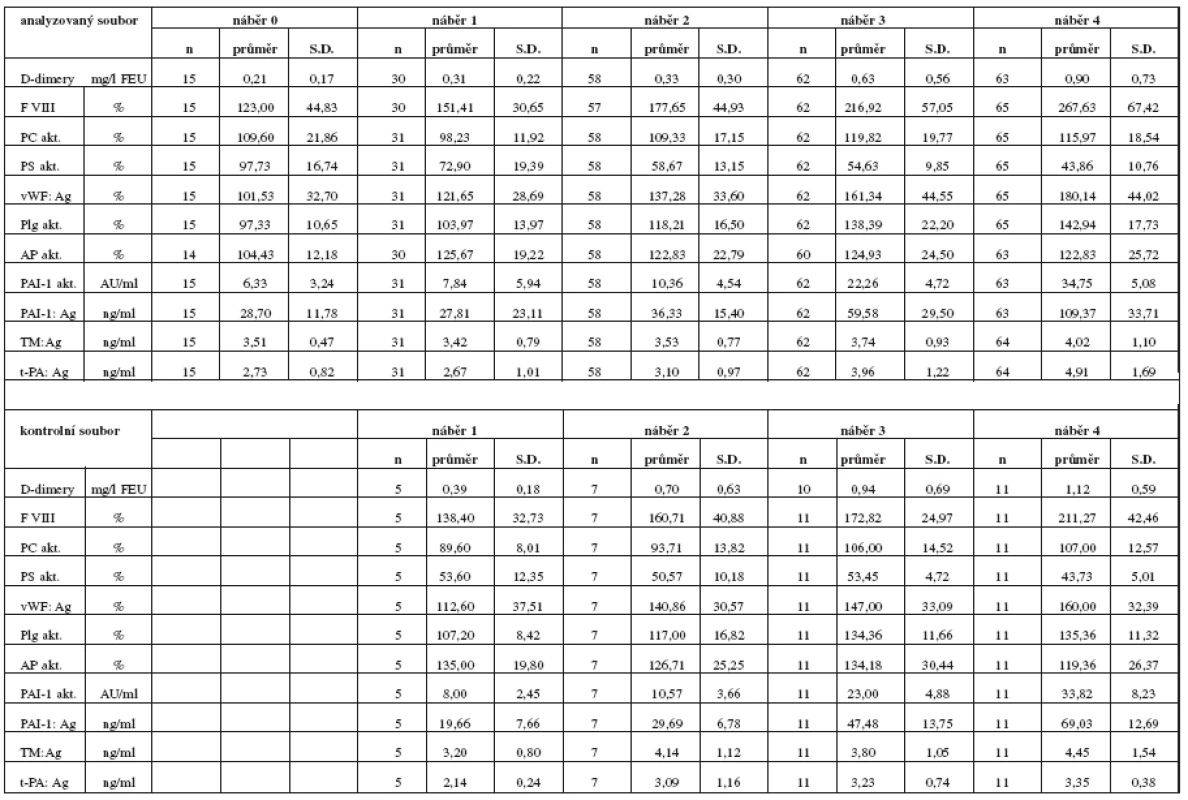
Tabulka 2 obsahuje statisticky zpracovaný přehled výsledků analyzovaných koagulačních parametrů vyšetřovaného a kontrolního souboru. V první části jsou laboratorní parametry naměřené u analyzovaného souboru žen léčených v graviditě LMWH (n = 67), sloupce ukazují posun v jednotlivých časových obdobích (náběr 0, 1, 2, 3, 4). V druhé části tabulky jsou laboratorní parametry kontrolního souboru zdravých gravidních žen (n = 11). Zdravé ženy jsme zařadili do kontrolního souboru již jako těhotné, proto chybí náběr 0.
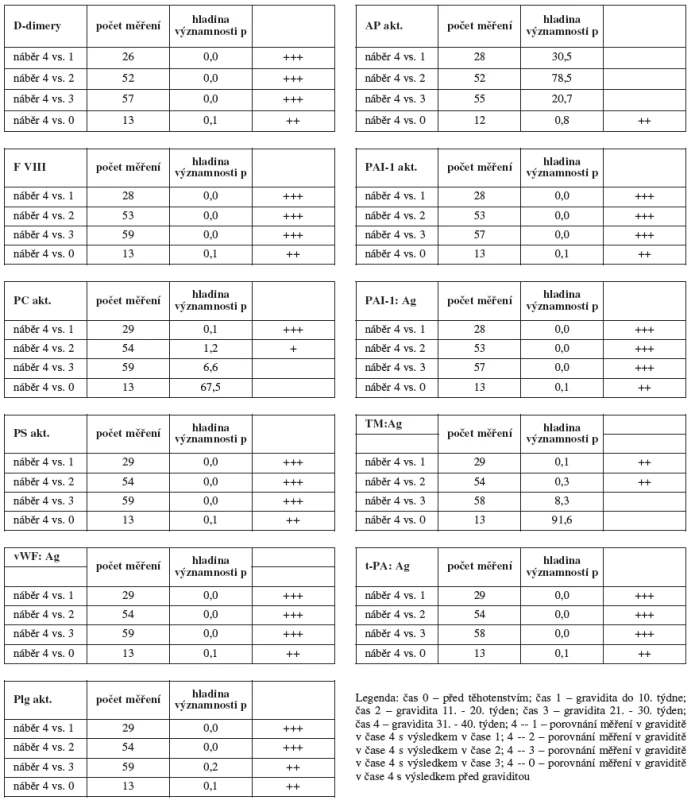
Tabulka 3 statisticky porovnává vývoj laboratorních parametrů v průběhu gravidity analyzovaného souboru. Jako výchozí jsme stanovili náběr 4, protože se v celém souboru vyskytoval nejčetněji a vůči němu jsme porovnávali náběry u netěhotných žen (náběr 0) a dále u gravidních žen v jednotlivých 10týdenních intervalech (náběr 1, 2, 3).
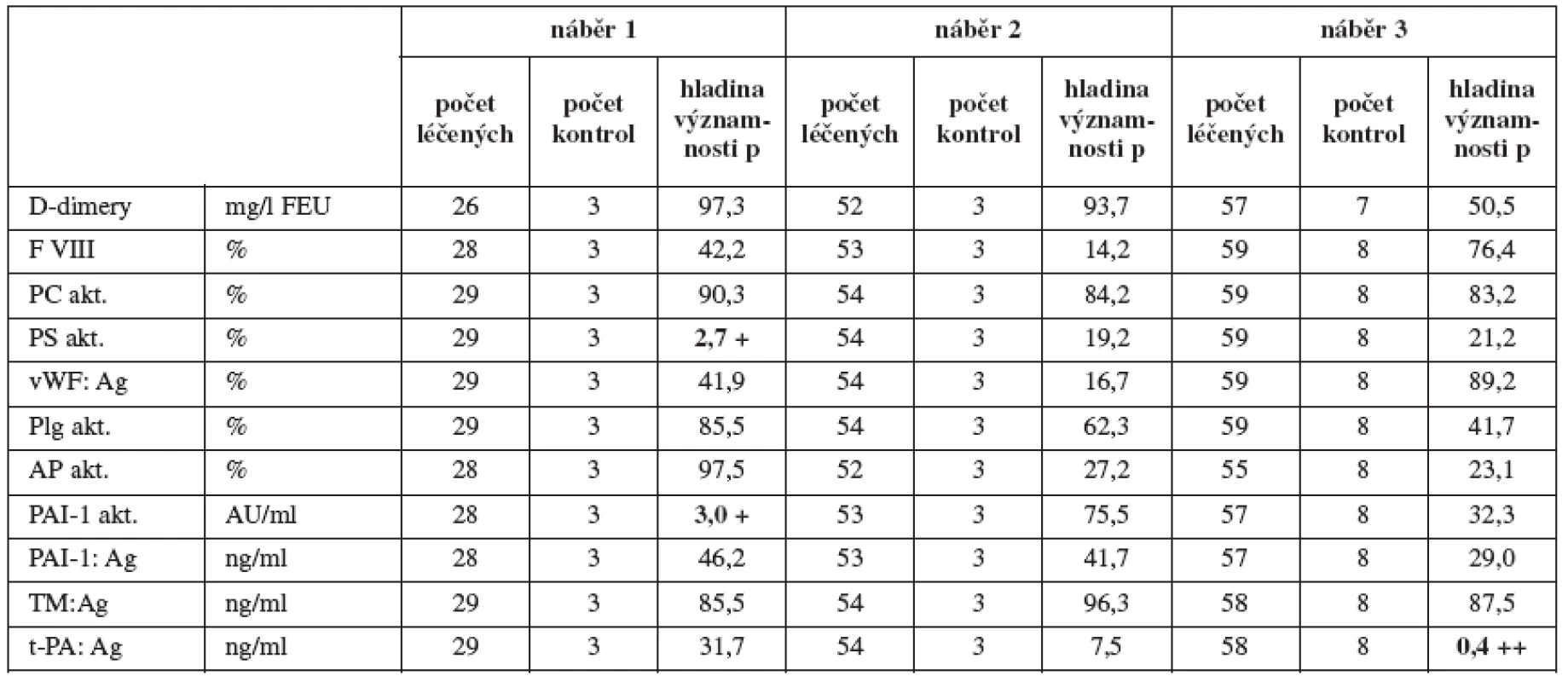
V tabulce 4 je statisticky porovnán rozdíl koagulačních parametrů v souboru léčených vs. kontroly v 10týdenních intervalech gravidity, kde jsme prokázali statistický rozdíl pouze ve třech parametrech: funkční aktivita proteinu S, funkční aktivita PAI-1 a antigenu t PA.
DISKUSE
Hladina a koagulační aktivita F VIII a koncentrace vWF, který slouží jako nosič F VIII a hraje roli v adhezi destiček, progresivně v průběhu těhotenství stoupají, a to až na 200–300 % [8, 20].
Bez ohledu na podávání heparinu došlo v obou našich souborech k vzestupu funkční aktivity F VIII na dvojnásobek původní hodnoty netěhotných žen, přičemž tato progrese je během těhotenství pozvolná. vWF jako marker aktivace endotelu velmi mírně v našich měřeních stoupá, a to jak ve sledovaném, tak v kontrolním souboru.
Protein C, S a trombomodulin jsou komponenty přirozeného inhibičního systému proteinu C. Aktivace systému nastává v okamžiku vazby trombinu na trombomodulin a rapidně snižuje vazbu faktoru VIIIa a Va na fosfolipidové povrchy. Tato degradace se 10–20krát zvyšuje při současném působení proteinu C a jeho kofaktoru proteinu S. Koncentrace trombomodulinu v průběhu těhotenství stoupají a koncentrace proteinu S postupně klesá až na 30–50 % jeho výchozí aktivity. Koncentrace proteinu C zůstává konstatní, nicméně získaná APC rezistence se v graviditě projevuje díky vzestupu F VIII a poklesu proteinu S. Všeobecně je těhotenství spojeno s poklesem inhibitorů koagulace, ačkoliv jsou také prokázány obousměrné změny v koncentraci i aktivitě inhibitorů koagulace a je zřejmé, že tyto změny se významnou měrou podílejí na křehké rovnováze koagulace a fibrinolýzy v graviditě [8, 20]. Aktivita proteinu C se v obou našich souborech v průběhu těhotenství nemění. Aktivita proteinu S u léčených žen na začátku těhotenství oproti netěhotným ženám poklesla o 20 %, zatímco u žen bez LMWH poklesla o 43 %. Od 11. týdne se v obou souborech funkční aktivita proteinu S vyrovnává bez ohledu na podávání LMWH a na konci těhotenství zůstávají její hodnoty v obou souborech shodné.
Na rozdíl od literatury [20] prokazujeme pouze mírný vzestup hodnoty trombomodulinu, a to jak longitudinálně s vývojem těhotenství, tak při srovnání obou souborů.
Fibrinolýza je složitý regulační systém, který zabezpečuje rozklad fibrinové sítě, tkáňový aktivátor plazminogenu (t-PA) mění plazminogen na plazmin, který štěpí fibrin a fibrinogen. Alfa 2-antiplazmin, inhibitor plazminu a inhibitor aktivátoru plazminogenu typ 1 a nově i 2 (PAI-1, PAI-2) kontrolují degradaci fibrinu plazminem. Zatímco v literatuře [20] je popisován vzestup PAI-1 produkovaný endotelem až v třetím trimestru, a zejména až těsně před porodem, prokázali jsme v naší práci jak ve sledovaném, tak i v kontrolním souboru kontinuální vzestup aktivity i antigenu PAI-1.
Ve shodě s literaturou [8, 13, 20] jsme též dokázali, že v počátku těhotenství je hodnota antigenu t-PA prakticky shodná s hodnotami před graviditou a poté plynule stoupá. Tyto změny korelují se vzestupemD-dimerů. V kontrolním souboru prokazujeme ve všech měřeních hodnoty D-dimerů vyšší než u souboru léčených žen, což lze vysvětlit možným vlivem trombinem aktivovaného inhibitoru fibrinolýzy (TAFI) na fibrinolýzu při snížené genezi trombinu účinkem LMWH.
Plazminogen jako základní substrát fibrinolýzy v průběhu těhotenství mírně stoupá oproti výchozí hodnotě před těhotenstvím, a to v souboru sledovaném i kontrolním.
Alfa 2-antiplazmin se v průběhu těhotenství ani v kontrolním, ani ve sledovaném souboru zásadněji nemění.
ZÁVĚR
Klinickou částí studie se zabývala i jiná naše práce [12], při které jsme se zaměřili na pacientky s opakovanými těhotenskými ztrátami, kterým se podařilo ve sledované graviditě při podávání LMWH donosit a porodit zdravé dítě. 94% úspěšnost dlouhodobého podávání LMWH znamená ve skutečnosti 60 porodů a 63 živě narozených novorozenců, kteří se narodili bez závažných komplikací. Koagulační parametry těhotných žen dlouhodobě léčených LMWH nebyly statisticky významně odlišné od souboru kontrolních žen. Z toho vyplývá, že na úspěšném zakončení těhotenství u žen s předchozími opakovanými potraty či patologickým vývojem plodu se podávání heparinu pravděpodobně uplatňuje i jinými mechanismy než koagulačními (např. přes komplementový systém nebo přes sekreci prostaglandinů).
Tato i naše dříve publikovaná studie [12] jasně ukazují, že včasně indikovaná léčba u prokázané hemato-imunologické příčiny potrácivosti nebo doposud neúspěšných opakovaných in vitro fertilizačních pokusů je v řadě případů úspěšná, i když t.č. nejsme schopni zmapovat jemné hemokoagulační změny odehrávající se zřejmě na celulární či subcelulární úrovni.
Práce byla podpořena grantem IGA MZ, NR 8917-3.
Seznam zkratek
ACCP American College of Chest Physicians
AP alfa 2- antiplazmin
APC aktivovaný protein C
AT antitrombin
F VIII koagulační aktivita faktoru VIII
F VIIIa aktivovaný faktor VIII
IUFD intrauterinní odúmrtí plodu
IUGR intrauterinní růstová retardace
IVF in vitro fertilizace
LMWH nízkomolekulární heparin
PAI-1, 2 inhibitor aktivátoru plazminogenu 1, 2
PC protein C
Plg plazminogen
PS protein S
TEN tromboembolická nemoc
TM trombomodulin
t-PA tkáňový aktivátor plazminogenu
vWF von Willebrandův faktor
MUDr. Pavla Šigutová
Hematologický úsek
ÚKBH LF UK a FN Plzeň
Alej svobody 80
304 60 Plzeň
e-mail: sigutova@fnplzen.cz
Sources
1. Bates, SM., Greer, IA., Hirsch, J., et al. Use of antithrombotic agents during pregnancy. ACCP guidelines, 7th Ed., Chest, 2004, 126, p. 627S-644S.
2. Bates, SM., Greer, IA., Pabinger, I., et al. Venous thromboembolism, thrombophilia, antithrombotic therapy, and pregnancy. ACCP evidence-based clinical practice guidelines. 8th Ed., Chest, 2008, 133, p. 844S-884S.
3. Bick, RL. Recurrent miscarriage syndrome and infertility caused by blood coagulation protein/platelet defects. In: Hematological complications in obstetrics, pregnancy, and gynecology. Ed. Blick, RL., Cambridge University Press, 2006, p. 55-74.
4. Brenner, B. Thrombophilia and pregnancy loss in first intended pregnancy. J Thromb Haemost, 2005, 3, p. 2176–2177.
5. Brenner, B. Antithrombotic prophylaxis for women with thrombophilia and pregnancy complications –Yes. J Thromb Haemost, 2003, 1, p. 2070-2072.
6. Brenner, B. Maternal anticoagulant prophylaxis for prevention of pregnancy loss in women with trombophilia. J Thromb Haemost, 2003, 1, p. 416-417.
7. Brenner, B., Hoffman R., Carp H., et al. for the LIVE- ENOX investigators. J Thromb Haemost, 2005, 3, p. 227- 229.
8. Brenner, B. Hemostatic changes in pregnancy. Thrombosis Res, 2004, 114, p. 409-412.
9. De Groot, PD., Derksent RHWM. Pathophysiology of the antiphospholipid syndrome. J Thromb Haemost, 2005, 3, p. 1854–1860.
10. Gris, JC., Mares, P. The long and winding road towards LMWH for pregnancy loss. Thromb Haemost, 2005, 3, p. 224-226.
11. Gris, JC., et al. Low- molecular- weight heparin versus low dose aspirin in women with one fetal loss and a constitutional thrombophilic disorder. Blood, 2004, 103, 10, p. 3695-3699.
12. Hajšmanová, Z., Šlechtová, J., Šigutová, P., et al. Průběh těhotenství při dlouhodobém podávání nízkomolekulárního heparinu pro opakované těhotenské ztráty. Čes Gynek, 2008, 73, 5, s. 278-283.
13. Kvasnička, J., Srp, B., Bendl, J., et al. Hemostáza v těhotenství, Čes Gynek, 1994, 59, 1, s. 21-28.
14. Levi, M. All heparins are equal, but some are more equal than others. J Thromb Haemos, 2003, 1, p. 884–885.
15. Lindquist, PG. Low molecular weight heparin for repeated pregnancy loss: is it based on solid evidence? J Thromb Haemost, 2003, 3, p. 221-223.
16. Redline, RW. Hemorrhagic and thrombotic lesions of the placenta, In: Hematological complications in obstetrics, pregnancy, and gynecology. Ed. Blick, RL., Cambridge University Press, 2006, p. 251-268.
17. Rey, E., David, M. Fetal loss, thrombophilia and heparin: the clinician’s dilemma. J Thromb Haemost, 2005, 3, p. 782-783.
18. Walker, D. The use of LMWH in pregnancies at risk: new evidence or perception? J Thromb Haemost, 2005, 3, p. 778-793.
19. Salmon, JE. Are heparins effective in some patiens with recurrent pregnancy loss because they inhibit complement activation? J Thromb Haemost, 2005, 3, p. 783-784.
20. Sudrová, M., Kvasnička, J., Linhartová, P., et al. Trombofilie v těhotenství – fyziologie a patofyziologie hemokoagulačních změn v normální graviditě a při některých patologických těhotenských stavech. Čas Lék čes, 2007, 146, 11, s. 853-857.
21. Ulcova-Gallova, Z., Krauz, V., Novakova, P., et al. Anti- phospholipid antibodies against phosphatidylinositol, and phosphatidylserine are more significant in reproductive failure than antibodies against cardiolipin only. Amer J Reprod Immunol, 54, 2005, p. 112-117.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2009 Issue 5
Most read in this issue
- Současný pohled na duktální karcinom in situ
- Akutní hysterektomie pro prolaps velkého submukózního myomu do pochvy
- Karcinom děložního těla - raritní varianta vzdálené metastázy
- Časné těhotenské ztráty a vrozené trombofilní stavy
