Nekultivační stanovení mikroorganismů v plodové vodě u pacientek s předčasným odtokem plodové vody
Nonculture techniques of microorganisms determination in amniotic fluid in patients with preterm prelabor rupture of membranes
Objective:
The preterm prelabor rupture of membranes is a serious obstetric complication that is frequently complicated by the presence of microorganisms in amniotic fluid. The aim of our work is to characterize current status of nonculture detection of microbial invasion into the amniotic cavity and the experience with the technique performed in University Hospital in Hradec Kralove.
Design:
Original survey article.
Setting:
Institute of Clinical Biochemistry and Diagnostics – molecular biology department, University Hospital Hradec Kralove.
Conclusion:
Application of nonculture techniques of microorganisms determination in amniotic fluid in patients with preterm prelabor rupture of membranes is currently available. According to the detection of genital mycoplasmas as the dominant pathogens in the amniotic fluid this technique should be regarded as the standard examination method in these patients.
Keywords:
preterm labor, genital mycoplasmas, polymerase chain reaction, bacterial DNA
Authors:
R. Kutová 1; L. Plíšková 1; M. Kacerovský 2
Authors‘ workplace:
Ústav klinické biochemie a diagnostiky FN, Hradec Králové, přednostka MUDr. L. Pavlíková
1; Porodnická a gynekologická klinika FN, Hradec Králové, přednosta doc. MUDr. J. Špaček, Ph. D., IFEPAG
2
Published in:
Ceska Gynekol 2016; 81(5): 384-388
Overview
Cíl studie:
Předčasný odtok plodové vody (preterm prelabor rupture of membranes) je závažná porodnická komplikace, která je často doprovázena přítomností mikroorganismů v plodové vodě. Cílem práce je charakterizovat současné možnosti nekultivačního stanovení mikrobiální invaze do amniální dutiny a zkušenosti s tímto přístupem ve Fakultní nemocnici Hradec Králové.
Typ práce:
Přehledová práce.
Název a sídlo pracoviště:
Ústav klinické biochemie a diagnostiky – úsek molekulární biologie, Fakultní nemocnice Hradec Králové.
Závěr:
Využití nekultivačních technik při stanovení mikroorganismů v plodové vodě u pacientek s předčasným odtokem plodové vody je v současné době dostupná metoda. Vzhledem k nálezu genitálních mykoplazmat jako dominantních patogenů v plodové vodě by tato technika měla být považována za standardní vyšetření.
Klíčová slova:
předčasný porod, genitální mykoplazmata, polymerázová řetězová reakce, bakteriální DNA
ÚVOD
Předčasný odtok plodové vody (PPROM – preterm prelabor rupture of membranes), definovaný jako porušení plodových obalů s odtokem plodové vody nejméně dvě hodiny před nástupem děložní aktivity před dokončeným 37. týdnem těhotenství, je závažnou porodnickou patologií komplikující přibližně 3 % všech těhotenství [1, 18, 19, 26, 27]. PPROM je příčinou jedné třetiny všech předčasných porodů [3, 6].
Příčina PPROM je podle posledních poznatků zejména neinfekční [2, 3, 4, 6, 12–16, 23]. Rozmanité rizikové faktory spojené s oxidativním stresem a zánětem vedou k aktivaci senescence, apoptózy a proteolýzy rezultující ve snížení pevnosti plodových obalů a jejich následné ruptuře [3, 4, 6,] Navzdory neinfekční etiologii PPROM je 15–32 % případů komplikováno přítomností mikroby indukovaného intraamniálního zánětu (průkaz mikroorganismů v plodové vodě a elevace zánětlivých mediátorů v plodové vodě), 4–6 % případů PPROM je komplikováno sterilním intraamniálním zánětem (elevace zánětlivých mediátorů v plodové vodě bez průkazu mikroorganismů v plodové vodě) a 13–15 % případů PPROM je komplikováno tzv. kolonizací (přítomnost mikroorganismů v plodové vodě bez elevace zánětlivých mediátorů v plodové vodě) [2, 3, 4, 6, 12–16, 23].
K diagnostice těchto komplikací je nutno použít dva přístupy: a) prokázat, či vyloučit přítomnost mikroorganismů v plodové vodě, b) potvrdit, či vyloučit elevaci zánětlivých mediátorů v plodové vodě. Druhý přístup je snazší, jednodušší, rychlejší a levnější, neboť k němu lze využít stanovení interleukinu-6 v plodové vodě pomocí tzv. bedside testu – vyšetření trvá asi 20 minut [9–11, 24, 25, 28].
K průkazu přítomnosti mikroorganismů v plodové vodě je možno použít kultivačních či molekulárně biologických technik. Vzhledem k náročnosti kultivace genitálních mykoplazmat a rychlosti dostupnosti výsledků není klasická mikrobiologická diagnostika v této oblasti tolik využívaná [4, 17].
Vzhledem k tomu, že nejčastějším původcem mikroby indukovaného intraamniálního zánětu jsou tzv. genitální mykoplazmata (Ureaplasma parvum, Ureaplasma urealyticum a Mycoplasma hominis), která jsou zodpovědná asi za 80–85 % všech mikrobiálních nálezů v plodové vodě u pacientek s PPROM, je nutno nejprve pátrat po těchto mikroorganismech pomocí real-time PCR (Polymerase Chain Reaction) [3, 6, 7, 12, 15, 20, 29]. Při negativitě DNA (deoxyribonukleová kyselina) mykoplazmat se pokračuje v diagnostice jiných původců bakteriální infekce pomocí širokospektré (broad-range) PCR s následnou sekvenací podle Sangera. Tímto způsobem je možné identifikovat DNA jakékoli bakterie přítomné ve vyšetřovaném biologickém materiálu [7, 20, 29].
SEZNÁMENÍ S TERMINOLOGIÍ
Nejprve si objasníme terminologii molekulárně biologických metod, které se k diagnostice genitálních mykoplazmat a jiných původců bakteriální infekce využívají.
PCR je metoda, umožňující zmnožení (amplifikaci) vybraného úseku DNA. Lze provést analýzu i ze vzorku s velmi nízkou koncentrací mikroba. Konkrétní amplifikovaný úsek DNA je ohraničen dvěma primery (krátká sekvence oligonukleotidů). Po vlastní PCR se amplifikovaný produkt značený ethidium bromidem vizualizuje pomocí gelové elektroforetické detekce.
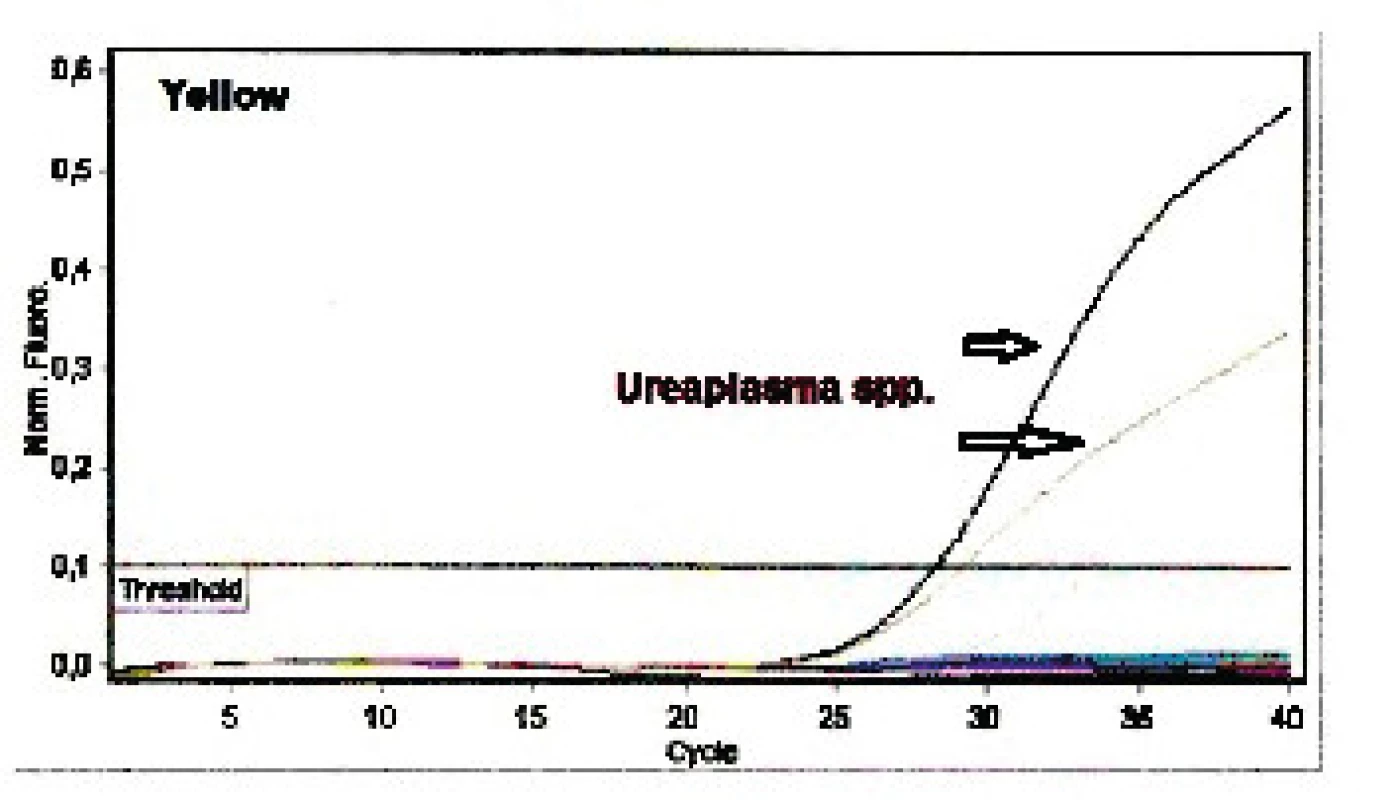
PCR má mnoho modifikací. V současné době se nejvíce využívá PCR v reálném čase real-time (rt) PCR. Amplifikace produktu je s narůstající fluorescencí snímána laserem v reálném čase, což umožňuje okamžitý odečet výsledku. Od standardní PCR se liší tím, že odpadá závěrečný krok elektroforetické detekce produktu (rychlejší odečet výsledku) a že je k amplifikaci nutno použít nejen primery, ale i sondu (krátká sekvence oligonukleotidů značených příslušnou fluorescenční značkou, která nasedá mezi dva primery ohraničující amplifikovaný úsek DNA a svým zářením umožňuje měřit amplifikaci produktu). V případě modifikace PCR multiplex rt-PCR je více sond značeno rozdílnou fluorescenční značkou, což zajišťuje současnou diagnostiku například čtyř patogenů v jedné zkumavce – urychlení času a dřívější vydání výsledku. Pozitivní výsledek (esovitě prohnutá amplifikační křivka) (viz obr. 1) se prokládá „přímkou“ (příslušným thresholdem – práh detekce), která protíná amplifikační křivku, a tím určuje hodnotu CT (cycle threshold). CT vypovídá o intenzitě pozitivity. Čím je nižší hodnota CT (amplifikační křivka se dříve zvedá), tím je větší nálož mikroba ve vzorku. Pokud je mikrob ve vzorku jen v nízké koncentraci, amplifikační křivka se zvedne až později a CT hodnota je vyšší. CT lze využít i k tzv. semikvantitě – orientační kvantifikaci.
MOLEKULÁRNĚ BIOLOGICKÁ DIAGNOSTIKA PŮVODCŮ MYKOPLAZMATICKÝCH INFEKCÍ
K diagnostice původců mykoplazmatických infekcí se využívá multiplex rt-PCR, detekující přítomnost DNA Ureaplasma species, Mycoplasma hominis, Mycoplasma genitalium, Chlamydia trachomatis v reálném čase a současně zajišťující koamplifikaci vnitřní inhibiční kontroly vzorku (vyloučení falešně negativního výsledku). Vlastní multiplex rt-PCR předchází izolace DNA – nejčastěji se jedná o kolonkovou izolaci, ale lze využívat i jiné technologie (magnetické partikule, manuální či automatické izolátory). Následná amplifikace každého patogena je zajištěna specifickými primery a sondou z příslušného konkrétního úseku genu jednotlivého mikroba (obr. 1). Analýzou výsledků se získá CT hodnota, která vypovídá o intenzitě amplifikace pozitivního nálezu (slabě, silně pozitivní). CT hodnotu je možné využívat jako náhradu relativní kvantifikace a pro kliniky je cennou informací. Lékař tak získá představu o náloži DNA patogena způsobujícího intraamniální zánět. Citlivost multiplex real-time PCR je 50–100 kopií/mL a umožňuje rychlou diagnostiku nejčastěji přítomných patogenů v plodové vodě u PPROM [22].
MOLEKULÁRNĚ BIOLOGICKÁ DIAGNOSTIKA JINÝCH PŮVODCŮ BAKTERIÁLNÍCH INFEKCÍ S NÁSLEDNOU SEKVENACÍ PODLE SANGERA
Při negativitě DNA mykoplazmat se pokračuje v diagnostice pomocí širokospektré (broad-range) PCR s primery cílenými do oblasti 16S rRNA (ribozomální ribonukleová kyselina) s následnou sekvenací podle Sangera. Gen pro 16S rRNA je přítomen ve všech bakteriích, a proto je vhodný pro identifikaci druhu bakterie. Tvoří ribozomální malou podjednotku, je 1542 nukleotidů dlouhý a skládá se z devíti hypervariabilních regionů V1 až V9, ve kterých je značná sekvenční diverzita mezi různými bakteriemi (viz obr. 2). Oblasti konzervovaných sekvencí C1–C9 se využívají pro design univerzálních primerů [5, 8, 21].
![Konzervované (C1–C9) a hypervariabilní (V1–V9) regiony v genu pro 16S rRNA [21, 30, upraveno]](https://www.cs-gynekologie.cz/media/cache/resolve/media_object_image_small/media/image/916b92add52641491ade2dc537143669.jpg)
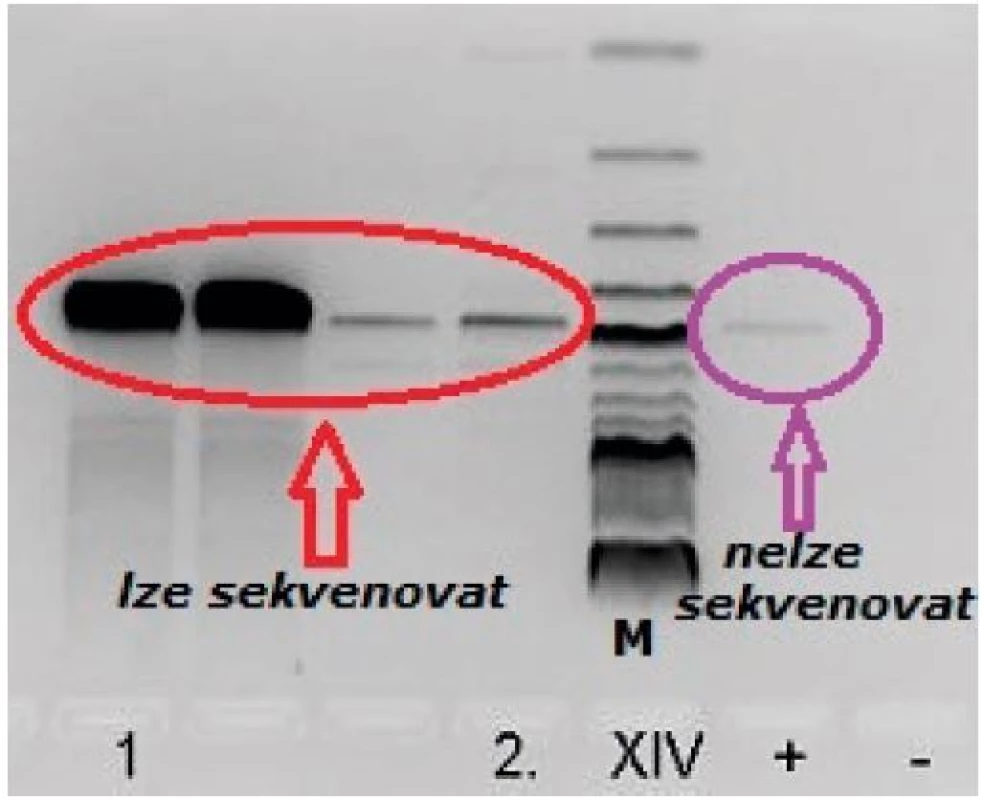
K průkazu bakteriální DNA se využívá standardní PCR, zajišťující amplifikaci konkrétního úseku 16S rRNA ohraničeného primery. Po amplifikaci následuje elektroforetická detekce vzniklého produktu na 2% agarózovém gelu. Při pozitivním nálezu bakteriální DNA následuje sekvenační analýza na sekvenátoru ABI 3130. Intenzita bandu pozitivní kontroly je kritériem, zda je možné bakteriální DNA sekvenovat, a je zjištěna experimentálně. Vzorky o stejné či slabší intenzitě identifikovat sekvenační analýzou nelze (obr. 3). Citlivost metody průkazu bakteriální DNA je 1–5 kopií/μL; 10–15 kopií/μL již lze sekvenovat (zjištěno experimentálně).
Konečným výsledkem je získaná sekvence bakteriální DNA ve FASTA formátu (obr. 4). Ta se vyhodnocuje pomocí identifikačních programů, volně dostupných na internetu (BLAST, SepsiTestTM BLAST). Pomocí těchto programů je získaná sekvence porovnávána s referenčními a za výsledek je považována bakterie s nejvyšším procentem identifikace (98–100 %).
PRAKTICKÉ INFORMACE
Odebranou plodovou vodu (přibližně 1,5 ml) ve sterilní odběrové zkumavce bez aditiv je důležité do laboratoře dopravit co nejrychleji. Čím dříve je biologický materiál laboratoři dodán, tím dříve může laboratoř poskytnout výsledek lékaři. V případě urgentního vyšetření je vhodné před odesláním telefonicky informovat laboratoř, která se vzorkem pak pracuje ve statimovém režimu. Pokud odebranou plodovou vodu nelze transportovat do laboratoře hned po odběru, uchovává se v lednici při 4 °C. Při této teplotě je DNA stabilní po dobu asi pěti až sedmi dnů od odběru. V případě delšího transportu je nutné zajistit, aby vzorek byl transportován v chladu. Pokud je vzorek plodové vody dodán do laboratoře v dopoledních hodinách, výsledek real-time PCR mykoplazmat a průkazu bakteriální DNA je k dispozici tentýž den. V případě pozitivity bakteriální DNA je výsledek sekvenační analýzy podle Sangera vydán následující den.
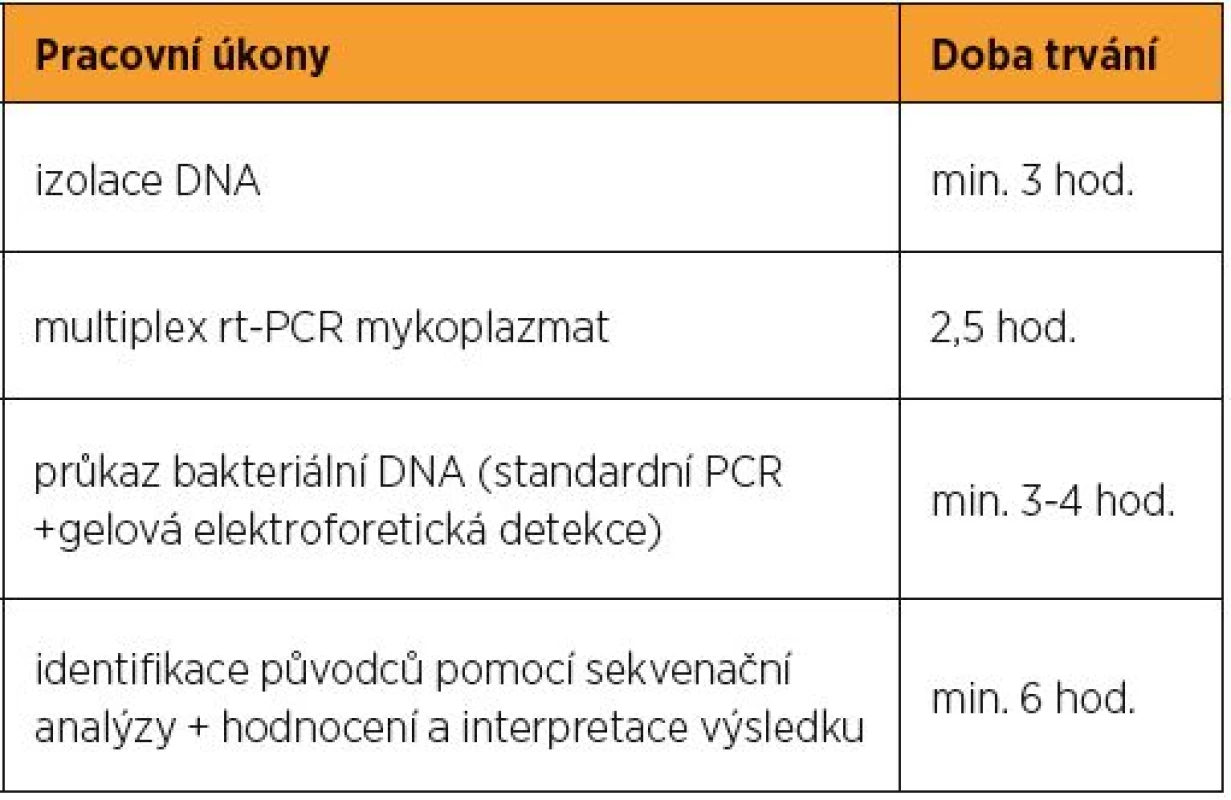
Doba odezvy jednotlivých kroků vyšetření je uvedena v tabulce 1.
ZÁVĚR
Znalost informace o přítomnosti či absenci mikrobiální invaze do amniální dutiny je u pacientek s PPROM důležitá. Umožňuje totiž individualizovat léčbu a management této porodnické komplikace. Vyžaduje to však odběr vzorku plodové vody, přítomnost laboratoře, která je schopna provést výše popsaná vyšetření, a těsnou spolupráci klinika s personálem laboratoře.
Mgr. Radka Kutová
Ústav klinické biochemie a diagnostiky
Fakultní nemocnice
Sokolská 581
500 05 Hradec Králové – Nový Hradec Králové
e-mail: radka.kutova@centrum.cz
Sources
1. Bredeson, S., Papaconstantinou, J., Difford, JH., et al. HMGB1 promotes a p38MAPK associated non-infectious inflammatory response pathway in human fetal membranes. PLoS One, 2014, 9, e113799. http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0113799
2. Combs, CA., Gravett, M., Garite, TJ., et al. Amniotic fluid infection, inflammation, and colonization in preterm labor with intact membranes. Am J Obstet Gynecol, 2014, 210, p. 121–125. http://www.ncbi.nlm.nih.gov/pubmed/24274987
3. DiGiulio, DB., Romero, R., Amogan, HP., et al. Microbial prevalence, diversity and abundance in amniotic fluid during preterm labor: a molecular and culture-based investigation. PLoS ONE, 2008, 3(8): e3056. http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0003056
4. DiGiulio, DB., Romero, R., Kusanovic, JP., et al. Prevalence and diversity of microbes in the amniotic fluid, the fetal inflammatory response, and pregnancy outcome in women with preterm pre-labor rupture of membranes. Am J Reprod Immunol, 2010, 64, p. 38–57. http://www.ncbi.nlm.nih.gov/pubmed/20331587
5. Fouhy, F., Deane, J., Rea, MC., et al. The effects of freezing on faecal microbiota as determined using MiSeq sequencing and culture-based investigations. PLoS ONE, 2015, 10(3), e0119355. http://www.ncbi.nlm.nih.gov/pubmed/25748176
6. Goldenberg, RL., Culhane, JF., Iams, JD., Romero, R. Epidemiology and causes of preterm birth. Lancet, 2008, 371, p.75–84. http://www.ncbi.nlm.nih.gov/pubmed/18177778
7. Gregory, KE. Microbiome aspects of perinatal and neonatal health. J. Perinat. Neonatal Nurs, 2011, 25, p. 158–164. http://www.ncbi.nlm.nih.gov/pubmed/21540692
8. Chakravorty, S., Helb, D., Burday, M., et al. A detailed analysis of 16S ribosomal RNA gene segments for the diagnosis of pathogenic bacteria. J Microbiol Methods, 2007, 69, p. 330–339. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2562909/
9. Chaemsaithong, P., Romero, R., Korzeniewski, SJ., et al. A point of care test for the determination of amniotic fluid interleukin-6 and the chemokine CXCL-10/IP-10. J Matern Fetal Neonatal Med, 2015, 28(13), p. 1510–1519. http://www.ncbi.nlm.nih.gov/pubmed/25182862
10. Chaemsaithong, P., Romero, R., Korzeniewski, SJ., et al. A point of care test for interleukin-6 in amniotic fluid in preterm prelabor rupture of membranes: a step toward the early treatment of acute intra-amniotic inflammation/infection. J Matern Fetal Neonatal Med, 2016, 29(3), p. 360–367. http://www.ncbi.nlm.nih.gov/pubmed/25758620
11. Chaemsaithong, P., Romero, R., Korzeniewski, SJ., et al. A rapid interleukin-6 bedside test for the identification of intra-amniotic inflammation in preterm labor with intact membranes. J Matern Fetal Neonatal Med, 2016, 29(3), p. 349–359. http://www.ncbi.nlm.nih.gov/pubmed/25758618
12. Jacobsson, B., Mattsby-Baltzer, I., Andersch, B., et al. Microbial invasion and cytokine response in amniotic fluid in a Swedish population of women with preterm prelabor rupture of membranes. Acta Obstet Gynecol Scand, 2003, 82, p. 423–431. http://www.ncbi.nlm.nih.gov/pubmed/12752072
13. Jacobsson, B., Aaltonen, R., Rantakokko-Jalava, K., et al. Quantification of Ureaplasma urealyticum DNA in the amniotic fluid from patients in PTL and pPROM and its relation to inflammatory cytokine levels. Acta Obstet Gynecol Scand, 2009, 88, p. 63–70. http://www.ncbi.nlm.nih.gov/pubmed/19031281
14. Kacerovsky, M., Pliskova, L., Bolehovska, R., et al. The microbial load with genital mycoplasmas correlates with the degree of histologic chorioamnionitis in preterm PROM. Am J Obstet Gynecol, 2011, 205, p. 213 e211–217. http://www.ncbi.nlm.nih.gov/pubmed/21663889
15. Kacerovsky, M., Musilova, I., Khatibi, A., et al. Intraamniotic inflammatory response to bacteria: analysis of multiple amniotic fluid proteins in women with preterm prelabor rupture of membranes. J Matern Fetal Neonatal Med, 2012, 25, p. 2014–2019. http://www.tandfonline.com/doi/abs/10.3109/14767058.2012.671873?journalCode=ijmf20#.V1KjQOTKDIU
16. Kacerovsky, M., Pliskova, L., Bolehovska, R., et al. The impact of the microbial load of genital mycoplasmas and gestational age on the intensity of intraamniotic inflammation. Am J Obstet Gynecol, 2012, 206, p. 342 e341–348. http://www.ncbi.nlm.nih.gov/pubmed/22340945
17. Kacerovsky, M., Celec, P., Vlkova, B., et al. Amniotic fluid protein profiles of intraamniotic inflammatory response to Ureaplasma spp. and other bacteria. PLoS One, 2013, 8, e60399. http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0060399
18. Menon, R., Boldogh, I., Hawkins, HK., et al. Histological evidence of oxidative stress and premature senescence in preterm premature rupture of the human fetal membranes recapitulated in vitro. Am J Pathol, 2014, 184, p. 1740–1751. http://www.ncbi.nlm.nih.gov/pubmed/24832021
19. Menon, R., Polettini, J., Syed, TA., et al. Expression of 8-oxoguanine glycosylase in human fetal membranes. Am J Reprod Immunol, 2014, 72, p. 75–84. http://www.ncbi.nlm.nih.gov/pubmed/24589083
20. Musilova, I., Kutova, R., Pliskova, L., et al. Intraamniotic inflammation in women with preterm prelabor rupture of membranes. PloS ONE, 2015, 10(7), e0133929. http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0133929
21. Petrosino, JF., Highlander, S., Luna, RA., et al. Metagenomic pyrosequencing and microbial identification. Clin Chem, 2009, 55, p. 856–866. http://www.ncbi.nlm.nih.gov/pubmed/19264858
22. Příbalová informace kitu AmpliSens© C. trachomatis/Ureplasma/M. hominis/M. genitalium – MULTIPRIME-FRT firmy AmpliSens.
23. Romero, R., Ghidini, A., Mazor, M., Behnke, E. Microbial invasion of the amniotic cavity in premature rupture of membranes. Clin Obstet Gynecol, 1991, 34, p. 769–778.
24. Romero, R., Yoon, BH., Kendy, JS., et al. Amniotic fluid interleukin-6 determinations are of diagnostic and prognostic value in preterm labor. Am J Reprod Immunol, 1993, 30, p. 167–183. http://www.ncbi.nlm.nih.gov/pubmed/8311926
25. Romero, R., Yoon, BH., Mazor, M., et al. A comparative study of the diagnostic performance of amniotic fluid glucose, white blood cell count, interleukin-6, and gram stain in the detection of microbial invasion in patients with preterm premature rupture of membranes. Am J Obstet Gynecol, 1993, 169, p. 839–851. http://www.ncbi.nlm.nih.gov/pubmed/7694463
26. Romero, R., Espinoza, J., Goncalves, LF., et al. The role of inflammation and infection in preterm birth. Semin Reprod Med, 2007, 25, p. 21–39. http://www.ncbi.nlm.nih.gov/pubmed/17205421
27. Romero, R., Miranda, J., Chaemsaithong, P., et al. Sterile and microbial-associated intra-amniotic inflammation in preterm prelabor rupture of membranes. J Matern Fetal Neonatal Med, 2014, 28 (12), p. 1394–409. http://www.ncbi.nlm.nih.gov/pubmed/25190175
28. Romero, R., Kadar, N., Miranda, J., et al. The diagnostic performance of the Mass Restricted (MR) score in the identification of microbial invasion of the amniotic cavity or intra-amniotic inflammation is not superior to amniotic fluid interleukin-6. J Matern Fetal Neonatal Med, 2014, 27, p. 757–769. http://www.ncbi.nlm.nih.gov/pubmed/24028673
29, Romero, R., Hassan, SS., Gajer, P., et al. The composition and stability of the vaginal microbiota of normal pregnant women is different from that of non-pregnant women. Microbiome, 2014, 2(4). http://www.ncbi.nlm.nih.gov/pubmed/24484853
30. http://www.alimetrics.net/en/index.php/dna-sequence-analysis
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2016 Issue 5
Most read in this issue
- Periferní předčasná puberta (pseudopubertas praecox)
- Aktuální poznatky o HPV infekci
- Sexuální morbidita pacientek po léčbě karcinomu děložního hrdla
- Akutní inverze dělohy po porodu
