Využití medroxyprogesteron acetátu k blokádě LH při stimulaci dárkyní vajíček
Medroxyprogesteron acetate use to block LH surge in oocyte donor stimulation
Objective:
To compare the results of ovarian stimulation with LH surge blockade by medroxyprogesterone acetate or GnRH antagonist in oocytes donors. To present current options of exogenous and endogenous progestins instead of GnRH analogues to block LH surge during ovarian stimulation.
Design:
Retrospective study of oocyte donor cycles and literature review.
Setting:
Department of Obstetrics and Gynecology, Faculty of Medicine, Masaryk university and University Hospital Brno.
Methods:
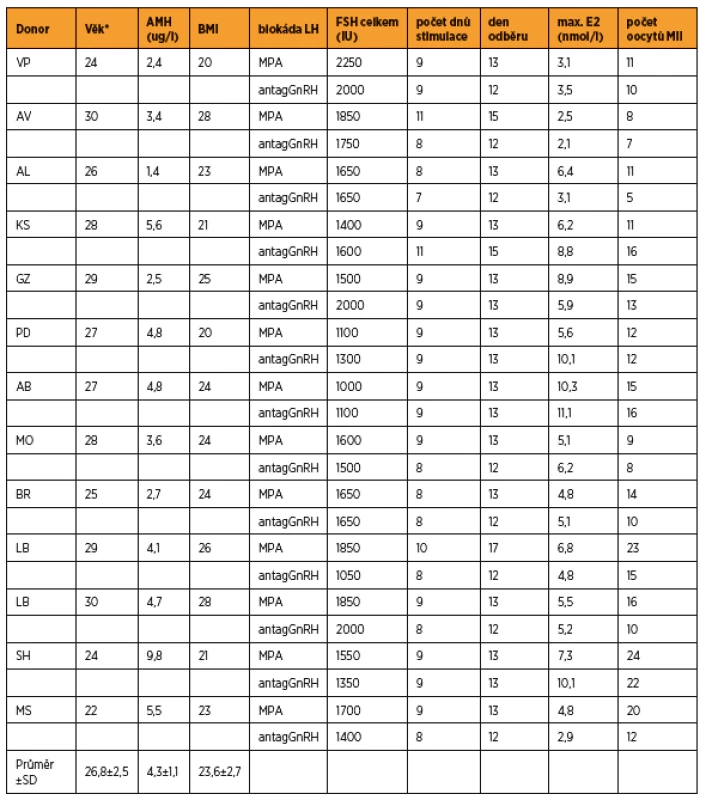
Thirteen oocyte donors (26.8 ± 2.5 years old) were stimulated with recFSH and MPA to block the LH surge during January – October 2017. The results were compared to the previous cycle stimulated with recFSH and GnRH antagonist performed during January –December 2016. Wilcoxon´s pair test was used to test the statistics. A literature search of SCOPUS was carried out.
Results:
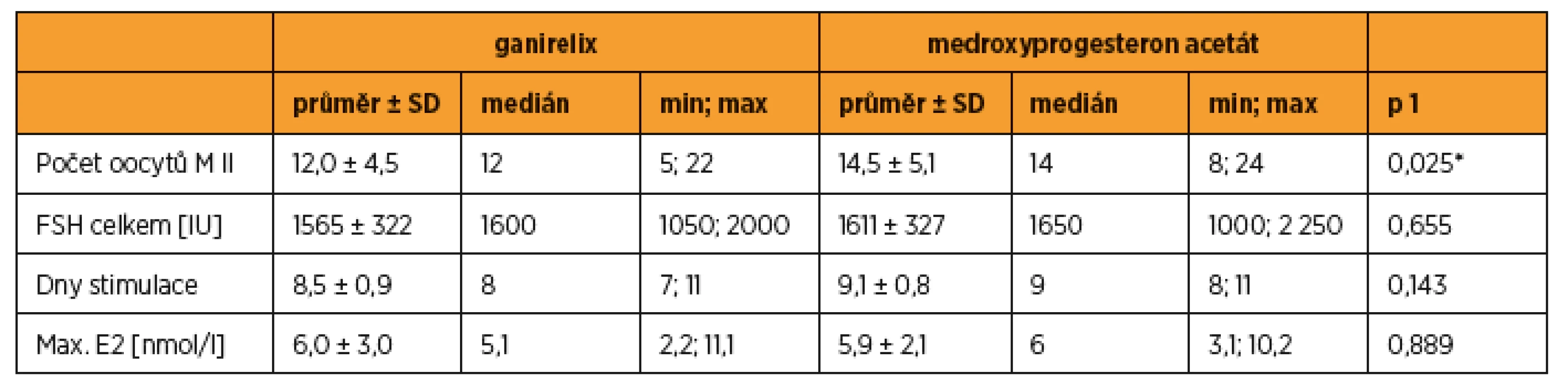
In cycles with MPA blockade the average number of oocytes was 14.5 ± 5.1, in cycles with GnRH antagonist blockade 12.0 ± 4.5 oocytes (statistical significance p = 0.025). FSH total dose (1611 ± 327 vs. 1565 ± 322 IU), days of stimulation (9.1 ± 0.8 vs. 8.5 ± 0.9) and maximum estradiol levels (5.9 ± 2.1 vs. 6.0 ± 3.0 nmol/l) were not statistically different.
Progestins are effective in blocking the LH surge during ovarian stimulation and do not affect the number and quality of collected oocytes or obtained embryos. Their adverse effect on the endometrial receptivity obstructs the embryo implantation in the same cycle. Such protocol requires total freezing and delayed transfer. Progestins can be used in a variety of stimulation protocols – progestin primed follicular phase stimulation, luteal phase stimulation with endogenous progesteron, double stimulation in follicular and luteal phase of the same cycle „duostim“ in low responders.
Conclusion:
Eggs donor ovarian stimulation with MPA resulted in more oocytes than stimulation protocol with GnRH antagonist, the total dose of FSH and the length of stimulation were similar. According to current experiences progestins effectively block the LH surge and do not affect the number and quality of collected eggs and obtained embryos. Their use opens new possibilities of ovarian stimulation protocols and their flexibility. Its main constraint is that it requires total freezing and delayed transfer.
Keywords:
ovarian stimulation, progestins, medroxyprogesterone acetate, oocyte donation, LH block, luteal phase stimulation
Authors:
I. Crha 1,2
; P. Ventruba 1; E. Filipinská 1; M. Dziakova 1; J. Žáková 1; M. Ješeta 1; E. Lousová 1; Z. Papíková 1
Authors‘ workplace:
Gynekologicko-porodnická klinika LF MU a FN, Brno, přednosta prof. MUDr. P. Ventruba, DrSc., MBA
1; Katedra porodní asistence a zdravotnických záchranářů LF MU, Brno, přednosta doc. MUDr. I. Crha, CSc.
2
Published in:
Ceska Gynekol 2018; 83(1): 11-16
Overview
Cíl studie:
Porovnat výsledky ovariální stimulace s blokádou „peaku“ LH aplikací medroxyprogesteron acetátu (MPA) nebo antagonisty gonadoliberinu u dárkyní vajíček, prezentovat současné možnosti využití exogenních a endogenních gestagenů místo analog gonadoliberinu pro blokádu preovulačního vzestupu LH v protokolech ovariální stimulace
Typ studie:
Retrospektivní studie dárcovských cyklů a literární přehled.
Název a sídlo pracoviště:
Gynekologicko-porodnická klinika Lékařské fakulty Masarykovy univerzity a FN Brno.
Metodika:
Soubor 13 dárkyní vajíček (průměrný věk 26,8 ± 2,5 let). V období leden až říjen 2017 stimulace recFSH s blokádou LH medroxyprogesteron acetátem ve folikulární fázi. Výsledky porovnány s předchozím cyklem provedeným v období leden až prosinec 2016 při stimulaci krátkým protokolem s antagonistou GnRH. Pro statistickou analýzu byl použit Wilcoxonův párový test. Literární rešerše databáze SCOPUS.
Výsledky:
V cyklech s blokádou MPA bylo získáno v průměru 14,5 ± 5,1 oocytů, při blokádě antagonistou GnRH 12,0 ± 4,5 oocytů (statistická významnost p = 0,025). Celková dávka FSH (1611 ± 327 vs. 1565 ± 322 IU), počet dnů stimulace (9,1 ± 0,8 vs. 8,5 ± 0,9) a maximální hodnota estradiolu (5,9 ± 2,1 vs. 6,0 ± 3,0 nmol/l) se statisticky nelišily.
Gestageny v průběhu ovariální stimulace účinně blokují preovulační „peak“ LH“, nebyl prokázán negativní vliv na počet a kvalitu získaných oocytů nebo embryí. Jejich nepříznivý vliv na receptivitu endometria však v daném cyklu brání implantaci embrya. Účinky gestagenů mohou být využity v různých variantách – zahájení stimulace ve folikulární fázi s exogenními gestageny, zahájení v luteální fázi s endogenním progesteronem, dvojitá stimulace ve folikulární i luteální fázi stejného cyklu tzv. duostim u žen s nízkou ovariální rezervou.
Závěr:
Při aplikaci MPA v protokolu ovariální stimulace dárkyní vajíček bylo získáno více oocytů v porovnání se stimulačním protokolem využívajícím antagonisty GnRH při srovnatelné spotřebě FSH a délce stimulace. Gestageny podle současných zkušeností účinně blokují „peak LH“, nesnižují počet a kvalitu získaných oocytů, umožňují větší flexibilitu stimulačních protokolů. V daném cyklu jejich vliv na endometrium brání implantaci embrya, což vyžaduje kryokonzervaci oocytů nebo embryí.
Klíčová slova:
ovariální stimulace, gestageny, medroxyprogesteron acetát, dárcovství oocytů, blokáda LH, stimulace luteální fáze
ÚVOD
Ve stimulačních protokolech IVF cyklů je zásadním krokem spolehlivá kontrola „peaku“ LH, který je signálem k maturaci oocytů a vlastní ovulaci. Velmi účinným a spolehlivým prostředkem blokády „peaku“ LH a ovulace jsou gestageny, což se využívá v hormonální antikoncepci [9]. Při historicky standardním postupu „stimulace – odběr oocytů – transfer embrya“ brání jejich použití nepříznivý vliv na endometrium daný jejich podáváním již ve folikulární fázi cyklu [13]. V klasických protokolech – krátkých i dlouhých – je proto využívána blokáda pomocí analog gonadoliberinu [17].
U dárkyní vajíček však receptivita jejich endometria není nutná, může být spíše výhodou vzhledem k nechtěnému otěhotnění. Současné trendy psychosociální a etické probematiky byly uvedeny nedávno [15]. Prostor pro využití gestagenů při blokádě peaku LH v protokolech ovariální stimulace otevřela také efektivní kryokonzervace oocytů a embryí [1, 14]. Kromě technik preimplantační genetické diagnostiky z trofoblastu [6], kryokonzervace oocytů jako ochrany reprodukce [5, 7, 8] při gonadotoxické terapii nebo „social freezing“ je také využíván postup primárně plánovaného zamražení všech embryí bez čerstvého transferu, „freeze all“.
Kuang et al. [11] publikovali jednu z prvních randomizovaných studií, ve které využili blokádu „peaku LH“ podáním medroxyprogesteron acetátu (MPA). Stimulaci zahájili již v časné folikulární fázi cyklu třetí den po začátku spontánní menstruace aplikací lidského menopauzálního gonadotropinu (HMG) v dávce 150–225 IU současně s 10 mg MPA. Výsledky porovnali se stimulací krátkým protokolem s antagonistou GnRH. V obou skupinách byla všechna embrya vitrifikována a transferována v následujícím cyklu. Pro statistické hodnocení byl stanoven počet 150 žen kategorie „normal responder“ pro každý stimulační protokol. V protokolu s MPA byl průměrný počet získaných vajíček 9,9 nesignifikantně vyšší proti 9,0 v protokolu s antagonistou GnRH, počet zamražených embryí také, 4,3 vs. 3,7. Srovnatelné byly také hladiny estradiolu v průběhu stimulace, výsledky „implantation rate“ a „pregnancy rate“. U narozených dětí nebyly prokázány vrozené vady a signifikantní rozdíly porodní váhy.
Cílem práce je porovnat výsledky ovariální stimulace s blokádou peaku LH aplikací medroxyprogesteron acetátu (MPA) nebo antagonisty gonadoliberinu u dárkyní vajíček a prezentovat současné možnosti využití gestagenů místo analog gonadoliberinu pro blokádu preovulačního vzestupu LH v protokolech ovariální stimulace.
SOUBOR PACIENTEK A METODIKA
Do studie bylo zařazeno 13 dárkyní vajíček (průměrný věk 26,8 ± 2,5 let) splňujících zákonné požadavky na dárcovství gamet přicházejících k zahájení stimulace v období leden až říjen 2017. Podmínkou zařazení bylo provedení stimulace a odběr vajíček v období leden až prosinec 2016 v krátkém protokolu s antagonistou GnRH (ganirelix 0,25 mg). Stimulace byla provedena kombinací recFSH v dávce 150–225 IU/den s medroxyprogesteron acetátem 10 mg/den (rozděleně 5–0–5 mg) současně se zahájením aplikace recFSH. Stimulace byla monitorována ultrazvukovou folikulometrií, stanovením estradiolu a LH. Maturace oocytů byla indukována aplikací choriogonadotropin α v dávce 250 µg 36–38 hodin před punkcí ovarií.
Výsledky porovnány s předchozím cyklem provedeným v období leden až prosinec 2016 při stimulaci krátkým protokolem s antagonistou GnRH při stejném monitorování cyklu. Pro statistickou analýzu byl použit Wilcoxonův párový test. Literární rešerše databáze SCOPUS.
VÝSLEDKY
Přehled jednotlivých cyklů včetně věku při stimulaci MPA, hodnoty AMH (anti-müllerian hormone) a BMI (body mass index) jsou uvedeny v tabulce 1. V cyklech s blokádou MPA bylo získáno v průměru 14,5 ± 5,1 oocytů, při blokádě antagonistou GnRH 12,0 ± 4,5 oocytů (statistická významnost p = 0,025). Celková dávka FSH (1611 ± 327 vs. 1565 ± 322 IU), počet dnů stimulace (9,1 ± 0,8 vs. 8,5 ± 0,9) a maximální hodnota estradiolu (5,9 ± 2,1 vs. 6,0 ± 3,1 nmol/l) se statisticky nelišily (tab. 2). Aplikaci tablet MPA ženy snášely bez vedlejších nežádoucích účinků, preferovaly ji před aplikací injekcí GnRH analog.
DISKUSE
Ve studii Kuang et al. [11] v protokolu s MPA byl průměrný počet získaných vajíček 9,9 nesignifikantně vyšší proti 9,0 v protokolu s antagonistou GnRH. V naší studii bylo získáno s MPA v průměru 14,5 ± 5,1 oocytů, při blokádě antagonistou GnRH 12,0 ± 4,5 oocytů (statistická významnost p = 0,025). Rozdíl může být v souvislosti s charakterem souboru – dárkyně vajíček s optimální reprodukční kondicí oproti pacientkám z dvojic s poruchou plodnosti. Významnou roli může mít také rozdílná velikost souborů (150 vs. 13).
MPA je v experimentech na zvířatech teratogenní, jeho podávání je v těhotenství kontraindikováno, ale v tomto protokolu nejsou embrya MPA exponována. MPA se z organismu rychle vylučuje, v následných cyklech je již z organismu eliminován. Podmínkou pro blokádu pozitivní zpětné vazby vedoucí k peaku LH je zahájení aplikace gestagenů dříve, než hladina estradiolu převýší 50 pg/ml. Dávka 10 mg MPA byla zvolena na základě zkušeností ve studiích kontracepce, kde dávka 5 mg neměla potřebnou spolehlivost.
Alternativou MPA může být použití mikronizovaného progesteronu nebo dydrogesteronu. Zhu et al. [19] v souboru 250 žen stimulovaných hMG (150-225 IU) podávali od třetího dne cyklu 100 mg mikronizovaného progesteronu nebo 20 mg dydrogesteronu denně. U žádné ženy nedošlo k předčasnému peaku LH; počet oocytů (8,2 ± 5,4 vs. 8,8 ± 5,6), embryí (2,9 ± 2,2 vs. 3,4 ± 2,5); počet klinických těhotenství, (53,1 vs. 51,7 %), časných těhotenských ztrát (8,2 vs. 11,8 %), implantace (38,6 vs. 35,7 %) a kumulativního počtu těhotenství (66,7 vs. 69,4 %) byl také srovnatelný.
Nové protokoly zahájení ovariální stimulace vychází z fyziologie ovariálního cyklu. Představy o dynamice vývoje folikulů byly založeny na klasickém modelu, který publikoval v polovině osmdesátých let 20. století Gougeon [4]. Základem byla histologická vyšetření vaječníků žen v reprodukčním období. Podle této teorie na začátku folikulární fáze vstoupí do finální fáze růstu jediná kohorta antrálních folikulů, ze které je selektován dominantní folikul. V roce 2003 Baerwald et al. [2] publikovali práci, která vycházela z velmi přesného každodenního ultrazvukového vyšetření folikulů ≥ 5 mm ve vaječnících žen s pravidelným ovulačním cyklem. V průběhu jednoho menstruačního cyklu prokázali u 68 % žen dvě kohorty a u 32 % žen tři kohorty malých antrálních folikulů, které vstupují do finální fáze růstu. Tyto kohorty mohou být označeny jako hlavní, pokud z jejich folikulů dojde k ovulaci, nebo vedlejší, pokud k ovulaci nedojde. U většiny žen ovulace nastává pouze v jedné z kohort rostoucích folikulů. Kohorta, která nastupuje v první polovině folikulární fáze, je obvykle ovulační, kohorta, která nastupuje v luteální fázi, je obvykle anovulační. Počet folikulů ≥ 5 mm je maximální za čtyři dny od počátku této vlny.
Pro ovariální stimulaci v klinické praxi je důležité mít na paměti tento rytmus jednotlivých kohort, které po sobě následují s časovým odstupem. Je proto možné získat kvalitní oocyty při zahájení stimulace nejen v časné folikulární fázi jako v klasických protokolech, ale také v pozdní folikulární fázi nebo fázi luteální.
První zkušenosti s ovariální stimulací zahájenou v luteální fázi byly získány u žen, kde bylo nutné pro zachování fertility před agresivní chemoterapií zahájit léčbu bez dalšího časového prodlení [12]. Buendgen et al. [3] publikovali v roce 2013 prospektivní randomizovanou studii, kde porovnávali výsledky ovariální stimulace zahájené mezi 19.–21. dnem cyklu (luteální fáze verifikována vzestupem hladiny progesteronu v krvi) s výsledky stimulace zahájené ve folikulární fázi. V obou ramenech byl aplikován FSH s antagonisty GnRH. Kvalita oocytů, fertilizace a embryí byla v obou skupinách srovnatelná.
Při zahájení stimulace v luteální fázi je možné pro blokádu peaku LH využít endogenní progesteron produkovaný corpus luteum nebo exogenní gestageny. V retrospektivní studii Wang et al. [18] prokázali srovnatelné výsledky stimulace luteální fáze v porovnání se stimulací folikulární fáze s analogy GnRH.
Charakter dozrávání folikulů ve dvou až třech kohortách v průběhu jednoho menstruačního cyklu umožňuje využít pro získání oocytů dvě těsně po sobě jdoucí stimulace. Tento postup bývá označován také jako „duostim“ nebo „double stimulation regimen“. V pilotní studii Kuang et al. [10] u žen s nízkou ovariální rezervou ve folikulární fázi stimulovali kombinací HMG, clomifen citrát a letrozol, blodáda peaku LH GnRH antagonisty. Po odběru oocytů 15. den nasazen HMG 225 IU/den, letrozol 2,5 mg/den a MPA od 24. dne cyklu, maturace oocytů indukována agonistou GnRH, odběr oocytů 29. den. V této studii z 38 žen byly oba odběry provedeny u 30 žen. Počet oocytů z druhého odběru byl signifikantně vyšší než z prvního odběru (3,5 vs. 1,7) při jejich srovnatelné kvalitě.
Dobré výsledky s dvojitou stimulací u „poor responders“ prokázali také Ubaldi et al. [16], kteří provedli PGS trofoblastu embryí. Počet euploidních blastocyst z oocytů získaných stimulací zahájenou ve folikulární i luteální fázi byl srovnatelný. Na dobré výsledky stimulace v luteální fázi může mít vliv předchozí stimulace FSH na další rostoucí kohortu, ze které se rekrutují dominantní folikuly aspirované při druhém odběru.
Využití výše uvedených protokolů do klinické praxe vyžaduje komplexní posouzení všech aspektů u konkrétní ženy připravující se na cyklus IVF. V případech urgentního zahájení stimulace před gonadotoxickou léčbou, kde odkládání chemoterapie je spojeno s rizikem progrese onemocnění, je situace specifická. Povzbudivé výsledky opravňují k využití „random start“ přístupu včetně blokády LH gestageny.
U žen s adekvátní ovariální rezervou je důležité pro rutinní používání zvážit otázku neprovedení čerstvého transferu, kryokonzervaci všech embryí, možného zvýšení celkové dávky FSH nebo případné potíže s dostupností centra IVF. U žen, kde není primárně transfer čerstvých embryí plánován – např. preimplantační genetické vyšetření trofoblastu blastocysty – je rozhodnutí o využití blokády LH gestageny v časné folikulární fázi jednodušší. V souvislosti s přijetím strategie cíleného zamražení všech embryí („freeze all“) je možné také využití protokolu s gestageny místo GnRH analog. Také u dárkyní vajíček je aplikace perorálních gestagenů lépe tolerována než injekce GnRH analog.
ZÁVĚR
Při aplikaci MPA v protokolu ovariální stimulace dárkyní vajíček bylo získáno více oocytů v porovnání se stimulačním protokolem využívajícím antagonisty GnRH při srovnatelné spotřebě FSH a délce stimulace. Gestageny podle současných zkušeností účinně blokují peak LH, nesnižují počet a kvalitu získaných oocytů, umožňují větší flexibilitu stimulačních protokolů. V daném cyklu jejich vliv na endometrium brání implantaci embrya, což vyžaduje kryokonzervaci oocytů nebo embryí.
Práce byla podpořena MZ ČR – RVO (FNBr 65269705) a projektu Lékařské fakulty MU pro juniorského výzkumníka M. Ješetu.
Korespondující autor
Ing. Michal Ješeta, Ph.D.
Gynekologicko-porodnická klinika LF UK a FN
Obilní trh 11
602 00 Brno
e-mail: jeseta.michal@fnbrno.cz
Sources
1. Argyle, CE., Harper, JC., Davies, MC. Oocyte cryopreservation: where are we now? Hum Reprod Update, 2016, 22(4), p. 440–449.
2. Baerwald, AR., Adams, GP., Pierson, RA. A new model for ovarian follicular development during the human menstrual cycle. Fertil Steril, 2003, 80, p. 116–122.
3. Buendgen, NK., Schultze-Mosgau, A., Cordes, T., et al. Initiation of ovarian stimulation independent of the menstrual cycle: a case-control study. Arch Gynecol Obstet, 2013, 288, p. 901–904.
4. Gougeon, A. Dynamics of follicular growth in the human: a model from preliminary results. Hum Reprod, 1986, 1(2), p. 81–87.
5. Halászová, N., Crha, I., Huser, M., et al. Zachování fertility u žen s karcinomem prsu před gonadotoxickou léčbou. Čes Gynek, 2017, 82(4), s. 287–292.
6. Hens, K., Dondorp, W., Handyside, AH., et al. Dynamics and ethics of comprehensive preimplantation genetic testing: a review of the challenges. Hum Reprod Update, 2013, 19(4), p. 366–375.
7. Huser, M. Onkofertilita – nová oblast reprodukční medicíny. 1.ed. Praha: Mladá fronta, 2014, 109 s.
8. Huser, M., Smardova, L., Janku, P., et al. Fertility status of Hodgkin lymphoma patients treated with chemotherapy and adjuvant gonadotropin-releasing hormone analogues. J Assist Reprod Genet, 2015, 32(8), p. 1187–1193.
9. Křepelka, P. Hormonální antikoncepce – zásady bezpečné praxe. Praha: Mladá fronta, 2013, 284 s.
10. Kuang, Y., Chen, Q., Fu, Y., et al. Medroxyprogesterone acetate is an effective oral alternative for preventing premature luteinizing hormone surges in women undergoing controlled ovarian hyperstimulation for in vitro fertilization. Fertil Steril, 2015, 104, p. 62–70.
11. Kuang, Y., Chen, Q., Hong, Q., et al. Double stimulations during the follicular and luteal phases of poor responders in IVF/ICSI programmes (Shanghai protocol). Reprod Biomed Online, 2014, 29, p. 684–691.
12. Maman, E., Meirow, D., Brengauz, M., et al. Luteal phase oocyte retrieval and in vitro maturation is an optional procedure for urgent fertility preservation. Fertil Steril, 2011, 95, p. 64–67.
13. Messinis, IE., Messini, CI., Dafopoulos, K. Novel aspects of the endocrinology of the menstrual cycle. Reprod Biomed Online, 2014, 28, p.714–722.
14. Roque, M., Valle, M., Guimarães, F., et al. Freeze-all policy: fresh vs. frozen-thawed embryo transfer. Fertil Steril, 2015, 103, p. 1190–1193.
15. Rumpíková, T., Oborná, I., Konečná, H. Současné trendy v psychosociální a etické problematice dárcovství gamet. Čes Gynek, 2017, 82(4), s. 293–299.
16. Ubaldi, FM., Capalbo, A., Vaiarelli, A., et al. Follicular versus luteal phase ovarian stimulation during the same menstrual cycle (DuoStim) in a reduced ovarian reserve population results in a similar euploid blastocyst formation rate: new insight in ovarian reserve exploitation. Fertil Steril, 2016, 105(6), p. 1488–1495.
17. Ventruba, P., Žáková, J., Trávník, P., et al. Aktuální otázky asistované reprodukce v České republice. Čes Gynek, 2013, 78(4), s. 392–398.
18. Wang, N., Wang, Y., Chen, Q., et al. Luteal phase ovarian stimulation vs conventional ovarian stimulation in patients with normal ovarian reserve treated for IVF: a large retrospective cohort study. Clin Endocrinol, 2016, 84, p. 720–728.
19. Zhu, X., Ye, H., Fu, Y. Duphaston and human menopausal gonadotropin protocol in normally ovulatory women undergoing controlled ovarian hyperstimulation during in vitro fertilization/intracytoplasmic sperm injection treatments in combination with embryo cryopreservation. Fertil Steril, 2017, 108(3), p. 505–512.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2018 Issue 1
Most read in this issue
- Možnosti přípravy endometria ke kryoembryotransferu
- Antibiotická terapie v graviditě
- Malformace Galenovy žíly u plodu
- Využití medroxyprogesteron acetátu k blokádě LH při stimulaci dárkyní vajíček
