Implantace a diagnostika receptivity endometria
Implantation and diagnostics of endometrial receptivity
Objective: Literature review of endometrial receptivity in embryo implantation and its diagnostic possibilities.
Design: Literature review.
Setting: Department of Obstetrics and Gynecology, University Hospital, Faculty of Medicine, Palacky University, Olomouc; Institute of Molecular and Translational Medicine, Faculty of Medicine and Dentistry, Palacky University, Olomouc.
Results: Endometrial tissue is very dynamic, undergoing cyclic proliferation, differentiation and cell transportation, especially of immune system cells under the influence of circulating estradiol and progesterone. Endometrial remodelling during embryo implantation is controlled by decidual cells senescence and effectivity of their immunologic destruction.
Endometrial receptivity can be assessed by transcriptomic profiling of endometrial biopsy using ERA system or proteomic analysis of either endometrial secretome or cervical mucus by gel electrophoresis (DIGE) or mass spectrometry (MS).
Conclusion: With respect to recent discoveries in endometrial physiology and molecular biology, clinical application of proteomic approaches in research of potential biomarkers of endometrial receptivity could be of interest.
Keywords: implantation, endometrial receptivity, proteomic analysis, secretome, cervical mucus
:
M. Dvořan 1; J. Vodička 1; J. Dostál 1
; M. Hajdúch 2
; P. Džubák 2
; M. Pešková 1; R. Pilka 1
:
Porodnicko-gynekologická klinika FN a LF UP, Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D.
1; Ústav molekulární a translační medicíny LF UP, Olomouc, přednosta doc. MUDr. M. Hajdúch, Ph. D.
2
:
Ceska Gynekol 2018; 83(4): 291-298
:
Cíl studie: Přehled problematiky mechanismů receptivity endometria při implantaci embrya a možnosti její diagnostiky.
Typ studie: Přehledový článek.
Název a sídlo pacoviště: Porodnicko-gynekologická klinika, FN a LF UP Olomouc; Ústav molekulární a translační medicíny, LF UP Olomouc.
Výsledky: Endometrium je velmi dynamická tkáň procházející cyklickou proliferací, diferenciací a transportem buněk, zvláště pak buněk imunitního systému. Vše se děje v závislosti na změně cirkulujících ovariálních hormonů estradiolu a progesteronu. Remodelování endometria v době implantace embrya je kontrolováno v časoprostoru intenzitou senescence deciduálních buněk a efektivitou jejich imunologické likvidace. Receptivita endometria může být dnes hodnocena jak na bázi transkriptomického profilování biopsie endometria pomocí ERA systému, tak i proteomickou analýzou endometriálního sekretomu nebo cervikálního hlenu pomocí metod diferenční gelové elektroforézy (DIGE) a hmotnostní spektrometrie (MS).
Závěr: Vzhledem k nejnovějším poznatkům v oblasti fyziologie a molekulární biologie endometria by bylo zajímavé aplikovat proteomické přístupy v hledání kandidátních biomarkerů ze vzorků získaných pokud možno neinvazivními postupy a aplikovat je v klinické praxi.
Klíčová slova: implantace, endometriální receptivita, proteomická analýza, sekretom, cervikální hlen
ÚVOD
Endometrium je dynamická tkáň procházející cyklickou regenerací a degenerací, která je založena nejen na změně cirkulujících ovariálních hormonů estradiolu a progesteronu, ale také na řadě různých cytokinů, které regulují optimální vývoj endometriálních a imunitních buněk. Cyklické změny endometria jsou rozděleny na jednotlivé fáze: proliferační, sekreční, ischemickou a menstruační. Pokud nedojde k otěhotnění, dochází k rozpadu tkáně následovanému její regenerací. Hlavním cílem tohoto komplexního procesu je úspěšná adheze, invaze a placentace plodu s další regenerací postpartum [11].
IMPLANTAČNÍ OKNO ENDOMETRIA
Koncept implantačního okna (window of implantation, WOI) definovaného jako krátké období v menstruačním cyklu, kdy se endometrium připravuje na nidaci embrya, byl poprvé navržen v roce 1956 [16]. Toto období trvá čtyři až pět dnů v době, kdy je možné detekovat maximální hladinu progesteronu v krvi. Na počátku devadesátých let minulého století byl koncept implantačního okna jako časového intervalu, ve kterém je nutné přenést embryo pro co největší šanci na implantaci, demonstrován Navotem a spol. [28]. V roce 1999 byla na základě detekce změn koncentrací estron 3-glucuronidu a pregnandiol 3-glucuronidu v moči stanovena ovulace a následně nejvhodnější doba pro implantaci embrya na 8–10 dní po ovulaci [42]. Do úvah o receptivitě endometria ale nebyly zahrnuty individuální rozdíly nebo hormonální léčba předcházející embryotransferu (kontrolovaná ovariální stimulace, IVF v nativním cyklu, substituční hormonální terapie).
V dnešní době je možno díky novým diagnostickým metodám, jako je například transkripční profilování, přesněji klasifikovat období nejvyššího implantačního potenciálu a optimální receptivity endometria [34, 39]. Další, prozatím experimentální diagnostickou metodou je proteomická analýza endometriálního sekretu, popřípadě cervikálního hlenu, dnes většinou prováděná pomocí metod hmotnostní spektrometrie. Tyto metody dovolují velmi přesně detekovat různé proteiny přítomné v získaném vzorku. Role endometria není omezena jen na implantaci embrya, ale také na vytvoření adekvátního prostředí pro další rozvoj embrya. Postimplantační vývoj je spojen s rozvojem komunikace mezi embryem a endometriem na základě signálních molekul a zajištění kontinuálního zdroje živin pro rostoucí embryo. Mezibuněčné interakce jsou přenášeny proteiny, cytokiny a jejich inhibitory, růstovými faktory, receptory nebo modulátory. Poslední studie však ukazují, že endometrium mnohem dynamičtěji kontroluje implantaci embrya, než se doposud myslelo.
AKTIVITA METALOPROTEINÁZ JAKO SOUČÁST PROCESU IMPLANTACE EMBRYA
Matrix-metaloproteinázy (MMP) jsou skupinou enzymatických proteinů s proteolytickou aktivitou, hrajících zásadní roli v procesu remodelace endometria (obr. 1). Syntéza MMP proteinů je regulována mnoha faktory včetně steroidních hormonů, růstových faktorů, cytokinů, onkogenů [26]. Proteolytická aktivita MMP proteinů závisí na typu tkáně, lokálním pH a aktivitě jejich tkáňových inhibitorů (TIMP). Bylo zjištěno, že tyto inhibitory (TIMP 1–4) nejenže regulují aktivitu metaloproteináz, ale také se účastní stimulace růstu tkání, angiogeneze a apoptotických procesů [43].
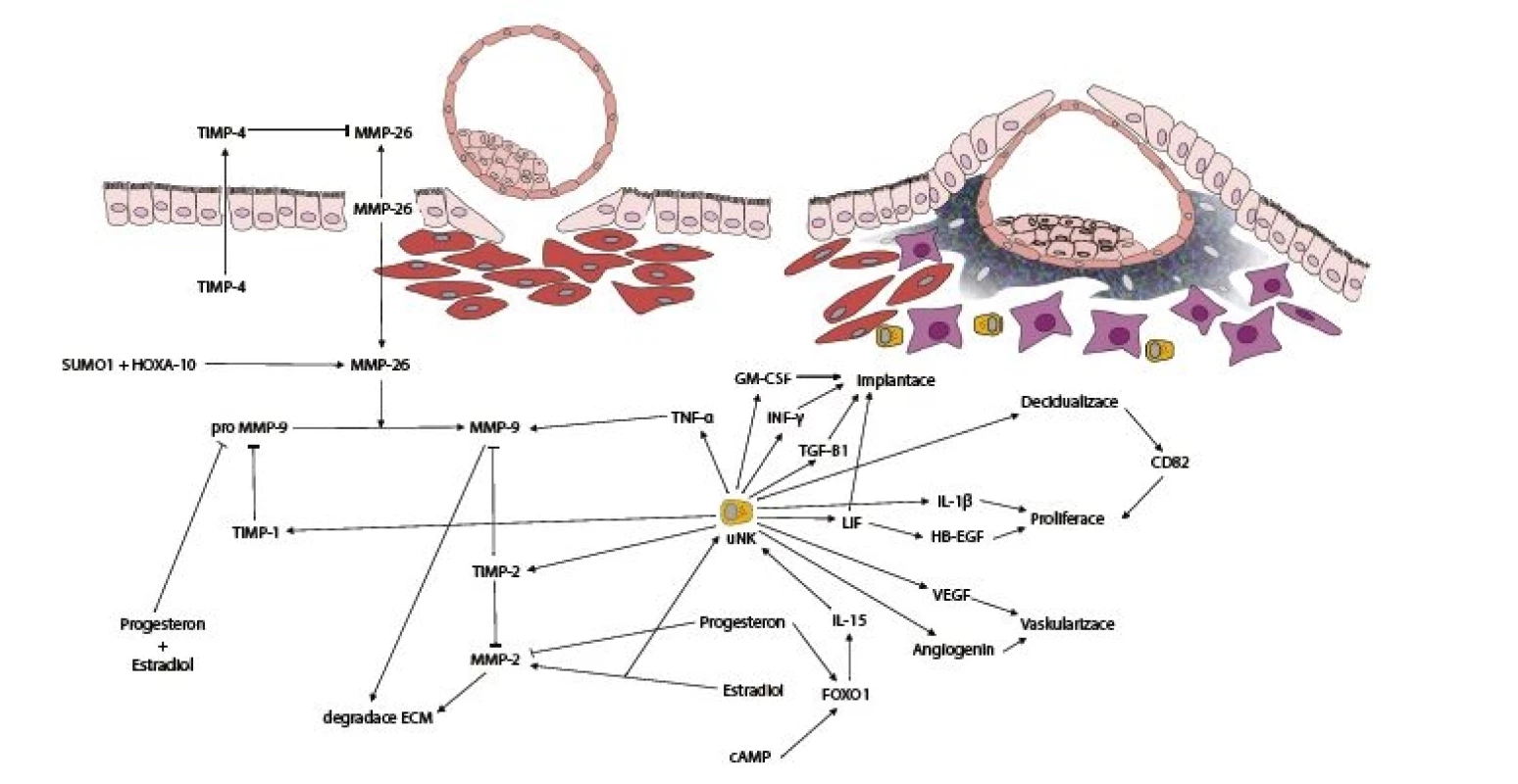
Důležitou součástí stability endometria je kontinuálně exprimovaný enzym MMP-2 ve stromálních buňkách endometria [20]. Exprese MMP-2 pozitivně koreluje s koncentrací estradiolu a negativně s hladinou progesteronu. Produkce MMP-2 dosahuje maxima v pozdně sekreční fázi cyklu a po jejím poklesu na konci cyklu dochází k rozpadu endometriální tkáně a počátku menstruace [20].
Dalším nepostradatelným enzymem je MMP-9, který se podílí na degradaci kolagenu IV a elastinu, jež jsou jednou z hlavních komponent extracelulární matrix (ECM). MMP-9 je exprimován ve stromálních buňkách endometria (hESC) jako neaktivní zymogen pro-MMP-9 [30]. Se zvýšením koncentrace jak estradiolu, tak i progesteronu klesá koncentrace pro-MMP-9, zatímco koncentrace MMP-9 zůstává stabilní a je nezávislá na poklesu koncentrace progesteronu [6]. TIMP-2 je protein syntetizovaný pouze fibroblasty a endoteliálními buňkami a má vysokou afinitu k MMP-2 a aktivované formě MMP-9. Naproti tomu glykoprotein TIMP-1 je produkován více typy buněk a má vysokou afinitu k pro-MMP-9. [27].
Na základě studie Cheginiho z roku 2003 bylo zjištěno, že jedna z hlavních cest aktivace pro-MMP-9 je pomocí relativně nedávno objevené metaloproteinázy MMP-26 [18]. MMP-26 je lokalizována pouze v epiteliálních buňkách endometria (hEEC) s narůstající intenzitou exprese v průběhu proliferační fáze cyklu, maximem v období ovulace a následnou klesající tendencí v pozdně sekreční fázi cyklu. V menstruační fázi již nebyla MMP-26 exprese detekovatelná [33]. V prostředí in vitro kultivace byla prokázána regulace exprese MMP-26 prostřednictvím jak estradiolu, tak i progesteronu [33]. Maximální exprese MMP-26 v časné sekreční fázi cyklu je doprovázena expresí jejího inhibitoru TIMP-4. V hESC buňkách byla detekována mRNA, ale pouze velmi nízká úroveň samotného TIMP-4 inhibitoru. Samotný enzym TIMP-4 byl detekován v apikální části hEEC, kde plní svou funkci regulace MMP-26 [32]. Tento fakt podporuje skutečnost, že v endometriálním sekretu byl detekován pouze TIMP-4 bez MMP-26, který tak omezuje aktivitu MMP-26 na oblast hEEC [32]. Na základě in vitro experimentů s Ishikawa buňkami a BeWo sferoidy bylo později zjištěno, že MMP-26 se aktivně účastní implantace embrya (obr. 1) a její samotná exprese je regulována transkripčním faktorem homeobox a 10 (HOXA-10) [23]. Exprese HOXA-10 spolu s dalším transkripčním faktorem HOXA-11 byla u 31 žen s endometriózou značně snížena a korelovala s objektivním nálezem vrásčitější struktury endometria, než tomu bylo v případě 26 kontrol [21]. V roce 2017 bylo dále zjištěno, že samotný transkripční faktor HOXA-10 je modifikován prostřednictvím small ubiquitin-like modifier 1 (SUMO1). Touto modifikací dochází ke snížení stability HOXA-10 a inhibici implantace embrya demonstrované in vitro na Ishikawa buňkách a BeWo sferoidech [22]. Vysoká úroveň modifikace HOXA-10 pomocí SUMO1 byla zjištěna u žen s opakovaným potrácením (RIF) v průběhu sekreční fáze cyklu endometria vzhledem ke kontrolní skupině pacientek [22].
Na základě výše zmíněných skutečností můžeme tvrdit, že MMP-26 spolu s MMP-9 a TIMP-4 tvoří důležitou složku v procesu implantace embrya na pozadí imunologického procesu decidualizace. MMP-26 je spolu s TIMP-4 vhodným kandidátem na potenciální biomarkery receptivity endometria.
PROCES DECIDUALIZACE ENDOMETRIA REGULUJE PRŮBĚH IMPLANTACE EMBRYA
Proces implantace je v mnohém podobný karcinogenezi. Dochází k destrukci endometriálních epiteliálních buněk implantujícím embryem, enzymatickému narušení matrix stromatu a nakonec k invazi maternální deciduy a vnitřního myometria. Invaze semialogenního fetálního trofoblastu je tolerována i kontrolována deciduální reakcí [35]. Nekontrolovatelná invaze trofoblastu do endometria může způsobit v případě nadměrné invaze klinicky manifestovanou placentu accreta nebo v případě neadekvátní invaze ohrozit plod a způsobit řadu těhotenských komplikací, jako je například intrauterinní růstová restrikce, preeklampsie nebo potrat v raném i pozdním stadiu gravidity [35]. Bylo zjištěno, že proces decidualizace začíná explozí volných radikálů pomocí aktivace signalizační dráhy NADPH oxidázy 4 (NOX-4) [37]. Signály dráhy NAD(P)H oxidázy 4 (NOX-4) jsou spouštěčem exprese dalších genů decidualizace s cílem zajistit optimální receptivitu endometria pro úspěšnou implantaci embrya. Samotný proces decidualizace je založen na základě prozánětlivé odpovědi kontrolované nejen progesteronem, ale také signalizační dráhou protein-kinázy A (PKA) a produkcí cyklického adenozin-monofosfátu (cAMP) [11].
Podstatou decidualizace je vytvoření lokálního edému, koncentrace a proliferace uterinních natural killer (uNK) buněk s následnou extenzivní remodelací hESC specializované deciduální buňky, které koordinují jak nidaci embrya, tak i samotné vytváření placenty [11, 44]. Deciduální buňky a buňky trofoblastu embrya mezi sebou aktivně signalizují jednak na bázi chemotaxe prostřednictvím různých cytokinů, ale také pomocí exozomů, což jsou nano-vezikuly o průměru 40–150 mm. Ty obsahují různé signalizační molekuly jak solubilní, tak i membránově vázané [14]. Velmi důležitou úlohu ve správné signalizaci s nidovaným embryem sehrávají uterinní natural killer buňky (uNK) (obr. 1), které se odlišují od periferních NK buněk na základě přítomnosti dvou povrchových antigenů CD56+ a CD16+ [40]. Tyto uNK buňky produkují velké množství různých signalizačních molekul (leukémie inhibující faktor – LIF, TNF-α, INF-γ, interleukin IL-1β, GM-CSF, TGF-β1, inhibitory metaloproteináz – TIMP-1,TIMP-2,VEGF aj.) důležitých pro správný vývoj nidovaného embrya a zaručují, že embryo bude obklopeno převahou kompetentních deciduálních buněk [4, 5, 40]. Tato selektivní likvidace senescentních deciduálních buněk umožní vznik již zmíněné imuno-privilegované deciduální matrix. V těhotenství uNK buňky exprimují senescentní markery a jsou spíše proangiogenní než cytotoxické [36], což napomáhá vaskularizaci v oblasti nidovaného embrya a následně také i přísunu živin pro další vývoj nidovaného embrya [36]. V průběhu decidualizace spouští akutní senescence subpopulace hESC buněk několikastupňový proces, jehož cílem je transformace cyklujícího endometria v gestační tkáň.
Deciduální buňky jsou tak schopny na základě vzájemné signalizace upravit migrační aktivitu vzhledem k implantujícímu embryu a jeho kvalitě. Tyto buňky ale nedokážou rozlišit mezi normálním a abnormálním embryem u pacientek s opakovaným potrácením [41]. Tato implantační kompetence endometria je závislá od schopnosti IL-15 aktivovaných uNK buněk selektivně likvidovat senescentní deciduální buňky prostřednictvím exocytózy cytotoxických granulí v luteální fázi cyklu. Pokud v endometriu není přítomna žádná další patologie, tak by při zajištění funkčnosti tohoto mechanismu měl být reprodukční potenciál endometria maximální [4]. Proliferace hESC buněk je zajištěna kombinací signálních molekul, mezi něž patří heparin-vázající EGF-like růstový faktor (HB-EGF), LIF a interleukin IL-1β. Vedle proliferace je motilita hESC buněk zvýšena prostřednictvím CD82, který je známý metastatický supresor a ve značné míře je exprimován v deciduálních buňkách [12].
Komplexní remodelace endometria je kontrolována v čase jak proliferací hESC buněk a intenzitou senescence deciduálních buněk, tak i efektivitou jejich imunologické likvidace [4]. V diferencujících hESC buňkách je přítomen FOXO1, hlavní deciduální transkripční faktor zodpovědný za zástavu buněčného cyklu a indukci důležitých genů v procesu decidualizace, jako jsou prolaktin (PRL) a IGF-vázající protein 1 (IGFBP1). Exprese FOXO1 je regulována jak cAMP, tak i progesteronem [38]. FOXO1 byl také označen jako spouštěč senescence buněk ovariálního karcinomu, které byly ovlivňovány progesteronem [8]. Absencí FOXO1 v buňkách dochází také k omezení exprese IL-8, IL-6 a aktivity enzymu β-galaktosidázy asociovaného se senescencí (SAbG). SAbG je biomarker běžně používaný pro senescentní buňky, bohužel ale postrádá specificitu [25]. Právě při procesu decidualizace dochází paralelně ke stabilizaci p53 a zvýšené expresi p16, inhibitoru cyklin dependentní kinázy (CDK). Inhibice CDK vede k zastavení proliferace a buněčného cyklu [4]. Jako potenciální proteinové biomarkery receptivity endometria byly stanoveny lamin B1 (LMNB1), high mobility group box 2 (HMGB2), histone H2A variant macroH2A (mH2A), nucleosome linker histone H1 (H.H1 and trimethylated lysine 9 on histone H3 (H3K9Me3). Tato histonová varianta se vyskytuje ve formě heterochromatinu, která je přítomna v senescentních buňkách (SAHF) [4].
TRANSKRIPTOMICKÝ PODPIS RECEPTIVITY ENDOMETRIA
Jednou z možností, jak adekvátně definovat receptivitu endometria, je prostřednictvím charakterizace cyklických změn v endometriálním transkriptomu. Technologie DNA microarray je schopna simultánní analýzy transkriptomu u tisíců různých genů. Výsledky této transkriptomické analýzy dávají možnost charakterizace genové exprese na úrovni mRNA a vytvoření specifického profilu pro každý odebraný vzorek endometria [29].
Studie z roku 2004 Horcajadase a spol. zkoumala více než 12 000 genů pomocí DNA microarray technologie v období prereceptivním (LH peak + 2 dny) a receptivním (LH peak + 7 dnů) z bioptických vzorků lidského endometria [17]. Nalezeno bylo od 90 do 323 pozitivně regulovaných genů a 46–377 negativně regulovaných genů v receptivní fázi. Pouze u tří genů [osteopontin (stukturní protein), apolipoprotein D (transportér) a Dickkopf/DKK1 (signalizace)] byla data konzistentní mezi jednotlivými studiemi. Nicméně Diaz-Gimeno et al. [7] zavedli v roce 2011 diagnostický test ERA (endometrial receptivity array) zahrnující 238 kandidátních genů. Z nich 134 je transkripčně definováno. Cílem ERA testu je tzv. datování a patologická klasifikace endometria. Limitací testu je nutnost odběru biopsie a s tím spojená invazivita výkonu společně s potenciální variabilitou genové exprese způsobené odběrem malého vzorku endometriální tkáně v určité lokální oblasti, která nemusí nutně poukazovat na celkový stav receptivity endometria. S vývojem technologií se naskytla další alternativa diagnostiky receptivity endometria pomocí proteomických technik a analýz endometriálního sekretomu nebo cervikálního hlenu.
PROTEOMICKÉ PŘÍSTUPY V DIAGNOSTICE RECEPTIVITY ENDOMETRIA
Složení proteomu endometria je velmi komplexní a jeho analýza může být ovlivněna jak preanalytickou fází odběru vzorku, tak i post-translačními modifikacemi analyzovaných proteinů [2]. Hlavní komponenty endometriálního sekretomu jsou cytokiny, močovina, glukóza, aminokyseliny, metaloproteinázy a jejich inhibitory, imunoglobuliny, muciny, α-1 antitrypsin prekurzor, haptoglobulin, transferrin a další proteiny [1, 31]. Některé z proteinů mohou sloužit jako biomarkery pro stanovení receptivity endometria (tab. 1). Komplexní profil proteomických biomarkerů nabízí techniky diferenční gelové elektroforézy (DIGE), multiplex imunoassay či hmotnostní spektrometrie (MS) z různých typů vzorků.
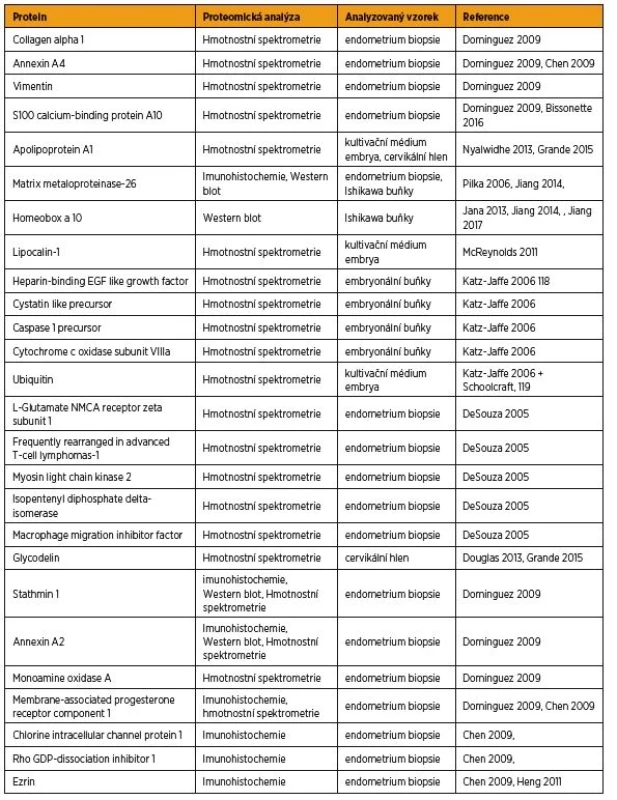

Vzorek pro proteomickou analýzu může být získán buď přímo z endometria biopsií [9], laváží, nebo odběrem endometriálního sektretu [3]. Laváží je možno získat až desetkrát více proteinů než aspirací díky uvolnění dalších proteinů z glykokalyxu endometria. Alternativní metodou je získání vzorku z cervikálního hlenu [13] nebo cervikální zátky [24]. Výhodou odběru cervikálního hlenu je neinvazivní přístup. Podle Boomsma 2010 nebyl odběr endometriálního sekretu katétrem pro embryotransfer doprovázen snížením implantation rate [3]. S příchodem vysoce výkonné high-throughput tandemové hmotnostní spektrometrie (MS) začalo být možné kvantifikovat z jednoho vzorku jeho komplexní proteomické složení. V roce 2009 Dominguez et al. porovnali vzorky receptivního a nereceptivního endometria pomocí DIGE. Kandidátní skupiny proteinů byly poté z gelu vyjmuty a analyzovány pomocí MALDI-MS. Výsledky studie označily stathmin-1 a annexin A2 jako rozdílně regulované proteiny a potenciální proteinové biomarkery [9].
Počátky proteomických studií endometria se datují do šedesátých let minulého století, kdy se jako hlavní metoda používala imunodifuze a reakce se specifickými protilátkami proti hledanému proteinu [10]. Výsledky první komplexní proteomické studie naznačily, že glycodelin na rozdíl od leukémii inhibujícího faktoru (LIF) koreluje s histologickým nálezem maturace endometria. Zatím jedna z největších studií zahrnovala vzorky endometriálního sektretu odebraného před embryotransferem u 210 IVF pacientek. Výsledky proteomické analýzy pomocí multiplex immunoassay odhalily dalších 17 potenciálních regulátorů implantace, interleukiny 1-β, 5, 6, 10, 12, 15, 17 a 18, TNF-α, INF-γ, eotaxin, VEGF, Dickkopf homolog 1, heparin-vázající epidermální růstový faktor (HB-EGF), INF-γ indukující 10 kd protein (IP-10), monocyt chemoatraktant protein (MCP-1), macrophage migration inhibitory factor. Hlavními markery byly stanoveny IL 1-β a TNF-α [15]. Pomocí DIGE Chen et al., definovali 196 proteinů, které jsou odlišně produkovány endometriem v proliferační a sekreční fázi. Bohužel většina proteinů nebyla ve shodě s daty získanými na základě genetických analýz. Pouze šest proteinů se shodovalo s proteomickými daty [19]. Za příčinu neshody byla označena lokální variace exprese vyšetřovaných genů, protože biopsie reprezentuje pouze 2–4 % povrchu epitelu. Rozdíly mohly být dále způsobeny heterogenitou odebrané endometriální tkáně (epiteliální, stromální buňky, žlázy, komponenty vaskularizace apod.), která ve výsledku exprimuje různé proteomické profily [19]. Naproti tomu odběr a analýza endometriálního sekretu nebo cervikálního hlenu je méně invazivní alternativou než biopsie a je schopna poskytnout komplexní obraz receptivity endometria díky technikám, jako je hmotnostní spektrometrie.
ZÁVĚR
Receptivita endometria může dnes být hodnocena jak konvenční analýzou transkriptomu pomocí ERA systému, tak i proteomickou analýzou endometriálního sekretomu nebo cervikálního hlenu prostřednictvím hmotnostní spektrometrie. Vzhledem k nejnovějším poznatkům v oblasti fyziologie endometria by bylo vhodné se zaměřit na bližší výzkum biomarkerů účastnících se regulace imunitní odpovědi na úrovni deciduy, signalizace uNK buněk a komunikace mezi buňkami trofoblastu embrya a stromálními buňkami endometria. Kandidátní biomarkery by mohly sloužit jako podklad pro klinickou aplikaci nové alternativní diagnostické metody receptivity endometria.
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. NV-08-00291.
Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Zkratky
ATR3 – activating transcription factor 3
CD82 – cluster of diferenciation 82
CDK – cyklin dependentní kinázy
DIGE – diferenční gelová elektroforéza
ECM – extracelulární matrix
ERA – endometrial receptivity array
GM-CSF – granulocyte-macrophage colony stimulating factor
H.H1 – nucleosome linker histone H1
H3K9me3 – trimethylated lysine 9 on histone H3
HB-EGF – heparin-vázající EGF-like růstový faktor
hCG – lidský chorionový gonadotropin
hEEC – lidské epiteliální buňky endometria
hESC – lidské stromální buňky endometria
HMGB2 – high mobility group box 2
HOXA-10 – homeobox a 10
IGFBP1 – IGF-vázající protein 1 (gen)
IL – interleukin (obecně)
INF-γ – interferon gamma
IP10 – INF-γ indukující 10 kd protein
IVF – in vitro fertilizace
LIF – leukémie inhibující faktor
LMNB1 – lamin B1
MALDI (MS) – matrix-assisted laser desorption/ionization MS
MCP-1 – monocyt chemoatraktant protein
mH2A – histone H2A variant macroH2A
MMP – matrix metaloproteináza (obecně)
MS – mass spectrometry
NOX-4 - NAD(P)H oxidáza 4
p16 – tumour suppresor protein p16 (cyclin-dependent kinase inhibitor 2A)
p53 – tumour suppresor protein p53 (transformation-related protein 53)
PG – prostaglandiny
PRL – prolaktin (gen)
RIF – repeated implantation failure (opakované potrácení)
S100A10 – S100 calcium-binding protein A10 (p11)
SAbG – senescence-associated b-galactosidase
SAHF – senescence-associated heterochromatin formation
SUMO1 – small ubiquitin-like modifier 1
TIMP – tkáňový inhibitor MMP
TNF-α – tumor necrosis factor alpha
uNK – uterine natural killer
VEGF – vascular endothelial growth factor
WOI – window of implantation (implantační okno)
Mgr. Michal Dvořan
Porodnicko-gynekologická klinika
FN a LF UP
I. P. Pavlova 6
779 00 Olomouc
e-mail: michal.dvoran@fnol.cz
Sources
1. Beier, HM., Beier-Hellwig, K. Molecular and cellular aspects of endometrial receptivity. Hum Reprod Update, 1998, 4(5), p. 448–458.
2. Berlanga, O., Bradshaw, HB., Vilella-Mitjana, F., et al. How endometrial secretomics can help in predicting implantation. Placenta, 2011, 32 Suppl. 3, p. S271–S275.
3. Boomsma, CM., Kavelaars, A., Eijkemans, MJ., et al. Endometrial secretion analysis identifies a cytokine profile predictive of pregnancy in IVF. Hum Reprod, 2009, 24(6), p. 1427–135.
4. Brighton, PJ., Maruyama, Y., Fishwick, K., et al. Clearance of senescent decidual cells by uterine natural killer cells in cycling human endometrium. Elife, 2017, 6.
5. Cooper, MA., Fehniger, TA.,Caligiuri, MA. The biology of human natural killer-cell subsets. Trends Immunol, 2001, 22(11), p. 633–640.
6. Cornet, PB., Galant, C., Eeckhout, Y., et al. Regulation of matrix metalloproteinase-9/gelatinase B expression and activation by ovarian steroids and LEFTY-A/endometrial bleeding-associated factor in the human endometrium. J Clin Endocrinol Metab, 2005, 90(2), p. 1001–111.
7. Diaz-Gimeno, P., Horcajadas, JA., Martinez-Conejero, JA., et al. A genomic diagnostic tool for human endometrial receptivity based on the transcriptomic signature. Fertil Steril, 2011, 95(1), p. 50–60, 60 e1–15.
8. Diep, CH., Charles, NJ., Gilks, CB., et al. Progesterone receptors induce FOXO1-dependent senescence in ovarian cancer cells. Cell Cycle, 2013, 12(9), p. 1433–1449.
9. Dominguez, F., Garrido-Gomez, T., Lopez, JA., et al. Proteomic analysis of the human receptive versus non-receptive endometrium using differential in-gel electrophoresis and MALDI-MS unveils stathmin 1 and annexin A2 as differentially regulated. Hum Reprod, 2009, 24(10), p. 2607–2617.
10. Elstein, M., Pollard, AC. Proteins of cervical mucus. Nature, 1968, 219(5154), p. 612–613.
11. Gellersen, B., Brosens, JJ. Cyclic decidualization of the human endometrium in reproductive health and failure. Endocr Rev, 2014, 35(6), p. 851–905.
12. Gellersen, B., Wolf, A., Kruse, M., et al. Human endometrial stromal cell-trophoblast interactions: mutual stimulation of chemotactic migration and promigratory roles of cell surface molecules CD82 and CEACAM1. Biol Reprod, 2013, 88(3), p. 80.
13. Grande, G., Milardi, D., Vincenzoni, F., et al. Proteomic characterization of the qualitative and quantitative differences in cervical mucus composition during the menstrual cycle. Mol Biosyst, 2015, 11(6), p. 1717–1725.
14. Greening, DW., Nguyen, HP., Elgass, K., et al. Human endometrial exosomes contain hormone-specific cargo modulating trophoblast adhesive capacity: insights into endometrial-embryo interactions. Biol Reprod, 2016, 94(2), p. 38.
15. Hannan, NJ., Stephens, AN., Rainczuk, A., et al. 2D-DiGE analysis of the human endometrial secretome reveals differences between receptive and nonreceptive states in fertile and infertile women. J Proteome Res, 2010, 9(12), p. 6256–6264.
16. Hertig, AT., Rock, J., Adams, EC. A description of 34 human ova within the first 17 days of development. Am J Anat, 1956, 98(3), p. 435–493.
17. Horcajadas, JA., Riesewijk, A., Dominguez, F., et al. Determinants of endometrial receptivity. Ann N Y Acad Sci, 2004, 1034, p. 166–175.
18. Chegini, N., Rhoton-Vlasak, A., Williams, RS. Expression of matrix metalloproteinase-26 and tissue inhibitor of matrix metalloproteinase-3 and -4 in endometrium throughout the normal menstrual cycle and alteration in users of levonorgestrel implants who experience irregular uterine bleeding. Fertil Steril, 2003, 80(3), p. 564–570.
19. Chen, JI., Hannan, NJ., Mak, Y., et al. Proteomic characterization of midproliferative and midsecretory human endometrium. J Proteome Res, 2009, 8(4), p. 2032–2044.
20. Chung, HW., Lee, JY., Moon, HS., et al. Matrix metalloproteinase-2, membranous type 1 matrix metalloproteinase, and tissue inhibitor of metalloproteinase-2 expression in ectopic and eutopic endometrium. Fertil Steril, 2002, 78(4), p. 787–795.
21. Jana, SK., Banerjee, P., Mukherjee, R., et al. HOXA-11 mediated dysregulation of matrix remodeling during implantation window in women with endometriosis. J Assist Reprod Genet, 2013, 30(11), p. 1505–1512.
22. Jiang, R., Ding, L., Zhou, J., et al. Enhanced HOXA10 sumoylation inhibits embryo implantation in women with recurrent implantation failure. Cell Death Discov, 2017, 3, p. 17057.
23. Jiang, Y., Yan, G., Zhang, H., et al. Activation of matrix metalloproteinase-26 by HOXA10 promotes embryo adhesion in vitro. Biochem Biophys Res Commun, 2014, 445(3), p. 622–628.
24. Lee, DC., Hassan, SS., Romero, R., et al. Protein profiling underscores immunological functions of uterine cervical mucus plug in human pregnancy. J Proteomics, 2011, 74(6), p. 817–828.
25. Matjusaitis, M., Chin, G., Sarnoski, EA., et al. Biomarkers to identify and isolate senescent cells. Ageing Res Rev, 2016, 29, p. 1–12.
26. Murphy, G., Nagase, H. Progress in matrix metalloproteinase research. Mol Aspects Med, 2008, 29(5), p. 290–308.
27. Nagase, H., Visse, R., Murphy, G. Structure and function of matrix metalloproteinases and TIMPs. Cardiovasc Res, 2006, 69(3), p. 562–573.
28. Navot, D., Scott, RT., Droesch, K., et al. The window of embryo transfer and the efficiency of human conception in vitro. Fertil Steril, 1991, 55(1), p. 114–118.
29. Nevins, JR., Potti, A. Mining gene expression profiles: expression signatures as cancer phenotypes. Nat Rev Genet, 2007, 8(8), p. 601–609.
30. O‘Sullivan, S., Medina, C., Ledwidge, M., et al. Nitric oxide-matrix metaloproteinase-9 interactions: biological and pharmacological significance – NO and MMP-9 interactions. Biochim Biophys Acta, 2014, 1843(3), p. 603–617.
31. Parmar, T., Gadkar-Sable, S., Savardekar, L., et al. Protein profiling of human endometrial tissues in the midsecretory and proliferative phases of the menstrual cycle. Fertil Steril, 2009, 92(3), p. 1091–1103.
32. Pilka, R., Noskova, V., Domanski, H., et al. Endometrial TIMP-4 mRNA is expressed in the stroma, while TIMP-4 protein accumulates in the epithelium and is released to the uterine fluid. Mol Hum Reprod, 2006, 12(8), p. 497–503.
33. Pilka, R., Whatling, C., Domanski, H., et al. Epithelial expression of matrix metalloproteinase-26 is elevated at mid-cycle in the human endometrium. Mol Hum Reprod, 2003, 9(5), p. 271–277.
34. Ponnampalam, AP., Weston, GC., Trajstman, AC., et al. Molecular classification of human endometrial cycle stages by transcriptional profiling. Mol Hum Reprod, 2004, 10(12), p. 879–893.
35. Quenby, S., Brosens, JJ. Human implantation: a tale of mutual maternal and fetal attraction. Biol Reprod, 2013, 88(3), p. 81.
36. Rajagopalan, S., Long, EO. Cellular senescence induced by CD158d reprograms natural killer cells to promote vascular remodeling. Proc Natl Acad Sci U S A, 2012, 109(50), p. 20596–20601.
37. Salker, MS., Nautiyal, J., Steel, JH., et al. Disordered IL-33/ST2 activation in decidualizing stromal cells prolongs uterine receptivity in women with recurrent pregnancy loss. PLoS One, 2012, 7(12), p. e52252.
38. Takano, M., Lu, Z., Goto, T., et al. Transcriptional cross talk between the forkhead transcription factor forkhead box O1A and the progesterone receptor coordinates cell cycle regulation and differentiation in human endometrial stromal cells. Mol Endocrinol, 2007, 21(10), p. 2334–2349.
39. Talbi, S., Hamilton, AE., Vo, KC., et al. Molecular phenotyping of human endometrium distinguishes menstrual cycle phases and underlying biological processes in normo-ovulatory women. Endocrinology, 2006, 147(3), p. 1097–1121.
40. Ulcova-Gallova, Z., Pesek, M., Chaloupka, P., et al. [Screening of endometrial NK cells in selected infertile patients First part – Methods and current results]. Ces Gynek 2017, 82(5), p. 366–371.
41. Weimar, CH., Kavelaars, A., Brosens, JJ., et al. Endometrial stromal cells of women with recurrent miscarriage fail to discriminate between high- and low-quality human embryos. PLoS One, 2012, 7(7), p. e41424.
42. Wilcox, AJ., Baird, DD., Weinberg, CR. Time of implantation of the conceptus and loss of pregnancy. N Engl J Med, 1999, 340(23), p. 1796–1799.
43. Wilkins-Port, CE., Higgins, SP., Higgins, CE., et al. Complex regulation of the pericellular proteolytic microenvironment during tumor progression and wound repair: functional interactions between the serine protease and matrix metalloproteinase cascades. Biochem Res Int, 2012, 2012, p. 454368.
44. Zhang, J., Dunk, CE., Lye, SJ. Sphingosine signalling regulates decidual NK cell angiogenic phenotype and trophoblast migration. Hum Reprod, 2013, 28(11), p. 3026–3037.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2018 Issue 4
Most read in this issue
- Late morbidity in cesarean section scar syndrome
- Implantation and diagnostics of endometrial receptivity
- Zoon vulvitis – a rare form of chronic inflammation of the vulva
- Possibilities and real meaning of assessment of ovarian reserve
