Kompletní mola hydatidosa u perimenopauzální pacientky imitující zhoubný nádor dělohy
Complete hydatidiform mole in perimenopausal patient imitating uterine cancer
Case report of a perimenopausal patient with
histologically confirmed molar pregnancy, which was
imitating a malignant tumor of the uterus according to
an ultrasound examination.
Design: Case report.
Setting: Department of Obstetrics and Gynecology,
Masaryk University, University Hospital Brno.
Case report: The 51-year-old patient went to the gynecological
clinic for a month of spotting. A large tumor
was described during the ultrasound examination. It was
without an obvious invasion of the myometrium, but
significantly oppressing it. Dilatation and curettage were
indicated, which brought a surprising result – complete
hydatidiform mole. The patient wished to preserve the
uterus, so the treatment was completed by vacuum
aspiration and curettage of the uterus under ultrasound
control to remove all the rest material. The patient was
monitored at regular intervals until β-hCG negativity.
Currently, there are no signs of disease recurrence three
years after the procedure.
Conclusion: Gestational trophoblastic disease is relatively
rare in women in the peri- and postmenopausal
period, however, it is advisable to keep this diagnosis in
mind and complete β-hCG examination in the case of a
suspicious ultrasound image. Hysterectomy dominates
as the treatment method even in benign forms of the
disease. A vacuum aspiration/curettage of the uterus
with subsequent careful follow up can be alternative
option.
Keywords:
complete hydatidiform mole – gestational trophoblastic disease – perimenopausal bleeding
Authors:
Petra Bretová 1
; Luděk Kostka 2
; J. Hausnerová 3; Vít Weinberger 1
Authors‘ workplace:
Gynekologicko‑porodnická klinika LF MU a FN, Brno, přednosta doc. MUDr. V. Weinberger, Ph. D.
1; Lékařská fakulta Masarykovy univerzity, Brno, rektor prof. MUDr. M. Repko, Ph. D.
2; Ústav patologie FN Brno a LF MU, přednosta doc. MUDr. L. Křen, Ph. D.
3
Published in:
Ceska Gynekol 2020; 85(5): 314-318
Category:
Case Report
Overview
Cíl práce: Popis případu perimenopauzální pacientky
s histologicky potvrzeným molárním těhotenstvím,
které podle ultrazvukového vyšetření imitovalo zhoubný
nádor dělohy.
Typ studie: Kazuistika.
Název a sídlo pracoviště: Gynekologicko-porodnická
klinika LF MU a FN Brno.
Vlastní pozorování: Pacientka ve věku 51 let se dostavila
do gynekologické ambulance pro měsíc trvající špinění.
Během ultrazvukového vyšetření byl popsán objemný
tumor bez jednoznačné invaze do myometria, ale výrazně
jej utlačující. Byla indikována diagnostická separovaná
abraze, která přinesla překvapivý výsledek – kompletní
mola hydatidosa. Pacientka si přála ponechání dělohy,
proto byl výkon dokončen vakuumaspirací a kyretáží
dělohy pod ultrazvukovou kontrolou k odstranění veškerého
materiálu. Dále byla pacientka sledována v pravidelných
intervalech až do negativity β-hCG. Aktuálně
je tři roky po zákroku bez známek recidivy onemocnění.
Závěr: Gestační trofoblastická nemoc je u žen v peria
postmenopauzálním období poměrně vzácná, nicméně
je vhodné mít tuto diagnózu na paměti a v případě
suspektního UZ obrazu doplnit též odběr β-hCG. Při léčbě
těchto pacientek dominuje provedení hysterektomie
i u benigních forem. Alternativou je vakuumaspirace/
kyretáž dělohy a následná pečlivá dispenzarizace.
Klíčová slova:
gestační trofoblastická nemoc – kompletní mola hydatidosa – perimenopauzální krvácení
ÚVOD
Gestační trofoblastická nemoc (GTD, gestational trophoblastic disease) je skupina onemocnění, která je charakterizována abnormální proliferací placentárního trofoblastu a abnormálním embryonálním vývojem. Všechny typy GTD mají svůj původ v placentárním trofoblastu. Nejčastější formou onemocnění je mola hydatidosa (kompletní nebo parciální), která pro svůj maligní potenciál bývá někdy označována jako premaligní stadium. V 15–20 % případů kompletní moly a u méně než 5 % parciální moly mohou následovat invazivnější formy onemocnění [4, 7, 13]. Jedná se o maligní skupinu tumorů nazývanou jako gestační trofoblastická neoplazie (GTN, gestational trophoblastic neoplasia), kam se řadí invazivní mola, choriokarcinom (CC), trofoblastický tumor placentárního lůžka (PSTT, placental site trophoblastic tumor) a epiteloidní trofoblastický tumor (ETT, epitheloid trophoblastic tumor) [4, 8] (schéma 1).
GTD – gestační trofoblastická nemoc, GTN – gestační trofoblastická
neoplazie, PSTT – trofoblastický tumor placentárního lůžka, ETT –
epiteloidní trofoblastický tumor

V rámci diagnostiky molárního těhotenství se ultrazvukové vyšetření (UZ) řadí k metodám první volby. Jedná se často o náhodný nález u asymptomatických pacientek, jež podstupují rutinní UZ vyšetření v prvním trimestru, nebo se může jednat o pacientky, které udávají vaginální krvácení nebo mají hladinu hCG vyšší, než by odpovídala týdnu těhotenství [1, 13]. S rozvojem a dostupností UZ je tak mola hydatidosa diagnostikována časněji a samotný ultrazvukový nález je závislý na gestačním stáří.
Pro GTD je typická produkce lidského choriogonadotropinu (hCG) a jeho vysoká hladina je často první známkou možného výskytu gestační trofoblastické nemoci. Sérový β-hCG je vynikající biomarker progrese samotného onemocnění, reakce na léčbu i následného sledování po léčbě [10, 12]. Zatímco u moly hydatidosy, invazivní moly a choriokarcinomu je produkce β-hCG výrazná, tak u PSTT a ETT je produkce nízká [11].
Kompletní (KMH) a parciální mola (PMH) se od sebe liší morfologicky a geneticky. Na počátku onemocnění stojí patologická fertilizace následovaná nadměrnou proliferací trofoblastu blastocysty. Kompletní mola je ve většině případů diploidní útvar. V 80–90 % případů vzniká za situace, kdy je prázdné vajíčko oplodněno haploidní spermií, která se následně reduplikuje (v tomto případě bude karyotyp 46, XX nebo 46, YY) nebo za situace, kdy je prázdné vajíčko oplodněno dvěma spermiemi za vzniku diploidního útvaru (46, XY nebo 46, XX). V obou případech je vzniklý genetický materiál kompletně paternálního původu [2, 6]. Parciální mola je triploidní útvar (69, XXX nebo 69, XXY). Haploidní vajíčko je oplodněno dvěma spermiemi, vzácně je haploidní vajíčko oplodněno diploidní spermií [7].
Možnosti léčby u GTD jsou závislé na typu a stadiu onemocnění a zahrnují kyretáž s vakuumaspirací, chemoterapii, hysterektomii či kombinaci výše zmíněných. Kyretáž s vakuumaspirací je obecně indikována u molárního těhotenství a také v případech, kdy si pacientka přeje fertilitu zachovávající postup. Důležitá je také pooperační monitorace pacientky pro brzký záchyt recidivy. V případě chemoterapie se běžně užívá metotrexát, aktinomycin D, etoposid, cyklofosfamid, vinkristin a cisplatina. U chemorezistentních případů a starších pacientek lze zvážit hysterektomii [3].
Incidence molárního těhotenství se pohybuje ve většině rozvinutých zemí mezi 1–3 případy na 1000 těhotenství [3, 12]. Prezentujeme vzácný případ kompletní moly hydatidosy u ženy v perimenopauzálním období imitující zhoubný nádor dělohy, ale s histopatologickým korelátem molárního těhotenství.
VLASTNÍ POZOROVÁNÍ
Pacientka ve věku 51 let, gravida 2, para 2 (před 30 a 26 lety – spontánní porody v termínu, záhlavím, bez komplikací), přichází do gynekologické ambulance pro měsíc trvající špinění. Při vaginálním a abdominálním sonografickém vyšetření je nalezena zvětšená děloha (130×80×70 mm) se suspektním tumorem, který vykazuje mnohočetné degenerativní změny, roste polypoidně a zevnitř roztlačuje dutinu dělohy, color score 3. Nejeví jasné známky invaze do myometria, ale to je ztenčeno dominantně na přední stěně až na 4–5 mm. Ovaria normální velikosti i echogenity, okolí dělohy bez patologického nálezu. Retroperitoneum malé pánve bez lymfadenopatie, rektosigma volné, močový měchýř volný, ascites není, serózy hladké (obr. 1, 2).
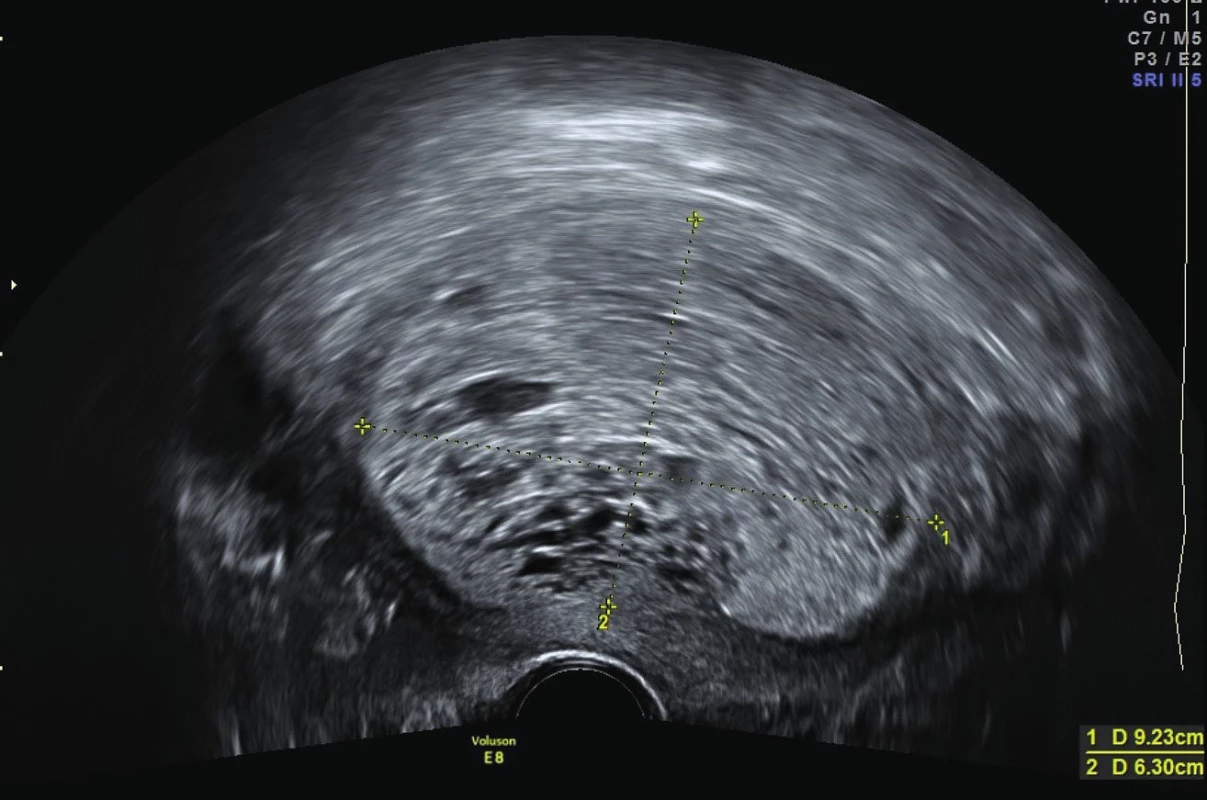
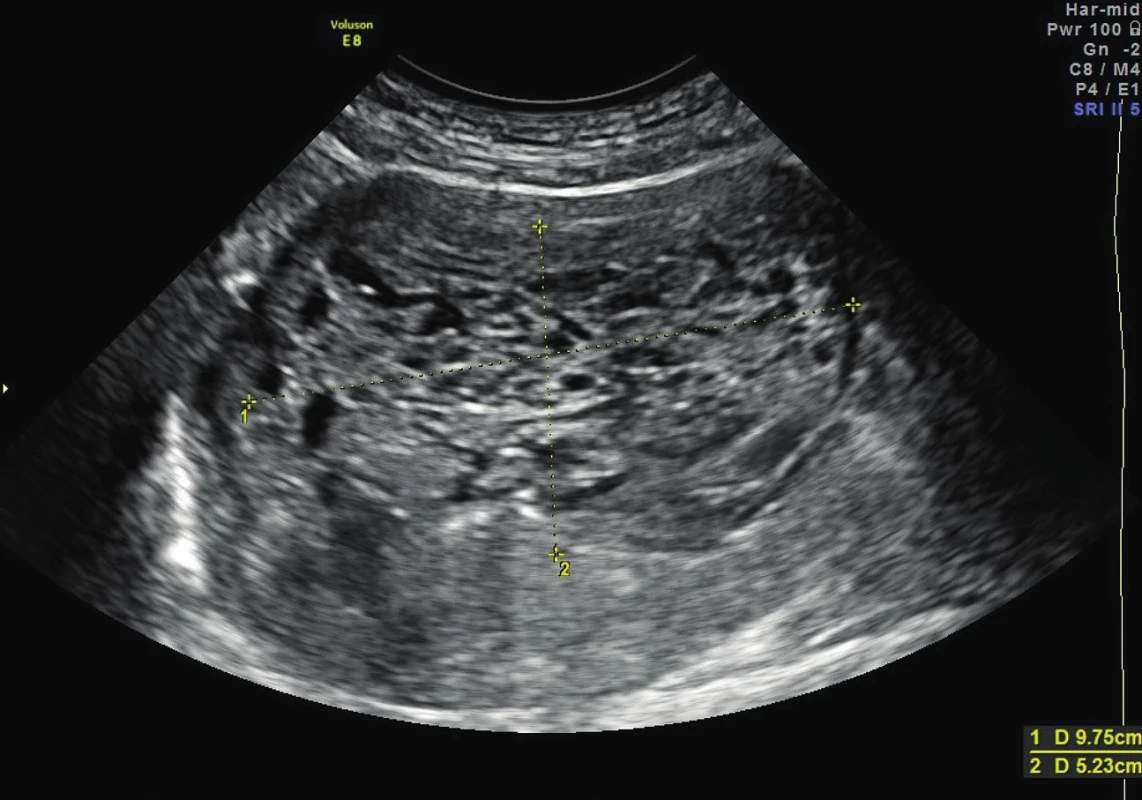
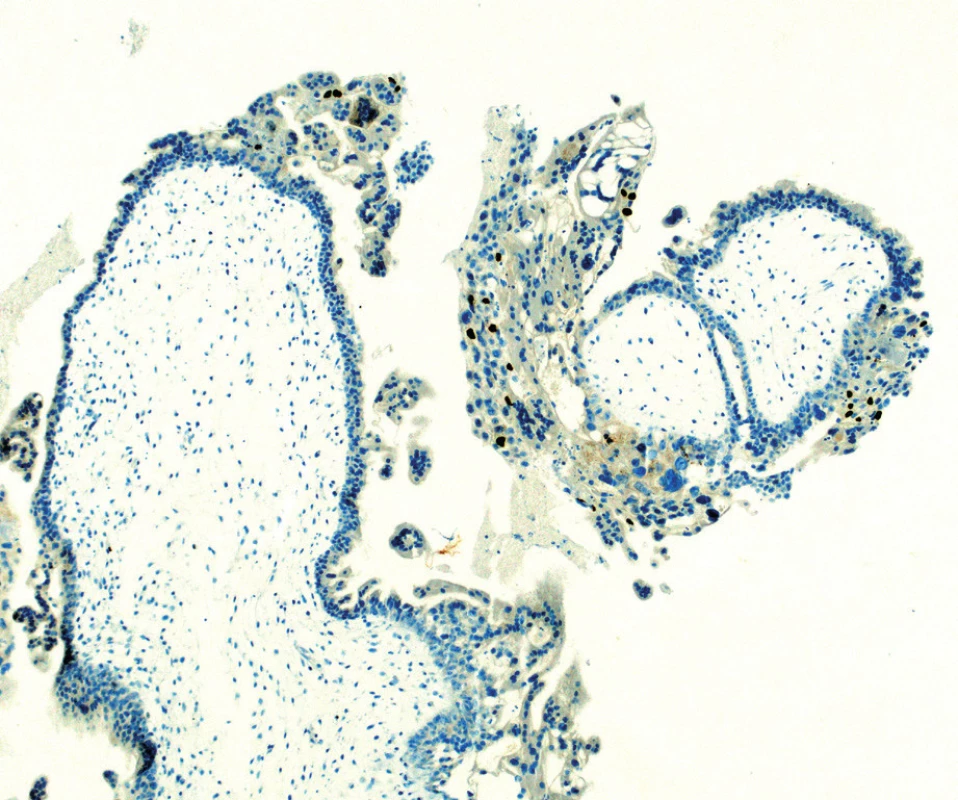
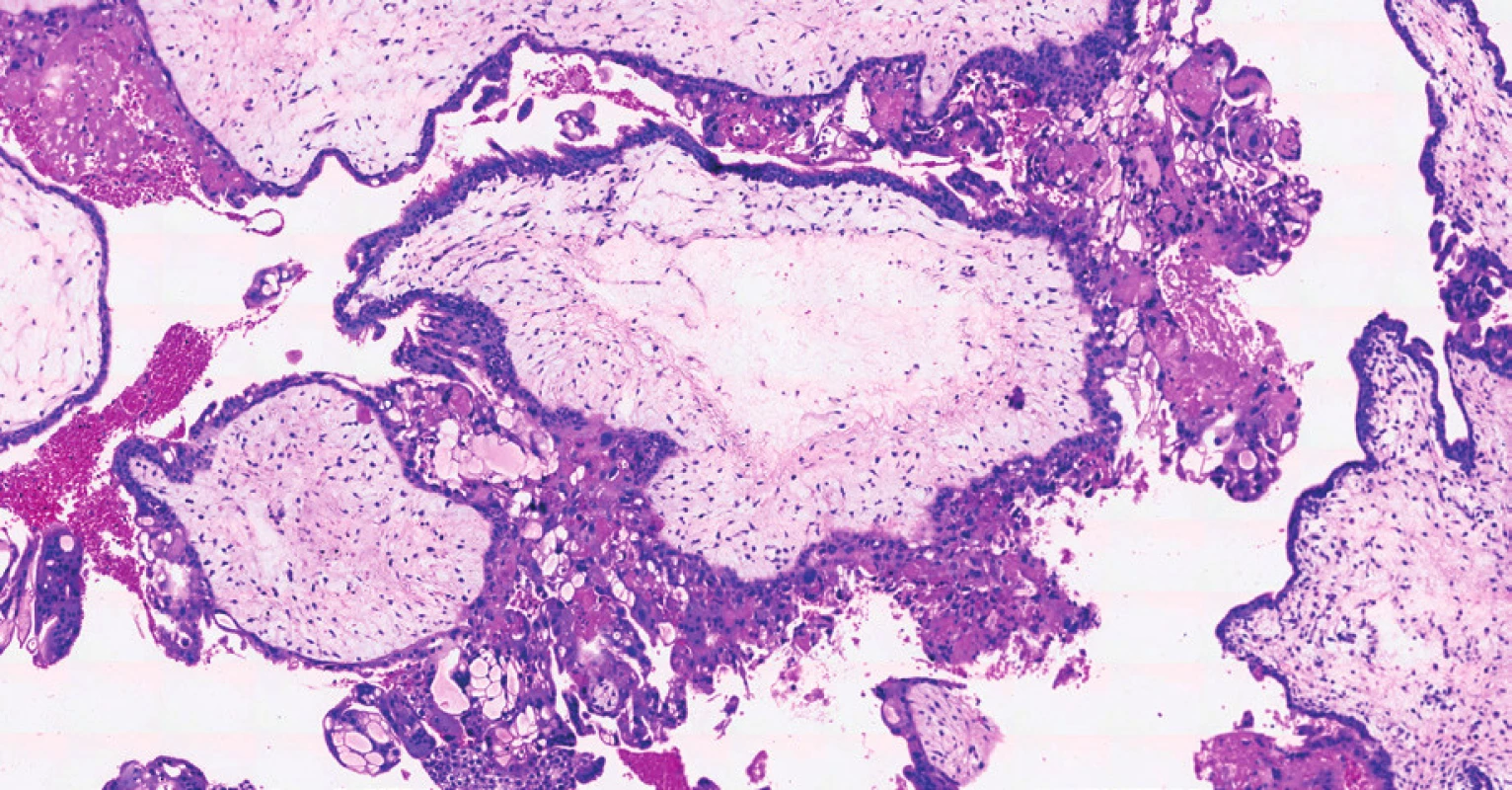
Vzhledem k nálezu suspektního tumoru děložního těla byla indikována diagnostická separovaná abraze. Z děložní dutiny byl získán suspektní drolící se hrozníčkovitý materiál. Makroskopicky se jednalo o objemný materiál charakteru blanité, drobně hrozníčkovité i cisternovité tkáně a krevních koagul. Mikroskopické vyšetření ukázalo typické histopatologické znaky kompletní moly hydatidosy s hydropicky zvětšenými choriovými klky a fokální až difuzní hyperplazií trofoblastu. Karyorhexe byla přítomna v buňkách stromatu klků. V cytotrofoblastu a ve vilózních stromálních buňkách byla úplná absence pozitivity imunohistochemického markeru p57. V daném materiálu se jednalo o nález časné kompletní moly hydatidosy (obr. 3, 4).
Kompletní mola hydatidosa. Vilózní cytotrofoblast a buňky
stromatu jsou negativní na imunohistochemii p57. Intermediální
trofoblast slouží jako vnitřní pozitivní kontrola.
Kompletní mola hydatidosa s hydropicky zvětšenými choriovými
klky a s centrální tvorbou cisteren. Nepravidelná, nahodilá
proliferace vilózního trofoblastu.
Byla indikována vakuumaspirace a revize děložní dutiny jako terapeutický výkon pod ultrazvukovou kontrolou k odstranění veškerého materiálu. Odstranění dělohy si pacientka nepřála. Následně byla sledována za pravidelných kontrol hladin β-hCG a ultrazvukovým vyšetřením. Hladina sérového β-hCG klesla z počátečních hodnot 630 000 na 0 U/l po 34 týdnech (graf 1). Aktuálně je pacientka tři roky od výkonu, bez známek recidivy onemocnění.

DISKUSE
Gestační trofoblastická nemoc je typická pro ženy v reprodukčním věku. Vzácně se však můžeme setkat s tímto onemocněním v perimenopauzálním či postmenopauzálním období, kde častěji probíhá pod obrazem gestační trofoblastické neoplazie. Tsukamto a kol. v roce 1985 zveřejnili studii s 20 případy GTD u žen starších než 50 let. Celkem 35 % z nich mělo molu hydatidosu, invazivní molu 40 % a 25 % choriokarcinom [14]. Od té doby jsou publikovány spíše kazuistické případy.
Mezi typické klinické příznaky patří u kompletní moly vaginální krvácení, zvětšená děloha a hyperemeze. U parciální moly je popisováno vaginální krvácení [13]. Diagnostika gestační trofoblastické nemoci je postavena na ultrazvukovém vyšetření, hladině sérového β-hCG a histologickém vyšetření. Naše pacientka sice měla příznaky nepravidelného krvácení, nicméně vzhledem k věku byl ultrazvukový nález považován spíše za karcinom endometria a β-hCG nebylo zpočátku odebráno. K samotné diagnostice vedl až odběr biologického materiálu separovanou abrazí s následnou histologickou verifikací. Pro možný výskyt GTD i u starších žen je důležité pomýšlet v rámci diferenciální diagnostiky také na toto onemocnění, které může mít v případě maligních forem i letální důsledky.
Histopatologickou diagnostiku může ztížit i menší zkušenost patologa. Podle Golfiera a kol. [3] existuje značný rozdíl v přesnosti diagnostiky molárního těhotenství mezi zkušeným a začínajícím patologem. Uvádí například, že pokud začínající patolog diagnostikoval parciální molu, tak zkušený patolog potvrdil diagnózu pouze v 64 % případů. Dále studie uvádí, že část zkušeností, které umožňují přesnější diagnostiku molárního těhotenství, pozbyli zkušení patologové používáním imunohistochemických markerů, jako je například p57 [3].
V rámci diagnostiky a při sledování po léčbě vyšetřujeme sérovou hladinu β-hCG, která je přibližně u 50 % pacientek s kompletní molou nad 100 000 U/l. U parciální moly se setkáváme v předoperačním období s hodnotou nad 100 000 U/l v méně než 10 % případů [7, 13]. Po evakuaci molárního těhotenství je doporučení sledovat hladiny β-hCG v séru v týdenním intervalu do poklesu k negativitě [5]. V sérii 45 případů parciální moly hydatidosy bylo do čtyř týdnů dosaženo negativity u 57 %, do šesti týdnů u 89 % případů. U parciální moly je vhodné kontrolovat hladinu β-hCG po dosažení negativity v měsíčním intervalu třikrát [5]. V souboru 46 sledovaných pacientek s kompletní molou bylo dosaženo negativity u 28 %, do šesti týdnů u 78 % případů. Po dosažení negativity je vhodné sledovat hladinu β-hCG v měsíčním intervalu šestkrát [5]. Při neadekvátním poklesu nebo naopak vzestupu hladiny β-hCG nebo při maligních formách GTD je vhodné pacientku referovat do centra specializujícího se na gestační trofoblastickou nemoc.
Pro riziko malignizace většina autorů u pacientek v peri- a postmenopauzálním období volí jako léčebnou metodu hysterektomii [9], naše pacientka však odstranění dělohy odmítla a preferovala pečlivou dispenzarizaci.
ZÁVĚR
Gestační trofoblastická nemoc je u žen v peri- a postmenopauzálním období poměrně vzácná, častěji se pak vyskytuje její maligní forma. Nicméně je vhodné mít tuto diagnózu na paměti a v případě suspektního UZ obrazu doplnit též odběr β-hCG. Vhodnou léčebnou metodou je u těchto starších pacientek definitivní operační řešení ve smyslu hysterektomie i u benigních forem GTD. U pacientek, které tuto možnost neakceptují, je důležité kompletní odstranění materiálu z děložní dutiny vakuumaspirací/kyretáží a následná dispenzarizace se sledováním hodnot β-hCG.
Práce vznikla za podpory Ministerstva zdravotnictví ČR – RVO (FNBr 65269705).
Doc. MUDr. Vít Weinberger, Ph.D.
Gynekologicko-porodnická klinika LF MU a FN Brno
Jihlavská 20
625 00 Brnoe-mail: Weinberger.Vit@fnbrno.cz
Sources
1. Benson, CB., Genest, DR., Bernstein, MR., et al. Sonographic appearance of first trimester complete hydatidiform moles. Ultrasound Obstet Gynecol, 2000, 16(2), p. 188–191.
2. Ghassemzadeh, S., Kang, M. Hydatidiform mole. In: StatPearls. Treasure Island (FL): StatPearls Publishing; June 29, 2020.
3. Golfier, F., Clerc, J., Hajri, T., et al. Contribution of referent pathologists to the quality of trophoblastic diseases diagnosis. Hum Reprod, 2011, 26(10), p. 2651–2657.
4. Heller, DS. Update on the pathology of gestational trophoblastic disease. APMIS, 2018, 126(7), p. 647–654.
5. Heřman, J., Rob, L., Robová, H., et al. Molární těhotenství z pohledu patologa a klinika. Čes Gynek, 2019, 84(6), s. 418–424.
6. Kubelka-Sabit, KB., Prodanova, I., Jasar, D., et al. Molecular and immunohistochemical characteristics of complete hydatidiform moles. Balkan J Med Genet, 2017, 20(1), p. 27–34.
7. Lurain, JR. Gestational trophoblastic disease I: epidemiology, pathology, clinical presentation and diagnosis of gestational trophoblastic disease, and management of hydatidiform mole. Am J Obstet Gynecol, 2010, 203(6), p. 531–539.
8. Lurain, JR. Gestational trophoblastic disease II: classification and management of gestational trophoblastic neoplasia. Am J Obstet Gynecol, 2011, 204(1), p. 11–18.
9. Mehrotra, S., Singh, U., Chauhan, S. Molar pregnancy in postmenopausal women: a rare phenomenon. BMJ Case Reports, 2012, 2012, bcr2012006213.
10. Ngan, HYS., Seckl, MJ., Berkowitz, RS., et al. Update on the diagnosis and management of gestational trophoblastic disease. Int J Gynaecol Obstet, 2018, 143, Suppl 2, p. 79–85.
11. Santaballa, A., García, Y., Herrero, A., et al. SEOM clinical guidelines in gestational trophoblastic disease (2017). Clin Transl Oncol, 2018, 20(1), p. 38–46.
12. Seckl, MJ., Sebire, NJ., Berkowitz, RS. Gestational trophoblastic disease. Lancet, 2010, 376(9742), p. 717–729.
13. Shaaban, AM., Rezvani, M., Haroun, RR., et al. Gestational trophoblastic disease: clinical and imaging features. Radiographics, 2017, 37(2), p. 681–700.
14. Tsukamoto, N., Iwasaka, T., Kashimura, Y., et al. Gestational trophoblastic disease in women aged 50 or more. Gynecol Oncol, 1985, 20(1), p. 53–61.
15. Yuk, JS., Baek, JC., Park, JE., et al. Incidence of gestational trophoblastic disease in South Korea: a longitudinal, population-based study. Peer J, 2019, 7, p. e6490.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2020 Issue 5
Most read in this issue
- Clinical significance of routine ultrasound screening of fetal growth restriction in third trimester of pregnancy
- Bilateral salpigektomy as a sterilization method – ovarian cancer prevetion and a rare complication
- Complete hydatidiform mole in perimenopausal patient imitating uterine cancer
- Cervical mucus and its role in reproduction
