Vrozený deficit antitrombinu a gravidita – závažný trombofilní stav ohrožující matku i plod
Hereditary antithrombin deficiency in pregnancy – severe thrombophilic disorder as a danger for mother and foetus
Setting: In the article, we remember the role of antithrombin (AT) in hemostasis, escalation of AT-potential with heparin and difficulties with monitoring the effectiveness of LMWH therapy (low molecular weight heparin) in patients with AT deficiency. We pay most of our attention to hereditary AT deficiency and its thromboembolic risk in pregnancy.
Methods: In the introduction, the principle of AT function, its two main domains and the regulation of synthesis are cleared. We describe the causal mutations of hereditary AT deficiency in SERPINC1 gen and the relation to a thromboembolic risk. The general recommendations for patients with hereditary AT deficiency and pregnant women are mentioned. As the risk of thromboembolic disease is escalated in pregnancy, the LMWH should always be considered. There has been frequently observed that patients with AT deficiency do not elevate anti-Xa-levels when standard prophylactic LMWH doses are used. This fact well illustrates that heparin without AT may not inhibit the active coagulant factors efficiently enough. Therefore, if a high thromboembolic risk in the patient’s anamnesis is present, the LMWH dosing should be escalated. In individual cases, concomitant administration of an antithrombin concentrate to the heparin treatment is recommended at the time of delivery or in the case of deep venous thrombosis. In this article, three cases of unusual pregnancy in patients with different types of AT deficiency are reported. The case reports are summarized from the Department of Hematology at Hospital Kolín, the Centre of Hemostasis and Thrombosis at Institute of Hematology and Blood Transfusion in Prague and from cooperating obstetrical departments in the Czech Republic.
Results: We demonstrated the threat of hereditary AT deficiency in three case reports. In one case, the estimated risk of thromboembolism – type I of AT-deficiency (quantitative) – was in a good correlation with real peripartal complications. In the next two cases with different types of AT deficiency, we showed surprising courses of complicated pregnancies.
Conclusion: As it has been shown, it is not safe to estimate the risk of thromboembolism on the base of causal mutation for AT deficiency. For present clinical practice, we should still remember AT deficiency as a potentially very dangerous thromboembolic disorder for mother and fetus; thus, excellent cooperation of an obstetrician and a hematologist is necessary.
Keywords:
antithrombin – Heparin – antithrombin deficiency – gen SERPINC1 – Thromboembolism – antithrombotic prophylaxis – anti-Xa – aPTT – disseminated intravascular coagulopathy – consumptive coagulopathy
Authors:
Čápová Irena 1,2; Salaj Peter 1; Hrachovinová Rid 1
Authors‘ workplace:
Centrum pro trombózu a hemostázu, Ústav hematologie a krevní transfuze, Praha
1; Transfuzní a hematologické oddělení, Oblastí nemocnice Kolín a. s.
2
Published in:
Ceska Gynekol 2021; 86(3): 175-182
Category:
doi:
https://doi.org/10.48095/cccg2021175
Overview
Cíl práce: Objasnění klíčové role antitrombinu (AT) v hemostáze, možnosti eskalace jeho účinku hepariny a úskalí kontroly efektu této léčby při deficitu AT. Seznámení s typy hereditárního deficitu AT, jejich molekulární podstatou a odvozeným odhadem trombembolického rizika. Deficit AT v klinické praxi se zaměřením na těhotenství.
Metodika: V úvodu je čtenář seznámen s principem antitrombotické funkce AT, s jeho klíčovými funkčními doménami a regulací syntézy. Okrajově se dotkneme v praxi častěji vídaného získaného deficitu AT, a to v souvislosti s konzumpčními koagulopatiemi. Pozornost jsme pak zaměřili zejména k vrozenému deficitu AT, což je potenciálně velmi nebezpečný trombofilní stav. V práci čtenáře seznámíme s typy I a II hereditárního deficitu AT, s kauzálními mutacemi v genu SERPINC1 a vysvětlíme rozdíl v jejich odhadním riziku trombembolické nemoci (TEN). V návaznosti pak nastíníme obecné hematologické přístupy k AT-deficientním pacientům bez ohledu na pohlaví. Protože ženy s deficitem AT v graviditě či v puerperiu mají riziko TEN dále násobené, vždy u nich zvažujeme profylaxi nízkomolekulárním heparinem (LMWH – low moleculary weight heparin). V praxi pak tato léčba nezřídka naráží na zádrhel, že pacientky nereagují adekvátním nárůstem anti-Xa na běžné profylaktické dávky LMWH odhadnuté dle hmotnosti. V přiložených kazuistických sděleních, která jsou sumarizována z hematologické ambulance Oblastní nemocnice Kolín, a. s., Centra pro trombózu a hemostázu Ústavu hematologie a krevní transfuze a spolupracujících gynekologicko-porodnických pracovišť, pak ilustrujeme nezbytnost eskalace dávek LMWH a doporučení peripartálních intravenózních aplikací AT dle individuálního rizika TEN.
Výsledky: Popisem tří komplikovaných gravidit jsme demonstrovali nebezpečí hereditárního deficitu AT pro matku i plod. V jedné, edukačně názorné, kazuistice pacientka s rizikovým typem deficitu AT (kvantitativní deficit, typ I) prodělala v graviditě recidivující TEN, která vyústila v nezbytnost ukončení porodu akutním sectio caesarea. V dalších dvou kazuistikách jsme pak ukázali, že odhad rizika TEN jen dle typu kauzální mutace pro deficit AT může být zavádějící – hlubokou žilní trombózu asociovanou s graviditou prodělala mladá žena s teoreticky příznivějším typem AT deficitu (typ IIB s mutací domény vážící heparin v heterozygotní konstituci), a naopak riziková pacientka s kvantitativním deficitem AT typu I zůstala i přes nedokonale vedenou peripartální léčbu a pozitivní rodinnou anamnézu bez trombembolických komplikací.
Závěr: I přes stále lepší možnosti diagnostiky typů hereditárního deficitu AT je zatím příliš brzy na odhady rizika TEN a porodních komplikací dle typu deficitu AT a jeho molekulárně genetické příčiny. Pro klinickou praxi by v tuto chvíli měl deficit AT (vrozený, ale i získaný) zůstat varovným a potenciálně velmi rizikovým trombofilním stavem, který si žádá efektivní spolupráci porodníka a hematologa.
Klíčová slova:
antitrombin – Heparin – deficit antitrombinu – gen SERPINC1 – trombembolická nemoc – anti-Xa – aPTT – diseminovaná intravaskulární koagulopatie – konzumpční koagulopatie – antitrombotická profylaxe
Úvod
Antitrombin (AT) je glykoprotein ze skupiny serpinů (inhibitorů serinových proteáz) syntetizovaný v játrech. Je jedním z nejdůležitějších přirozených inhibitorů aktivované koagulační kaskády. Cílovými místy jeho inhibičního působení jsou zejména trombin (FIIa) a aktivovaný faktor X (FXa), o něco méně pak faktory kontaktní fáze, faktory vnitřního systému a komplex faktor VIIa/tkáňový faktor (obr. 1). Komplexy AT s inhibovanými koagulačními faktory jsou odbourávány v retikuloendoteliálním systému, bez návratu AT zpět do cirkulace [1,2].
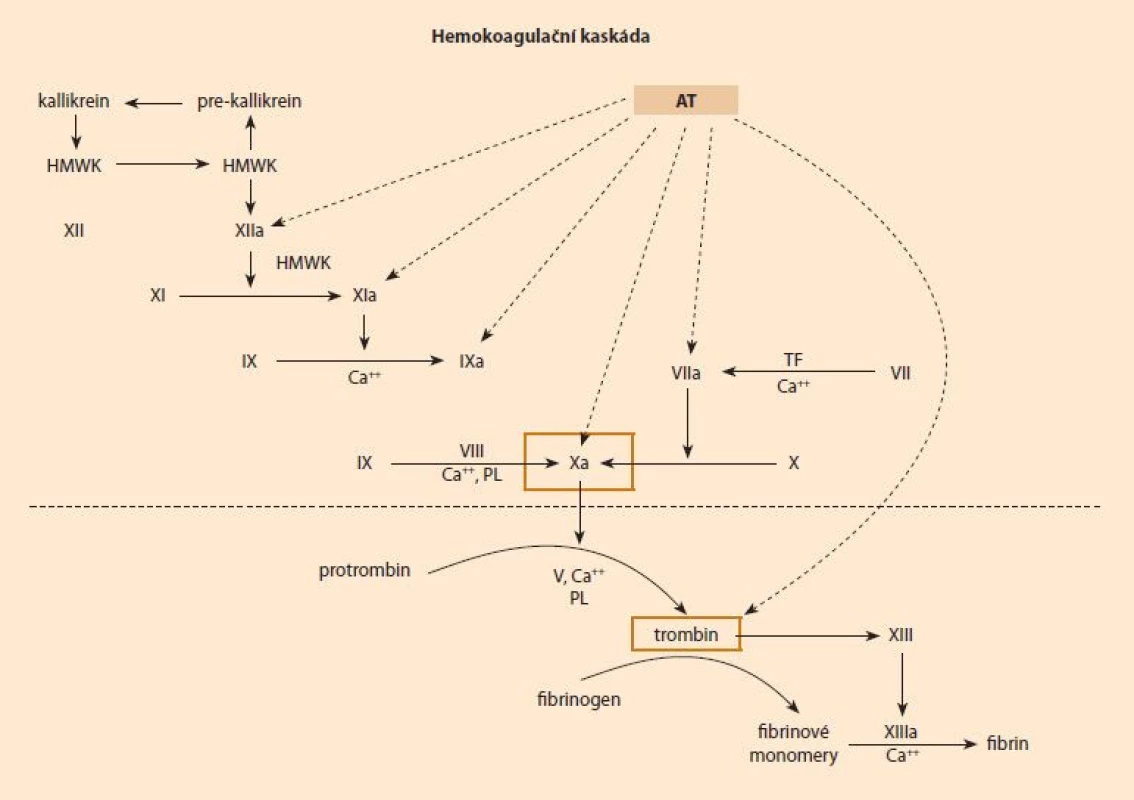
Aktivita AT v plazmě je u dospělých 80–120 %. Biologický poločas AT je u zdravého jedince 2–3 dny, ale při stavech zvýšené konzumpce či léčbě heparinen se rapidně zkracuje, řádově na hodiny [2], antitrombin je negativní reaktant akutní fáze [3]. Gen pro AT (gen SERPINC1) je lokalizován na chromozomu 1q23–25. Regulace syntézy AT je zřejmě navázána na dynamiku syntézy fibrinogenu, a to tak, že při štěpení fibrinogenu během aktivace koagulace přichází signál k další, reaktivní syntéze AT [4].
Ve své molekule obsahuje AT dvě funkčně důležité domény. První je reakčním místem pro vazbu trombinu, FXa, případně dalších aktivních koagulačních faktorů (RS – reactive-site). Druhá je doména vážící heparin (HBS – heparin-binding-site), ta po svém obsazení vede ke konformační změně molekuly AT, kterou se usnadní inhibice aktivních koagulačních faktorů. Účinnost AT je velmi výrazně (cca 1 000×) zvýšena heparinem (obr. 2) a jeho příbuznými reagens [5,6]. Dlouhá molekula nefrakcionovaného heparinu (UFH – unfractionated heparin) potencuje více inhibici trombinu, čím je molekula heparinu kratší (LMWH – low moleculary weight heparin, pentasacharidy), tím spíše je usnadňována inhibice FXa než trombinu [1,6].
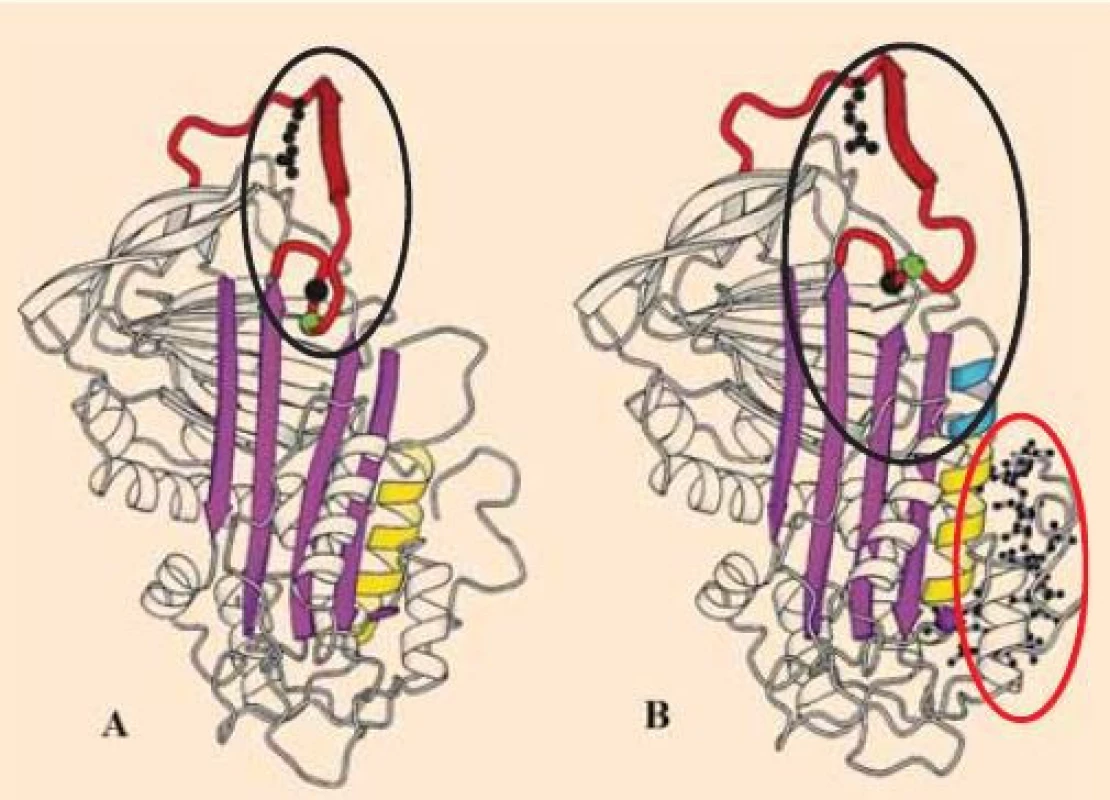
Jak z výše uvedeného plyne, účinky heparinů jsou in vivo závislé na přítomnosti AT, bez něj nemohou svou antikoagulační funkci realizovat, a jsou proto nazývány nepřímými inhibitory trombinu. Vzato do důsledků nelze bez dostatečné aktivity AT v plazmě (ať již při získaném, či vrozeném deficitu) očekávat od heparinů standardní antikoagulační profylaxi. Z praxe se také jeví, že ti AT-deficientní pacienti, kteří na standardní dávky heparinu nereagují žádoucí laboratorní odezvou (růst aPTT, anti-Xa), mohou být bezpečně léčeni vysokými dávkami heparinu bez vysokého rizika krvácení.
K testování efektu UFH na hemostázu je běžně používán aktivovaný parciální tromboplastinový čas (aPTT – activated partial thromboplastin time), pro LMWH je to vyšetření anti-Xa z plazmy odebrané za 3–4 hod po aplikaci LMWH s.c. [3,7–9]. U pacientů s deficitem AT vídáme fenomén, kdy jen neochotně roste hodnota anti-Xa při podávání běžných dávek LMWH. Je to tím, že pokud se heparin, resp. častěji používaný LMWH pro funkční či kvantitativní defekt k molekule AT nenaváže, nedojde k raketové eskalaci inhibice aktivovaných koagulační faktorů, tedy ani Fxa [10,11].
Deficit antitrombinu (< 70 % aktivity) může být získaný nebo vrozený
Získaný deficit AT je v chronické formě typický pro pacienty s hepatopatií, proteinurií, malnutricí, malignitou apod. Subakutní a akutní získaný deficit AT bývá asociován s konzumpčními koagulopatiemi při zánětech, život ohrožujícím krvácení (ŽOK), diseminované intravaskulární koagulopatii (DIC – disseminated intravascular coagulation). Jak již bylo řečeno, AT je negativní reaktant akutní fáze [1].
V praxi se často do sporu dostane lékař-intenzivista a hematolog, zda substituovat AT při koagulopatii asociované s těžkým stavem pacienta, který je navíc ve velkém riziku krvácení. V takovou chvíli je klíčové rozlišit, zda před sebou máme prosté krvácení zapříčiněné úrazovou, poporodní či chirurgickou ztrátou krve, anebo konzumpční koagulopatii typu DIC (ať již asociovanou s HELLP – – hemolysis, elevated liver enzymes, low platelet count syndrome), sepsí, otravou či prolongovanou léčbou prostého krvácení). Obecně lze říci, že při prostém krvácení není substituce AT klíčová pro zástavu krvácení a změnu prognózy pacienta. Pokud již máme koagulopatii metamorfovanou v DIC, je podstatné zastavit tvorbu mikrotrombů, která při DIC masivně probíhá a vede následně ke kritické konzumpci většiny koagulačních faktorů. Spotřebované koagulační faktory pak chybí v místě krvácení a to se nedaří ztišit. K zástavě tvorby mikrotrombů je při probíhající DIC indikováno podání heparinů, které však, jak již bylo výše vysvětleno, svou antikoagulační funkci vykonají jen s dostatečnou aktivitou AT. Proto je tedy potřeba při DIC optimalizovat hladinu AT. Samotné podání AT krvácení nezpůsobí, běžně podávanými dávkami AT nelze „pacienta předávkovat“ a vyvolat nežádoucí krvácení [2]. Pokud krvácení po podání AT u pacienta nastane, nejspíše se jedná o nastupující efekt heparinu, akceleraci primární příčiny krvácení či souhru dalších okolností [3,12].
Vrozený deficit AT nepatří mezi časté trombofilní stavy, ve srovnání s mediálně proslulou mutací FV Leiden v heterozygotní konstituci se v populaci vyskytuje asi 20× řidčeji, tedy s prevalencí 0,02–0,2 %, bez ohledu na pohlaví [6,13]. Je však označován za trombofilní stav závažný, uvádí se, že riziko trombembolické nemoci (TEN) se zvyšuje 5–50×, odds ratio je až 16 (což je pak srovnatelné s rizikem TEN u mutace FV Leiden v homozygotní konstituci) [5,6,9]. Asi 50 % pacientů s hereditárním deficitem AT vyvine TEN do 50 let věku, 60 % z těchto TEN bývá spontánních [11]. V posledních letech ale začíná být zřejmé, že riziko TEN se u AT-deficientních pacientů liší nejen dle hloubky deficitu AT, ale také dle typu deficitu (kvantitativní typu I či kvalitativní typu II) a kauzální mutace [11,13]. K dnešnímu dni je známo již několik stovek mutací v genu pro AT, které zapříčiňují deficit AT. V naprosté většině se jedná o heterozygotní postižení genu, homozygotní bylo popsáno pouze u defektů AT s nedostatečnou vazbou na heparin, tedy mutací HBS domény, u ostatních je neslučitelné se životem [1,13].
Typ I deficitu AT, kvantitativní, je charakterizován snížením měřitelné aktivity i množství antigenu AT v plazmě, a to < 70 %. Samotná molekula AT je ale funkční. Za tímto typem deficitu obvykle stojí non-sence či null-mutace v genu SERPINC1. Až 65 % těchto pacientů vyvine TEN [3].
Typ II deficitu AT je kvalitativní, v populaci 2× častější než typ I [3]. Antigen AT je v normálním množství, měřitelná aktivita AT v plazmě je však < 70 %. Příčinou tohoto deficitu AT bývají missence mutace [13]. U typu II ještě rozlišujeme tři podtypy podle místa postižení v molekule AT:
Typ IIA, kdy je zasažena doména pro vazbu trombinu, resp. aktivovaných koagulačních faktorů (RS), a AT tak jen omezeně plní svou inhibiční funkci při korekci hemostázy, v důsledku čehož je pacient zatížen rizikem TEN podobným jako u deficitu AT typu I (tedy asi 50–60 % z nich vyvine za život TEN [13]).
Typ IIB, kdy je v molekule AT poškozena doména pro vazbu heparinu, pročež se pacientovi jen neochotně zvyšuje funkceschopnost AT při léčbě hepariny. Jelikož má ale AT určitou antikoagulační schopnost i bez exogenního heparinu, riziko TEN je u pacientů s deficitem AT typu IIB a kauzální mutací v heterozygotní konstituci nižší než u typu IIA či I, vyčísleně asi 20–40 % [13]. Při mutaci HBS domény v homozygotní formě je ovšem riziko TEN až 80 % [13].
Typ IIC má mutaci mimo RS či HBS domény AT a riziko TEN je těžko predikovatelné.
Z hematologických guidelines a praxe obecně platí, že pokud pacienti s hereditárním deficitem AT dosud neprodělali trombembolickou příhodu, není u nich automaticky indikována profylaktická antikoagulační léčba – v tomto směru k nim přistupujeme jako k pacientům s jinými trombofilními stavy [13,14].
V našich kazuistikách se budeme věnovat pacientkám gravidním, proto je třeba ještě připomenout, že riziko TEN je u těhotných žen 5–10× vyšší než před graviditou [15,16] a až 60× vyšší poporodně, v dalších 6–12 týdnech po porodu pak klesá [17]. Incidence TEN asociovaných s graviditou je v běžné populaci 1–3: 1 000 rodiček [19].
Asi dvě třetiny všech TEN asociovaných s graviditou je antepartálních, třetina postpartálních [17]. U neléčených pacientek s deficitem AT je výskyt TEN asociovaných s graviditou o 35–50 % vyšší než u zdravých kontrol [3,18]. Podle Macleana mají pacientky s deficitem AT typu I nebo s mutací v HBS v homozygotní formě incidenci TEN odhadovanou až na 1: 2,8 gravidit, pacientky s deficitem AT typu II a kauzální mutací v heterozygotní formě 1: 42. Jsou-li pacientky s deficitem AT adekvátně léčeny, redukuje se jejich riziko TEN o > 75 % [14,19]. Riziko potratu a intrauterinního úmrtí plodu mají pacientky s deficitem AT zvýšeno 2–5× oproti kontrole [3].
Názory na profylaxi TEN u AT-deficientních pacientek, cílové anti-Xa a intravenózní substituci AT nejsou v současné době celosvětově sjednoceny. Rozhodnutí o způsobu léčby těchto pacientek bývá odvislé zejména od jejich osobní a rodinné anamnézy pro výskyt TEN či těhotenských ztrát.
Pokud má pacientka známý deficit AT, ale nikdy neprodělala TEN ona ani její příbuzné, lze pacientku antepartálně jen sledovat a profylaxi LMWH zahájit poporodně, některé zdroje připouští dokonce možnost ji nezahájit vůbec [19]. Podle jiných autorů je naopak doporučováno graviditu a puerperium zajistit profylaktickými dávkami LMWH u všech AT-deficitních pacientek [8].
Má-li pacientka v osobní anamnéze TEN (může a nemusí být dlouhodobě antikoagulována před početím), opakované těhotenské ztráty, případně je-li alarmující její rodinná anamnéza, je v graviditě doporučena léčba LMWH, a to individuálně profylaktickými, adjustovanými až terapeutickými dávkami. Intravenózní podání AT je pak doporučeno zvážit před porodem (většina autorů doporučuje 1–6 hod před porodem, s cílem aktivity AT 80–120 %), zejména při záměru dočasného snížení/přerušení aplikací LMWH k redukci rizika porodního krvácení [11,15,16,20]. Pokud pacientka na profylaktických či adjustovaných dávkách LMWH v graviditě vyvine TEN, je třeba eskalovat LMWH za kontrol anti-Xa na dávky terapeutické a v indikovaných případech lze zvážit i pravidelné antepartální intravenózní aplikace AT (à 2–3 dny) [16]. Poporodně je dle vyhodnocení rizik nezřídka doporučeno opakování infuzí AT ve výši 60 % úvodní dávky (dle laboratorní monitorace aktivity AT), a to po dobu 1–9 dní nebo do nasazení efektivní perorální antikoagulační léčby [16].
Kazuistiky
Kazuistika 1
První kazuistika tohoto sdělení ilustruje naplnění téměř nejhoršího možného scénáře v péči o AT-deficientní gravidní pacientky, s jakým se hematolog a porodník mohou setkat.
Dosud zcela zdravá žena, 24 let, pouze s anamnézou jedné nekomplikované interrupce, byla ve 13. týdnu spontánní gravidity vyšetřena v okresní nemocnici pro bolestivost, lividní zbarvení a otok levé dolní končetiny. Sonograficky byla diagnostikována idiopatická vysoká ileofemorální trombóza a pacientka byla neprodleně zaléčena nadroparinem (Fraxiparine) v dávce dle SPC, tedy při hmotnosti pacientky 62 kg aplikací léku Fraxiparine 0,6 ml 2× denně s.c. (183 IU/kg/den). Při vstupním vyšetření u spádového hematologa bylo zjištěno, že v rodině nebyl dosud žádný výskyt TEN a v rámci vyšetřování trombofilního panelu byla zachycena snížená aktivita AT (43 %). Z provedených vyšetření bylo dále zjevné, že za stávajícího dávkování léku Fraxiparine je dosaženo (vyšetřením ze vzorku odebraného 3 hod po aplikaci LMWH) jen profylaktických hodnot anti-Xa (0,24 IU/ml), přičemž žádoucí při léčbě čerstvé hluboké žilní trombózy (DVT – deep venous thrombosis) by bylo anti-Xa > 0,6 IU/ml. Protože ani dalším navýšením dávek léku Fraxiparine nedosáhla spádová hematoložka anti-Xa > 0,3 IU/ml, empiricky zaměnila nadroparine za bemiparine (Zibor) v dávce 5 000 IU 1× denně s.c. a pacientku ve 26. gtt referovala na vyšší pracoviště. V Ústavu hematologie a krevní transfuze (ÚHKT) v Praze byl verifikován kvantitativní deficit AT (aktivita AT 50 %, antigen AT 48 %), tedy typ I. Podrobným molekulárně genetickým vyšetřením byla diagnostikována heterozygotní mutace ve splice side oblasti exonu 1 genu SERPINC1. Dávka léku Zibor byla navýšena na 7 500 IU 1× denně, čímž bylo dosaženo anti-Xa 0,34 IU/ml, poklesu D-dimerů (DD) z 1 592 na 690 µg/l (norma pro negravidní je 200 µg/l) a plné rekanalizace postižené žíly dle kontrolního sonografického vyšetření. Ve 33. gtt byla pacientka předána zpět do péče spádové nemocnice s doporučením pokračovat v zavedené antitrombotické léčbě a konzultovat s peripartální intravenózní podání AT, neboť k jeho navýšení v graviditě došlo jen o 5–10 % původních hodnot.
Po zbytek gravidity byla pacientka v dobrém klinickém stavu, bez gynekologických či trombembolických komplikací. Ve 41. gtt byla naplánována medikamentózní indukce porodu. V obavě z peripartálního krvácení byla pacientce 3 dny před porodem redukována dávka léku Zibor na 5 000 IU 1× denně s.c. a ten byl naposledy aplikován v den indukce porodu brzy ráno. Intravenózní aplikace AT nebyla konzultována, AT nebyl podán. Bohužel pacientka na snahu o vyvolání porodu reagovala velmi pomalu, a tak ještě za 32 hod od poslední dávky léku Zibor nebyl plod vybaven. V tomto časovém okně došlo k peripartální recidivě ipsilaterální vysoké ileofemorální trombózy manifestující se opět změnou barvy končetiny a úpornými bolestmi. Porod musel být ukončen akutním císařským řezem, bez újmy na zdraví novorozence. Třetí poporodní den byl pacientce zaveden suprarenálně kavální filtr, neboť ošetřující lékaři nedosáhli standardní léčbou LMWH terapeutických hodnot anti-Xa, hematolog nebyl ani tehdy konzultován, AT nebyl nikdy intravenózně podán. V rukou angiologa pak byla pacientka léčena přípravkem Fraxiparine v dávce 1,0 ml 2× denně s.c. (260 IU/kg/den), bez monitorace aktivity AT, anti-Xa dosáhlo maximálních hodnot 0,45 IU/ml. Po 3 měsících od porodu a hraničně uspokojivém kontrolním sonografickém vyšetření žil (posttrombotické nástěnné zesílení stěny) byl kavální filtr extrahován a u pacientky byla zahájena warfarinizace. Další recidivu DVT – tentokrát lýtka levé končetiny – pacientka vyvinula 11 měsíců po porodu při neúčinném INR (international normalization ratio). V další graviditě (právě započaté) k pacientce přistupujeme jako ke krajně rizikové. Léčba je vedena na vyšším pracovišti, a to antepartálně již adjustovanými dávkami LMWH (Clexane forte 0,8 ml 1× denně s.c. při hmotnosti 65 kg) s cílovým anti-Xa okolo 0,5 IU/ml. Peripartální intravenózní aplikaci AT jistě doporučíme, v šestinedělí při nekomplikovaném porodu předpokládáme návrat k warfarinizaci.
Kazuistika 2
Druhá kazuistika referuje gynekologicky nepříznivou graviditu jiné pacientky s tímto rizikovým deficitem AT typu I, tentokrát však stran TEN s překvapivě nekomplikovaným průběhem. Žena, 28 let, pochází z rodiny, kde byl deficit AT znám (ač ne molekulárně geneticky zpřesněn, ale znám). Matka pacientky má hladinu AT 50–60 % a z její anamnézy víme o dvou spontánních abortech (v prvním a druhém trimestru) a dvou hlubokých žilních trombózách, z nichž jedna byla v graviditě a druhá v šestinedělí, nakonec úspěšně porodila čtyři děti. Jedna sestra pacientky prodělala plicní embolii v šestinedělí – nebylo však možné zjistit, zda tato plicní embolie nastala za léčby heparinem a AT, stejně jako nebylo možné doplnit anamnézu druhé sestry a bratra, a to pro rozvrácené rodinné vztahy. Nicméně již tato rodinně-anamnestická data byla pro nás stran rizika TEN v graviditě alarmující. Do ambulance v oblastní nemocnici byla tato pacientka doporučena ošetřujícím gynekologem v 7. týdnu spontánní gravidity. Vstupně jsme odebrali anamnézu a stanovili aktivitu AT na 45 %. DD byly jen s nepatrnou elevací (0,86 – při normě do 0,5 mg/l FEU), klinicky pacientka nejevila známky TEN. Pro rizikovou rodinnou anamnézu a deficit AT byla u pacientky zahájena ihned profylaxe LMWH. Při hmotnosti 89 kg jsme doporučili enoxaparin (Clexane) 0,8 ml 1× denně s.c. (90 IU/kg), a dosáhli tak anti-Xa jen 0,08 IU/ml. Ve spolupráci s ÚHKT byl následně stanoven podtyp deficitu AT – typ I s heterozygotní kompletní delecí kódující oblasti genu SERPINC1 a byla navýšena dávka léku Clexane 1,0 ml (110 IU/kg) za dosažení cíleného profylaktického rozmezí anti-Xa, tedy nad 0,2 IU/ml [7]. Ve 24. gtt byl u pacientky sonograficky zachycen anhydramnion s dolichocefalií plodu, laboratorně paralelně s nárůstem DD (2,13 mg/l FEU) a s výrazným propadem hodnot anti-Xa (na 0,04 IU/ml) při zavedeném dávkování léku Clexane 1,0 ml 1× denně a při jen mírném nárůstu aktivity AT na 51 %. Situace si vynutila navýšení dávky enoxaparinu až na 130 IU/kg, tedy Clexane 0,6 ml forte 1× denně, a pacientka byla z okresního gynekologicko-porodnického oddělení promptně referována na vyšší klinické pracoviště. Hematologické doporučení ke stávající graviditě i pro případ nutnosti ukončení těhotenství bylo formulováno do předávací zprávy – změnit aplikace léku Clexane 0,6 ml forte na Clexane 0,6 ml 2× denně s.c. a těsně před porodem intravenózní podání 3 000 IU AT. Další 3 týdny jsme nebyli kontaktováni pacientkou ani jejími ošetřujícími porodníky, poté se dostavila do naší ambulance ke konzultaci, zda je nutno nadále pokračovat s aplikacemi léku Clexane. Ze zprávy z vyššího gynekologicko-porodnického pracoviště jsme zjistili, že pacientka absolvovala ve 26. gtt fetocidu plodu pro jeho polycystickou degeneraci ledvin následovanou indukcí vaginálního porodu, a to bez peripartálního podání AT a se snížením dávek léku Clexane několik dní před výkonem na 0,4 ml 1× denně. Enormně vysokému riziku TEN pak byla pacientka vystavena úplným přerušením těchto již suboptimálních aplikací LMWH více než 38 hod před fetocidou a porodem. Ani poporodně nebyla na klinice provedena kontrolní koagulační vyšetření a pacientka byla propuštěna na oněch třetinových dávkách léku Clexane, než byly námi doporučené na základě kontrol anti-Xa v graviditě. Pacientka, ač sama simplexní, z našeho poučení očekávala, že bude několik dní aplikovat lék Clexane ve dvou denních dávkách a že jí bude předporodně podán AT intravenózně. Když se pak těchto opatření v porodnici dožadovala, obdržela odpověď, že AT se do žíly nepodává pro riziko krvácení a takto vysoké dávky heparinu jsou nebezpečné, snad prý muselo dojít k omylu hematologa… Při našem kontrolním koagulačním vyšetření týden od indukovaného porodu jsme verifikovali neměřitelně nízké hodnoty anti-Xa vyšetřeného 3 hod po aplikaci léku Clexane 0,4 ml s.c., naštěstí však s elevací DD jen adekvátní probíhajícímu šestinedělí (1,28 mg/l FEU), AT byl v očekávaných hodnotách aktivity jen 43 %. S vědomím rizikové rodinné postpartální anamnézy pro TEN jsme zvýšili dávky léku Clexane na 1,0 ml 1× denně a s takto uspokojivými kontrolními hodnotami anti-Xa (0,19 IU/ml) a bez nežádoucích trombembolických událostí přečkali šestinedělí. Při negativní osobní anamnéze pro TEN pak není u pacientky indikována dlouhodobá antikoagulační léčba/profylaxe. Další graviditu má tato mladá žena v plánu co nejdříve.
Kazuistika 3
Pacientka ze třetí kazuistiky prodělala v prvním trimestru gravidity spontánní DVT, která byla její prvomanifestací TEN a následně vedla k diagnóze deficitu AT, v rodině dosud neznámého. Pacientka, 26 let, byla v 8. gtt spontánní gravidity vyšetřena v okresní nemocnici pro bolestivost levého lýtka, sonograficky byla diagnostikovaná neprovokovaná popliteocrurální DVT. Následně zde byla při své hmotnosti 52 kg zaléčena bemiparinem (Zibor) v dávce o něco nižší než dle SPC, tedy 5 000 IU 1× denně s.c. (92 IU/kg). Při vstupní návštěvě v naší hematologické ambulanci jsme provedli vyšetření trombofilních stavů a doplnili anamnézu – v rodině zjištěn varovný signál, že otec je po recidivujících plicních emboliích! Deficit AT u něj však dosud zachycen nebyl, neboť byl vždy vyšetřován při probíhající antikoagulační léčbě přímými orálními antikoagulancii (DOAC – direct oral anticoagulants), která deficit AT maskovala. U pacientky byla vstupně zachycena snížená aktivita AT 53 % a anti-Xa (0,35 IU/ml) nedosahující zdaleka antikoagulačních hodnot, které jsou při čerstvé DVT žádoucí. Během následných kontrol jsme i přes eskalaci dávek bemiparinu nedosahovali cílených hodnot anti-Xa, pročež byl empiricky vyměněn za enoxaparin (Clexane), a to ve dvou denních dávkách, kdy uspokojivých terapeutických hodnot anti-Xa jsem dosáhli aplikacemi léku Clexane 0,6 ml 2× denně s.c. (cca 110 IU/kg) po 3 týdnech od vzniku DVT. Po kontrolním sonografickém vyšetření žil, kde již byla prokázána plná rekanalizace postižené žíly, byla pacientka převedena na jednodenní aplikace enoxaparinu v dávce 180 IU/ml s.c. (Clexane 1,0 ml), které byly s kontrolami anti-Xa 0,5–0,6 IU/ml. Monitorace aktivity AT v graviditě prokázala asi 20–30% nárůst původních hodnot, tedy na max. 68 %. Ve spolupráci s ÚHKT byla u pacientky nalezena kauzální heterozygotní mutace č. 391 C>T v exonu 2 genu SERPINC1, která je spojena s funkčním deficitem AT typu IIB – poruchou vazby heparinu k AT (HBS) – a má být zatížena asi 7–10× menším rizikem TEN než u pacientek z předchozích kazuistik. Pro anamnézu prodělané DVT ve stávající graviditě jsme pro pacientku doporučili dispenzarizaci v rizikové těhotenské poradně v rámci naší nemocnice s vizí lepší mezioborové peripartální kooperace, kdy jsme předběžně plánovali ve 38. gtt změnit aplikace léku Clexane zpět na 2× denně k minimalizaci peripartálního krvácení a aplikovat AT intravenózně před porodem a po něm. Nakonec však byla pacientka pro nepříznivou polohu plodu a neztišitelné bolesti v podbřišku indikována ve 36. gtt k akutnímu sectio caesarea. Ten byl proveden 24 hod od poslední aplikace léku Clexane v neredukované dávce 1,0 ml bez komplikací. Pro spěch byl organizačním nedopatřením AT aplikován intravenózně až 3 hod po porodu (preferovali bychom cca 1–3 hod před porodem [9]), a to v dávce 3 000 IU (50 IU/kg) i.v. V prvních 3 poporodních dnech jsme pak s vědomím pozitivní osobní anamnézy DVT pacientky a na základě pravidelných kontrolních koagulačních vyšetření podávali další substituce AT ve výši 60 % první dávky a upravili dávkování enoxaparinu do profylaktických hodnot dle anti-Xa. Po dobu šestinedělí byla pacientka zajištěna enoxaparinem v dávce 140 IU/kg 1× denně (Clexane 0,8 ml) s profylaktickými hodnotami anti-Xa 0,3–0,4 IU/ml. Vzhledem k faktu, že až do gravidity byla pacientka bez trombembolických projevů, ukončili jsme po šestinedělí její antikoagulační léčbu LMWH bez další náhrady. Do budoucna je u pacientky vždy indikována prevence v obecně známých rizikových situacích pro vznik TEN.
Závěr
Hereditární deficit AT není v populaci zdaleka tak frekventní jako třeba mutace FV Leiden v heterozygotní konstituci. Je ale třeba k němu přistupovat jako k potenciálně závažnému trombofilnímu stavu (zejména deficitu AT typu I, typu II s mutací v RS doméně a mutací HBS domény v homozygotní konstituci), kdy u gravidních pacientek a v puerperiu je riziko TEN dále násobeno.
V našem sdělení předkládáme jednu ilustrativní kazuistiku, ve které byla DVT v rané graviditě s nebezpečnou peripartální recidivou ohrožena žena s vysoce rizikovým podtypem deficitu AT.
V dalších dvou kazuistikách jsme pak nastínili, že na odhad rizika TEN jen dle typu kauzální mutace se vždy spolehnout nelze – DVT asociovanou s graviditou prodělala mladá žena s teoreticky příznivějším typem AT deficitu (typ IIB s mutací HBS domény v heterozygotní konstituci), a naopak riziková pacientka s kvantitativním deficitem AT typu I zůstala i přes nedokonale vedenou peripartální léčbu a pozitivní rodinnou anamnézu bez trombembolických komplikací. Doporučení, zda u pacientky se známým deficitem AT zahájit antepartální profylaxi LMWH, či bude dostačující až poporodně (případně zda lze od ní ustoupit zcela), zda bude indikována i intravenózní substituce AT a v jakém schématu, je odvislé od osobní a rodinné anamnézy pacientky pro TEN, hloubky deficitu AT, kauzální mutace a případně heparinové rezistence.
Je odhadováno, že při dobře vedené hematologické léčbě se u pacientek s deficitem AT riziko s graviditou asociované TEN snižuje o 75 %, samozřejmě je naprosto nezbytná efektivní kooperace s gynekology.
Publikační etika: Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bio medicínských časopisů.
Konflikt zájmů: Autoři deklarují, že v souvislosti s předmětem studie/práce nemají žádný konflikt zájmů.
Poděkování: Děkuji touto cestou za podnětné připomínky ke tvorbě článku MUDr. Peteru Salajovi (toho času primáři Centra pro trombózu a hemostázu ÚHKT v Praze). Dále děkuji za plodnou spolupráci celému týmu CTH a vedoucí NRL pro poruchy hemostázy v ÚHKT v Praze RNDr. Ingrid Hrachovinové, Ph.D. Za podporu děkuji primářce MUDr. Dagmar Chalupové s kolegy z THO Kolín.
Sources
1. Van Cott EM, Orlando C, Moore GW et al. Recommendations for clinical laboratory testing for antithrombin deficiency. Communication from the SSC of the ISTH. J Thromb Haemost 2019; 18 (1): 17–22. doi: 10.1111/jth. 14648.
2. SÚKL. Anbinex, Grifols – SPC. 2021 [online]. Dostupné z: https: //www.sukl.cz/modules/medication/detail.php?code=0137484&tab=texts.
3. Maclean SP, Tait RC. Hereditary and acquired antithrombin deficiency: epidemiology, pathogenesis and treatment options. Drugs 2007; 67 (10): 1429–1440. doi: 10.2165/00003 495-200767100-00005.
4. Matýšková M, Šlechtová M, Zavřelová J et al. Antitrombin. Transfuze Hematol dnes 2013; 19 (4): 244–249.
5. Di Minno MN, Ambrosino P, Ageno W et al. Natural anticoagulants deficiency and the risk of venous thromboembolism: a meta-analysis of observational studies. Thromb Res 2015; 135 (5): 923–932. doi: 10.1016/j.thromres.2015.03. 010.
6. Khor B, Van Cott EM. Laboratory tests for antithrombin deficiency. Am J Hematol 2010; 85 (12): 947–950. doi: 10.1002/ajh.21893.
7. Hajšmanová Z, Šlechtová J, Šigutová P et al. Průběh těhotenství při dlouhodobém podávání nízkomolekulárního heparinu pro opakované těhotenské ztráty. Ceska Gynekol 2008; 73 (5): 278–283.
8. Royal College of Obstetricians and Gynecologists. Thrombosis and embolism during pregnancy and the puerperium, reducing the risk (green-top guideline no. 37a). 2015 [online]. Available from: https: //www.rcog.org.uk/en/guidelines-research-services/guidelines/gtg37a/.
9. Tsikouras P, Christoforidou A, Bothou A et al. Ovecomming heparin resistance in pregnant women with antithrombin deificiency: a case report and review of the literature. J Med Case Rep 2018; 12 (1): 169. doi: 10.1186/s13256-018- 1711-2.
10. Croles FN, Lukens MV, Mulder R et al. Monitoring of heparins in antithrombin-deficient patients. Thromb Res 2019; 175: 8–12. doi: 10.1016/j.thromres.2019.01.007.
11. Pabinger I, Thaler J. How I treat patients with hereditary antithrombin deficiency. Blood 2019; 134 (26): 2346–2353. doi: 10.1182/blood. 2019002927.
12. Iba T, Gando S, Saitoh D et al. Antithrombin supplementation and risk of bleeding in patients with sepsis-associated disseminated intravascular coagulation. Thromb Res 2016; 145: 46–50. doi: 10.1016/j.thromres.2016.07.016.
13. Provazníková D, Matýšková M, Čápová I et al. Seventeen novel SERPINC1 variants causing hereditary antithrombin deficiency in a Czech population. Thromb Res 2020; 189: 39–41. doi: 10.1016/j.thromres.2020.02. 025.
14. Kearon C, Akl EA, Comerota AJ et al. Antithrombotic therapy for VTE disease: antithrombotic therapy and prevention of thrombosis, 9th ed: American college of chest physicians evidence-based clinical practice guidelines. Chest 2012; 141 (Suppl 2): e419S–e494S. doi: 10.1378/chest.11-2301.
15. Durai S, Tan LK, Lim S. Antithrombin deficiency in pregnancy. BMJ Case Rep 2016; 2016: bcr2015213310. doi: 10.1136/bcl-2015-213310.
16. Refaei M, Xing L, Lim W et al. Management of venous thromboembolism in patients with hereditary antithrombin deficiency and pregnancy: case reports and review of the literature. Case Rep Hematol 2017; 2017: 9261351. doi: 10.1155/2017/9261351.
17. Biron-Andréani C. Venous trombembolic risk in postpartum. Phlebolymphology 2013; 20 (4): 167.
18. Robertson L, Wu O, Langhorne P et al. Trombophilia in pregnancy: a systematic review. Br J Haematol 2006; 132 (2): 171–196. doi: 10.1111/j.1365-2141.2005.05847.x.
19. Bates SM, Rajasekhar A, Middeldorp S et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: venous thromboembolism in the context of pregnancy. Blood Adv 2018; 2 (22): 3317– –3359. doi: 10.1182/bloodadvances.2018024 802.
20. James AH, Konkle BA, Bauer KA. Prevention and treatment of venous thrombembolism in pregnancy in patients with hereditary antithrombin deficiency. Int J Womens Health 2013; 5: 233–241. doi: 10.2147/IJWH.S43190.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2021 Issue 3
Most read in this issue
- Estetrol a možnosti jeho klinického využití
- Adenomyóza – možný vliv na funkci a receptivitu endometria
- Vrozený deficit antitrombinu a gravidita – závažný trombofilní stav ohrožující matku i plod
- Změny kvality sexuálního života po operacích pro sestup pánevních orgánů
