Léčebné přístupy u recidiv karcinomu endometria
Therapeutical strategies for recurrent endometrial cancer
Objective: A comprehensive overview of therapeutical strategies for recurrent endometrial cancer with illustrative case report. Methodology: A review providing basic overview of therapeutical options for different forms of recurrent endometrial cancer including surgical treatment, systemic treatment and radiotherapy. It includes a case report presenting a treatment of patient with an endometrial cancer recurrence in the abdominal wall. Conclusion: Therapeutical strategies in patients with endometrial cancer recurrence include surgical treatment, radiotherapy and systemic treatment depending on previous therapy, type and site of recurrence or dissemination, performance status and wishes of the patient. Decision about choice of treatment should be individually discussed and evaluated by multidisciplinary oncogynecological commission board.
Keywords:
surgery – endometrial cancer – radiotherapy – local recurrence – systemic treatment – distant recurrence
Authors:
Tomáš Crha
; Luboš Minář
; Michal Felsinger
; Vít Weinberger
Authors‘ workplace:
Onkogynekologické centrum, Gynekologicko-porodnická klinika LF MU a FN Brno
Published in:
Ceska Gynekol 2023; 88(4): 302-307
Category:
doi:
https://doi.org/10.48095/cccg2023302
Overview
Cíl: Ucelený přehled léčebných přístupů recidiv karcinomu endometria s ilustrativní kazuistikou. Metodika: Přehledová práce podávající základní přehled o využití léčebných modalit u různých forem recidivujícího karcinomu endometria vč. operačního řešení, systémové léčby a radioterapie. Součástí práce je kazuistika prezentující léčbu pacientky s recidivou karcinomu lokalizovanou v břišní stěně. Závěr: Léčebné přístupy u pacientek s recidivujícím karcinomem endometria zahrnují operační přístup, radioterapii a systémovou léčbu v závislosti na předchozí terapii, charakteru a místu recidivy či diseminace, fyzickém stavu a přání pacientky. Rozhodnutí o výběru léčebné modality by mělo být individuálně posuzováno multioborovou onkogynekologickou komisí.
Klíčová slova:
radioterapie – karcinom endometria – operační léčba – lokální recidiva – systémová léčba – vzdálená recidiva
Úvod
Zhoubný nádor děložního těla je v ČR mimo karcinom prsu nejčastější gynekologickou malignitou s incidencí 35/100 000 a mortalitou 6,4/100 000 žen v roce 2020 [1]. Zhoubné nádory děložního těla jsou nejčastěji karcinomy, ve většině případů je diagnostikován endometroidní adenokarcinom. Většina případů (67 %) je diagnostikována v časném stadiu onemocnění a chirurgicky řešena extrafasciální hysterektomií s oboustrannou adnexektomií a biopsií sentinelové uzliny [2]. Prognóza onemocnění časných stadií je dobrá, kdy se doba 5letého přežití u FIGO I stage (the International Federation of Gynecology and Obstetrics) udává 92 % [3]. I přes optimální chirurgickou a adjuvantní léčbu je celkové riziko recidivy onemocnění 10–15 % [4]. Volba léčebného přístupu u recidiv karcinomu endometria závisí na mnoha okolnostech – lokalizaci a rozsahu recidivy, předchozí léčebné modalitě, časovém intervalu od zahájení primární léčby do klinické manifestace recidivy a také na performance statutu (PS) pacientky. Naprostou nezbytností při určení léčebného přístupu je diskuze případu multidisciplinární komisí [5].
Izolovaná vaginální recidiva
Lokální vaginální recidiva karcinomu endometria se nejčastěji vyskytuje v proximální části pochvy, resp. v oblasti poševního pahýlu. Samotný léčebný přístup závisí na přesné anatomické lokalizaci, časovém intervalu bez onemocnění (DFI – disease free interval), morbiditě pacientky a předchozí použité léčbě. Zobrazovacími metodami je potřeba vyloučit metastatické postižení [6]. Kolektiv autorů Huh et al [7] prezentuje výsledky multiinstitucionální studie, v níž sleduje výsledky radioterapie-naivních žen s izolovanou vaginální recidivou, léčených radioterapií. Z 69 pacientek bylo 89 % úspěšně léčeno radioterapií a 5letá doba přežití byla 75 % [7]. Indikovaná adjuvantní radioterapie sice snižuje riziko lokální recidivy, nicméně recidivující pacientky mají horší prognózu než neozářené a možnost řešení recidivy opětovnou radioterapií má své výrazné limitace minimálně vzhledem k již aplikované dávce záření. Kromě reiradiace mají významnější místo mezi léčebnými modalitami chirurgický výkon nebo systémová léčba [8]. Tradiční vaginální brachyterapie pro vaginální recidivu je spojena se závažnou pozdní toxicitou u 20–25 % pacientek – atrofie kůže, podkoží a sliznic, chronické průjmy, střevní obstrukce, snížení kostní denzity a hematurie. Novější metody jako stereotactic body radiotherapy (SBRT) a image-guided brachyterapy (IGBT) nabízejí přesnější zacílení na recidivu onemocnění, a tím snižují radiační poškození okolních pánevních orgánů [9]. Chirurgická excize či kolpektomie by měly být zváženy v případech, kdy lze výkonem dosáhnout volných resekčních okrajů. Radikální operační řešení ve smyslu pánevní exenterace by mělo být zváženo u pacientek s lokálně pokročilou nemetastazující recidivou, kde je žádoucí efekt radioterapie nebo chemoradioterapie vysoce nepravděpodobný [6]. Naprostou samozřejmostí je centralizace těchto pacientek do specializovaných onkogynekologických center, které disponují adekvátním personálním a technickým zabezpečením pro úspěšné provedení tohoto typu operačních výkonů s dosažením nulového makroskopického rezidua (RD 0) [5].
Pánevní recidiva
Pacientky, u nichž se vyskytne pánevní recidiva, mají horší prognózu než pacientky s lokální izolovanou recidivou [6]. U recidivy, která zasahuje do pánevní stěny, je celkové 3leté přežití 5 % oproti recidivě zasahující pouze do parametrií 38 % [10]. V případech, kdy nelze provést operační výkon, lze využít radioterapie, která je ale málo efektivní, a to zejména v případech, kdy již byla využita v rámci primární léčby [6]. Systémová léčba by měla být zvážena samostatně nebo v kombinaci s radioterapií či operačním výkonem [6]. O možnosti operačního řešení by se mělo po vyloučení metastatického postižení uvažovat u pacientek jen v případech, kdy lze dosáhnout RD 0, a to při akceptovatelné morbiditě [5]. Práce švýcarských autorů Schmidt et al [11] analyzuje soubor 40 pacientek, které podstoupily pánevní exenteraci pro recidivu zhoubného nádoru endometria (37 pacientek) nebo pro primárně pokročilou formu onemocnění (tři pacientky). Rozsah DFI u recidivujících pacientek tohoto souboru je 4–111 měsíců s mediánem 24 měsíců. Dvě pacientky (5 %) podstoupily přední exenteraci, čtyři zadní exenteraci (10 %) a 34 (85 %) podstoupilo totální exenteraci. V 31 případech (78 %) byl operační cíl kurativní, v devíti případech u pacientek v celkově dobrém stavu při extrémně špatné kvalitě života (QoL – quality of life) se jednalo o paliativní záměr. U 37 pacientek bylo dosaženo volných resekčních okrajů (92 %), u tří pacientek (8 %) byly resekční okraje pozitivní. Volných resekčních okrajů bylo dosaženo u 95 % pacientek, které podstoupily pánevní exenteraci pro recidivu onemocnění. Celková doba 5letého přežití (OS – overall survival) byla 61,4 % a 10letého 51,1 %. Pooperační komplikace byly zaznamenány u 12 ze 40 pacientek (30 %). Nejčastěji se jednalo o tvorbu abscesu, ileus, píštěl, vznik lymfocysty a trombózu. Data získaná touto prací ukazují, že pánevní exenterace je opodstatněná léčebná modalita, která na základě racionální předoperační selekce vede k prodloužení OS se současným signifikantním zlepšením QoL [11].
Mimopánevní recidiva a metastatické postižení
Mimopánevní recidiva a metastatické postižení se vyznačují obecně nejhorší prognózou a léčebná snaha je zpravidla paliativní. V rozhodnutí o dalším léčebném postupu musí být brány do úvahy četné charakteristiky týkající se nádoru (vč. jeho vlastností, lokalizace a četnosti, resp. rozsahu postižení), použitých léčebných modalit a stavu pacientky (aktuální PS). Z léčebných možností lze využít samostatně nebo v kombinaci systémovou léčbu, radioterapii a operační řešení. To je zpravidla s paliativním záměrem ve snaze zlepšení QoL, v případě solitární metastázy může být samozřejmě realizováno i s primárně kurativním záměrem [6]. Poměrně novou podjednotkou metastatického postižení je oligometastatická recidiva. Jedná se o stav definovaný přítomností recidivy s 1–5 metastázami, u nichž může být lokálně ablativní terapie kurativní. V situacích, kdy je primární ložisko nádoru resekováno/kontrolováno a metastatická ložiska jsou radioterapií nebo chirurgicky odstraněna, bylo pozorováno prodloužení DFI a v některých situacích i úplné vyléčení. Základní myšlenkou v léčbě těchto pacientek je opět racionální individualizace léčebného přístupu na základě detailní diskuze případů multidisciplinární komisí. Případný benefit chemoterapie není znám [5].
Chirurgická cytoredukce
Výsledky několika retrospektivních studií ukazují benefit úspěšné cytoreduktivní operace u recidivujícího karcinomu endometria. Práce Barlin et al [12] sdružující data celkem 672 pacientek ze 14 retrospektivních prací ukazuje prodloužení přežití o 16 měsíců v případech, kdy byla dosažena optimální cytoredukce [12]. V těchto případech musí být brány do úvahy lokalizace recidivy, adekvátní chirurgická erudice týmu, pravděpodobnost dosažení optimální cytoredukce, morbidita pacientky a možný dopad operačního výkonu na kvalitu života [13].
Systémová léčba
Chemoterapie
Standardní první linie chemoterapie u pacientek, které doposud chemoterapií léčeny nebyly, je podání 6 cyklů karboplatiny AUC (area under the curve) 5–6 a paclitaxelu 175 mg/m2 každých 21 dnů. U této kombinace se ukázala být dobrá míra odezvy (response rate) 43 % při přijatelné toxicitě [14–16]. Doposud není nastaven standard druhé linie chemoterapie. Mezi dostupnými chemoterapeutiky byla míra odezvy (response rate) 10–15 %. Nejčastěji se využívá týdenní aplikace paclitaxelu a antracyklinů (vč. pegylované formy lipozomálního doxorubicinu). V těchto případech je podporováno zapojení pacientky do klinických studií [5]. Dle výsledků retrospektivní single center studie lze v případech výskytu recidivy v delším časovém intervalu od první linie (medián 25 měsíců) využít opětovnou aplikaci karboplatiny v monoterapeutickém schématu. Response rate byla 50 % s mediánem OS a mediánem doby přežití bez progrese onemocnění (PFS – progresion free survival) 27 a 10 měsíců [17].
Hormonální terapie
Response rate hormonální terapie u recidivujícího a pokročilého karcinomu endometria se uvádí až 55 % [18]. Největší benefit byl prokázán u low grade, pomalu progredujících, hormon-receptor-pozitivních nádorů, nicméně benefit byl pozorován i u pacientek hormon-receptor-negativních [19]. Lékem první volby jsou progesterony (medroxyprogesteron acetát 200–300 mg a megesterol acetát 160 mg). Alternativou mohou být tamoxifen, fulvesterant a inhibitory aromatázy [5]. Ve studii PARAGON byla v kohortě 82 pacientek s receptor-pozitivní recidivou karcinomu endometria léčených anastrozolem response rate 7 % a clinical benefit rate (CBR) 44 % [20]. Vzhledem k možnosti změny exprese hormonálních receptorů od výskytu primárního tumoru a výskytu recidivy by měla být zvážena biopsie [5]. U pacientek podstupujících hormonální terapii je zvýšené riziko trombembolických komplikací a měla by být zvážena profylaxe nízkomolekulárním heparinem [5].
Cílená léčba
U několika anti PD-1 a anti PD-L1 checkpoint inhibitorů byla prokázána efektivita při léčbě MSI-high (microsatellite instability) / MMRd (mismatch repair deficiency) karcinomů endometria, u kterých došlo k progresi při standardní chemoterapii. MMRd/MSI-high musí být stanoveno pomocí validované testovací metody, jako je imunohistochemické vyšetření (IHC – imunohistochemistry screening), polymerázová řetězová reakce (PCR – polymerase chain reaction) nebo sekvenování nové generace (NGS – next generation sequencing). V těchto případech se využívá aplikace dostarlimabu nebo pembrolizumabu [21,22]. U non MSI-high/MMRd recidivujících karcinomů endometria se při selhání standardní chemoterapie využívá dvojkombinace pembrolizumabu a levantinibu [23,24]. Uvedená cílená léčba není dosud hrazena z veřejného zdravotního pojištění.
Přibližně 30 % serózních karcinomů prokazuje zvýšenou expresi HER2. Při léčbě paclitaxelem a karboplatinou s podáním trastuzumabu, nebo bez něj bylo prokázáno prodloužení PFS o 4,6 měsíce [25].
Kazuistika
Pacientka ve věku 53 let byla v roce 2018 odeslána registrujícím gynekologem do Onkogynekologického centra Fakultní nemocnice Brno pro nález dobře diferencovaného endometriálního karcinomu z kyretáže, která byla provedena z důvodu postmenopauzálního krvácení. Stagingovými vyšetřeními v rozsahu CT trupu, mamografie a expertního onkogynekologického ultrazvukového vyšetření byl nález předoperačně klasifikován jako low-risk (s absencí hluboké myometrální invaze a bez podezření na infiltraci cervixu a bez průkazu vzdálené hematogenní nebo lymfogenní diseminace). Jednalo se o období před zavedením techniky biopsie sentinelové uzliny do rutinní operační léčby, pacientka byla indikována k laparoskopicky asistované vaginální extrafasciální hysterektomii s bilaterální adnexektomií a peroperační biopsií sentinelové uzliny. Při operačním výkonu byla v rámci detekce sentinelové uzliny použita patentová modř. I přes důkladnou preparaci retroperitoneálních prostor se nepodařilo najít odpovídající tkáň charakteru lymfatické uzliny, další části operačního výkonu proběhly ve stanoveném rozsahu bez komplikací. Ve finálním histologickém preparátu byl zjištěn invazivní endometroidní karcinom grade II s absencí hluboké myometrální invaze, avšak s přítomností infiltrace děložního hrdla, a multifokální invaze do krevních a lymfatických cév (LVSI) s nutností překlasifikace rizika nálezu na high risk. Pacientka po informaci o dalších možnostech terapeutického postupu preferovala dokončení chirurgického stagingu s provedením systematické aortopelvické lymfadenektomie. Při sekundárním operačním vstupu 5 týdnů po primárním operačním výkonu bylo získáno 40 lymfatických uzlin, které byly všechny bez metastatického postižení. V rámci adjuvantní terapie absolvovala pacientka brachyterapii a následně participovala na pravidelné dispenzární péči.
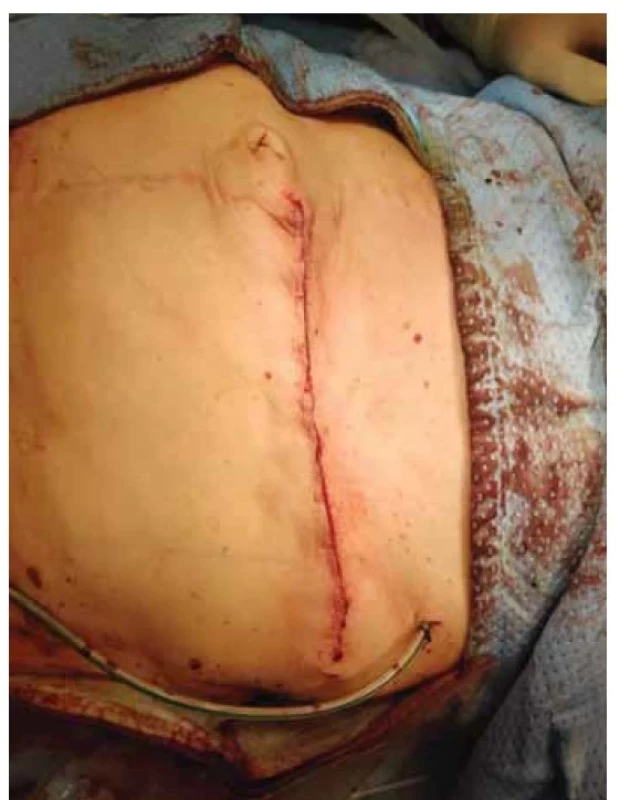
V září 2022 pacientka přichází pro nahmatání rezistence v břišní stěně. V levém mezogastriu v úrovni pupku byla palpovatelná tuhá semifixovaná rezistence 6 × 5 cm, nález infiltrace byl potvrzen ultrazvukovým vyšetřením. Do této doby byly všechny pravidelné kontroly bez nálezu jakékoli patologie a poslední restagingové vyšetření (červen 2022) bylo negativní. Byla provedena tru-cut biopsie z uvedené rezistence a pacientce bylo provedeno PET/MR trupu v rámci restagingu. Ze získaného bioptického vzorku byl zjištěn LG endometroidní adenokarcinom. Pomocí PET/MR byl potvrzen nález solitární infiltrace ventrální břišní stěny v oblasti levého mezogastria. Vzhledem k solitární operabilní recidivě byla indikována radikální excize ze stěny břišní. Recidiva byla radikálně odstraněna se všemi vrstvami břišní stěny (obr. 1) s makroskopicky dostatečným intaktním resekčním okrajem (obr. 2). Z důvodu protruze recidivy přes peritoneum byla odstraněna i na recidivu adherující část omenta. Tímto výkonem vzniklý defekt byl rekonstruován přítomným chirurgem za použití síťky (obr. 3, 4) a mobilizace sousedních tkání. Celková operační doba byla 3 hod. Pacientku jsme propustili ve stabilizovaném stavu 10. den do domácího léčení. Ve finálním histologickém preparátu bylo dosaženo volných resekčních okrajů a byla potvrzena metastáza endometroidního adenokarcinomu LG, MMRd. Pacientka je nyní v remisi převedena do systému ambulantní dispenzární kontroly.
Fig. 1. Recurrence of endometrial carcinoma in the abdominal
wall after complete excision.
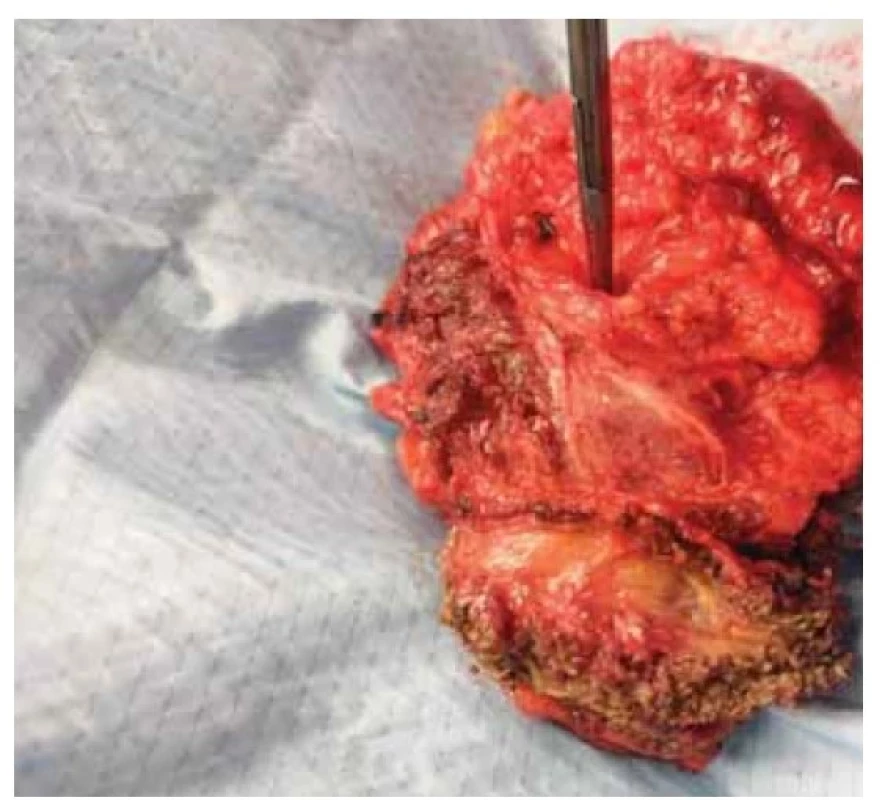
Fig. 2. Condition after resection of endometrial carcinoma
recurrence in the abdominal wall.
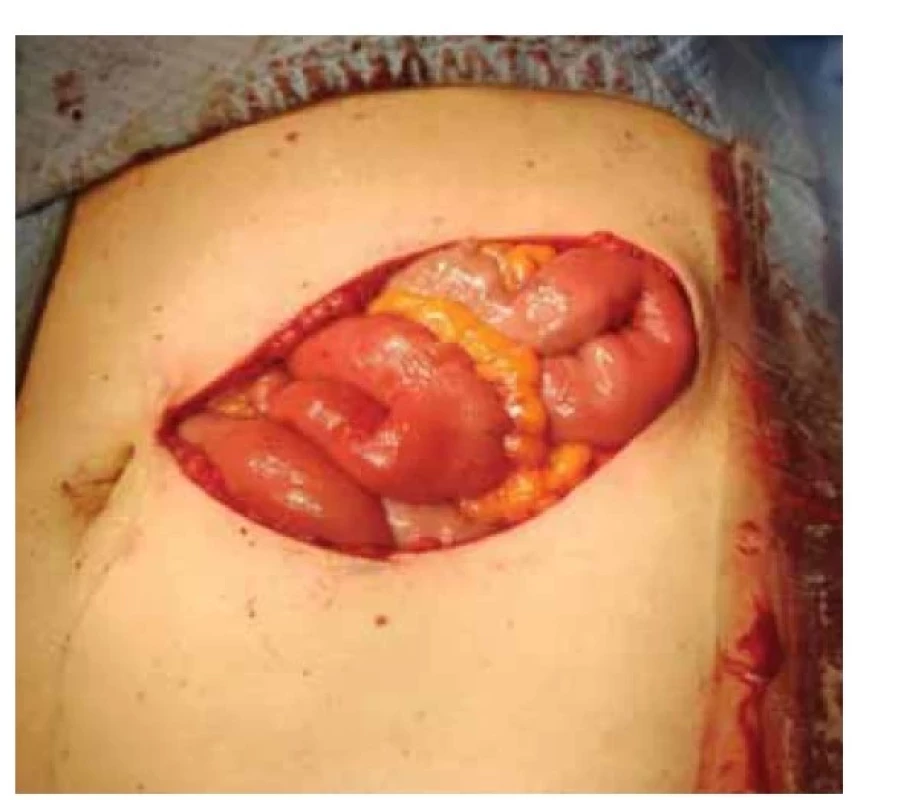
Fig. 3. Defect of the abdominal wall covered by a surgical
mesh.
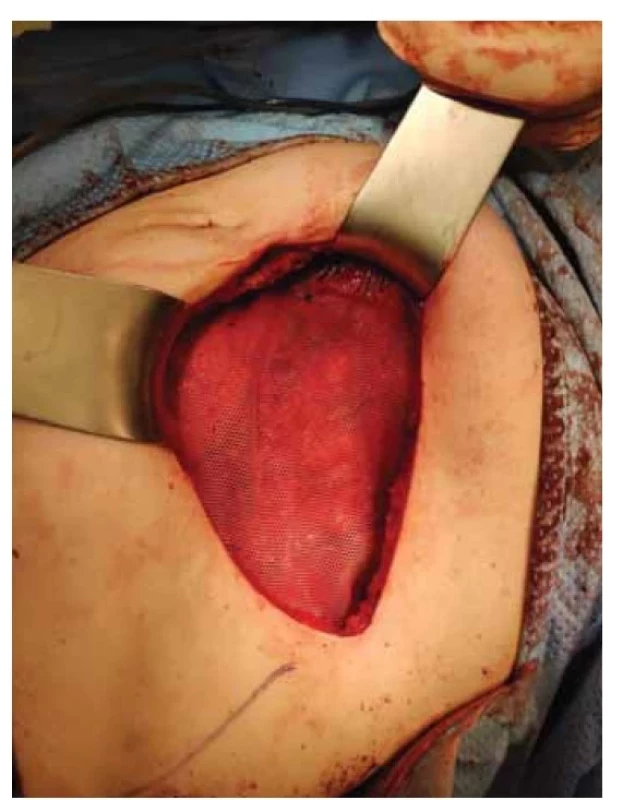
Fig. 4. Closed abdominal wall after surgery.
Závěr
Možnosti léčby pacientek s recidivujícím karcinomem endometria zahrnují modality operačního přístupu, radioterapie a systémové léčby v závislosti na předchozí terapii, charakteru a místu recidivy či diseminace, fyzickém stavu a přání pacientky. Rozhodnutí o výběru léčebné modality by mělo být individuálně posuzováno multioborovou onkogynekologickou komisí. Operační výkon by měl být zvolen v případech vedených s kurativním záměrem, kdy lze dosáhnout nulového makroskopického rezidua za cenu únosné morbidity. Radioterapii je možno zvážit v rámci adjuvance po chirurgickém odstranění lokoregionálního relapsu nebo u inoperabilního lokoregionálního relapsu u pacientek, které nebyly léčeny radioterapií. Hormonoterapie je indikována především u dobře diferencovaných, pomalu progredujících tumorů jako velmi dobře tolerovaná a současně účinná varianta paliativního přístupu. Chemoterapie se uplatňuje u rychle progredujícího diseminovaného onemocnění, tumorů s vyšším grade, non-endometrioidním typem tumorů a u masivního metastatického postižení. Léčba probíhá do progrese onemocnění či neakceptovatelné toxicity.
ORCID autorů
T. Crha 0000-0003-0980-8906
L. Minář 0000-0001-9088-5428
M. Felsinger 0000-0002-3826-5675
V. Weinberger 0000-0003-4858-1951
Doručeno/Submitted: 6. 3. 2023
Přijato/Accepted: 11. 5. 2023
doc. MUDr. Luboš Minář, Ph.D.
Onkogynekologické centrum
Gynekologicko-porodnická klinika
LF MU a FN Brno
Jihlavská 25
625 00 Brno
Sources
1. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice. Masarykova univerzita. 2007 [online]. Dostupné z: http: //www.svod.cz.
2. Legge F, Restaino S, Leone L et al. Clinical outcome of recurrent endometrial cancer: analysis of post-relapse survival by pattern of recurrence and secondary treatment. Int J Gynecol Cancer 2020; 30 (2): 193–200. doi: 10.1136/ijgc- 2019-000822.
3. UK CR, Uterine cancer statistics. 2023 [online]. Available from: https: //www.cancerresear chuk.org/health-professional/cancer-statistics/statistics-by-cancer-type/uterine- cancer.
4. Xu Y, Burmeister C, Hanna RK et al. Predictors of survival after recurrence in women with early-stage endometrial carcinoma. Int J Gynecol Cancer 2016; 26 (6): 1137–1142. doi: 10.1097/IGC. 0000000000000733.
5. Concin N, Matias-Guiu X, Vergote I et al. ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma. Int J Gynecol Cancer 2021; 31 (1): 12–39. doi: 10.1136/ijgc-2020-002230.
6. Connor EV, Rose PG. Management strategies for recurrent endometrial cancer. Expert Rev Anticancer Ther 2018; 18 (9): 873–885. doi: 10.1080/14737140.2018.1491311.
7. Huh WK, Straughn JM Jr, Mariani A et al. Salvage of isolated vaginal recurrences in women with surgical stage I endometrial cancer: a multiinstitutional experience. Int J Gynecol Cancer 2007; 17 (4): 886–889. doi: 10.1111/ j.1525-14 38.2007.00858.x.
8. Creutzberg CL, van Putten WL, Koper PC et al. Survival after relapse in patients with endometrial cancer: results from a randomized trial. Gynecol Oncol 2003; 89 (2): 201–209. doi: 10.1016/s0090-8258 (03) 00126-4.
9. Llewelyn M, Taylor A. Re-irradiation of cervical and endometrial cancer. Curr Opin Oncol 2017; 29 (5): 343–350. doi: 10.1097/CCO.0000 000000000392.
10. Jereczek-Fossa B, Badzio A. Recurrent JJ. Endometrial cancer after surgery alone: results of salvage radiotherapy. Int J Radiat Oncol Biol Phys 2000; 48 (2): 405–413. doi: 10.1016/s03 60-3016 (00) 00642-8.
11. Schmidt AM, Imesch P, Fink D et al. Pelvic exenterations for advanced and recurrent endometrial cancer: clinical outcomes of 40 patients. Int J Gynecol Cancer 2016; 26 (4): 716–721. doi: 10.1097/IGC.0000000000000678.
12. Barlin JN, Puri I, Bristow RE. Cytoreductive surgery for advanced or recurrent endometrial cancer: a meta-analysis. Gynecol Oncol 2010; 118 (1): 14–18. doi: 10.1016/j.ygyno.2010.04. 005.
13. Minář L, Petrovová D, Kümmel J. Karcinom děložního těla – raritní varianta vzdálené metastázy. Ceska Gynekol 2009; 74 (5): 383–389.
14. Thigpen JT, Blessing JA, DiSaia PJ et al. A randomized comparison of doxorubicin alone versus doxorubicin plus cyclophosphamide in the management of advanced or recurrent endometrial carcinoma: a Gynecologic Oncology Group study. J Clin Oncol 1994; 12 (7): 1408–1414. doi: 10.1200/JCO.1994.12.7. 1408.
15. van Wijk FH, Aapro MS, Bolis G et al. Doxorubicin versus doxorubicin and cisplatin in endometrial carcinoma: definitive results of a randomised study (55872) by the EORTC Gynaecological Cancer Group. Ann Oncol 2003; 14 (3): 441–448. doi: 10.1093/annonc/mdg 112.
16. Miller DF, Filiaci V, Fleming G et al. Randomized phase III non inferiority trial of first line chemotherapy for metastatic or recurrent endometrial carcinoma: a gynecologic oncology group study. SGO abstract Late-Breaking Abstract 1. Gynecol Oncol 2012; 125 (Suppl): 771–773. doi: 10.1016/j.ygyno.2012.03.034.
17. Rubinstein M, Halpenny D, Makker V et al. Retreatment with carboplatin and paclitaxel for recurrent endometrial cancer: a retrospective study of the Memorial Sloan Kettering Cancer Center experience. Gynecol Oncol Rep 2019; 28: 120–123. doi: 10.1016/j.gore.2019.04. 002.
18. van Weelden WJ, Massuger LF, ENITEC et al. Anti-estrogen treatment in endometrial cancer: a systematic review. Front Oncol 2019; 9: 359. doi: 10.3389/fonc.2019.00359.
19. Ethier JL, Desautels DN, Amir E et al. Is hormonal therapy effective in advanced endometrial cancer? A systematic review and meta-analysis. Gynecol Oncol 2017; 147 (1): 158–166. doi: 10.1016/j.ygyno.2017.07.002.
20. Mileshkin L, Edmondson R, O‘Connell RL et al. Phase 2 study of anastrozole in recurrent estrogen (ER) /progesterone (PR) positive endometrial cancer: the PARAGON trial – ANZGOG 0903. Gynecol Oncol 2019; 154 (1): 29–37. doi: 10.1016/j.ygyno.2019.05.007.
21. Marabelle A, Le DT, Ascierto PA et al. Efficacy of pembrolizumab in patients with noncolorectal high microsatellite instability/mismatch repair-deficient cancer: results from the phase II KEYNOTE-158 study. J Clin Oncol 2020; 38 (1): 1–10. doi: 10.1200/JCO.19.02105.
22. Mittica G, Ghisoni E, Giannone G et al. Checkpoint inhibitors in endometrial cancer: preclinical rationale and clinical activity. Oncotarget 2017; 8 (52): 90532–90544. doi: 10.18632/oncotarget.20042.
23. Makker V, Taylor MH, Aghajanian C et al. Lenvatinib plus pembrolizumab in patients with advanced endometrial cancer. J Clin Oncol 2020; 38 (26): 2981–2992. doi: 10.1200/JCO.19.02627.
24. Makker V, Rasco D, Vogelzang NJ et al. Lenvatinib plus pembrolizumab in patients with advanced endometrial cancer: an interim analysis of a multicentre, open-label, single-arm, phase 2 trial. Lancet Oncol 2019; 20 (5): 711–718. doi: 10.1016/S1470-2045 (19) 30020-8.
25. Fader AN, Roque DM, Siegel E et al. Randomized phase II trial of carboplatin-paclitaxel versus carboplatin-paclitaxel-trastuzumab in uterine serous carcinomas that overexpress human epidermal growth factor receptor 2/neu. J Clin Oncol 2018; 36 (20): 2044–2051. doi: 10.1200/JCO.2017.76.5966.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2023 Issue 4
Most read in this issue
- Účinnost vakcinace proti lidskému papilomaviru v prevenci recidivy těžké cervikální léze
- Léčebné přístupy u recidiv karcinomu endometria
- Diastáza priameho brušného svalu a stresová inkontinencia moču u žien po pôrode
- Vplyv drenáže pupočníka po spontánnom pôrode na tretiu dobu pôrodnú
