-
Úvodní stránka
Reklama
- Archiv čísel
Reklama- Aktuální číslo
Reklama- Informace o časopisu
ReklamaPrůběh těhotenství při dlouhodobém podávání nízkomolekulárního heparinu pro opakované těhotenské ztráty
Long-term Low Molecular Weight Heparin Protection during Pregnancy for the Recurrent Fetal Loss
Recurrent fetal loss affects 1 to 5% women of the fertile age all over the world. Pathogenesis of recurrent early or late fetal loss remains unclear and therefore the LMHW administration during pregnancy has not been sorted out so far.
Our trial deals with a cohort of 51 pregnant women with recurrent fetal loss in their personal history treated by long-term administration of LMWHs which was compared with a cohort of healthy women LMWHs untreated.
91% effectiveness of a long-term LMWH protection means in fact 43 liveborn babies delivered without any complications during pregnancy and delivery to 47 women - 30 of these women were primiparas.Key words:
recurrent fetal loss, low molecular weight heparin, pregnancy and delivery.
Autoři: Z. Hajšmanová 1; J. Šlechtová 1; P. Šigutová 1; Z. Ulčová-Gallová 2
Působiště autorů: ÚKBH FN a LF UK, Plzeň, přednosta prof. MUDr. J. Racek, DrSc. 1; Gynekologicko-porodnická klinika FN, Plzeň, přednosta doc. MUDr. Z. Rokyta, CSc. 2
Vyšlo v časopise: Ceska Gynekol 2008; 73(5): 278-283
Kategorie: Původní práce
Souhrn
Opakované těhotenské ztráty celosvětově postihují 1 až 5 % žen fertilního věku. Patogeneze opakovaných časných či pozdních těhotenských ztrát zůstává nejasná, proto není dosud vyřešeno ani podávání LMWH během těhotenství.
V naší práci srovnáváme soubor 51 žen s osobní anamnézou opakovaných časných či pozdních těhotenských ztrát, kterým byl dlouhodobě podáván nízkomolekulární heparin v preventivní dávce, se souborem gravidních žen heparinem neléčených.
Celkem 91% úspěšnost několikatýdenního podávání LMWH ve skutečnosti znamená 43 živě narozených novorozenců, kteří se narodili bez výskytu závažných komplikací během těhotenství a porodu 47 ženám, z nichž 30 rodilo poprvé.Klíčová slova:
opakované potrácení, nízkomolekulární heparin, gravidita a porod.ÚVOD
Opakované těhotenské ztráty jsou medicínským problémem, který ve světě postihuje 1–5 % žen fertilního věku. Protože příčina není jednoznačně patofyziologicky objasněna, neexistuje ani kauzální terapie. V posledních letech se vedou diskuse s kontroverzními závěry, které vyplynuly i z publikovaných guidelines 7. konference ACCP o antitrombotické a trombolytické léčbě, v nichž je doporučeno screeningově vyšetřovat na vrozenou trombofilní dispozici ženy s opakovanými poruchami reprodukce, ale zároveň se v tomto dokumentu uvádí, že neexistují přesvědčivá data dokumentující, zda antitrombotická léčba je u těchto žen přínosná [1–8, 10–14].
Trombofilie je rizikovým faktorem nejen pro organismus těhotné ženy, ale v posledních letech je spojována i s nepříznivou reprodukční anamnézou. Za těhotenské ztráty jsou považovány spontánní aborty mezi 8.–12. týdnem gestace, intrauterinní růstová retardace plodu (IUGR) nebo intrauterinní odumření plodu (IUFD). K pozdním těhotenským komplikacím patří abrupce placenty nebo rozvoj preeklampsie.
Těhotenství samo o sobě navozuje hyperkoagulační stav podmíněný hormonálními vlivy a hemodynamickými změnami, který navíc může potencovat vrozená trombofilní dispozice či osobní rizika těhotné ženy (věk, obezita, kouření) [4–12].
Nízkomolekulární heparin (LMWH), pokud je ženám s opakovanými ztrátami plodu podáván podle okolností v 1. a 3. trimestru, nebo dokonce po celou dobu těhotenství, sice umožňuje úspěšné dokončení gravidity porodem zdravého dítěte, ale nese s sebou i riziko možných nežádoucích účinků pro plod i matku vyplývající právě z několikaměsíčního podávání, a to i přesto, že neprochází placentární bariérou ani se nevylučuje do mateřského mléka [14].
CÍL PRÁCE
Cílem práce je sledovat vliv podávaného nízkomolekulárního heparinu během těhotenství na organismus matky a průběh a výsledek gravidity. Zjišťovali jsme úspěšnost podávání LMWH z hlediska počtu živě narozených dětí ve fyziologickém termínu porodu. Průběh porodu byl sledován z hlediska výskytu peri - a postpartálního život ohrožujícího krvácení vyžadujícího podání krevních převodů. Dalším cílovým kritériem úspěšnosti podávaného LMWH byl celkový stav právě porozeného novorozence. Možné nežádoucí účinky vlivu dlouhodobě podávaného heparinu na kostní metabolismus matky byly hodnoceny kostní denzitometrií prováděnou po skončení prevence LMWH. Sledován byl i možný výskyt heparinem indukované trombocytopenie (HIT) jako nežádoucí důsledek aplikovaného heparinu.
SOUBOR PACIENTEK
Soubor hodnocených žen tvoří pacientky, u nichž uplynulo 280 dnů od zjištění gravidity a jejich novorozenci. Sledovali jsme věk žen, jejich BMI při přijetí k porodu, osobní anamnézu zaměřenou na počet předchozích porodů, počet a příčinu spontánních abortů, koincidenci endokrinopatií a anatomických anomálií, použití umělých reprodukčních technik.
Dále jsme se soustředili na výskyt tromboembolické nemoci (TEN) či antifosfolipidového syndromu (APS) v osobní anamnéze a přítomnost vrozené trombofilní dispozice (deficit antitrombinu (AT), FV Leiden, mutace v genu pro protrombin G20210A (FIIG20210A), mutace methylentetrahydrofolát reduktázy (MTHFR) C677T a A1298C, hyperhomocysteinémie).
Hodnocen byl i průběh a ukončení probíhající gravidity z hlediska fyziologického termínu porodu a výskytu peri - a postpartálních krvácivých komplikací i vliv dlouhodobě podávaného heparinu na kostní metabolismus ženy a výskyt HIT.
Novorozenec byl hodnocen kritérii, jako je porodní hmotnost, trofika plodu, pro úplný přehled o stavu novorozence je uvedena i viabilita plodu po porodu (Apgar skóre). Za důležité považujeme i vizuální hodnocení plodové vody a porozené placenty.
METODIKA
LMWH byl podáván pouze sledovanému souboru žen, a to
- ženám s opakovanými ztrátami plodu (více než dva aborty v osobní anamnéze),
- ženám s osobní anamnézou prodělané ataky TEN (flebotrombózy nebo plicní embolizace), ať idiopatické, nebo v možné souvislosti s prokázanou vrozenou trombofilní dispozicí (FV Leiden, FIIG20210A atd.),
- ženám s primární nebo sekundární sterilitou, které otěhotněly pomocí IVF.
Kontrolní soubor tvoří ženy, které nesplňovaly požadavky pro dlouhodobou prevenci LMWH.
Dávka LMWH byla vždy adjustována na hmotnost pacientky a účinnost preventivní dávky byla kontrolována laboratorně stanovením aktivity anti-Xa spektrofotometricky metodou chromogenního substrátu, která se pro preventivní dávku LMWH pohybuje v rozmezí 0,2–0,4 IU/ml.
Standardně byl pro prevenci TEN používán nadroparin (Fraxiparine), v případě intolerance, např. pro kožní alergickou reakci, byl volen enoxaparin (Clexane). Několikaměsíční aplikace byla prováděna formou self-service s.c. aplikace ráno mezi 7. a 8. hodinou, aby bylo technicky zvládnutelné laboratorní stanovení anti-Xa aktivity, které je možno provést za 4 hodiny po s.c. aplikaci LMWH. Pro domácí léčbu byla vydávána 3 balení a ženy byly kontrolovány v měsíčních intervalech s cílem včasného zvýšení dávky LMWH při rychlém přírůstku hmotnosti.
Délka aplikace úzce souvisí s účelem prevence. Ženám, které otěhotněly asistovanou reprodukcí, byl LMWH podáván kontinuálně od okamžiku inseminace nebo embryotransferu až do porodu a 10 dnů po porodu. Ženy opakovaně potrácející, ale bez anamnézy prodělané ataky TEN a bez prokázané závažné trombofilní tendence, dostávaly LMWH od okamžiku USG prokázané gravidity a prevence byla ukončována 10. den po porodu. Pouze ženy s prodělanou atakou TEN a /nebo se závažnou vrozenou trombofilní dispozicí dostávaly prevenci LMWH od okamžiku diagnostiky těhotenství až do konce šestinedělí.
Ženy s APS byly léčeny navíc prednisonem v dávce 2,5 mg denně a kyselinou acetylosalicylovou v dávce 100 mg 2x týdně.
VÝSLEDKY
Výsledky této práce jsou uvedeny v tabulkách.
V tabulce 1 je popis sledovaného i kontrolního souboru – počet žen, jejich průměrný věk, průměrná hodnota BMI při přijetí k porodu, dále osobní anamnestické údaje, jako je počet porodů před sledovanou graviditou, počet předchozích fatálně probíhajících gravidit podle trimestru skončení, koincidence endokrinopatií (hypotyreóza, diabetes mellitus), přítomnost APS, prodělaná ataka TEN, přítomnost mono - nebo vícekomponentní vrozené trombofilní dispozice, přítomnost hyperhomocysteinémie v probíhající graviditě. Dále je uvedena doprovodná léčba, jako je užívání kostikosteroidů a antiagregancií při výskytu APS.
Tab. 1. Charakteristika souboru žen 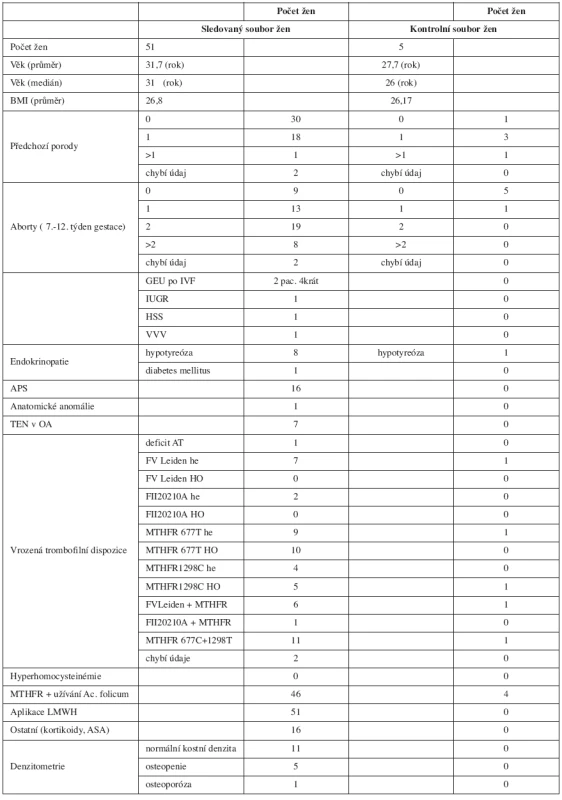
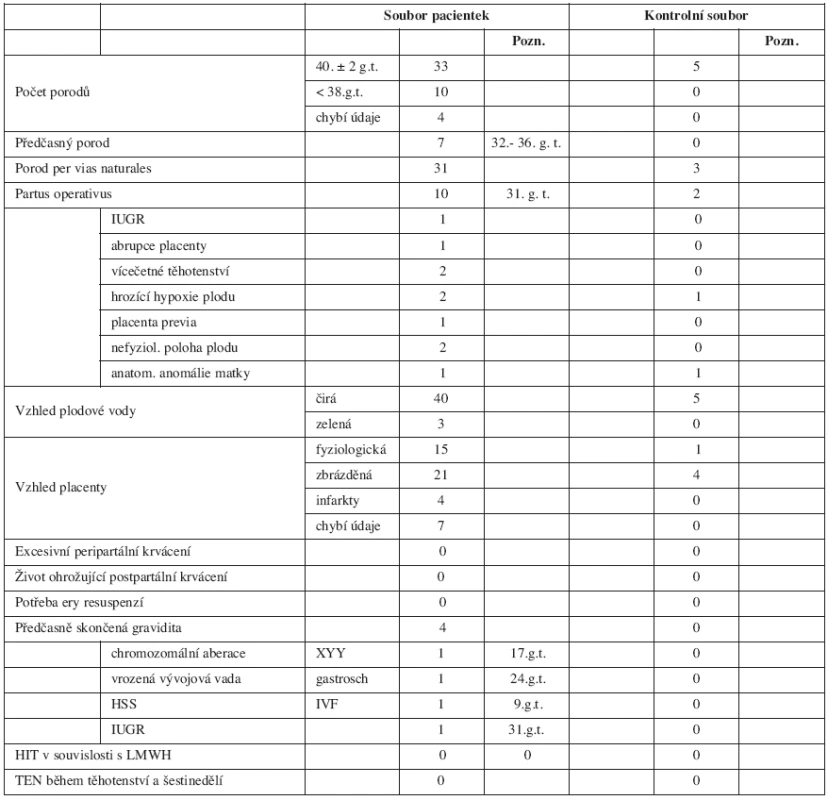
V tabulce 2 jsou zdokumentována data týkající se sledované gravidity – celkový počet fyziologických porodů, předčasných porodů, tabulka poskytuje přehled indikací k operačnímu porodu, dokumentuje výskyt život ohrožujících krvácivých komplikací a dává přehled o předčasně ukončených těhotenstvích. Podává informace o výskytu TEN během těhotenství, o výskytu HIT a výsledcích kontrolní denzitometrie.
V tabulce 3 jsou obsažena kritéria hodnotící porozeného novorozence a přehled výskytu vícečetných těhotenství.
Tab. 3. Hodnocení stavu novorozence 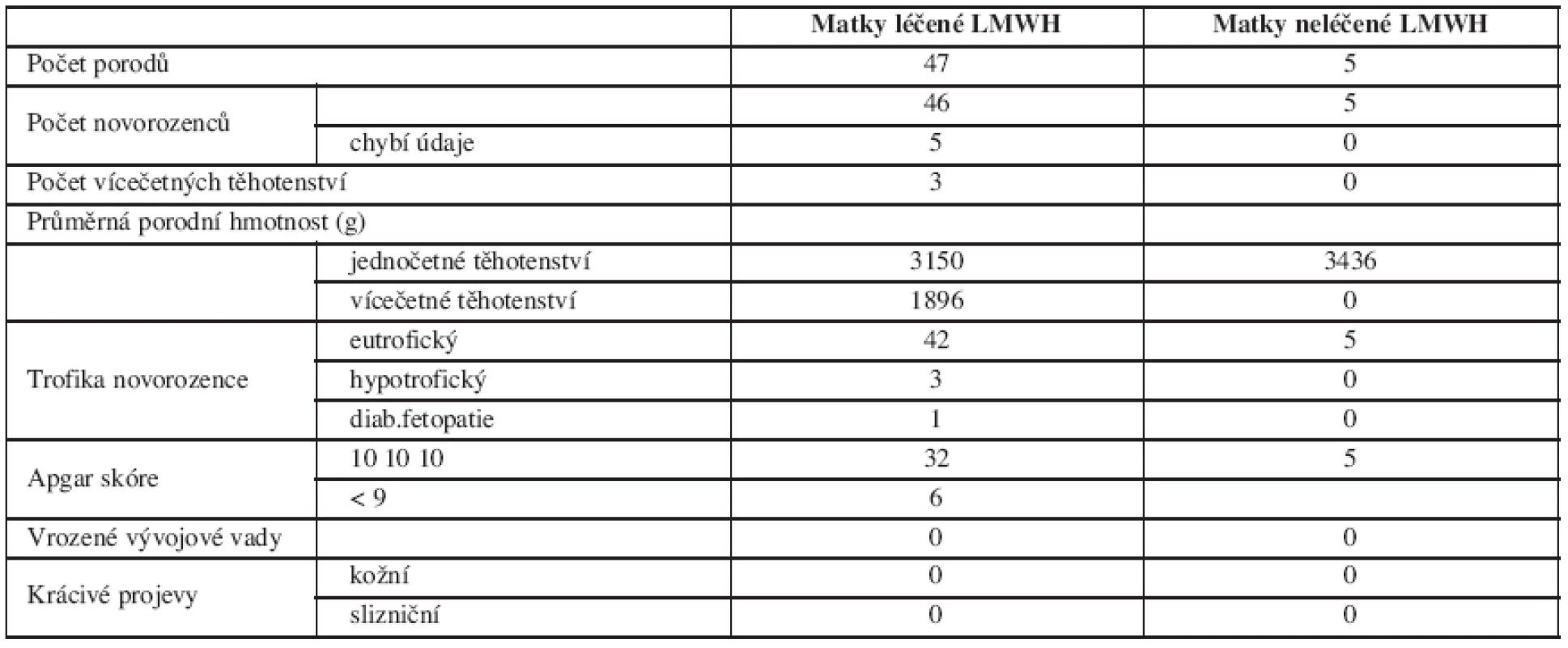
Komentář k výsledkům
Průměrná doba podávání LMWH byla 36 týdnů (25–40 týdnů). Enoxaparin byl podáván pouze 6 ženám, a to při kožních alergických projevech po s.c. aplikaci nadroparinu a u ženy s deficitem antitrombinu.
U 50 žen bylo bez ohledu na jejich hmotnost dosaženo žádané účinné inhibice FXa, která neovlivnila intenzitu fyziologických krevních ztrát při porodu a nedošlo ani k rozvoji závažného poporodního krvácení.
Fatální průběh měla gravidita u 22leté ženy s vrozeným těžkým deficitem antitrombinu (aktivita 40%), u níž z principu podání LMWH neúnčikuje. Tato žena potratila v 21. gestačním týdnu již druhé neúspěšné gravidity plod s gastroschízou. Tuto vrozenou vývojovou vadu nedáváme do příčinné souvislosti s deficitem AT. Neúspěšně skončila i přes zajištění LMWH gravidita po 3. neúspěšné IVF u 31leté ženy s APS, u níž došlo k rozvoji hyperstimulačního syndromu (HSS) a abortu v devátém týdnu 2. gravidity (nosička mutací MTHFR C677T a A1298T v heterozygotních formách). Chromozomální aberace XYY prokázaná amniocentézou byla indikací k umělému přerušení těhotenství u 31leté ženy v 21. týdnu 4. gravidity po 2 předchozích spontánních abortech a porodu zdravé dcery v 1. graviditě ve 20 letech (asymptomatická nosička mutace MTHFR C677T v homozygotní formě).
Poslední neúspěšně končící 2. gravidita skončila stejně jako první gravidita této ženy v 31. týdnu porodem chlapce s IUGR, který zemřel měsíc po porodu. Pacientka se léčí pro autoimunitní tyreoiditidu, kromě toho je nosičkou homozygotní formy mutace MTHFR C677T. Zejména hypofunkce štítné žlázy se může na habituálním potrácení jako multifaktoriálně zapříčiněném stavu spolupodílet.
Průměrná porodní hmotnost novorozenců žen léčených LMWH se významně nelišila od průměrné porodní hmotnosti novorozenců žen, které LMWH nedostávaly. Hypotrofické byly plody narozené předčasně a jejich stupeň maturace odpovídal pokročilosti těhotenství. Příčina předčasných porodů se nejeví jako zcela zřejmá. Žádný novorozenec neměl kožní ani slizniční krvácivé projevy. Nezaznamenali jsme ani jeden výskyt HIT.
Vyšetření kostní denzity jsme prováděli v rozmezí 6 až 24 týdnů po porodu, většina žen se po porodu na vyšetření z různých důvodů vůbec nedostavila. Přesto lze konstatovat, že ze 17 vyšetřených žen sledovaného souboru mělo 11 žen po dlouhodobé aplikaci LMWH kostní denzitu v pásmu fyziologické normy, u 5 žen byla zjištěna osteopenie a kritéria osteoporózy byla splněna pouze u 1 pacientky.
Statistické zhodnocení výsledků
Základním problémem statistického zhodnocení tohoto souboru je nízká početnost kontrolního souboru „zdravých“ žen. S touto výhradou byl testem dobré shody metodou χ2 vztah podávání heparinu na porod zdravého dítěte zhodnocen jako statisticky významný na hladině významnosti 0,001 a tato významnost byla potvrzena i Fisherovým exaktním testem.
DISKUSE
Ze souboru 51 sledovaných žen s anamnézou opakovaných těhotenských ztrát se 47 z nich dočkalo při následném dalším těhotenství s dlouhodobou aplikací LMWH zdravého dítěte. U 30 žen šlo o porod prvorozeného zdravého dítěte po několika stresujících neúspěších, aniž by bylo těhotenství provázeno jinými než psychickými potížemi. Sami nejsme na základě série provedených laboratorních testů přesvědčeni o antitrombotickém účinku heparinu, a proto se nám výsledky experimentálních prací Salmonové zdají zajímavé.
Salmonová protektivní vliv heparinu podávaný těhotných ženám s opakovaným potrácením nezpochybňuje, zpochybňuje však jeho antitrombotický účinek při sub-antikoagulačních dávkách, a to i u žen s jinou trombofilií, než kterou je APS. Uvažuje o možném vlivu na diferenciaci trofoblastu a následně i snazší implantaci nebo o aktivaci protizánětlivých pochodů na úrovni leukocytární adheze limitující rozsah následného tkáňového poškození.
U heparinu je již dlouho znám i jeho imunologický efekt spočívající v inhibici aktivace komplementu. Z experimentu na myším modelu je prokázáno, že pasivní přenos lidských antifosfolipidových protilátek (aPL) způsobí excesivní aktivaci komplementu ve fetomaternálním prostoru, a to je právě ta základní příčina ztráty zárodku. Inhibice aktivace komplementu chrání před růstovou retardací či odumřením zárodku. Myši deficientní ve složkách B, C4, C3 a C5 komplementu mají zárodek rezistentní k poškození aPL a léčba heparinem (nefrakcionovaným či nízkomolekulárním v preventivní dávce) zabrání aktivaci komplementu in vivo i in vitro. Tuto funkci však ani fondaparinux, ani hirudin nemá, a přestože mají nesporný antikoagulační potenciál, nedovedou poškození zárodku aPL protilátkami zabránit. Mechanismy, kterými heparin příznivě redukuje těhotenské ztráty, je natolik komplikovaný, že se s jistotou nejedná o pouhou inhibici geneze trombinu. Na druhé straně je těhotenství tak složitý a individuální proces, že opakované potrácení musí mít multifaktoriální etiologii [16].
V současné době prakticky chybějí klinické studie sledující vliv nízkomolekulárních heparinů na stav kostního metabolismu gravidních žen, takže dosud nemáme k dispozici srovnání stavu kostního metabolismu u žen před těhotenstvím a pak po několikaměsíčním podávání preventivní dávky LMWH [9].
Vzhledem ke skutečnosti, že gravidita je fyziologicky hyperestrogenní stav provázený hyperkalcémií, na níž se podílí kromě jiných mechanismů i placenta a zvýšenou hladinou vitamin D, je gravidita z hlediska rozvoje osteoporózy považována za méně rizikové období než následné období plné laktace, kdy ztráta kostní denzity (BMD) může dosánout 1 až 3 % měsíčně. Z hlediska rozvoje osteoporózy je rizikovým i III. trimestr gravidity a nulliparita [9], s níž se setkáváme u většiny žen našeho souboru. Proto považujeme za součást léčebného protokolu u gravidních žen na dlouhodobé prevenci LMWH vyšetření kostního metabolismu nejpozději do 2 měsíců po porodu, aby bylo možno včas léčebně zasáhnout.
Z literatury je známo, že HIT se při preventivním podávání LMWH nevyskytuje a je pouze komplikací léčebných dávek heparinu.
Dlouhodobá léčba preventivní dávkou LMWH je z hlediska matky i novorozence účinná a bezpečná a řeší i mnoho psychosociálních i medicínsko-ekonomických problémů.
Práce byla podpořena grantem IGA MZ, NR 8917 – 3.
Seznam zkratek
APC – aktivovaný protein C
ACCP – American College of Chest Physicians
APS – antifosfolipidový syndrom
BMI – body mass index
DIC – diseminovaná intravaskulární koagulace
DNA – deoxyribonukleová kyselina
HAK – hormonální antikoncepce
HIT – heparinem indukovaná trombocytopenie
IUFD – intrauterinní odúmrtí plodu
IUGR – intrauterinní růstová retardace
IVF – in vitro fertilizace
LMWH – nízkomolekulární heparin
MTHFR – metylentetrahydrofolátreduktáza
OHSS – ovariální hyperstimulační syndrom
TEN – tromboembolická nemoc
USG – ultrasonografie
MUDr. Zdeňka Hajšmanová
Hematologický úsek
ÚKBH FN a LF UK Plzeň
Alej svobody 80
304 60 Plzeň
e-mail: hajsmanova@fnplzen.cz
Zdroje
1. Brenner, B. Thrombophilia and pregnancy loss in first intended pregnancy. J Thromb Haemost, 2005, 3, p. 2176–2177.
2. Brenner, B. Antithrombotic prophylaxis for women with thrombophilia and pregnancy complications – Yes. J Thromb Haemost, 2003, 1, p. 2070–2072.
3. Brenner, B. Maternal anticoagulant prophylaxis for prevention of pregnancy loss in women with trombophilia. J Thromb Haemost, 2003, 1, p. 416–417.
4. Brenner, B., Hoffman, R., Carp, H., et al. for the LIVE - ENOX investigators. J Thromb Haemost, 2005, 3, p. 227–229.
5. Carp, H., Dolitzky, M., Inbal, A. Thromboprophylaxis improves the live birth rate in women with consecutive recurrent miscarriages and hereditary thrombophilia. J Thromb Haemost, 2003, 1, p. 433–438.
6. De Groot, PD., Derksent, RHWM. Pathophysiology of the antiphospholipid syndrome. J Thromb Haemost, 2005, 3, p. 1854–1860.
7. Gris, JC., Mares, P. The long and winding road towards LMWH for pregnacy loss. J Thromb Haemost, 2005, 3, p. 224–226.
8. Gris, JC., et al. Low-molecular-weight heparin versus low dose aspirin in women with one fetal loss and a constitutional thrombophilic disorder. Blood, 2004, 103, 10, p. 3695–3699.
9. Jenšovský, K. Konference o sekundární osteoporóze. Plzeň, duben 2008.
10. Levi, M. All heparins are equal, but some are more equal than others. J Thromb Haemost, 2003, 1, p. 884–885.
11. Lindquist, PG. Low molecular weight heparin for repeated pregnancy loss: is it based on solid evidence? J Thromb Haemost, 2003, 3, p. 221–223.
12. Middeldorp, S. Thrombophilia and pregnancy complications: cause of association? J Thromb Haemost, 2007, 5 (Suppl. 1), p. 276-282.
13. Pabinger, I., Grafenhofer, H., Kaider, A., et al. Risk of pregnancy-associated recurrent venous thromboembolism in women with a history of venous thrombosis. J Thromb Haemost, 2005, 3, p. 949–954.
14. Rey, E., David, M. Fetal loss, thrombophilia and heparin:the clinician’s dilemma. J Thromb Haemost, 2005, 3, p. 782–783.
15. Walker, D. The use of LMWH in pregnacies at risk: new evidence or perception? J Thromb Haemost, 2005, 3, p. 778–793.
16. Salmon, JE. Are heparins effective in some patiens with recurrent pregancy loss because they inhibit complement activation? J Thromb Haemost, 2005, 3, p. 783–784.
17. Seventh ACCP Consensus Conference on Antithrombotic Therapy. Bates, SM., Greer, IA., Hirsch, J., Ginsberg, JS. Use of antithrombotic agents during pregnancy. Chest, 2004, 126, p. 627S - 644S.
18. Ulcova-Gallova. Z., Krauz, V., Novakova, P., et al. Anti - phospholipid antibodies against phosphatidylinositol, and phosphatidylserine are more significant in reproductive failure than antibodies against cardiolipin only. Amer J Reprod Immunol, 54, 2005, s. 112–117.
19. Ulčová-Gallová, Z. Neplodnost – útok imunity. Praha: Grada, 2006, s. 144.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek vyšel v časopiseČeská gynekologie

2008 Číslo 5-
Všechny články tohoto čísla
- Řešení stresové inkontinence moči u žen operační medotou TVT-S – vztah mezi léčebným efektem operační metody a změnami hodnot ultrazvukových parametrů
- Průběh těhotenství při dlouhodobém podávání nízkomolekulárního heparinu pro opakované těhotenské ztráty
- Ductus venosus Arantii v fetální žilní cirkulaci: anatomické a klinické aspekty
- Pozvánka na 2. konferenci
- Abdominální myomektomie 2200 g vážícího myomu ve 20. týdnu gravidity
- Rizika léčby vaginálních a poporodních infekcí a jejich bezpečnost pro plod
- Inaktivace genů BRCA1, BRCA2 a p53 u sporadického karcinomu vaječníků
- Císařský řez – indikace, nebo volba?
- Myomy, fertilita a těhotenství
- Jak blokovat menstruaci u těžce psychomotoricky retardované dívky v pubertě Opožděný příspěvek k diskusi P. Čepického (Čes Gynek, 2007, 72, 5, s. 306)
- VZP ČR a prevence rakoviny děložního čípku
- Onkogynekologický seminář
- MVDr. Radslav Kinský 1928-2008
- NOVÉ KNIHY
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Průběh těhotenství při dlouhodobém podávání nízkomolekulárního heparinu pro opakované těhotenské ztráty
- Myomy, fertilita a těhotenství
- Císařský řez – indikace, nebo volba?
- Ductus venosus Arantii v fetální žilní cirkulaci: anatomické a klinické aspekty
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Archiv čísel