Vrozená imunita v patogenezi intraamniální infekce u těhotenství komplikovaného předčasným odtokem plodové vody
Innate immunity in pathogenesis of intraamniotic inflammation in pregnancies complicated by preterm premature rupture of membranes
Objective:
To give an overview about the role of the innate immunity in pathogenesis of intraamniotic inflammation in pregnancies complicated by preterm premature rupture of membranes.
Design:
Review article.
Setting:
Department of Clinical Immunology and Allergy, Faculty of Medicine and University Hospital in Hradec Kralove, Charles University in Prague.
Method:
An overview of recent published data.
Conclusion:
Immune system has an indisplaceable function throughout the successful pregnancy. Spontaneous labor is the result of many factors in which innate immunity playes a major role. The increased concentrations of proinflammatory markers (interleukin (IL)-1beta, IL-6, tumour necrosis factor alfa a IL-8) were found in amniotic fluid both in term and in preterm spontaneous delivery. These markers could be used for an early diagnosis of intraamnial infection/inflammation, which is the most common cause of preterm delivery (PTD) and preterm premature rupture of membranes (PPROM). The elevation of these markers could also better determine the patients with enhanced probability of PTD and PPROM.
Key words:
amniochorion, amniotic fluid, innate immunity, intraamniotic inflammation, preterm premature rupture of membranes, proinflammatory markers.
Autoři:
E. Flídrová; J. Krejsek
Působiště autorů:
Ústav klinické imunologie a alergologie, Lékařská fakulta Hradec Králové a Fakultní nemocnice, Hradec Králové, UK Praha, přednosta prof. RNDr. J. Krejsek, CSc.
Vyšlo v časopise:
Ceska Gynekol 2011; 76(1): 46-50
Souhrn
Cíl studie:
Podat přehled o úloze vrozené imunity v patogenezi intraamniální infekce u těhotenství komplikovaného předčasným odtokem plodové vody.
Typ studie:
Přehledový článek.
Název a sídlo pracoviště:
Ústav klinické imunologie a alergologie, Lékařská fakulta a Fakultní nemocnice UK v Hradci Králové.
Předmět a metoda studie:
Literární přehled recentních publikovaných dat.
Závěr:
Imunitní systém má nezastupitelnou funkci ve zdárném průběhu celého těhotenství. Ukončení těhotenství spontánním porodem je výsledkem mnoha faktorů, z nichž vrozená imunita hraje důležitou roli. Zvýšené koncentrace prozánětových markerů – interleukinu (IL)-1beta, IL-6, tumor nekrotizujícího faktoru (TNF)alfa a IL-8 – v plodové vodě jsou pozorovány jak u termínového, tak u předčasného spontánního porodu. Tyto ukazatelé by mohly být v budoucnu využívány k včasné diagnostice infekce a zánětlivých změn v intraamniální dutině, které jsou jednou z hlavních příčin předčasných porodů a předčasného odtoku plodové vody, a vymezit tak blíže ohroženou skupinu pacientek.
Klíčová slova:
amniochorion, intraamniální zánět, plodová voda, prozánětové markery, předčasný odtok plodové vody, vrozená imunita.
ÚVOD
Předčasný porod představuje jeden z nejzávažnějších problémů současného porodnictví. Významně se podílí na perinatální mortalitě a morbiditě novorozenců. Výskyt předčasných porodů (porod mezi 24. a 37. gestačním týdnem) se v České republice pohybuje okolo 6 %, zatímco ve Spojených státech amerických je jeho četnost až dvojnásobná. Předčasný odtok plodové vody (preterm premature rupture of membranes, PPROM) je charakterizován porušením integrity plodových obalů s následným odtokem plodové vody, který předchází minimálně 2 hodiny před nástupem děložních kontrakcí. Nastává zhruba u 3 % všech těhotenství a je zodpovědný za jednu třetinu předčasných porodů. Možnými komplikacemi jsou například předčasné odloučení placenty, pasivní apozice dělohy, neonatální sepse nebo syndrom respirační tísně novorozence. Ač přesná etiologie PPROM není zcela objasněna, došlo v posledním desetiletí ke značnému prohloubení poznatků o patofyziologických procesech v těhotenství vedoucích k předčasnému odtoku plodové vody. Nejrizikovějším faktorem se ukázala být infekce, resp. zánětlivá odpověď na infekci, která je asociována s více než 50 % případů PPROM a která většinou probíhá bez známek systémové reakce organismu [11]. Snaha porozumět patologickým mechanismům asociovaných s PPROM a identifikovat markery intraamniálního zánětu (intra-amniotic infection/inflammation, IAI) je podporována faktem, že počty PPROM a rovněž předčasných porodů stále stoupají [10]. Prozatím neexistuje objektivní ukazatel, jehož změna by měla význačnou vypovídací hodnotu v prenatální diagnostice IAI u pacientek s těhotenstvím komplikovaným PPROM. Informace o přítomnosti IAI je přitom zcela zásadní v klinických intervencích u pacientek s PPROM. Pouze v případech s vyloučením přítomnosti IAI je možno zvolit konzervativní postup se snahou o prodloužení gravidity umožňující dokončení kompletní léčby kortikosteroidy, které jsou nezbytné k indukci plicní tkáně plodu. V opačných případech je nutné těhotenství neodkladně ukončit.
Asociace mezi infekcí a předčasným porodem je zjevná a většina studií se přiklání k hypotéze, že infekcí indukovaná lokální exprese prozánětlivých cytokinů interleukinu (IL)-1β, IL-6, tumor nekrotizujícího faktoru (TNF)α a IL-8 v intraamniální dutině vede ke zvýšené produkci prostaglandinů, jenž podněcují mateřské myometriální buňky ke kontraktilní aktivitě a indukují zralost děložního hrdla [29].
Pravděpodobnost prematurity dále zvyšují cervikální inkompetence, vícečetná těhotenství, předčasný porod v anamnéze, nízký socioekonomický status či nízké BMI.
INFEKCE V TĚHOTENSTVÍ
Během těhotenství dochází k významným změnám v imunitním systému, které hrají zásadní roli při procesech, jakými jsou zdárná implantace plodového vejce, vývoj placenty, a zejména dlouhodobá tolerance plodu, jenž se jeví z pohledu částečně rozdílných alelických forem molekul HLA imunitnímu systému matky jako semialogenní. Nicméně určitá odpovídavost imunitního systému v reprodukčních orgánech ženy musí být zachována. Nedostatečná imunitní odpověď na infekční agens může být pro plod stejně fatální jako hyperreaktivita.
Invaze bakterií probíhá ve většině případů ascendentní cestou z vaginy skrze cervikální kanál. Následným transplacentárním přenosem bakterie prostupují přes plodové obaly plodu do amniální tekutiny a v nejzávažnějších případech až do fetální krve. Alternativní možností je invaze bakterií z matčiny krve přes placentu do plodových membrán [4, 11]. Pomocí molekulární metody polymerázové řetězové reakce (polymerase chain reaction, PCR) byly odhaleny nejčastěji se vyskytující bakterie v plodové vodě u žen s předčasným porodem. Šlo především o Mycoplasma hominis, Ureaplasma spp., Chlamydia trachomatis, Streptococcus mitis či Fusobacterium nucleatum [6]. Na druhou stranu je třeba si uvědomit, že samotná přítomnost bakterií, či dokonce pouhý průkaz specifických genových sekvencí technikou PCR neznamená automaticky infekci obalů a plodu.
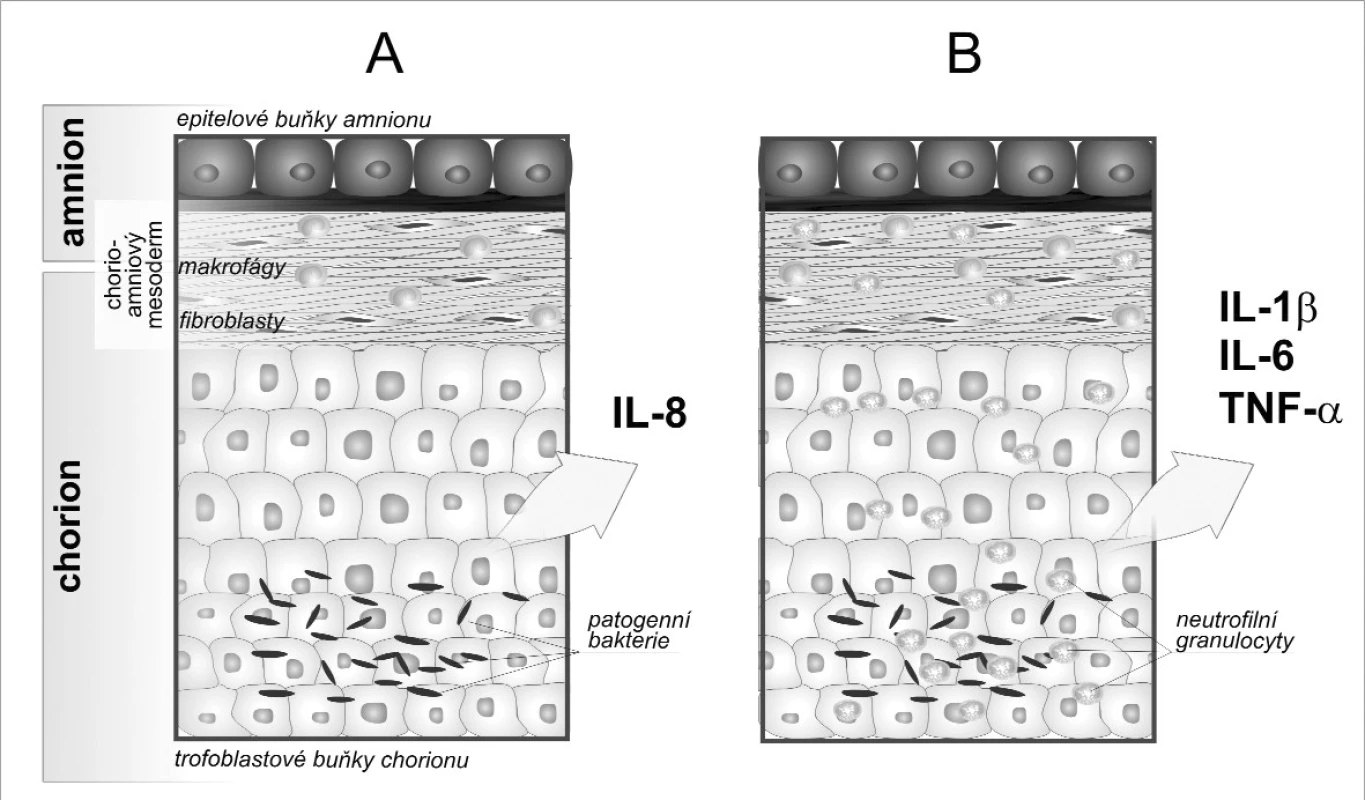
Mikrobiální invaze amniální dutiny (microbial invasion of the amniotic cavity, MIAC) doprovázená intraamniálním zánětem bývá často asociována s PPROM. Chorioamnionitida probíhá ve většině případů bez systémových klinických příznaků, tj. bez horečky nebo leukocytózy. Jde o tzv. subklinickou histologickou chorioamnionitidu (histological chorioamnionitis, HCA). Typickým znakem HCA jako projevu mateřské lokální zánětlivé odpovědi je infiltrát zánětových buněk, nekrotické buňky, edém tkáně či stopy po jejím zhojení [25]. Diagnóza HCA se potvrzuje histopatologicky přítomností již zmíněného infiltrátu v amnionu, chorion-deciduální tkáni, choriové ploténce a pupečníku. Diagnóza je tedy možná až po porodu. Vyšetřování vybraných imunologických markerů zánětu v plodové vodě by mohlo vést k dřívějšímu odhalení pacientek s rizikem předčasného porodu a včasné lékařské intervenci (obr. 1).
RECEPTORY PRO NEBEZPEČNÉ VZORY
K identifikaci patogenních agens dochází v urogenitálním ústrojí ženy pomocí receptorů pro nebezpečné vzory (pattern recognition receptors, PRRs) buněk vrozené imunity (transmembránových, intracelulárních a solubilních PRRs). Receptory PRR jsou v různé denzitě vyjádřeny i na buňkách „neimunní“ povahy, které se v tomto kompartmentu nacházejí.
Mezi membránově vázané PRRs patří lektiny typu C, vychytávací (scavengerové) receptory a zejména toll-like receptory (TLRs), které rozeznávají různorodé ligandy mikroorganismů, jako lipopolysacharidy (LPS), peptidoglykan, flagelin, jedno- a dvojvláknovou RNA. Nedávná studie potvrdila expresi funkčních TLR-2, TLR-3, TLR-4, TLR-5 a heterodimeru TLR-7,8 u placentálních makrofágů, trofoblastových buněk a infiltrujících hematopoetických buněk v placentě zdravých rodiček a zároveň prokázala zvýšenou produkci prozánětových cytokinů TNF, IL-6, IL-10 a IL-8 po stimulaci buněk TLRs ligandy [21]. Také se ukázalo, že u spontánního termínového porodu i předčasného porodu pacientek s HCA významně stoupá exprese TLR-2 a TLR-4 v chorioamniálních obalech [17], což naznačuje důležitost přirozeného imunitního systému v iniciaci porodu. Zásadní roli v zahájení zánětlivé odpovědi hraje tkáň trofoblastu, která, jak bylo ověřeno, je schopna rozlišit LPS pocházející z patogenních bakterií od LPS uvolněného komenzálními gramnegativními bakteriemi. Mechanismus identifikace nebezpečných agens je založen na odlišné expresi TLRs ve vrstvách trofoblastu v prvním trimestru těhotenství. Zatímco cytotrofoblast (vnitřní část – z pohledu od plodu) vykazoval silnou pozitivní imunoreaktivitu pro TLR-2 a TLR-4, syncytiotrofoblast (zevní část) byl pro oba receptory negativní [1]. Tento výsledek podporuje hypotézu, že placenta odpovídá pouze na ty mikroorganismy, které penetrují skrze fyzikální bariéru a prostupují do TLR-pozitivních tkáňových kompartmentů. Analogie vymezené exprese TLRs jako v trofoblastu lze nalézt u intestinálních epiteliálních buněk. Epiteliální buňky TLRs exprimují na své bazolaterální straně, takže reagují pouze na patogenní bakterie invadující z apikální části buněk na rozdíl od komenzálů, jenž na povrchu buněk adherují [8].
Nejznámějším receptorem PRR je bezesporu C-reaktivní protein (CRP) ze skupiny krátkých pentraxinů, jenž se označuje v tělních tekutinách jako klasický protein akutní fáze. Mezi hlavní funkce CRP patří opsonizace patogenů, aktivace klasické dráhy komplementové kaskády nebo indukce exprese cytokinů v monocytech. Zároveň brání adhezi neutrofilů na endotelové buňky, a tím znesnadňuje migraci do míst zánětu. Řadí se tak mezi důležité regulační molekuly imunitního systému. Je produkován hepatocyty jako odpověď na cirkulující prozánětlivé cytokiny a jeho koncentrace je rutinně vyšetřována v mateřské krvi v případech podezření na zánětlivé komplikace v graviditě, kdy nelze použít zvýšený počet leukocytů (fyziologická těhotenská leukocytóza). Bylo zjištěno, že vysoké hodnoty CRP (>8 mg/L) v mateřské plazmě v časné graviditě, dvojnásobně zvyšují riziko předčasného porodu. Tato asociace byla silněji pozorována u spontánního než u indikovaného předčasného porodu. Tím je posílen fakt, že IAI reprezentovaný zvýšením koncentrace CRP, může vyústit v předčasný porod [22]. Na druhou stranu CRP je příliš nespecifický marker zánětu a lékařská intervence pouze na základě jeho zvýšených hodnot není oprávněná. Aktuální metaanalýza nepovažuje zvýšené hladiny CRP v mateřském séru za spolehlivý prediktor HCA u gravidit komplikovaných PPROM, vzhledem k přílišné heterogenitě výsledků studií [18]. Prognosticky cennější jsou informace o hladině CRP v plodové vodě odebrané ve druhém trimestru těhotenství, neboť koncentrace CRP vyšší než 110 ng/mL v plodové vodě zvyšuje riziko předčasného porodu a PPROM až osminásobně. S ohledem na vyšší molekulární hmotnost (106 kDa), neprochází CRP přes placentální bariéru, a proto zřejmě jde pouze o CRP produkovaný játry plodu v reakci na zánětlivý podnět. To potvrzují i studie, kde nebyly nalezeny žádné korelace mezi hladinami CRP v plodové vodě a séru matky [9].
Jako vhodný ukazatel IAI se jeví molekula pentraxinu 3 (PTX3) měřená v plodové vodě. PTX3 spadá mezi tzv. dlouhé pentraxiny a je rovněž považován za protein akutní fáze, jehož koncentrace rychle stoupá po zahájení imunitní odpovědi. Na rozdíl od CRP je produkován mnoha typy buněk – mononukleárními, dendritickými, endotelovými – jako odpověď na prozánětlivé stimuly (LPS, IL1-β, TNF-α). Schopnost vytvářet PTX3 mají také buňky amniového epitelu nebo mezodermální buňky chorionu [27]. Recentní studie prokázala signifikantně vyšší koncentrace PTX3 v plodové vodě u pacientek s intramniálním zánětem v porovnání se skupinou bez zánětu [16].
CHEMOKINY, PROZÁNĚTLIVÉ CYTOKINY, MATRIXOVÉ METALOPROTEÁZY
Intraamniální infekce spouští kaskádu zánětlivého procesu infiltrací leukocytů z intravaskulárního prostoru do děložní dutiny. Vstup buněk je závislý na sekreci chemokinů, rodině cytokinů o nízké molekulární hmotnosti, které chemotakticky působí na imunitní buňky a podporují je v prozánětové aktivaci. Uvolnění chemokinů představuje první biochemické propojení mezi infekcí a následnými strukturálními modifikacemi plodových obalů a děložního krčku, jenž předchází PPROM. Chemokin zodpovědný za vstup neutrofilů do tkání chorioamnionu a placenty se nazývá interleukin 8 (IL-8). Jeho hlavním zdrojem jsou buňky choriodeciduy, které jsou jako první kolonizovány patogeny při ascendentní intrauterinní infekci [30]. Bylo zjištěno, že pacientky s PPROM a potvrzenou HCA mají výrazně vyšší koncentrace IL-8 v plodové vodě v porovnání se skupinou bez histologických známek zánětu [14]. Proto se uvažuje o IL-8 jako o možném časném prognostickém markeru předčasného porodu a PPROM. Hladinu IL-8 lze také stanovit v cervikálním hlenu, kde byla prokázána pozitivní korelace mezi jeho koncentrací a rozvojem IAI a/nebo HCA [12]. IL-8 tak slouží jako neinvazivní indikátor intraamniální infekce.
Akumulace neutrofilů je zřejmá v chorioamniálních obalech, zatímco v přiléhající mateřské tkáni – deciduální tkáni – převažuje infiltrát makrofágů. Právě fagocytující buňky jsou nejdůležitějším zdrojem prozánětlivých cytokinů IL-1β, IL-6 a TNFα v plodové vodě podílejících se na amplifikaci zánětlivé odpovědi a korelujících s intenzitou klinických projevů IAI. Časná cytokinová odpověď indukována přítomností bakteriálních produktů, spočívá v uvolňování IL-1β a TNFα z obalu decidui a fagocytů. Jejich koncentrace se v plodové vodě výrazně zvyšuje s délkou trvající infekce [2]. IL-1β a TNFα stimulují syntézu kyseliny arachidonové, aktivují fosfolipázu A2 a tím podporují produkci prostaglandinů tkáňovými buňkami myometria [23]. IL-1β také aktivuje signální dráhu NF-κB, jejímž výsledkem je mimo jiné zvýšená exprese inducibilní cyklooxygenázy-2 (COX-2), která urychluje metabolismus kyseliny arachidonové a dále navyšuje hladinu prostaglandinů [3]. Efekt prostaglandinů na buňky myometria je aktivační – nastává eflux vápenatých iontů nutných k děložním kontrakcím.
IL-1β a TNFα rovněž stimulují myometrium k produkci matrixových metaloproteáz zvláště matrixové metaloproteázy-9 (MMP-9), tj. gelatinázy degradující kolagen typu IV, jenž je hlavním extracelulárním proteinem zodpovídajícím za integritu obalů amnionu a chorionu [26]. Exprese MMP-9 je indukována v plodových obalech, kde se během normálního porodu, PPROM a infekce stává majoritní MMP, která velkou měrou přispívá k narušení plodových obalů a zrání cervixu [20]. MMP-9 je proteolyticky aktivována MMP-2 a MMP-3, jejichž hladiny byly rovněž výrazně zvýšené, zatímco koncentrace tkáňového inhibitoru metaloproteázy 2 (TIMP-2) byla signifikantně snížena v plodové vodě u pacientek s PPROM v porovnání se skupinou pacientek rodících předčasně [7]. Navýšené hodnoty v plodové vodě byly také zaznamenány u MMP-8, preferenčně degradující intersticiální kolagen typu I, ve skupině pacientek s PPROM a MIAC na rozdíl od pacientek s PPROM bez infekce [19].
Rozporuplnou molekulou pro diagnostiku HCA a s tím spojeného rizika předčasného porodu či PPROM, se jeví mediátor zánětu IL-6. Ač vyšší hladina IL-6 v plodové vodě u pacientek s MIAC a/nebo HCA je potvrzena, řada prací zpochybňuje jeho prediktivní schopnost u pacientek s PPROM, neboť tento nárůst koncentrace není signifikantní jako v případech předčasného porodu [15]. Jeho produkce je indukována IL-1β a TNFα zejména v plodových obalech (amnion, chorion, decidua) a v infiltrujících makrofázích. Účinek prozánětového cytokinu IL-6 může být ještě umocněn jeho schopností stimulovat buňky myometria k expresi oxytocinových receptorů, čímž dochází ke zvýšené odpovídavosti tkáně na oxytocin [24]. IL-6 tak má důležitou roli i ve fyziologickém porodu. Další zajímavostí je, že zvýšená koncentrace IL-6 urychluje dozrávání fetální plicní tkáně podnícením alveolárních buněk typu II k expresi surfaktového proteinu A (SP-A), jehož hlavní funkcí je snižování povrchového napětí na styku vodní fáze a vzduchu v alveolech [28]. Koncentrace SP-A v plodové vodě dramaticky narůstá ve třetím trimestru těhotenství a fosfolipid obsažený v SP-A může sloužit jako zdroj kyseliny arachidonové, která je využita při syntéze prostaglandinů buňkami plodových obalů. Navíc SP-A aktivuje fetální makrofágy k migraci do dělohy a k produkci IL-1β. Bylo doloženo, že hladina SP-A koreluje se zralostí plodu a iniciací porodu. Například u myší injekční podání SP-A do plodové vody zapříčinilo předčasný porod [5].
ZÁVĚR
Na patogenezi PPROM se z velké části podílí porušení jemné imunologické rovnováhy mezi prozánětovými a protizánětovými markery jako důsledek probíhající IAI a/nebo HCA. Regulace počátku porodu je již delší dobu spojována s vlivem imunitního systému. Recentní studie poukázala na signifikantně vyšší koncentrace IL-6, IL-8 a TNFα v plodové vodě a častějším známkám chorioamnionitidy u žen, které rodily spontánně v termínu oproti ženám, jež rodily plánovaným císařským řezem [13]. Spouštěčem spontánního porodu v termínu se tak jeví zánětlivá odpověď, podobně jako u předčasných porodů.
Intraamniální infekce/zánět je nejčastější rizikový faktor asociovaný s předčasným porodem a PPROM. Infekce bývá asymptomatická, zapříčiněná ascendentní invazí bakterií z vaginy. Patogenní bakterie stimulují hostitelské tkáně a infiltrující imunokompetentní buňky přes PRRs k navýšení produkce proteinů akutní fáze CRP, PTX3 a prozánětových cytokinů IL-1β, IL-6, TNFα a IL-8. Tyto působky slouží jako primární signální síť, která následně podněcuje zejména buňky myometria k produkci efektorových molekul, jako jsou prostaglandiny nebo MMPs. Koncentrace všech výše uvedených markerů je možné sledovat v plodové vodě. Ačkoliv u většiny ukazatelů ještě neexistuje přesný konsenzus ohledně jejich prediktivní hodnoty předčasného porodu a PPROM, dá se předpokládat, že v budoucnu bude mít jejich správná interpretace nezastupitelnou úlohu v klinické praxi každého porodníka.
Práce byla podpořena Specifickým vysokoškolským výzkumem 2010-260906 a grantem Ministerstva zdravotnictví ČR IGA NS 10382-3/2009.
Mgr. Eva Flídrová
Ústav klinické imunologie a alergologie
Lékařská fakulta UK a Fakultní nemocnice v Hradci Králové
Sokolská 581
500 05 Hradec Králové
e-mail: flidrova@lfhk.cuni.cz
Zdroje
1. Abrahams, VM., Bole-Aldo, P., Kim, YM., et al. Divergent trophoblast responses to bacterial products mediated by TLRs. J Immunol, 2004, 173(7), p. 4286-4296.
2. Arntzen, KJ., KjŅllesdal, AM., Halgunset, J., et al. TNF, IL-1, IL-6, IL-8 and soluble TNF receptors in relation to chorioamnionitis and premature labor. J Perinat Med, 1998, 26(1), p. 17-26.
3. Belt, AR., Baldassare, JJ., Molnár, M., et al. The nuclear transcription factor NF-kappaB mediates interleukin-1beta-induced expression of cyclooxygenase-2 in human myometrial cells. Am J Obstet Gynecol, 1999, 181(2), p. 359-366.
4. Cahill, RJ., Tan, S., Dougan, G., et al. Universal DNA primers amplify bacterial DNA from human fetal membranes and link Fusobacterium nucleatum with prolonged preterm membrane rupture. Mol Hum Reprod, 2005, 11(10), p. 761-766.
5. Condon, JC., Jeyasuria, P., Faust, JM., Mendelson, CR. Surfactant protein secreted by the maturing mouse fetal lung acts as a hormone that signals the initiation of parturition. Proc Natl Acad Sci U S A, 2004, 101(14), p. 4978-4983.
6. DiGiulio, DB., Romero, R., Amogan, HP., et al. Microbial prevalence, diversity and abundance in amniotic fluid during preterm labor: a molecular and culture-based investigation. PLoS One, 2008, 3(8), p. e3056.
7. Fortunato, SJ., Menon, R. Distinct molecular events suggest different pathways for preterm labor and premature rupture of membranes. Am J Obstet Gynecol, 2001, 184(7), p. 1399-1405.
8. Gewirtz, AT., Navas, TA., Lyons, S., et al. Cutting edge: bacterial flagellin activates basolaterally expressed TLR5 to induce epithelial proinflammatory gene expression. J Immunol, 2001, 167(4), p. 1882-1885.
9. Ghezzi, F., Franchi, M., Raio, L., et al. Elevated amniotic fluid C-reactive protein at the time of genetic amniocentesis is a marker for preterm delivery. Am J Obstet Gynecol, 2002, 186(2), p. 268‑273.
10. Goldenberg, RL., Culhane, JF., Iams, JD., Romero, R. Epidemiology and causes of preterm birth. Lancet, 2008, 5, p. 75-84.
11. Goldenberg, RL., Hauth, JC., Andrews, WW. Intrauterine infection and preterm delivery. N Engl J Med, 2000, 342(20), p. 1500-1507.
12. Holst, RM., Laurini, R., Jacobsson, B., et al. Expression of cytokines and chemokines in cervical and amniotic fluid: relationship to histological chorioamnionitis. J Matern Fetal Neonatal Med, 2007, 20(12), p. 885-893.
13. Houben, ML., Nikkels, PG., van Bleek, GM., et al. The association between intrauterine inflammation and spontaneous vaginal delivery at term: a cross-sectional study. PLoS One, 2009, 4(8), p. e6572.
14. Kacerovsky, M., Drahosova, M., Hornychova, H., et al. Value of amniotic fluid interleukin-8 for the prediction of histological chorioamnionitis in preterm premature rupture of membranes. Neuro Endocrinol Lett, 2009, 30(6), p. 733-738.
15. Kacerovský, M., Drahošová, M., Hornychová, H., et al. Interleukin 6 v plodové vodě pacientek s předčasným odtokem plodové vody. Čes Gynek, 2009, 74, 6, s. 403-410.
16. Kacerovsky, M., Tosner, J., Drahosova, M., et al. Pentraxin 3 in amniotic fluid as a marker of intra-amniotic inflammation in women with preterm premature rupture of membranes. Int J Gynaecol Obstet, 2010, 108, p. 203-206.
17. Kim, YM., Romero, R., Chaiworapongsa, T., et al. Toll-like receptor-2 and -4 in the chorioamniotic membranes in spontaneous labor at term and in preterm parturition that are associated with chorioamnionitis. Am J Obstet Gynecol, 2004, 191(4), p. 1346-1355.
18. Laar, R., Ham, DP., Oei, SG., et al. Accuracy of C-reactive protein determination in predicting chorioamnionitis and neonatal infection in pregnant women with premature rupture of membranes: a systematic review. Eur J Obstet Gynecol Reprod Biol, 2009, 147(2), p. 124-129.
19. Maymon, E., Romero, R., Pacora, P., et al. Human neutrophil collagenase (matrix metalloproteinase 8) in parturition, premature rupture of the membranes, and intrauterine infection. Am J Obstet Gynecol, 2000, 183(1), p. 94-99.
20. Maymon, E., Romero, R., Pacora, P., et al. Evidence of in vivo differential bioavailability of the active forms of matrix metalloproteinases 9 and 2 in parturition, spontaneous rupture of membranes, and intra-amniotic infection. Am J Obstet Gynecol, 2000, 183(4), p. 887-894.
21. Patni, S., Synem, LP., Sester, AL., et al. Expression and activity of toll-like receptors 1–9 in the human term placenta and changes associated with labor at term. Biol Reprod, 2009, 80(2), p. 243‑248.
22. Pitiphat, W., Gillman, MW., Joshipura, KJ., et al. Plasma C-reactive protein in early pregnancy and preterm delivery. Am J Epidemiol, 2005, 162(11), p. 1108-1113.
23. Pollard, JK., Mitchell, MD. Effects of gestational age on prostaglandin production and its regulation in human myometrial cells. J Matern Fetal Med, 1996, 5(2), p. 93-98.
24. Rauk, PN., Friebe-Hoffmann, U., Winebrenner, LD., Chiao, JP. Interleukin-6 up-regulates the oxytocin receptor in cultured uterine smooth muscle cells. Am J Reprod Immunol, 2001, 45(3), p. 148-153.
25. Redline, RW. Inflammatory responses in the placenta and umbilical cord. Semin Fetal Neonatal Med, 2006, 11(5), p. 296‑301.
26. Roh, CR., Oh, WJ., Yoon, BK., Lee, JH. Up-regulation of matrix metalloproteinase-9 in human myometrium during labour: a cytokine-mediated process in uterine smooth muscle cells. Mol Hum Reprod, 2000, 6(1), p. 96-102.
27. Rovere-Querini, P., Antonacci, S., Dell’Antonio, G., et al. Plasma and tissue expression of the long pentraxin 3 during normal pregnancy and preeclampsia. Obstet Gynecol, 2006, 108, p. 148-155.
28. Shimoya, K., Taniguchi, T., Matsuzaki, N., et al. Chorioamnionitis decreased incidence of respiratory distress syndrome by elevating fetal interleukin-6 serum concentration. Hum Reprod, 2000, 15(10), p. 2234-2240.
29. Smith, R. Parturition. N Engl J Med, 2007, 356(3), p. 271-283.
30. Zaga-Clavellina, V., Garcia-Lopez, G., Flores-Herrera, H., et al. In vitro secretion profiles of interleukin (IL)-1beta, IL-6, IL-8, IL-10, and TNF alpha after selective infection with Escherichia coli in human fetal membranes. Reprod Biol Endocrinol, 2007, 5, p. 46.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2011 Číslo 1
Nejčtenější v tomto čísle
- Vede užívání psychotropních látek k rizikovému sexuálnímu chování?
- Fatální průběh neonatální infekce citrobakterem a jeho právní posouzení
- Prevence tvorby adhezí a jejich léčba
- Poruchy ženské sexuální touhy – prevalence, klasifikace a možnosti terapie
