Mutace v genech ovlivňujících plodnost mužů – současná rutinní laboratorní genetická diagnostika a hledání dalších úseků DNA a genů, ovlivňujících spermatogenezi
Mutations in genes affecting fertility of men – current routine laboratory genetic diagnostics and searching for more DNA segments and genes influencing spermatogenesis
Objective:
To present the results of molecular genetics analysis in men with reproductive disorders focusing on the DNA segments and genes which affect spermatogenesis.
Design:
Original article.
Setting:
Institute of Biology and Medical Genetics of the First Faculty of Medicine and General Teaching Hospital, Prague.
Methods:
One hundred and twenty-three patients identified with a fertility disorder were screened for mutations of the CFTR gene. In all patients were performed cytogenic analysis and assessment of Y-chromosome microdeletions. In 107 patients where the fertility was not detected by routine examination we performed an analysis for X-chromosome microdeletions (CNV64, CNV67, CNV69) and in certain genes necessary for normal spermatogenesis (AGFG1, CAPZA3, CNTROB, HOOK1, GOPC, SPATA16).
Results:
Our results did not reveal any negative efffects of X-chromosome microdeletion on spermatogenesis. Analysis of six genes showed in two patients in gene SPATA16 a homozygotic haplotype [1526C>T + 1577T>C] which can be most probably responsible for the fertility in two examined patients.
Conclusion:
According to our results we do not recommend introduction of X-chromosome microdeletions assays in areas CNV64 , CNV67 and CNV69 into routine diagnostic. Regarding the selected genes affecting spermatogenesis, our results showed that homozygotic haplotype [ 1526C>T + 1577T>C] in SPATA16 gene is very likely responsible for infertility in two of our patients. The above mentioned haplotype deserves attention in the investigation of male infertility.
Keywords:
male infertility, X-chromosome microdeletions, AGFG1 gene, CAPZA3 gene, CNTROB gene, HOOK1 gene, GOPC gene, SPATA16 gene
Autoři:
I. Hrdlička 1; B. Chylíková 1; K. Veselá 1; M. Daňková 1; M. Janků 1; K. Řežábek 2; R. Mihalová 1; F. Liška 1
Působiště autorů:
Ústav biologie a lékařské genetiky 1. LF UK a VFN, Praha, přednostka doc. MUDr. M. Kohoutová, CSc.
1; Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha, přednosta prof. MUDr. A. Martan, DrSc.
2
Vyšlo v časopise:
Ceska Gynekol 2016; 81(6): 437-443
Souhrn
Cíl studie:
Prezentace výsledků molekulárně genetických vyšetření u mužů s poruchami reprodukce se zaměřením na výzkum úseků DNA a genů ovlivňujících spermatogenezi.
Typ studie:
Původní práce.
Název a sídlo pracoviště:
Ústav biologie a lékařské genetiky 1. LF UK a VFN Praha.
Metodika:
U 123 mužů s poruchami reprodukce jsme provedli rutinní laboratorní diagnostiku, tj. cytogenetické vyšetření, molekulárně genetické vyšetření mutací v CFTR genu a diagnostiku mikrodelecí chromozomu Y. U 107 pacientů bez záchytu patologie výše uvedeným rutinním vyšetřením jsme vyšetřili mikrodelece chromozomu X (CNV64, CNV67, CNV69) a vybrané geny ovlivňující spermatogenezi (AGFG1, CAPZA3, CNTROB, HOOK1, GOPC, SPATA16).
Výsledky:
U postižených mužů jsme neprokázali negativní vliv vybraných mikrodelecí chromozomu X na spermatogenezi. V rámci vyšetřovaných šesti genů jsme nalezli u dvou pacientů v genu SPATA16 homozygotní haplotyp [1526C>T + 1577T>C], který je pravděpodobně odpovědný za neplodnost obou vyšetřovaných mužů.
Závěr:
Podle našich vyšetření není účelné zavádět do rutinní diagnostiky vyšetření mikrodelecí chromozomu X v oblastech CNV64, CNV67 a CNV69. Pokud jde o vybrané geny ovlivňující spermatogenezi, naše výsledky ukázaly, že homozygotní haplotyp [1526C>T + 1577T>C] v genu SPATA16 je velmi pravděpodobně zodpovědný za neplodnost u dvou našich pacientů. Zmíněný haplotyp zasluhuje pozornost při vyšetřování mužské neplodnosti.
Klíčová slova:
mužská neplodnost, mikrodelece chromozomu X, gen AGFG1, gen CAPZA3, gen CNTROB, gen HOOK1, gen GOPC, gen SPATA16
ÚVOD
Neplodností trpí podle některých údajů až 15 % heterosexuálních párů v reprodukčním věku s tím, že zhruba v polovině případů je příčinou neplodný muž [16]. Porucha plodnosti mužů je způsobována mnoha faktory, z nichž některé mohou být genetické. Zde se v kontextu rutinní laboratorní diagnostiky neplodných mužů zaměříme na mikrodelece chromozomu X a dále na některé z genů, které jsou nezbytné pro poslední část spermatogeneze, tj. spermiogenezi. Mutace těchto genů obecně způsobují neobstrukční samčí sterilitu s oligo/teratozoospermií a zřejmě mohou vést až k azoospermii.
RUTINNÍ DIAGNOSTIKA V GENETICKÉ LABORATOŘI
Rutinní laboratorní genetické vyšetření u sterilních mužů spočívá jednak v cytogenetické analýze karyotypu, dále v molekulárně-genetické diagnostice mutací v CFTR genu a také v detekci mikrodelecí v oblasti AZF na chromozomu Y.
Cytogenetická analýza
Cytogenetické vyšetření odhalí u sterilních pacientů syndromy způsobené aneuploidií gonozomů, zejména Klinefelterův syndrom (47,XXY) vyskytující se u zhruba 3 % neplodných mužů [2]. Cytogenetickým vyšetřením jsou na mikroskopické úrovni zjištěny také strukturní aberace chromozomů, které bývají často spojeny s infertilitou páru, jež je dána početím života neschopných embryí s nadbytečnou či chybějící genetickou informací. U mužů se strukturálními aberacemi chromozomů se tedy nemusí jednat o postižení spermatogeneze, které by se promítlo do patologického spermiogramu.
Diagnostika mutací v CFTR genu
Mutace v CFTR genu nejsou mutacemi, které by ovlivňovaly vlastní spermatogenezi, vyšetřují se však proto, že způsobují obstrukci vas deferens až CBAVD (kongenitální bilaterální absenci vas deferens). U neplodných mužů se CBAVD vyskytuje v 1–5 % a tito pacienti mívají v 50–60 % mutace na obou alelách CFTR genu [4].
Detekce mikrodelecí na chromozomu Y
Delece v oblasti AZF (AZospermia Factor) na chromozomu Y se vyšetřují proto, že se v tomto úseku DNA vyskytuje řada genů důležitých pro spermatogenezi. Přehled genů z oblasti AZF uvádí např. Yu XW et al. [23]. U neplodných pacientů je záchyt mikrodelecí v AZF na chromozomu Y zhruba 7 % [16], nicméně u rutinní diagnostiky bez selekce, která by zohlednila ostatní klinické nálezy pacientů, klesne záchyt pod 2 % [20].
NOVĚ ZKOUMANÉ OBLASTI DNA A „SINGL“ GENY S POTENCIÁLEM OVLIVNIT SPERMATOGENEZI
Mikrodelece chromozomu X
V roce 2012 publikoval mezinárodní tým španělských a italských autorů své výsledky vyšetření chromozomu X u 96 neplodných mužů pomocí array-CGH. Výsledky vyšetření porovnávali autoři s kontrolní skupinou 103 mužů s normospermií. Zmíněná práce ukázala u čtyř pacientů malou (5,42 Kb) deleci oblasti CNV67 (Copy number variation 67), lokalizovanou na dlouhých raménkách X chromozomu v oblasti Xq28. Tato delece se nevyskytovala u zdravých kontrol [11].
Obdobný španělsko-italský tým publikoval v roce 2014 další práci, ve které srovnával 627 pacientů trpících idiopatickou sterilitou s kontrolní skupinou 627 normospermických mužů. Tato práce, využívající PCR na tři vytipované oblasti CNV dlouhých ramének chromozomu X, potvrdila asociaci mezi delecí CNV67 a poruchou mužské plodnosti nálezem zmíněné delece u sedmi pacientů s tím, že u normospermiků se delece nevyskytla. Dále byly zjištěny asociace s mužskou neplodností u dalších dvou delecí na X chromozomu, konkrétně šlo o deleci oblasti CNV64 (lokalizované na Xq27.3) a CNV69 (lokalizované na Xq28). Obě nově popsané delece se sice vyskytovaly i u normospermických mužů, avšak u mužů sterilních byl výskyt těchto delecí statisticky významně zvýšený [14].
Geny ovlivňující spermiogenezi
Pokusy na myších a potkanech ukázaly, že spermatogeneze je ovlivňovaná řadou genů, jejichž mutace jsou samy o sobě schopny způsobit postižení ve smyslu patologického spermiogramu.
V databázi „mouse genome informatics“ [3] bylo v květnu 2016 uvedeno již přes 1000 genotypů vedoucích k samčí neplodnosti „MP:0001925 – male infertility“, viz http://www.informatics.jax.org/searches/Phat.cgi?id=MP:0001925
Lidské geny (zde zejména tzv. ortology ke genům myším a potkaním), které jsme zařadili do této studie, způsobují u zkoumaných savců postižení spermiogeneze na základě autozomálně recesivní dědičnosti. Je tedy nutné poškození obou alel konkrétního genu [12, 16, 17, 22]. Zde jsme se zaměřili na následující geny:
AGFG1 (HRB)
Gen AGFG1 (ArfGAP with FG repeats 1) se nachází na chromozomu č. 2 a kóduje protein, který je asociovaný s vývojem proakrozomálních váčků ve spermiích. Při vyřazení tohoto genu z funkce nemůže u myších samců vzniknout v přední části hlavičky spermie akrozom, který je nezbytný při průniku spermie do vajíčka [10].
CAPZA3
Gen CAPZA3 (capping protein /actin filament/muscle Z-line, alpha 3), se nachází na chromozomu č. 12 a kóduje protein, který je regulátorem aktinového cytoskeletu. Missense mutace tohoto genu vedou u myší ke komplexní poruše formování hlavičky a bičíku spermie [6].
CNTROB
Gen CNTROB (centrosome BRCA2 interacting protein), se nachází na chromozomu č. 17 a kóduje protein centrobin, který je lokalizován v centriolu a akroplaxomu spermie. Mutace tohoto genu způsobuje u potkanů poruchu tvarování hlavičky spermie a poruchu spojení bičíku s hlavičkou spermie [13, 22].
HOOK1
Gen HOOK1 (poprvé bylo užito pojmenování hook gen podle mušího genu schopného ovlivnit zahnutí chloupků do tvaru háku u mušky Drosophila melanogaster) se nachází na chromozomu č. 1 a kóduje stejnojmenný protein, který se účastní mikrotubulárního transportu. U skupiny HOOK genů je popsán pleiotropní efekt. U myší vede nepřítomnost HOOK1 genu k poruše vývoje spermatid a vytváření hákovité struktury hlavičky spermie [15, 18].
GOPC
Gen GOPC (Golgi associated DPZ domain contatining protein), se nachází na chromozomu č. 6 a kóduje protein nezbytný pro tvorbu proakrozomálních váčků. U myší vede nepřítomnost tohoto genu k poruše vývoje spermatid s abnormalitami hlavičky i bičíku spermie [21, 24].
SPATA16
Gen SPATA16 (spermatogenesis associated protein 16), se nachází na chromozomu č. 3 a jeho mutace byla detekována u tří bratrů postižených globozoospermií, což je forma teratozoospermie, při které dochází ke změně tvaru hlavičky spermie v důsledku ztráty akrozomu [5].
SOUBOR A METODIKA (S VÝSLEDKY RUTINNÍ DIAGNOSTIKY)
Soubor pacientů a jejich rutinní vyšetření
Do této studie bylo původně zařazeno 172 pacientů s poruchou plodnosti danou patologickým spermiogramem (azoo-, oligo-, asteno-, kryptozoo-, terato- spermie) a přibližně 12 měsíci pravidelného nechráněného pohlavního styku, při kterém nedošlo k otěhotnění partnerky. Muži s kolísavým spermiogramem nebyli do studie zařazeni. Spermiogram byl hodnocen podle kritérií „WHO laboratory manual for the Examination and processing of human semen (fifth edition)“. Biologický materiál (periferní krev) pacientů přicházel do laboratoře s žádankou na rutinní genetickou diagnostiku bez detailního spermiogramu (ten lze pro konkrétního pacienta dožádat zpětně přes genetickou ambulanci obvykle v příslušném Centru asistované reprodukce). Výše uvedených 172 pacientů je možno na základě spermiogramu rozdělit takto: 77 oligoastenospermiků, 47 azoospermiků, 28 oligoastenoteratospermiků, 14 oligospermiků, pět astenospermiků, jeden kryptozoospermik. Jako kontrolní skupinu jsme na mikrodelece chromozomu X a varianty ve vybraných „singl“ genech vyšetřili 131 mužů s normálním spermiogramem (hodnocené parametry spermiogramu >5. percentil).
U všech 172 pacientů původně zařazených do studie bylo (podle požadavků indikujících lékařů) provedeno rutinní cytogenetické vyšetření optickými mikroskopy (hodnocení karyotypu při G-pruhování na minimálně 550 bphs – bands per haploid set). Dále byla všem 172 pacientům provedena rutinní molekulárně genetická diagnostika (DNA z periferní krve) mutací v CFTR genu (CE IVD kit ViennaLab CF StripAssay, Austria) s tím, že u polymorfismu IVS-8 T(5) se vyšetřovala varianta TG (CE IVD kit Devyser CFTR Core, Sweden) kvůli zpřesnění interpretace výsledků [7]. Nakonec byla u všech 172 pacientů provedena diagnostika mikrodelecí Y chromozomu v oblasti AZF (CE IVD kit Devyser AZF, Sweden).
Pro potřebu této studie jsme však z další – již jen výzkumné – diagnostiky vyloučili 49 pacientů (28,5 %) většinou s klinickými nálezy, které naznačovaly, že porucha mužské plodnosti zde může být způsobena jinými než zkoumanými cytogenetickými a molekulárně genetickými faktory. Jednalo se zejména o pacienty s varikokélou, hormonálními poruchami, tumory, urologickými infekcemi a kryptorchismem. Mezi vyloučenými z výzkumné diagnostiky se ocitlo i několik pacientů jiné než české národnosti, protože jsme chtěli tuto studii zaměřit na mutační spektrum vybraných genů u mužů z české populace (pro případné mezipopulační srovnání).
Do studie, hodnotící jak rutinní laboratorní genetická vyšetření, tak zejména naše nálezy ve smyslu mikrodelecí chromozomu X a mutací vybraných genů, bylo tedy zařazeno 123 pacientů. Cytogenetickým vyšetřením jsme u devíti pacientů (7,3 %) s azoospermií zjistili Klinefelterův syndrom (karyotyp 47,XXY). Molekulárně genetické vyšetření odhalilo u šesti pacientů (4,9 %) mikrodeleci v oblasti AZF na chromozomu Y (z toho tři pacienti měli azoospermii, dva oligoastenospermii a jeden oligoastenoteratospermii). Molekulárně genetickým vyšetřením jsme detekovali mezi azoospermiky také jednoho složeného heterozygota (0,8 %) pro mutace v CFTR genu.
Rutinní genetická laboratorní vyšetření odhalila příčinu neplodnosti u 16 pacientů (13 %) ze souboru 123 pacientů, kteří splnili námi nastavené podmínky na klinický nález. U 107 zbývajících pacientů bylo následně provedeno a vyhodnoceno vyšetření na přítomnost mikrodelecí chromozomu X a sekvenace vybraných genů.
Mikrodelece chromozomu X
Vyloučení a průkaz mikrodelecí chromozomu X bylo provedeno (DNA z periferní krve) u 107 pacientů a 131 kontrol s využitím PCR a následné horizontální elektroforézy úseků DNA z oblastí mikrodelecí CNV64, CNV67 a CNV69. V rámci mikrodelece CNV69 bylo možno specifikovat i menší deletované úseky, a tak jsme mikrodeleci CNV69 mohli rozdělit na podtypy A, B a C. Sekvence primerů a podmínky PCR byly převzaty z literatury [14]. Pro upřesnění začátků a konců jednotlivých podtypů A, B a C mikrodelece CNV69 byly příslušné produkty PCR sekvenovány. Bližší informace o primerech a metodice lze nalézt v publikaci naší pracovní skupiny [9].
Geny ovlivňující spermiogenezi
U 107 pacientů bylo na platformě NGS (next generation sequencing) sekvenováno s využitím přístroje GS Junior od firmy Roche šest výše specifikovaných genů (AGFG1 (HRB), CAPZA3, CNTROB, HOOK1, GOPC, SPATA16), které prokazatelně ovlivňují spermiogenezi savců.
U 131 kontrol byla provedena buď výše zmíněná sekvenace na platformě NGS, nebo byly varianty zjištěné u pacientů hledány u kontrol pomocí restrikčního štěpení příslušných PCR produktů, popř. byly použity alelově specifické primery.
DNA (popř. cDNA u vybraných úseků genů CNTROB, HOOK1, GOPC) jednotlivých pacientů byla amplifikována s využitím primerů, navržených tak, že produkty PCR pokryly kódující oblasti všech šesti vyšetřovaných genů. Sekvence primerů je k dispozici na dotaz u autorů.
Výsledky byly nejprve vyhodnoceny v sekvenátoru softwarem (GS Reference Mapper). Následně byly s využitím databáze SNP (The Single Nucleotide Polymorphism database) viz http://www.ncbi.nlm.nih.gov/projects/SNP/snp_summary.cgi a s pomocí tabulkového procesoru přiřazeny jednotlivým variantám jejich identifikátory a funkce. Varianty, v kódujících oblastech mimo variant synonymních, které se nenašly v homozygotní formě u kontrol, byly vyhodnoceny třemi predikčními programy: Polyphen-2 [1], Sift [19] a Provean [8].
VÝSLEDKY VÝZKUMNÉ DIAGNOSTIKY
Mikrodelece chromozomu X
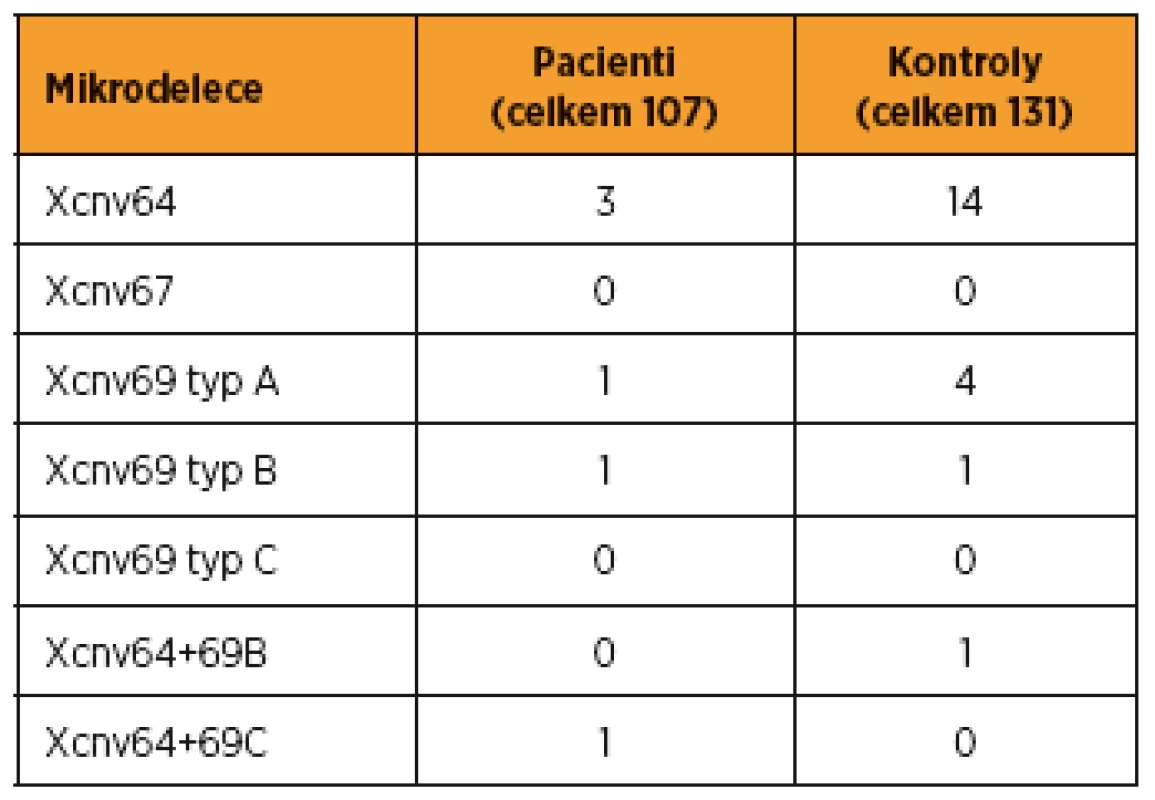
Ve skupině 107 mužů s abnormálním spermiogramem (bez záchytu patologie v rámci rutinní laboratorní genetické diagnostiky) jsme při vyšetření mikrodelecí chromozomu X nalezli u tří pacientů (2,8 %) izolovanou deleci CNV64, u dvou pacientů (1,9 %) izolovanou deleci CNV69 (z toho jednou CNV69 typu A, jednou CNV69 typu B) a u jednoho pacienta (0,9 %) dokonce dvě různé delece, a to CNV64 a CNV69 typu C. Delece CNV67 nebyla u našich pacientů zjištěna.
V kontrolní skupině 131 mužů s normálním spermiogramem jsme nalezli u 14 mužů (13,1 %) izolovanou deleci CNV64, u pěti mužů (3,8 %) izolovanou deleci CNV69 (z toho čtyřikrát CNV69 typu A, jednou CNV69 typu B) a u jednoho muže (0,8 %) dvě různé delece, a to CNV64 a CNV69 typu B. Ani u mužů s normálním spermiogramem nebyla zjištěna delece CNV67. Přehled výsledků vyšetření mikrodelecí chromozomu X u našich pacientů s poruchami reprodukce a u kontrolní skupiny fertilních mužů viz v tab. 1. Podrobněji jsou tyto výsledky (tvořící část grantového projektu) uvedeny v naší předcházející práci [9].
Geny ovlivňující spermiogenezi
Ve skupině 107 mužů s abnormálním spermiogramem (bez záchytu patologie v rámci rutinní laboratorní genetické diagnostiky) jsme při vyšetření kódujících oblastí šesti vybraných genů nalezli kromě variant synonymních, také varianty následující (kódy dle výše zmíněné databáze SNP):
AGFG1 (ref. sekvence NM_004504.4) = 1x heterozygot pro missense variantu rs61752216; 1x heterozygot pro missense variantu rs144407737.
CAPZA3 (ref. sekvence NM_033123.3) = 1x heterozygot pro missense variantu rs61912355; 1x heterozygot pro missense variantu rs117330813; 1x heterozygot pro missense variantu rs146799170.
CNTROB (ref. sekvence NM_001037144.5) = 18x heterozygot a 17x homozygot pro missense variantu rs11650083; 5x heterozygot pro missense variantu rs62623385; 3x heterozygot pro missense variantu rs78236778; 1x heterozygot pro missense variantu rs748617832.
SPATA16 (ref. sekvence NM_031955.5) = 1x heterozygot a 1x homozygot pro missense variantu rs1515441; 1x heterozygot a 1x homozygot pro missense variantu rs1515442; 2x homozygot pro missense variantu rs115095786; 2x homozygot pro missense variantu rs626227782. Poznamenejme, že homozygotní missense varianta rs115095786 se vyskytla u dvou pacientů společně s variantou rs626227782 jako haplotyp.
U genů HOOK1 (ref. sekvence NM_015888.4) a GOPC (ref. sekvence NM_001017408.2) jsme žádnou nesynonymní variantu v kódujících oblastech nenašli.
U kontrolní skupiny mužů s normálním spermiogramem uvádíme jenom zjištění podstatná k nálezům u pacientů (blíže viz Diskuse). Bylo zjištěno, že:
Homozygot pro missense variantu rs11650083 v genu CNTROB byl detekován i u zdravých kontrol.
Homozygot pro missense variantu rs1515441 v genu SPATA16 byl detekován i u zdravých kontrol.
Homozygotní missense varianta rs115095786 společně s variantou rs62622782 jako haplotyp v genu SPATA16 nebyla detekována u zdravých kontrol. Tyto dvě varianty nebyly detekovány u zdravých kontrol ani samostatně (ve smyslu heterozygozity).
DISKUSE
Rutinní diagnostika
Obvyklé genetické vyšetření u sterilních mužů (cytogenetická analýza, diagnostika mutací v CFTR genu a detekce mikrodelecí v oblasti AZF na chromozomu Y) objasnilo v našem souboru 172 pacientů u 9,3 % (16 mužů) příčinu postižení. Pokud se ze souboru vyloučí pacienti s klinickými nálezy, naznačujícími, že porucha plodnosti zde může být způsobena jinými než cytogenetickými a molekulárně genetickými faktory (v našem případě asi čtvrtina pacientů), potom se záchyt samozřejmě zvýší. Ze souboru 172 pacientů tak po vyřazení 49 mužů zůstalo 123 pacientů, u kterých 16 detekovaných patologií tvoří již 13% záchyt.
Mikrodelece chromozomu X
V našich souborech pacientů a kontrol jsme nezachytili mikrodeleci CNV67, a nemůžeme se proto vyjádřit k jejímu výskytu – dosud zaznamenanému jinými autory jen u infertilních mužů. Zmíněná mikrodelece se podle jihoevropských autorů [11, 14] vyskytuje jen u přibližně 1 % infertilních mužů v rámci zkoumaných souborů infertilních mužů z Itálie a Španělska. Je možné, že pokud bychom hodnotili větší soubor českých infertilních mužů, tak by se nám mikrodeleci CNV67 podařilo zachytit. Nelze také vyloučit, že v populaci českých infertilních mužů bude zastoupení CNV67 ještě menší než v hodnocených souborech z jižní Evropy.
Ostatní naše nálezy nepotvrdily závěry jiných autorů [14], kteří uvádějí statisticky významně zvýšený výskyt mikrodelecí CNV64 a CNV69 u sterilních mužů oproti zdravým kontrolám. Naše závěry jsou dokonce v případě mikrodelece CNV64 statisticky významně opačné. Nelze však asi hned tvrdit, že mikrodelece CNV64 a CNV69 mají snad protektivní účinek na mužskou neplodnost. Zdá se totiž, že v oblasti CNV64 a CNV69 na chromozomu X se nenacházejí žádné kódující geny. Proto je možné, že zmíněné oblasti nemají žádný (nebo mají zanedbatelný) vliv na mužskou plodnost a rozdíly ve frekvenci mikrodelecí mezi zkoumanými soubory jsou třeba jenom rozdíly mezipopulační. Detailnější diskuse a statistické zpracování zde uvedených výsledků, viz naši předcházející práci [9].
Geny ovlivňující spermiogenezi
V této práci bylo možno vyhodnotit zejména homozygotní varianty zkoumaných genů ovlivňujících spermiogenezi, a to proto, že se jedná o geny, jejichž patologický vliv je autozomálně recesivní. Z tohoto pohledu zasluhuje pozornost homozygotní missense varianta rs115095786 (c.1526C>T, p.A509V) v genu SPATA16, která se u 2 (1,9 %) ze 107 pacientů objevila společně s variantou rs62622782 (c.1577T>C, p.M526T) jako haplotyp [1526C>T + 1577T>C]. Připočteme-li pacienty se záchytem patologií způsobujících mužskou neplodnost z rutinní diagnostiky, potom se haplotyp [1526C>T + 1577T>C] v homozygotní formě vyskytl dvakrát (1,6 %) ve skupině 123 pacientů. U zdravých kontrol tyto varianty nebyly detekovány ani samostatně. Variantu rs115095786 označily predikční programy jako „damaging“ (program Sift) a „probably damaging“ (program Polyphen-2) s tím, že program Provean označil uvedenou variantu jako „neutral“. Variantu rs62622782 označily predikční programy jako „tolerated“ (program Sift) dále „benign“ (program Polyphen-2) a „neutral“ (program Provean). Výše uvedený genotyp jsme detekovali konkrétně u jednoho pacienta s astenospermií (tři patologické spermiogramy s průměrem pohyblivých spermií = 23 %, z toho průměr progresivně pohyblivých = 18,5 %, navíc s hraničním průměrem morfologicky normálních forem = 4,3 %) a u jednoho pacienta s kryptozoospermií (dva patologické spermiogramy, z toho první = kryptozoospermie – po centrifugaci cca 1 spermie/10 zorných polí, z toho asi 50 % pohyblivých, 99 % defektních; druhý spermiogram = azoospermie). Je-li výše popsaný genotyp kauzální pro postižení spermiogeneze našich pacientů, jak vyplývá z hodnocení predikčními programy, potom po IVF příp. spontánní koncepci nebudou postiženy dcery pacientů. Gen SPATA16 by totiž měl mít vliv pouze na spermiogenezi. U synů našich pacientů hrozí „jen“ porucha plodnosti, samozřejmě pouze v případě, že tito synové dostanou také od svých matek mutantní gen SPATA16. Lze rovněž konstatovat, že u pacientů–mužů by se mimo poruchy plodnosti nemělo objevit žádné další postižení.
Kombinace heterozygotních variant je v rámci jednotlivých genů těžké hodnotit, pokud nejsme schopni určit, zda jsou různé varianty navzájem v poloze „trans“ nebo „cis“. V našem souboru se však nevyskytly takové kombinace variant (možných složených heterozygotů), z nichž by se alespoň jedna nevyskytovala v homozygotní konfiguraci i u zdravých kontrol. Případné složené heterozygoty s mutacemi v poloze trans nemusíme tedy v této práci řešit.
ZÁVĚR
Naše práce ukázala, že není účelné zavádět u mužů s poruchami reprodukce do rutinní diagnostiky vyšetření mikrodelecí chromozomu X v oblastech CNV64, CNV67 a CNV69. Zmíněné mikrodelece buď pravděpodobně nemají patologický efekt (CNV64 a CNV69), nebo se jejich výskyt zdá být v naší populaci zanedbatelný (CNV67).
U vybraných šesti „singl“ genů, které ovlivňují spermiogenezi (AGFG1 (HRB), CAPZA3, CNTROB, HOOK1, GOPC, SPATA16), jsme odhalili jednu mutaci, resp. haplotyp, zasluhující pozornost. Jedná se o missense variantu c.1526C>T, p.A509V (rs115095786) v genu SPATA16, kterou dva predikční programy označily za (pravděpodobně) škodlivou. Zmíněná varianta se jako homozygotní vyskytla u našich pacientů dvakrát, a to vždy v kombinaci s benigní variantou c.1577T>C, p.M526T (rs62622782) jako haplotyp [1526C>T + 1577T>C]. Obě varianty tvoří spolu zřejmě komplexní alelu, která zasluhuje další pozornost a naše pracoviště se na ni u mužů s poruchami spermiogeneze v budoucnu zaměří.
Podpořeno grantem č. IGA MZ NT12269-5.
Mgr. Ivan Hrdlička, Ph.D.
Ústav biologie a lékařské genetiky
1. LF UK a VFN
Albertov 4
128 00 Praha 2
e-mail: hrdlickai@seznam.cz
Zdroje
1. Adzhubei, IA., Schmidt, S., Peshkin, L., et al. A method and server for predicting damaging missense mutations. Nat Methods, 2010, 7, p. 248–249.
2. Behre, HM., Bergmann, M., Simoni, M., Tüttelmann, F. Primary testicular failure. In: De Groot, LJ., Beck-Peccoz, P., Chrousos, G., et al., eds. Source Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000–2015 Aug 30.
3. Bult, CJ., Eppig, JT., Blake, JA., et al. Mouse Genome Database 2016. Nucleic Acids Res, 2016, 44(D1):D840–7. Epub 2015 Nov 17.
4. Castellani, C., Cuppens, H., Macek, M. Jr., et al. Consensus on the use and interpretation of cystic fibrosis mutation analysis in clinical practice. J Cyst Fibros, 2008, 7, p. 179–196.
5. Dam, AH., Koscinski, I., Kremer, JA., et al. Homozygous mutation in SPATA16 is associated with male infertility in human globozoospermia. Am J Hum Genet, 2007, 81, p. 813–820.
6. Geyer, CB., Inselman, AL., Sunman, JA., et al. A missense mutation in the Capza3 gene and disruption of F-actin organization in spermatids of repro32 infertile male mice. Dev Biol, 2009, 330, p. 142–152.
7. Hrdlička, I. Problematika interpretace výsledků molekulárně genetických vyšetření se zaměřením na mutace v CFTR genu u mužů s poruchami reprodukce a u dárců/dárkyň gamet. Čes Gynek, 2008, 73, 6, s. 323–327.
8. Choi, Y., Sims, GE., Murphy, S., et al. Predicting the functional effect of amino acid substitutions and indels. PLoS One, 2012, 7, e46688.
9. Chylíková, B., Hrdlička, I., Veselá, K., et al. Recurrent microdeletions at Xq27.3-Xq28 and male infertility: a study in the Czech population. PLoS ONE, 2016, 11(6), e0156102.
10. Kierszenbaum, AL., Tres, LL., Rivkin, E., et al. The acroplaxome is the docking site of Golgi-derived myosin Va/Rab27a/b- containing proacrosomal vesicles in wild-type and Hrb mutant mouse spermatids. Biol Reprod, 2004, 70, p. 1400–1410.
11. Krausz, C., Giachini C., Lo Giacco D., Daguin, F., et al. High Resolution X Chromosome-Specific Array-CGH Detects New CNVs in Infertile Males. PLoS One, 2012, 7(10): e44887.
12. Liška, F. Selected genetic aspects of male infertility – what animal models tell us. Folia Biol (Praha), 2003, 49, p. 129–141.
13. Liska, F., Gosele, C., Rivkin, E., et al. Rat hd mutation reveals an essential role of centrobin in spermatid head shaping and assembly of the head-tail coupling apparatus. Biol Reprod, 2009, 81, p. 1196-1205.
14. Lo Giacco, D., Chianese, C., Ars, E., et al. Recurrent X chromosome-linked deletions: discovery of new genetic factors in male infertility. J Med Genet, 2014, 51, p. 340–344.
15. Maldonado-Baez, L., Cole, NB., Kramer, H., Donaldson, JG. Microtubuledependent endosomal sorting of clathrin-independent cargo by Hook1. J Cell Biol, 2013, 201, p. 233–247.
16. Massart, A., Lissens, W., Tournaye, H., Stouffs, K. Genetic causes of spermatogenic failure. Asian J Androl, 2012, 14, p. 40–48.
17. Matzuk, MM., Lamb, DJ. The biology of infertility: research advances and clinical challenges. Nat Med, 2008, 14, p. 1197–1213.
18. Mendoza-Lujambio, I., Burfeind, P., Dixkens, C., et al. The Hook1 gene is non-functional in the abnormal spermatozoon head shape (azh) mutant mouse. Hum Mol Genet, 2002, 11, p. 1647–1658.
19. Ng, PC., Henikoff, S. SIFT: Predicting amino acid changes that affect protein function. Nucleic Acids Res, 2003, 31, p. 3812–3814.
20. Simoni, M., Bakker, E., Krausz, C. EAA/EMQN best practice guidelines for molecular diagnosis of y-chromosomal microdeletions. State of the art 2004. Int J Androl, 2004, 27, p. 240–249.
21. Suzuki-Toyota, F., Ito, C., Toyama, Y., et al. Factors maintaining normal sperm tail structure during epididymal maturation studied in Gopc-/- mice. Biol reprod, 2007, 77, p. 71–82.
22. Wang, Y., Liska, F., Gosele, C., et al. A novel active endogenous retrovirus family contributes to genome variability in rat inbred strains. Genome Res, 2010, 20, p. 19–27.
23. Yu, XW., Wei, ZT., Jiang, YT., Zhang, SL. Y chromosome azoospermia factor region microdeletions and transmission characteristics in azoospermic and severe oligozoospermic patients. Int J Clin Exp Med, 2015, 8, p. 14634–14646.
24. Yao, R., Ito, C., Natsume, Y., et al. Lack of acrosome formation in mice lacking a Golgi protein, GOPC. Proc Natl Acad Sci USA, 2002, 99, p. 11211–11216.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2016 Číslo 6
Nejčtenější v tomto čísle
- Cervix skóre dle Bishopa a jeho modifikace
- Samovyšetření prsu. Ano, či ne?
- Ektopická gravidita v jizvě po císařském řezu
- Incidence císařského řezu a úspěšnost vaginálně vedeného porodu u těhotných po myomektomii
