Celiakia ako možná príčina niektorých gynekologicko-pôrodníckych ochorení
Coeliac disease as a possible cause of some gynecological and obstetric abnormalities
Objective:
To bring a review of available literature sources on the prevalence of coeliac disease and its possible impact on gynecological and obstetric disorders.
Design:
Review article.
Setting:
Gynecology and Obstetrics Clinic, Jessenius Faculty of Medicine, Comenius University in Bratislava, Martin, Slovakia.
Methods:
Analysis of literary sources.
Conclusion:
Coeliac disease is an autoimmune enteropathy caused by abnormal immune system response to gluten. Over the last decade when the prevalence of the disease increases rapidly confirming the relationship between coeliac disease and a range of reproductive disorders. Problems in this area are mostly confirmed in untreated women. Among the atypical symptoms of coeliac disease also include infertility such as delayed onset of menstruation, early menopause, secondary amenorrhea, infertility and pregnancy complications, such as recurrent abortions, intrauterine fetal growth restriction, small fetus for gestational age, low birth weight and premature birth.
Keywords:
coeliac disease, infertility, pregnancy complications
Autoři:
K. Fiolková; K. Biringer; M. Hrtánková; R. Fiolka; J. Danko
Působiště autorů:
Gynekologicko-pôrodnícka klinika UNM, Jesseniova lekárska fakulta UK, Martin
přednosta prof. MUDr. J. Danko, CSc.
Vyšlo v časopise:
Ceska Gynekol 2016; 81(6): 470-476
Souhrn
Cieľ práce:
Priniesť ucelený prehľad dostupných literárnych zdrojov o výskyte celiakie a jej možných vplyvoch na gynekologicko-pôrodnícke ochorenia.
Typ štúdie:
Prehľadová práca.
Názov a sídlo pracoviska:
Gynekologicko-pôrodnícka klinika, Jesseniova lekárska fakulta, Univerzita Komenského v Bratislave, Martin, Slovensko.
Metodika:
Analýza literárnych zdrojov.
Záver:
Celiakia je autoimunitná enteropatia spôsobená abnormálnou odpoveďou imunitného systému na lepok. Počas posledných desaťročí, kedy sa prevalencia ochorenia rapídne zvyšuje, sa potvrdzuje vzťah medzi celiakiou a širokou škálou ochorení reprodukčného systému. Problémy v tejto oblasti sa potvrdili prevažne u neliečených žien. Medzi atypické príznaky celiakie zahrňujeme aj poruchy plodnosti, ku ktorým patrí oneskorený začiatok menštruácie, včasná menopauza, sekundárna amenorea, infertilita a komplikácie tehotenstva, ako sú opakujúce sa potraty, vnútromaternicová reštrikcia rastu plodu, plody malé pre svoj gestačný vek, nízka pôrodná hmotnosť a predčasný pôrod.
KĽÚČOVÉ SLOVÁ:
celiakia, infertilita, komplikácie tehotnosti
ÚVOD
Celiakia je autoimunitné ochorenie tenkého čreva, ktoré sa vyvíja u geneticky citlivých jedincov po expozícii lepkom v strave. Prejavuje sa aj extraintestinálnymi príznakmi, ku ktorým patrí ohrozenie reprodukčného zdravia žien. Už v roku 1970 Morris a kolektív opísali tri pacientky s neliečenou celiakiou a neplodnosťou, ktoré všetky otehotneli po nasadení bezlepkovej diéty [36]. Cieľom mnohých štúdií je skúmať problémy plodnosti a patologických stavov v tehotnosti v súvislosti s diagnostikovanou aj nediagnostikovanou celiakiou.
CHARAKTERISTIKA OCHORENIA
Celiakia je autoimunitná enteropatia spôsobená abnormálnou odpoveďou imunitného systému na lepok – proteínovú frakciu pšenice, raže a ovsa v strave u geneticky predisponovaných jedincov. Najvýznamnejšie podklady ochorenia spôsobujú mutácie HLA-DQ2 a DQ8 na krátkom ramene šiesteho chromozómu. Táto zmena sa vyskytuje u väčšiny celiatikov. Zmeny imunity, zmeny priepustnosti sliznice tenkého čreva a celková náchylnosť k autoimunitným ochoreniam sú spôsobované aj mutáciami chromozómov 2, 5 a 19. Tieto gény sú zodpovedné za patologickú prezentáciu peptidov T-lymfocytom. Expozícia imunitného systému toxickému peptidu gliadínu môže podporovať zápalovú reakciu, a to jeho nestrávenými molekulami v podmienkach zvýšenej priepustnosti cez epitelovú bariéru čreva v interakcii s bunkami prezentujúcimi antigén (APC – angl. antigen presenting cells) v lamina propria [50]. Adaptívna imunitná odpoveď je sprostredkovaná CD4+ T lymfocytmi v lamina propria, kde sa peptidy gliadínu viažu prostredníctvom HLA-DQ2 a HLA-DQ8 molekúl na APC, čo vedie k produkcii prozápalového cytokínu – interferónu gama [44]. Ďalej dochádza k aktivácii B-lymfocytov a k produkcii protilátok, ako sú tzv. endomyziálne protilátky, protilátky proti tkanivovej transglutamináze (tTG) a anti-gliadínu [24]. Lokálny zápalový stav spôsobuje zmeny architektúry sliznice tenkého čreva vrátane zvýšenej infiltrácie lymfocytov do epitelových buniek klkov a atrofiu krýpt klkov (obr. 1) [16].
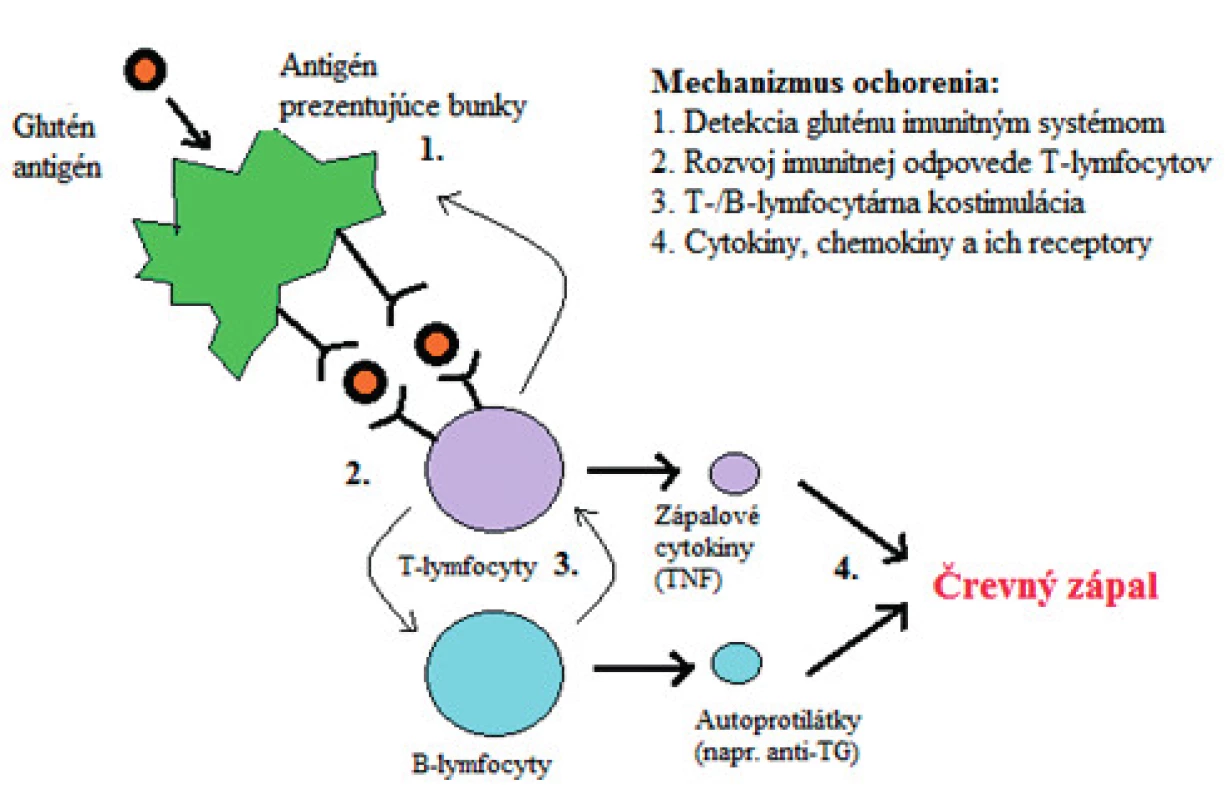
Prevalencia celiakie sa za posledných dvadsať rokov rapídne zvyšuje. Postihuje jedincov každej vekovej skupiny, viac sú ohrozené ženy ako muži [41]. Avšak iba 20–50 % postihnutých má subjektívne príznaky [13, 31, 54, 52]. Klasicky sa ochorenie prejavuje malabsorpciou, chronickou hnačkou, steatoreou, nadúvaním, únavou, nauzeou, zvracaním, chudokrvnosťou a rastovou retardáciou. Poznáme aj príznaky mimo gastrointestinálneho systému, ako sú psychické problémy, herpetiformná dermatitída, periférna neuropatia, znížená kostná denzita, ťažkosti v reprodukčnom živote mužov aj žien [12, 37, 30].
V rámci tohto ochorenia sa stretávame s tichou, potenciálnou či latentnou celiakiou [21]. Tichá celiakia sa vyskytuje u jedincov s poškodením čreva, avšak bez subjektívnych príznakov. Potenciálna celiakia sa prejavuje zvýšenými špecifickými sérovými autoprotilátkami a môžu aj nemusia sa u nej vyskytnúť subjektívne príznaky. Chýbajú pri nej dôkazy autoimunitného poškodenia črevnej sliznice. Pri latentnej celiakii majú jedinci normálnu slizničnú črevnú morfológiu, javia však známky enteropatie v závislosti od lepku od určitého okamihu života. Rôznorodosť klinického obrazu a atypické prípady môžu byť neadekvátne diagnostikované a môžu ohrozovať jedinca vznikom dlhodobých komplikácií, zvýšiť jeho chorobnosť až spôsobiť úmrtie [14].
Medzi atypické príznaky celiakie zahrňujeme aj poruchy plodnosti, ku ktorým patrí oneskorený začiatok menštruácie, včasná menopauza, sekundárna amenorea, infertilita a komplikácie tehotenstva, ako sú opakujúce sa potraty, vnútromaternicová reštrikcia rastu plodu (IUGR), plody malé pre svoj gestačný vek (SGA), nízka pôrodná hmotnosť (LBW) a predčasný pôrod [12].
Endomyziálne protilátky a protilátky proti tkanivovej transglutamináze sú považované za najcitlivejšie sérologicky špecifické testy vhodné pre skríning celiakie. Citlivosť testov oboch protilátok je viac ako 90 % [43]. Zlatým štandardom liečby je celoživotné vylúčenie lepku zo stravy, a tým prerušenie imunitnej odpovede spúšťanej lepkom [51].
CELIAKIA A OCHORENIA REPRODUKČNÉHO SYSTÉMU
Počas posledných desaťročí sa potvrdzuje vzťah medzi celiakiou a širokou škálou ochorení reprodukčného systému. Problémy v tejto oblasti sa potvrdili prevažne u neliečených žien, u ktorých sa zaznamenal vyšší vek menarché, skorá menopauza a zvýšený výskyt sekundárnej amenorey [45]. Iba jedna štúdia nepotvrdila dané poznatky [46]. Ochorenia reprodukčného systému sú priamo úmerne spojené s aktivitou celiakie. Ukázalo sa, že ženy s celiakiou a dlhodobou bezlepkovou diétou vykazujú rovnakú kvalitu reprodukčného zdravia ako skupina žien, ktoré dané ochorenie nemajú [15, 45, 49].
Súčasne sa dokázala súvislosť medzi neliečenou celiakiou a dĺžkou obdobia dojčenia, pričom ženy s nediagnostikovanou a neliečenou celiakiou vykazovali krátke obdobie dojčenia, až 2,5krát kratšie ako u bežnej populácie zdravých žien [6].
Americkí a talianski vedci vykonali retrospektívnu kohortovú štúdiu, v ktorej skúmali plodnosť žien s biopticky dokázanou celiakiou. Preukázalo sa v nej mnoho reprodukčných komplikácií, ku ktorým zaraďujeme nevysvetliteľnú neplodnosť, opakujúci sa samovoľný potrat, narodenie mŕtveho plodu, rastovú reštrikciu plodu, nízku pôrodnú hmotnosť. Išlo o neliečené matky, ktoré nevykazovali klasické príznaky malabsorpcie, trpeli najčastejšie tichou alebo latentnou celiakiou [23, 32, 39]. Tento stav viedol k predĺženiu expozície lepkom v strave, k oneskorenej diagnostike a k zvýšeniu negatívnych vplyvov ochorenia na organizmus ženy, vrátane komplikácií plodnosti.
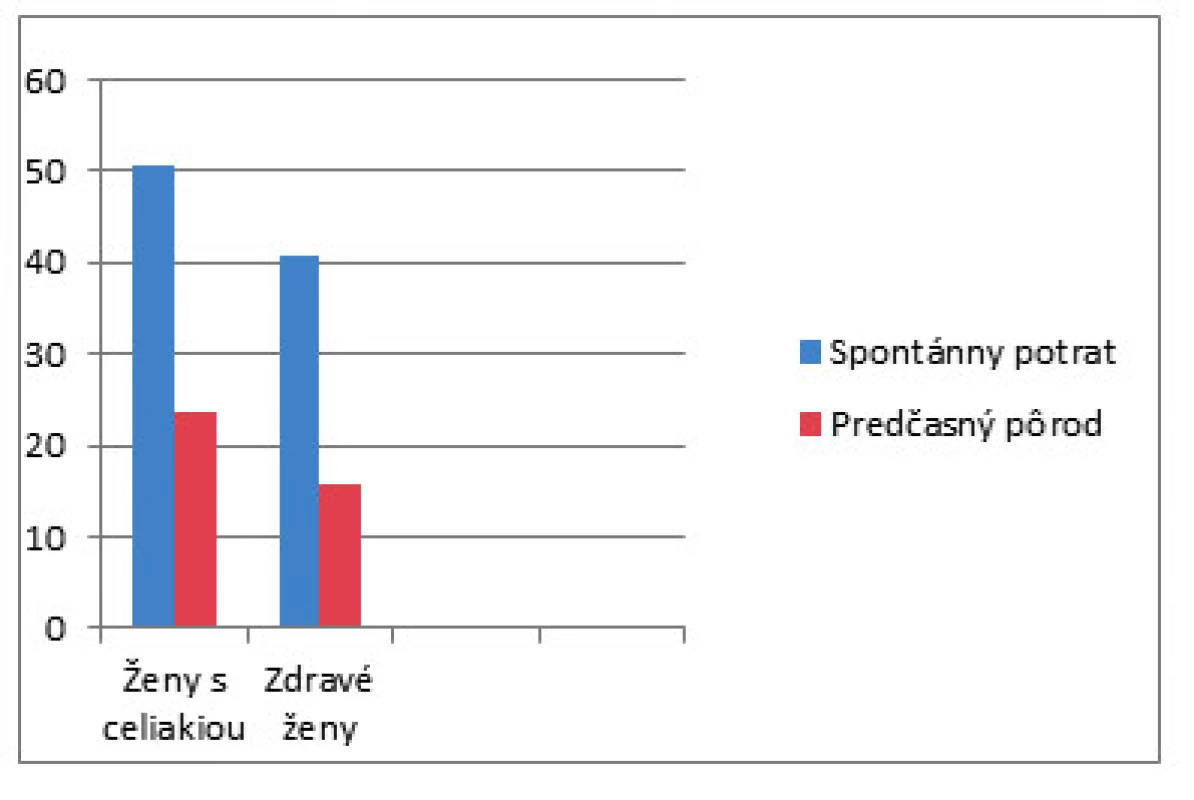
Spomínaná americká štúdia skúmala prevalenciu nediagnostikovanej celiakie v skupine pacientok s opakujúcimi sa idiopatickými potratmi, idiopatickými mŕtvo narodenými deťmi, nevysvetliteľnou neplodnosťou a idiopatickou rastovou reštrikciou plodu. Výsledkom bolo zistenie zvýšenej séropozitivity IgA a anti-tTG u týchto žien [28]. Spomínané komplikácie tehotnosti sa vyskytovali pred diagnostikovaním a vylúčením lepku zo stravy. Zistilo sa, že ženy s nediagnostikovaným ochorením majú 8,9násobne vyššie riziko potratu a 5,84násobne vyššie riziko nízkej pôrodnej hmotnosti dieťaťa v porovnaní s liečenými pacientkami (obr. 2), štatisticky významným zvýšením rizika vnútromaternicovej rastovej reštrikcie, s nízkou pôrodnou hmotnosťou (<2500 g), veľmi nízkou pôrodnou hmotnosťou (<1500 g) a predčasným pôrodom [29].
Aj Meloni a spol. hodnotili plodnosť u sérologicky a histologicky dokázanej celiakie [33, 34]. Prevalencia subklinickej formy celiakie bola významne vyššia u nevysvetliteľne neplodných žien ako u zdravej populácie (3,03 % oproti 1,06 %). Taktiež sa v tejto skupine zaznamenal vyšší výskyt spontánnych potratov v porovnaní s kontrolnou vzorkou. Výsledky daných štúdií sú stále kontroverzné. Mnoho vedeckých tímov preto opakovane vykonáva metaanalýzy doteraz publikovaných štúdií na objasnenie vzťahu medzi celiakiou a zvýšeným rizikom reprodukčného zlyhania žien.
SÚČASNÉ HYPOTÉZY GYNEKOLOGICKÝCH OCHORENÍ INDUKOVANÝCH CELIAKIOU
Patogenéza gynekologicko-pôrodníckych ochorení pri celiakii nie je úplne objasnená. Doteraz bolo navrhnutých niekoľko hypotéz, ktoré môžu byť rozdelené do dvoch hlavných kategórií: nedostatok živín a autoimunitné mechanizmy.
MALAPSORPCIA A NEDOSTATOK ŽIVÍN
Počas aktívneho ochorenia pred diagnostikovaním celiakie a dodržiavaním bezlepkovej diéty sa často u pacientok stretávame s nedostatkom živín, čo bolo historicky považované za hlavnú príčinu ich gynekologicko-pôrodníckych ochorení. Poškodenie štruktúr tenkého čreva charakteristické pre celiakiu vedie k malabsorpcii, čo sa môže prejaviť hematologickými abnormalitami, anémiou a ďalším selektívnym nedostatkom živín, ako selén, zinok a kyselina listová, ktoré hrajú významnú úlohu vo vývine plodu počas tehotnosti [17, 20, 25, 46, 56]. Nedostatok selénu a zinku zhoršuje syntézu a sekréciu luteinizačného hormónu (LH) a hormónu stimulujúceho folikuly (FSH), čo môže následne spôsobiť poškodenie mechanizmov hypotalamo-hypofyzýzovej osi, a tým navodiť sekundárnu amenoreu, samovoľné potraty a preeklampsiu [2, 3]. Napokon je dobre známe, že kyselina listová je nevyhnutný vitamín v metabolizme nukleových kyselín. Jej nedostatok má negatívny vplyv na rýchlo proliferujúce tkanivá, ktorým je aj embryo. Dickey a spol. skúmali možnosti vplyvu materskej celiakie na vznik ochorení fetálnej neurálnej trubice v súvislosti s nedostatkom kyseliny listovej v materskom organizme. Daný predpoklad sa im však nepodarilo potvrdiť, nakoľko výživové štúdie počas tehotnosti sú značne obmedzené [10]. Kötze a spol. zdôrazňovali nutričný stav ako dôležitý a relevantný faktor výsledku tehotnosti. Závažná podvýživa je v priamej korelácii s gynekologicko-pôrodníckymi ochoreniami. Dodržiavanie bezlepkovej diéty výrazne zlepšilo reprodukčné zdravie žien trpiacich celiakiou [27]. Na druhej strane, ženy s neplodnosťou spojenou s úplnou alebo čiastočnou atrofiou črevných klkov často nejavili príznaky ťažkej podvýživy a príznaky nedostatku stopových prvkov [7, 34, 47, 55]. Preto nemôžeme považovať nedostatok živín pri celiakii za hlavný patologický stav zodpovedný za reprodukčné poruchy.
AUTOIMUNITNÉ MECHANIZMY
V posledných rokoch boli skúmané nové patogénne mechanizmy, ktoré ukázali priame imunitne mediované zhoršenie fyziologických procesov prebiehajúcich v období implantácie embrya a vývinu placenty. Pacientky s nezistenou a neliečenou celiakiou vykazujú zvýšené koncentrácie najmä anti-tTG protilátok [11, 30], ktoré by okrem špecifického diagnostického markera mohli byť zapojené aj do porúch placentácie v tehotnosti. Anti-tTG protilátky indukujú apoptózu trofoblastu, vyvolávajú črevné a neurologické poškodenie, narušujú bunkový cyklus ľudských enterocytov, indukujú apoptózu nervových buniek [4, 5]. Dôvodom možnej priamej väzby cirkulujúcich anti-tTG protilátok do placentárnych buniek je dokázaná prítomnosť enzýmu tkanivová transglutamináza v mnohých tkanivách a orgánoch intracelulárne aj extracelulárne, v endometriálnych bunkách, v stromálnych a trofoblastových bunkách placenty, s vyššími koncentráciami v neskorých fázach tehotnosti [42]. Vzhľadom k tomu, že tTG v extracelulárnom prostredí je zapojená do výstavby extracelulárnej matrix a do adhézie buniek, šírenia a migrácie rôznorodých tkanív [40, 57], je pravdepodobné, že jeden alebo viac bunkových procesov sprostredkovaných tTG pravdepodobne zohráva kľúčovú úlohu v procese implantácie. Takto môže byť trofoblast cieľom materských protilátok u tehotných s celiakiou. Ukazuje sa možná väzba cirkulujúcich anti-tTG protilátok s bunkami placenty, čo môže spôsobiť imunologický mechanizmus tehotenských patológií.
Normálny vývin a funkcia placenty vyžaduje inváziu materskej decidui do extravilózneho trofoblastu (EVT), nasledovanú rastom a organizáciou ciev [19]. EVT produkuje veľké množstvo bázických proteínov a hormónov podieľajúcich sa na udržiavaní tehotnosti. Je preto pravdepodobné, že zvýšená apoptóza EVT môže prispievať k patofyziológii potratu a k rastovej reštrikcii plodu [18, 35]. Tieto placentárne komplikácie sa vyskytujú s vyššou frekvenciou u žien s aktívnou celiakiou v porovnaní so zdravou populáciou. Hadziselimovic a spol. dokázali nárast apoptózy EVT spojený s nízkou pôrodnou hmotnosťou novorodencov u žien s celiakiou pri nedodržiavaní bezlepkovej diéty. Výskum Anjum a spol. hovorí, že anti-tTG protilátky triedy IgA sú schopné priamej väzby na syncyciálny povrch placenty, čo signifikantne inhibuje tTG aktivitu [1]. Táto hypotéza vysvetľuje funkčnú poruchu placentárneho vývinu. Anjum et al. však hodnotili iba účinok triedy IgA protilátok na placentárne bunky, keďže IgA trieda imunoglobulínov sa vo zvýšenej miere vylučuje pri aktívnej celiakii. Je ale dobre známe, že jediný imunoglobulín schopný prechádzať placentárnou bariérou a priamo determinovať efekt na fetálnu časť placenty je imunoglobulín IgG. Predpokladalo sa, že anti-tTG protilátky sa viažu na tTG exprimovanú bunkám trofoblastu in vivo a spôsobujú tým ich funkčné poškodenie. Aby bolo možné posúdiť danú hypotézu, skupina vedcov izolovala IgG a IgA polyklonálnej frakcie zo sér pacientok s aktívnou celiakiou a vysokými anti-tTG protilátkami, ktoré ešte nedržali bezlepkovú diétu [8]. Bunkové kultúry trofoblastu boli vystavené zvýšenej koncentrácii IgA a IgG anti-tTG protilátok, kde sa zameriavali na pôsobenie anti-tTG protilátok na inváziu placenty, činnosť metaloproteináz bunkovej matrix (MMP) a bunkovej apoptózy, ako na ukazovatele poškodenia trofoblastu. Pozorovania ukázali, že obe frakcie polyklonálnych anti-tTG protilátok a monoklonálnych protilátok anti-tTG boli schopné priamej väzby na bunky trofoblastu, výrazne znížili inváziu trofoblastu prostredníctvom apoptotického poškodenia [8]. Ďalej došlo k výraznému poklesu MMP aktivity, čo by mohlo byť nepriamym dôsledkom zvýšenej apoptózy trofoblastu (obr. 3A) [8].

Tieto štúdie vo všeobecnosti poskytujú patogenetický model imunitne podmieneného poškodenia placenty u žien s aktívnou celiakiou a vysokým titrom cirkulujúcich anti-tTG protilátok, čo zdôvodňuje zvýšený výskyt placentárnych komplikácií v tehotnosti.
ANTI-TRANSGLUTAMINÁZOVÉ PROTILÁTKY A ICH VPLYV NA ANGIOGENÉZU ENDOMETRIA
Angiogenéza a decidualizácia endometria, ako aj invázia trofoblastu sú základnými predpokladmi na úspešnú implantáciu a pozitívny výsledok tehotnosti. V tehotnej maternici poznáme kritické angiogénne signály, ktoré sú produkované decidualizáciou endometriálnych buniek, pôsobia na endotelové bunky a podporujú proliferáciu a decidualizáciu. Po stimulácii angiogénnymi faktormi dochádza k degradácii bazálnej membrány prostredníctvom MMP a proteolytických enzýmov vylučovaných endotelovými bunkami. Bunky potom invadujú, migrujú a proliferujú do základnej intersticiálnej matrix a vytvárajú nové kapilárne štruktúry [38, 52, 53]. Angiogenéza takto vyvoláva základné zmeny endometria, čo umožňuje prijať blastocystu a začať proces implantácie.
Vedci predpokladajú, že priame apoptotické poškodenie endometria a cirkulujúce anti-tTG protilátky by mohli byť spoločne zodpovedné za ďalší mechanizmus poškodenia vývinu placenty, tentoraz v materskej časti placenty – poškodením angiogenézy endometria. Na potvrdenie tejto hypotézy skupina vedcov najprv izolovala bunky ľudského endometria (HEEC – human endometrial endothelial cells) z placenty. Po inkubácii HEEC kultúr oboma IgA a IgG polyklonálnymi imunoglobulínmi izolovanými zo séra celiatikov a komerčnou monoklonálnou anti-tTG IgG sa dokázala priama väzba protilátok anti-tTG na bunkovú membránu endometriálnych buniek a následný pokles bunkovej tTG aktivity [9]. Táto väzba bola nasledovaná výrazným poklesom angiogenézy in vitro. Model na myšiach hodnotí účinok anti-tTG protilátok, ktorý potvrdzuje autoprotilátkami spôsobenú inhibíciu angiogenézy. Na identifikáciu molekulárnych mechanizmov zapojených do inhibície angiogenézy vedci hodnotili aktivity MMP-2 v kultúre izolovaných buniek ľudského endometria, prítomnosť polyklonálnych a monoklonálnych protilátok anti-tTG2. Pozorovalo sa významné zníženie pro - a aktívnych MMP-2 proteínov. Je teda možné, že molekulárny mechanizmus zodpovedný za inhibíciu angiogenézy indukovanú anti-tTG spočíva v znížení sekrécie MMP a degradácii extracelulárnej matrix. Funkčná porucha angiogenézy izolovaných buniek ľudského endometria nebola spojená so zvýšením bunkovej apoptózy. Navyše nebolo pozorované žiadne zníženie sekrécie rastového faktora cievneho endotelu po naviazaní anti-tTG protilátok. Protilátkami indukovaná inhibícia angiogenézy je spôsobená zvýšenou apoptózou buniek a znížením sekrécie proangiogénnych faktorov.
Predpokladom ďalšej hypotézy je väzba anti-tTG protilátok na tTG povrchu buniek, čo môže ovplyvniť efekt interakcie aktínových vlákien na cytoskelet spojený s bunkovou membránou. Je dobre známe, že cytoskelet sprostredkúva rôzne bunkové funkcie, ako napríklad vzájomnú adhéziu buniek zásadnú pre replikáciu a migráciu, riadi aktínovú dynamiku a prestavbu cytoskeletu endotelových buniek, ktorá hrá kľúčovú úlohu v procese angiogenézy. Z toho dôvodu vedci skúmali na in vivo aj in vitro modeloch, či prebieha na izolovaných bunkách endometria protilátkami indukované zhoršenie organizácie F-aktínových vlákien, čo môže vysvetliť inhibíciu angiogenézy po expozícii anti-tTG protilátkami. Prostredníctvom mikroskopickej vizualizácie sa popisuje dramatická dezorganizácia F-aktínu cytoskletu za prítomnosti anti-tTG protilátok a nepriamo sa deteguje zvýšenie tuhosti cytoskeletu, zníženie fluidity a bunkovej adhezivity membrán buniek izolovaného endometria, čo vedie k zníženiu funkčnej modifikácie cytoskeletu (obr. 3B) [22, 26].

Na záver možno povedať, že antigénne štruktúry prítomné na izolovaných bunkách ľudského endometria, väzba protilátok na endometrium a endotelové bunky a ich následná funkčná inhibícia môže predstavovať kľúčový mechanizmus, ktorým by anti-tTG protilátky mohli ovplyvniť implantáciu embrya a placentáciu na materskej časti fetomaternálnej jednotky. Endometriálna angiogenéza má zásadný vplyv na vývin placenty a rast plodu. Poškodenie tejto zložky môžeme považovať za základný patogénny mechanizmus, ktorý prispieva k nepriaznivým výsledkom tehotenstva u žien s neliečenou celiakiou.
ZÁVER
Doterajšie výskumy potvrdzujú súvislosť medzi poruchami plodnosti a celiakiou u žien. V populácii pozorujeme trend vzostupu daného ochorenia, hlavne výskyt jeho atypických foriem, ktoré sú často nediagnostikované. Súčasne vzrastá počet nevysvetliteľnej neplodnosti a problémových tehotností. Je dôležité s určitosťou potvrdiť hypotézy súvisu týchto dvoch stavov a vytvoriť formu skríningu celiakie u žien s reprodukčnými poruchami, ktoré by mohli súvisieť s enteropatiou. Jednoduchou terapiou bezlepkovou diétou by mohli zrejme byť mnohé komplikácie fertility eliminované.
MUDr. Katarína Fiolková
Zvolenská 20/48
036 01 Martin
Slovensko
e-mail fiolkova.katarina@gmail.com
Zdroje
1. Anjum, N., Baker, PN., Robinson, NJ., Aplin, JD. Maternal celiac disease autoantibodies bind directly to syncytiotrophoblast and inhibit placental tissue transglutaminase activity. Reprod Biol Endocrinol, 2009, 19, p. 7–16.
2. Bedwal, RS., Bahuguna, A. Zinc, copper and selenium in reproduction. Experientia, 1994, 50, p. 626–640.
3. Bingley, PJ., Williams, AJ., Norcross, AJ., et al. Avon Longitudinal Study of Parents and Children Study Team. Undiagnosed coeliac disease at age seven: population based prospective birth cohort study. BMJ, 2004, 328, p. 322–323.
4. Caputo, I., Barone, MV., Lepretti, M., et al. Celiac anti-tissue transglutaminase antibodies interfere with the uptake of alpha gliadin peptide 31–43 but not of peptide 57–68 by epithelial cells. Biochim Biophys Acta, 2010, 1802, p. 717–727.
5. Cervio, E., Volta, U., Verri, M., et al. Sera of patients with celiac disease and neurologic disorders evoke a mitochondrial-dependent apoptosis in vitro. Gastroenterology, 2007, 133, p. 195–206.
6. Ciacci, C., Cirillo, M., Auriemma, G., et al. Celiac disease and pregnancy outcome. Am J Gastroenterol, 1996, 91, p. 718–722.
7. Collin, P., Vilska, S., Heinonen, PK., et al. Infertility and coeliac disease. Gut, 1996, 39, p. 382–384.
8. Di Simone, N., Silano, M., Castellani, R., et al. Anti-tissue transglutaminase antibodies from celiac patients are responsible for trophoblast damage via apoptosis in vitro. Am J Gastroenterol, 2010, 105, p. 2254–2261.
9. Di Simone, N., De Spirito, M., Di Nicuolo, F., et al. Potential new mechanisms of placental damage in celiac disease: anti-transglutaminase antibodies impair human endometrial angiogenesis. Biol Reprod, 2013, 89, p. 88.
10. Dickey, W., Stewart, F.. Nelson, J., et al. Screening for coeliac disease as a possible maternal risk factor for neural tube defect. Clin Genet, 1996, 49, p. 107–108.
11. Dieterich, W., Ehnis, T., Bauer, M., et al. Identification of tissue transglutaminase as the utoantigen of celiac disease. Nature Med, 1997, 3, p. 797–801.
12. Eliakim, R., Sherer, DM. Celiac disease: fertility and pregnancy. Gynecol Obstet Invest, 2001, 51, p. 3–7.
13. Fasano, A., Berti, I., Gerarduzzi, T., et al. Prevalence of celiac disease in at-risk and not-at-risk groups in the United States: a large multicenter study. Arch Intern Med, 2003, 163, p. 286–292.
14. Fasano, A., Catassi, C. Clinical practice. Celiac disease. N Engl J Med, 2012, 20, p. 2419–2426.
15. Ferguson, R., Holmes, GK., Cooke, WT. Coeliac disease, fertility, and pregnancy. Scand J Gastroenterol, 1982, 17, p. 65–68.
16. Guandalini, S., Assiri, A. Celiac disease: a review. JAMA Pediatr, 2014, 168, p. 272–285.
17. Haapalahti, M., Kulmala, P., Karttunen, TJ., et al. Nutritional status in adolescents and young adults with screen-detected celiac disease. J Pediatr Gastroenterol Nutr, 2005, 40, p. 566–570.
18. Hadziselimovic, F., Geneto, R., Buser, M. Celiac disease, pregnancy, small for gestational age: role of extravillous trophoblast. Fetal Pediatr Pathol, 2007, 26, p. 125–134.
19. Helige, C., Ahammer, H., Hammer, A., et al. Trophoblastic invasion in vitro and in vivo: similarities and differences. Hum Reprod, 2008, 23, p. 2282–2291.
20. Hogberg, L., Danielsson, L., Jarleman, S., et al. Serum zinc in small children with coeliac disease. Acta Paediatr, 2009, 98, p. 343–345.
21. Husby, S., Koletzko, S., Korponay-Szabó, IR., et al. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease. J Pediatr Gastroenterol Nutr., 2012, 54, p. 136–160.
22. Chichili, GR., Rodgers, W. Cytoskeleton-membrane interactions in membrane raftstructure. Cell Mol Life Sci, 2009, 66, p. 2319–2328.
23. Choi, JM., Lebwohl, B., Wang, J., et al. Increased prevalence of celiac disease in patients with unexplained infertility in the United States. J Reprod Med, 2011, 56, p. 199–203.
24. Jabri, B., Sollid, LM. Mechanisms of disease: immunopathogenesis of celiac disease. Nat Clin Pract Gastroenterol Hepatol, 2006, 3, p. 516–525.
25. Jameson, S. Zinc deficiency in malabsorption states: a cause of infertility? Acta Med Scand, 1976, Wiley Online Library.
26. Khurana, S. Role of actin cytoskeleton in regulation of ion transport: examples from epithelial cells. J Membr Biol, 2000, 178, p. 73–87.
27. Kotze, LM. Gynecologic and obstetric findings related to nutritional status and adherence to a gluten-free diet in Brazilian patients with celiac disease. J Clin Gastroenterol, 2004, 38, p. 567–574.
28. Kumar, A., Meena, M., Begum, N., et al. Latent celiac disease in reproductive performance of women. Fertil Steril, 2011, 95, p. 922–927.
29. Ludvigsson, JF., Montgomery, SM., Ekbom A. Celiac disease and risk of adverse fetal outcome: a population-based cohort study. Gastroenterology, 2005, 129, p. 454–463.
30. Maki, M., Lohi, O. Enteropathy. In: Walker, WA., Goulet, O., Kleinman, R., Sherman, P., Sheinder, B., Sanderson, I. (eds). Pediatric gastrointestinal disease. Hamilton, ONT, Canada: BC Decker Inc., 2004, p. 932–943.
31. Maki, M., Mustalahti, K., Kokkonen, J., et al. Prevalence of celiac disease among children in Finland. N Engl J Med, 2003, 348, p. 2517–2524.
32. Machado, AP., Silva, LR., Zausner, B., et al. Undiagnosed celiac disease in women with infertility. J Reprod Med, 2013, 58, p. 61–66.
33. Martinelli, P., Troncone, R., Paparo, F., et al. Coeliac disease and unfavourable outcome o pregnancy. Gut, 2000, 46, p. 332–335.
34. Meloni, GF., Dessole, S., Vargiu, N., et al. The prevalence of coeliac disease in infertility. Hum Reprod, 1999, 14, p. 2759–2761.
35. Minas, V., Jeschke, U., Kalantaridou, SN., et al. Abortion is associated with increased expression of FasL in decidual leukocytes and apoptosis of extravillous trophoblasts: a role for CRH and urocortin. Mol Hum Reprod, 2007, 13, p. 663–673.
36. Morris, JS., Adjukiewicz, AB., Read, AE. Coeliac infertility: an indication for dietary gluten restriction. Lancet, 1970, 1, p. 213.
37. Murray, JA., Van Dyke, C., Plevak, MF., et al. Trends in the identification and clinical features of celiac disease in a North American community, 1950–2001. Clin Gastroenterol Hepatol, 2003, p. 19–27.
38. Murray, MJ., Lessey, BA. Embryo implantation and tumor metastasis: common pathways of invasion and angiogenesis. Semin Reprod Endocrinol, 1999, 17, p. 275–290.
39. Nenna, R., Mennini, M., Petrarca, L., et al. Immediate effect on fertility of a gluten-free diet in women with untreated coeliac disease. Gut, 2011, 60, p. 1023–1024.
40. Park, D., Choi, SS., Ha, KS. Transglutaminase 2: a multifunctional protein in multiple subcellular compartments. Amino Acids, 2010, 39, p. 619–631.
41. Riddle, MS., Murray, JA., Porter, CK. The incidence and risk of celiac disease in a healthy US adult population. Am J Gastroenterol., 2012, 107, p. 1248–1255.
42. Robinson, NJ., Glazier, JD., Greenwood, SL., et al. Tissue transglutaminase expression and activity in placenta. Placenta, 2006, 27, p. 148–157.
43. Rostom, A., Dube, C., Cranney, A., et al. The diagnostic accuracy of serologic tests for celiac disease: a systematic review. Gastroenterology, 2005, 128, p. 38–46.
44. Salvati, VM., Mazzarella, G., Gianfrani, C., et al. Recombinant human IL-10 suppresses gliadin-dependent T-cell activation in ex vivo cultured coeliac intestinal mucosa. Gut, 2005, 54, p. 46–53.
45. Santonicola, A., Iovino, P., Cappello, C., et al. Frommenarche to menopause: the fertile life span of celiac women. Menopause, 2011, 18, p. 1125–1130.
46. Sferlazzas, C., Arrigo, T., Salzano, G., et al. Menarcheal age in celiac disease may not be delayed and maybe irrespective of age at diagnosis and dietary management. J Endocrinol Invest, 2008, 31, p. 432–435.
47. Shamaly, H., Mahameed, A., Sharony, A., Shamir, R. Infertility and celiac disease: doweneed more than one serological marker? Acta Obstet Gynecol Scand, 2004, 83, p. 1184–1188.
48. Singhal, N., Alam, S., Sherwani, R., Musarrat, J. Serum zinc levels in celiac disease. Indian Pediatr, 2008, 45, p. 319–321.
49. Smecuol, E., Maurino, E., Vazquez, H., et al. Gynaecological and obstetric disorders in coeliac disease: frequent clinical onset during pregnancy or the puerperium. Eur J Gastroenterol Hepatol, 1996, 8, p. 63–89.
50. Sollid, LM. Coeliac disease: dissecting a complex inflammatory disorder. Nat Rev Immunol, 2002, 2, p. 647–655.
51. Tack, GJ., Verbeek, WHM., Schreurs, MWJ., Mulder, CJJ. The spectrum of celiac disease: epidemiology, clinical aspects and treatment. Nat Rev Gastroenterol Hepatol, 2010, 7, p. 204–213.
52. Tatar, G., Elsurer, R., Simsek, H., et al. Screening of tissue transglutaminase antibody in healthy blood donors for celiac disease screening in the Turkish population. Dig Dis Sci, 2004, 49, p. 1479–1484.
53. Taylor, CM., McLaughlin, B., Weiss, JB., Maroudas, NG. Concentrations o endothelial-cell-stimulating angiogenesis factor, a major component of human uterine angiogenesis factor, in human and bovine embryonic tissues and decidua. J Reprod Fertil, 1992, 94, p. 44544–44549.
54. West, J., Logan, RF., Hill, PG., et al. Seroprevalence, correlates, and characteristics of undetected coeliac disease in England. Gut, 2003, 52, p. 960–965.
55. Wilson, C., Eade, OE., Elstein, M., Wright, R. Subclinical celiac disease and infertility. Brit Med J, 1976, 2, p. 215–216.
56. Yuce, A., Demir, H., Temizel, IN., Kocak, N. Serum carnitine and selenium levels in children with celiac disease. Indian J Gastroenterol, 2004, 23, p. 87–88.
57. Zemskov, EA., Janiak, A., Hang, J., et al. The role of tissue transglutaminase in cell-matrix interactions. Front Biosci, 2006, 1, p. 1057–1076.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2016 Číslo 6
Nejčtenější v tomto čísle
- Cervix skóre dle Bishopa a jeho modifikace
- Ektopická gravidita v jizvě po císařském řezu
- Samovyšetření prsu. Ano, či ne?
- Celiakia ako možná príčina niektorých gynekologicko-pôrodníckych ochorení
