Mola hydatidosa completa s přechodem do nemetastázující perzistující trofoblastické nemoci
Kazuistika, poučení a úvaha nad pravidly dispenzarizace a rozhodovacích mechanismů Forenzní zodpovědnost a postavení spádového gynekologa
Complete molar pregancy with development of non-metastatic persistent trophoblastic disease
A case report, reflection of rules of care and decision-making processes Forensic responsibility and the position of doctor in the general gynecologic and obstetric outpatient practice
Objective:
To define the forensic responsibility and the position of doctor in the general gynecologic and obstetric outpatient practice in care of the complete molar pregancy.
Design:
Case report and review article.
Setting:
General gynecologic and obstetric outpatient practice Velké Meziříčí; Sanatorium REPROMEDA, Centre of reproductive medicine and preimplantation genetics, Brno; Histopatology department of Hospital Jihlava.
Case report:
The changing clinical presentation of complete molar pregnancy with development of non-metastatic gestational trophoblastic disease: management. Subsequent early pregnancies outcome following complete hydatiform molar pregnancy.
Discussion:
Discussed are the forensic responsibility and the position of doctor in the general gynecologic and obstetric outpatient practice with the collaboration of Trophoblastic Disease Center based on the detail expert knowledges: rules of care and decision-making processes and potential controversies, the pitfalls of the histopathologic diagnosis, the genetics of complete hydatiform mole: new lights on a disease, outpatient follow-up and possibility and the risks of the subsequent pregnancy.
Conclusion:
The conclusion is trying to guide quickly a doctor in the general gynecologic and obstetric outpatient practice in the decision-making processes through the crossings of any situation of the complete molar pregnancy and outpatient follow-up, alternatively with the collaboration of Trophoblastic Disease Center.
Keywords:
complete hydatiform mole, persistent gestational trophoblastic disease/neoplasia, GTN, chemotherapy, general gynecologic and obstetric outpatient practice, Trophoblastic Disease Center, molar pregnancy, trofoblast, genetics, outpatient follow-up, forensic responsibility
Autoři:
S. Zeman 1; P. Trávník 2
; K. Dvořáková 3; J. Zemanová 1
Působiště autorů:
Gynekologicko-porodnická ambulance, Velké Meziříčí, MUDr. S. Zeman
1; REPROMEDA, Centrum reprodukční medicíny a preimplantační diagnostiky, Brno, ředitelka MUDr. K. Veselá
Ph. D.
2; Patologicko-anatomické oddělení nemocnice, Jihlava, prim. MUDr. M. Kheck
3
Vyšlo v časopise:
Ceska Gynekol 2017; 82(5): 396-406
Souhrn
Cíl studie:
Definovat forenzní zodpovědnost a postavení spádového gynekologa v péči o pacientku s kompletní hydatidózní molou.
Typ studie:
Kazuistika. Přehledový článek.
Název a sídlo pracoviště:
Gynekologicko-porodnická ambulance Velké Meziříčí; REPROMEDA, Centrum reprodukční medicíny a preimplantační diagnostiky, Brno; Patologicko-anatomické oddělení nemocnice Jihlava.
Kazuistika:
Případ evakuované kompletní hydatidózní moly s přechodem do nemetastázující perzistující trofoblastické nemoci úspěšně zaléčené chemoterapií. Prezentován je přístup k časné následné graviditě krátce po ukončení chemoterapie a úspěšný výsledek koncepce při dalším otěhotnění rok po absolvování chemoterapie.
Diskuse:
Autoři rozebírají postavení spádového gynekologa v péči o pacientku ve spolupráci s Centrem pro trofoblastickou nemoc: kontroverze v hodnocení klinických výsledků, indikací a postupů u perzistující trofoblastické nemoci, úskalí histopatologické diagnostiky, nová genetická zjištění etiopatogeneze kompletní hydatidózní moly, nastavení dispenzarizace a možnosti a rizika další koncepce.
Závěr:
Závěr má v krátkém souhrnu spádovému gynekologovi pomoci rychle se zorientovat v problematice kompletní hydatidózní moly a upozornit na klíčové situace při rozhodování o dalším postupu a následné dispenzarizaci, event. ve spolupráci s Centrem pro trofoblastickou nemoc.
Klíčová slova:
mola hydatidosa completa, perzistující trofoblastická nemoc/neoplazie, GTN, chemoterapie, spádová gynekologicko-porodnická praxe, Centrum pro trofoblastickou nemoc, molární těhotenství, trofoblast, genetika, dispenzarizace, forenzní zodpovědnost
VLASTNÍ POZOROVÁNÍ
Dne 15. 1. 2014 se pacientka, 32letá nuligravida, nulipara (0G/0P), dostavila na gynekologickou prohlídku z důvodu předpokládaného těhotenství, striptest na graviditu pozitivní, těhotenství by si přála. Poslední menstruace (PM) září/říjen 2013, TK 100/60, P 72/min., hmotnost 65 kg, výška 165 cm, BMI 23,88. Pravidelnou roční gynekologickou prohlídku absolvovala v téže ambulanci 27. 9. 2013 včetně cervikální cytologie s normálním výsledkem. Užívala hormonální antikoncepci (Mercilon), kterou v září 2013 vysadila, téměř hned otěhotněla.
Rodinná a osobní anamnéza nevýznamná. Pacientka se na jiná onemocnění neléčí. Operace a úrazy nebyly. Menarche v 15 letech, menses před nasazením hormonální antikoncepce 28/5 pravidelné nebolestivé. Profesně asistentkou v autoškole, rok žije s přítelem.
Uvádí od posledních menses nahnědlé nebo růžové špinění. Jinak byla bez obtíží. Do prenatální poradny i přes krvavý spotting „nespěchala“.
Objektivně v pochvě růžovonahnědlé špinění. Čípek 2 cm s malým ektropiem. Děloha vpředu velikosti 12. týdne těhotenství, dosahuje do poloviny vzdálenosti symfýza-pupek. Okolí volné. Kultivace poševního sekretu negativní.
Ultrazvuk transabdominálně: Děloha vpředu objemná, celou děložní dutinu vyplňuje multicystický hrozníčkovitý obsah (jejich dutiny hypoizoechogenního charakteru hladké výstelky), dopplerovsky s chudým krevním zásobením. Plod není přítomen. Velikost obsahu dutiny děložní 10,02 × 6,86 × 11,54 cm, objemově 415,333ccm. Ovaria normální velikosti (vlevo 30,1 × 17,5 mm, vpravo 26,8 × 14,5 mm) a echogenity, dopplerovsky klidná bez přítomnosti luteinních cyst. Jiné atypie nebyly zjištěny (obr. 1, 2).
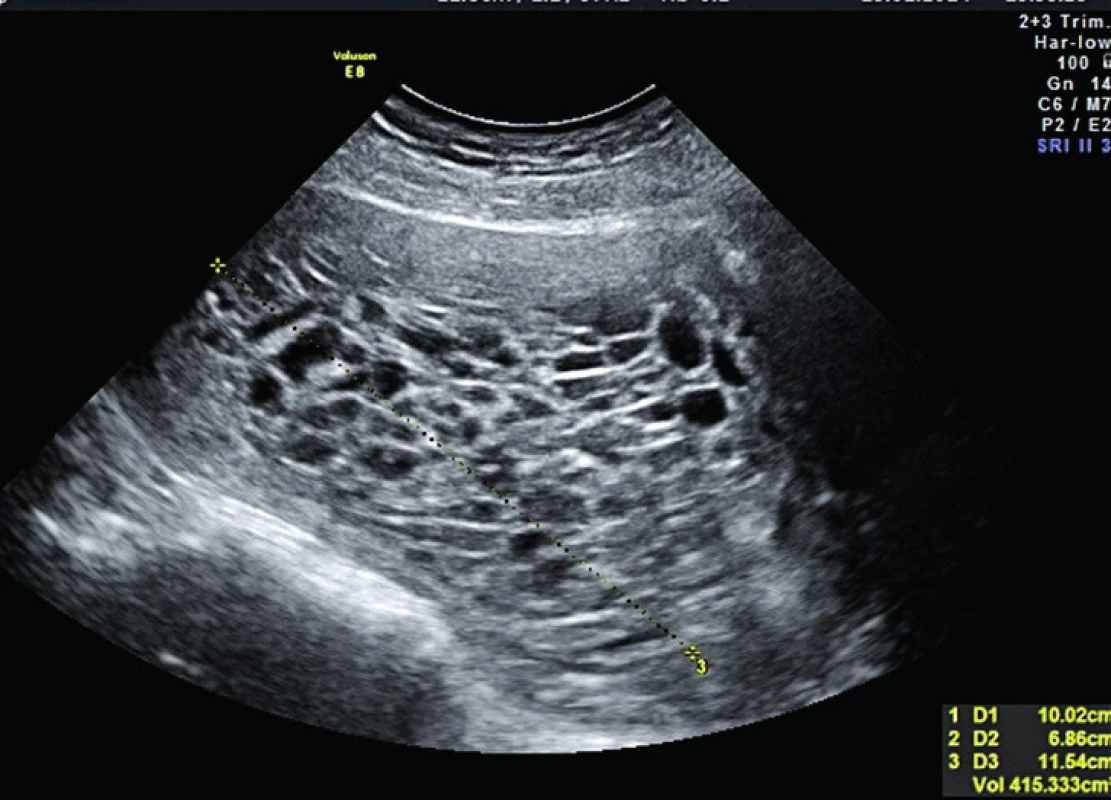
![Mola hydatidosa completa. UZ transabdominální sagitální pohled, 15. týden těhotenství. Minimální krevní zásobení zralé kompletní hydatidózní moly, cévy ve stromatu klků přítomné u kompletní moly postupně ustupují ve II. trimestru [60], prostorovou převahu nabývají edématózní choriové klky. Patrno krevní zásobení junkce proliferujícího trofoblastu s děložní stěnou. Plod chybí.](https://www.cs-gynekologie.cz/media/cache/resolve/media_object_image_small/media/image/37f58408d561fa15d476681893c816b0.jpg)
Resume: Mola hydatidosa. 1G/0P.
Hodnota sérového humánního choriového gonadotropinu (hCG) 148 994,1 IU/l.
Na gynekologickém oddělení Nemocnice Jihlava byla provedena 16. 1. 2014 revize děložní dutiny.
Histologie z 20. 1. 2014: Předmět: mola hydatidosa. Větší množství bělavých částek s cystickými útvary průměru až 1 cm se serózním obsahem z dutiny děložní. Z velké části nekrotické, široké až cystické značně edematózní avaskulární choriové klky s výraznějším perivilózním fibrinoidem, místy s tlakově atrofickým, jinde s hyperplastickým trofoblastem. Části plodu v daném materiálu nenacházíme. Nález odpovídá klinické diagnóze – kompletní mola hydatidosa (MHC)“ (obr. 3).
![Edematózní choriové klky se zastižením jak tlakově atrofického, tak jinde hyperplastického trofoblastu. Hyperplastický trofoblast po obvodu klků a bezcévná stěna klků jsou typickými pro kompletní hydatidózní molu [17]. V edematózním stromatu některých klků jsou prázdné prostory, tzv. cisterny [23]. Zvětšeno 25x. MUDr. Dvořáková Klára, patologie Jihlava.](https://www.cs-gynekologie.cz/media/cache/resolve/media_object_image_small/media/image/9cb41605ce6392bd623062bc637f224b.jpg)
Následují kontroly sérového hCG (graf 1).

Dne 1. 4. 2014 pacientka absolvuje kontrolu na gynekologické ambulanci Nemocnice Jihlava: „Pacientka subjektivně bez větších gynekologických obtíží, tento měsíc ale vynechaly menses. PM 19. 2. 2014. Špinila. Na UZ verifikována cysta pravého ovaria nesuspektního vzhledu. Vzhledem k telefonické konzultaci CTN v Ústavu pro péči o matku a dítě (ÚPMD) Praha Podolí další sledování hCG za jeden měsíc, pokud bude hodnota nadále klesat, není nutná intervence, pokud by došlo k zastavení poklesu či jen mírné elevaci, je nutná kontrola v nemocnici v Jihlavě a event. odeslání do CTN. Poučena, kontrola cysty po menses cestou obvodního gynekologa.“
S ohledem na pochybnosti spádového gynekologa o navrženém postupu je následně telefonicky konzultováno CTN FN Motol Praha, kam jsou obratem elektronicky přeposlány všechny výsledky sérových hCG, původní UZ snímky a histologické snímky z revize.
Dne 11. 4. 2014 pacientka v FN Motol fyzicky absolvuje kontrolu s veškerou dokumentací s výsledným vyjádřením: „Perzistence a plateau po evakuaci MHC – k dispozici neúplné náběry, v dokumentaci doporučeno hCG z ÚPMD za měsíc, což je zcela nestandardní postup. hCG do negativity a týden nutné, nyní plateau – dnes menses.“
Pacientka byla hospitalizována v CTN FN Motol Praha 23. 4. 2014 a po vyloučení metastáz cestou rtg plic 23. 4. 2014: přiměřený nález na snímku hrudníku bez ložiskových změn a CT 24. 4. 2014: s normálním nálezem je při diagnóze „perzistující trofoblastická nemoc bez metastáz“ zahájena chemoterapie v protokolu OM (Vincristine, Metotrexát, Leukovorin), třídenní režim ve 14denních intervalech. Pro suspekci na rezistenci ke kombinaci OM (sérové hladiny hCG stoupají nebo vykazují plateau), byla ve čtvrté a páté sérii provedena změna medikace a nasazena polychemoterapie v protokolu EMA-MO (Etoposid, Metotrexát, Actinomycin D + Leukovorin) ve 14denních intervalech. Během 6. hospitalizace 2. 7. 2014 další chemoterapie („konsolidační léčba“) při laboratorně definovaných negativních hodnotách hCG nebyla indikována. Celkem bylo u pacientky aplikováno pět cyklů chemoterapie (třikrát OM, dvakrát EMA-MO), po změně na EMA-MO s dobrou odpovědí a minimem nežádoucích účinků (nauzea, vomitus, padání vlasů).
Dne 5. 8. 2014 byl spádovým gynekologem detekován vzestup hCG 103 IU/l a následně zjištěno nové nitroděložní těhotenství 2G/0P. Dne 23. 8. 2014 mini ITP ve FN Motol Praha ze zdravotní indikace (grav. hebd. 5+5/7, stav po léčbě cytostatiky – gravidita do měsíce od ukončení); 24. 9. 2014 kontrolní hCG 1,9 IU/l (graf 2).
![Referovaná kazuistika graficky – možnost originálního porovnání sestupu serózních hladin hCG po evakuaci kompletní hydatidózní moly s přechodem do nemetastázující perzistující trofoblastické nemoci zaléčené chemoterapií a následně typická křivka hCG u fyziologické gravidity ukončené interupcí.
Změna protokolu OM po třech sériích chemoterapie na protokol EMA-MO s ohledem na vzestup a plateau sérových hladin hCG. Po dvou sériich EMA-MO a dosažení prakticky nulových hodnot hCG je chemoterapie ukončena, bez přesahu další „konsolidační“ léčby. Zajímavostí jsou tranzitorně zvýšené hladiny hCG, které se objevují v těsné návaznosti na podání chemoterapie a dosahují až 10 % stávajících hodnot hCG. Do příští chemoterapie mizí a nastává pokles hCG podle citlivosti nádoru. Samotné tranzitorní zvýšení hCG nemusí být projevem nepříznivého průběhu léčby, ale naopak znamením její úspěšnosti. Je možné, že vzniká zvýšenou disociací, štěpením a odštěpením tzv. karboxylového terminálního peptidu (CTP) intaktního hCG při chemoterapii [63].](https://pl-master.mdcdn.cz/media/image/dd5bd45da041300d63a77776869b05a2.jpg?version=1537797233)
Po léčbě byla pacientka gynekologicky bez obtíží, menses prakticky hned pravidelné 28/5. Antikoncepci neužívala. Relaps základního onemocnění nebyl prokázán.
Později, 21. 10. 2015, bylo potvrzeno nové jednočetné vitální těhotenství 11+4 t.g. podle CRL s předpokládaným termínem porodu 7. 5. 2016. Dne 27. 10. 2015 kontingenční screening: T21 1 : 1856; T18 1 : 5975; T13 1 : 18757, plod anatomicky bez atypií. Následná prenatální péče standardní, průběh těhotenství nekomplikovaný. Porod zdravého dítěte proběhl 8. 5. 2016 – po nástupu kontrakcí byl ukončen císařským řezem z indikace Asynclitismus sec. Naegele in grav. hebd. 40+1/7, Partus medicamentosus non progrediens, Anemia secundaria matris, Mola hydatidosa completa in anamn.
Dne 13. 7. 2016 se uskutečnila pravidelná roční gynekologická prohlídka a kontrola po šestinedělí. Gynekologický nález fyziologický, hCG 0,3 IU/l. Kontrola za rok.
DISKUSE
Standardní postup u kompletní moly a možné kontroverze
Při ukončení fyziologické gravidity sérové hodnoty hCG většinou negativizují do 15, maximálně 30 dnů [41, 60]. Pokud hodnoty hCG přetrvávají déle než 30 dnů, jedná se o perzistující trofoblastickou invazi (PTI) [28]. V 80 % diagnostikujeme PTI po evakuaci molárních těhotenství, kdy dochází k trvalému a plynulému poklesu hCG v období osm až dvanáct týdnů od evakuace molární gravidity [15, 61], výjimečně i šest měsíců [15, 28]. Pokles hodnot hCG nevyžaduje chemoterapii [17, 61]. Jejím podkladem je pomaleji probíhající apoptóza trofoblastických buněk.
Pokud dojde při sledování PTI k dlouhodobějšímu plateau sledovaných hodnot sérového hCG nebo k jejich vzestupu po evakuaci moly a/nebo při zjištění metastáz, je stav indikován k systematickému došetření [15, 21, 28] a mluvíme pak o perzistující trofoblastické nemoci (PTN), která je léčena chemoterapií, ale nemáme histologii. Jedná se o termín pro maligní formu GTN (gestational trophoblastic neoplasia) bez histologické verifikace. GTN je obecné pojmenování pro gestační trofoblastickou nemoc, která invaduje lokálně nebo metastázuje, nejběžnější formou je hydatidózní mola, dalšími jsou proliferující mola (chorioadenoma destruens), choriokarcinom a placental site trophoblastic tumor (PSTT) [15].
Kompletní hydatidózní mola malignizuje ve 2–8 % případů [21, 40, 58], u 4–5 % žen s kompletní molou jsou diagnostikovány plicní metastázy [33].
S ohledem na tento podíl rizika PTN s metastázami i bez metastáz navrhují někteří autoři pro skupinu nespolupracujících pacientek s hydatidózní molou aplikaci profylaktické dávky metotrexátu [22, 30].
U perzistujících či stoupajících hladin hCG nemocná podstupuje komplexní vyšetření s cílem najít zdroj perzistujících hodnot hCG a vyloučit metastázy [61]. Výsledkem je definování typu PTN: nemetastázující, metastázující s nízkým rizikovým stupně a metastázující s vysokým rizikovým stupněm [60].
Místem lokalizace metastáz jsou nejčastěji plíce, dále pak dolní genitální trakt, mozek, játra, ledviny a gastrointestinální trakt. Nicméně nález metastáz v jiných lokacích je extrémně vzácný, pokud nejsou primárně prokázány v plicích nebo dolním genitálním traktu [15]. Při negativním plicním nálezu je tak PTN hodnoceno jako nemetastázující [60].
V kontextu výsledků dalších klinických vyšetření (CT) je nicméně referována přítomnost mikrometastáz odhadem u 40–45 % žen s diagnózou nemetastázující PTN s normálním rtg plicním nálezem [12, 35]. Detekce mikrometastáz v plicích v těchto případech vysvětluje lokalizaci a vzestup hCG, ale nelze tento pozitivní CT nález použít pro staging [26, 46, 47].
Některá centra mohou považovat za faktor malignity u perzistujících hladin hCG i překročení určité časové hranice, bez ohledu k trvalému a plynulému poklesu sérových hladin hCG po evakuaci moly. V nastavení této časové hranice, kdy indikovat chemoterapii, není obecný konsenzus. Přetrvávající sérové hladiny hCG více než šest měsíců považují za faktor malignity The International Federation of Gynecology and Obstetrics [15], Rob [40] nebo Mezinárodní společnost pro studium a léčbu trofoblastické nemoci (ISSTD) [17], hranici osm týdnů Registration committee of the Japan society of gestational trophoblastic diseases [48], pouze tři týdny New England Trophoblastic Disease Center [13, 34]. Na druhou stranu největší centrum pro trofoblastickou nemoc v Evropě, Charing Cross Hospital v Londýně [25, 27] a ÚPMD Praha [18] perzistenci zvýšených hodnot hCG více než šest měsíců k nasazení chemoterapie, a to i za podmínky, že setrvale klesají, přehodnotilo a z terapeutického algoritmu vypustilo.
Nejednotný je i pohled, kdy indikovat chemoterapii při vzestupu hCG během dispenzarizace po evakuaci moly; zda při jakémkoliv zachyceném vzestupu [15], stoupání hCG dva týdny [61], stoupání hCG dva týdny minimálně o 10 % [18], kontinuálním stoupání [19] či snad nasazení chemoterapie vázat na dosažení jakési „kritické“ hranice 150 IU/l [19], resp. 3000 IU/1 [3].
Rozdíly jsou také v názoru, jak dlouho vyčkávat s odesláním do CTN při přetrvávání plateau sérových hodnot hCG, před event. nasazením chemoterapie – tři týdny [40], šest týdnů [61], dva měsíce [28]?
PTN je čistě klinická diagnóza trofoblastické nemoci (TN), postavená na vzestupu nebo perzistujících hodnotách hCG a nevypovídá o jejím histopatologickém podkladu [60, 61]. Zdrojem perzistující trofoblastické nemoci jsou vždy elementy trofoblastu, které mohou být lokalizovány v děloze nebo diseminovány hematogenně v organismu ženy [17]. Důvod, proč některá hydatidózní mola, resp. perzistující trofoblastická invaze, přejde do maligní fáze, a některá ne, je nejasný. Některá data ukazují na odlišný molekulární profil u maligního a nemaligního trofoblastického onemocnění [9, 10, 24]. Maligní transformace trofoblastických buněk a zvrat v invazivní onemocnění bývají také vysvětlovány apoptózou syncitiotrofoblastických buněk a jejich náhradou za elementy cytotrofoblastické [19]. Otázkou může být i role časového faktoru, zda časná ukončování malých sonograficky verifikovaných neprosperujících afetálních gravidit s event. možným histopatologickým podhodnocením, doprovázená poklesem incidence zralých molárních forem, mohou mít příznivý vliv i na nižší incidenci případů GTN.
Variantou laboratorně přetrvávajících sérových hodnot hCG může být některý typ syndromu PLL-hCG (Perzistent Low Levels – hCG). (PLL-H hypofyzární, PLL-Q quiescentní, PLL-U undetermined), či falešně pozitivní PLL-F (tzv. fantomové hCG) [23, 36, 37, 60, 62]. Při perzistenci nízkých hladin hCG se doporučuje použít pro sérovou detekci jiný dostupný test na detekci β hCG a současně vyšetřit hCG z moči. Pokud je i zde pozitivita – perzistují elementy trofoblastu – a je nutná dispenzarizace (PLL-Q, PLL-U); pokud ne, jedná se o artefakt (PLL-F). U perimenopauzálních a menopauzálních žen se může jednat o falešně pozitivní výsledky komerčních testů na hCG zkříženou reakcí s podjednotkami hypofýzy, hlavně beta-podjednotkou LH (luteinizační hormon) (PLL-H) [62].
Před předáním na vyšší pracoviště by spádový gynekolog měl vyloučit možnost incipientního následného těhotenství či reziduí. Úskalím může být nerozpoznané mimoděložní těhotenství [60].
Uvedená klinická doporučení, s dlouhodobě prováděnými ambulantními krevními odběry, bez jasného časového horizontu, kdy bude trofoblastické onemocnění doléčeno, včetně dlouhodobých spekulací o charakteru a závažností hodnot hCG, mohou nicméně být pro pacientku, která chtěla a chce znovu otěhotnět, špatně akceptovatelná, frustrující a v běžné ambulantní praxi lidsky i forenzně kolizní.
Odhaduje se, že ve chvíli, kdy hCG poklesne při aplikaci chemoterapie na neměřitelné hodnoty, perzistuje v těle asi 105–106 trofoblastů dispergovaných kdekoli v organismu. Z tohoto důvodu je kladen velký důraz na „konsolidační léčbu“. Podle doporučení Centra pro trofoblastickou nemoc v Londýně je vhodné v aplikaci chemoterapie pokračovat ještě třemi cykly po dosažení negativního výsledku [2, 44], resp. po dobu dalších 6–8 týdnů podle stupně rizika základního onemocnění [15]. Diskutabilním může nicméně být u low-risk pacientek, plánujících další otěhotnění, risk/benefit této konsolidační léčby ve smyslu potenciálně negativního vlivu chemoterapeutik, bez ohledu na mechanismus jejich působení, na primordiální oocyty (ovariální rezervu), granulózové buňky a stroma ovarií [7], včetně negativního ovlivnění cévního zásobení ovarií s jejich následnou fibrózou [32]. Navíc aplikace etoposidu skrývá zvýšené riziko sekundárního rozvoje leukémie [42, 60].
Po evakuaci kompletní moly jsou indikovány krevní odběry do negativity sérového hCG po týdnu do dosažení 2–4 negativních hodnot [15, 28], poté jednou měsíčně po dobu jednoho roku [15, 40] (event. i ve spolupráci se spádovým gynekologem). Někteří autoři považují, po dosažení negativního výsledku hCG po evakuaci kompletní moly bez léčby, monitoring po dobu šesti měsíců za dostatečný [54, 55]. Podobný postup zastává v indikovaných případech i Evropská společnost pro léčbu trofoblastické nemoci (EOTTD – European organisation for treatment of trophoblastic disease) [18].
Některé studie doporučují u pacientek s anamnézou gestačního trofoblastického onemocnění kontrolu sérových hladin hCG šest týdnů po každém následném otěhotnění k vyloučení přítomnosti latentního trofoblastického onemocnění [15, 61].
Včasné nasazení hormonální antikoncepce je vhodné [15], i když někteří autoři doporučují její aplikaci až po úplné negativizaci hCG [60, 61].
Úskalí histopatologické diagnostiky
Zavadil [59] literárně definoval pro stanovení histologické diagnózy hydatidózní moly kompletní, hydatidózní moly parciální, hydatidózní moly kompletní nezralé, proliferující moly a hydropického abortu 14 morfologických znaků vyhodnocovaných kvantitativně k systematické analýze konkrétního mikroskopického obrazu.
Neexistuje žádná histopatologická metoda, která by byla schopna přesně predikovat klinické chování evakuované hydatidózní moly [15]. Navíc, ve všech hlavních histopatologických skupinách trofoblastické nemoci existují, stejně jako v jiných systémech, „hraniční“ pásma, tedy plynulé přechody mezi benigními a maligními entitami [61]. Smysl stanovení histologické diagnózy Zavadil vidí u konkrétní histopatologické jednotky v následném definování statistické pravděpodobnosti rozvoje choriokarcinomu a nastavení příslušné délky dispenzarizace. Choriokarcinom vzniká v souvislosti s parciální hydatidózní molou jen zcela výjimečně, s kompletní hydatidózní molou ve 2–8 % [21, 40, 58] a s proliferující molou až ve 20 %. Choriokarcinom nebo PTN může vznikat i po abortu nebo po porodu, výjimečně po mimoděložním těhotenství. Polovina léčených maligních forem má v anamnéze molární těhotenství, 24 % porod, 24 % potrat, a v 1–2 % mimoděložní těhotenství [40].
V odborné literatuře se diskutuje o možnosti histopatologického stanovení stupně a atypie trofoblastické invaze, které by umožňovalo včasné spolehlivé zachycení rozvoje perzistující trofoblastické nemoci. Částečným důvodem je široce dostupná ultrazvuková diagnostika s časným ukončováním malých neprosperujících gravidit bez jasných sonografických známek molárního těhotenství a výrazným poklesem incidence jejich zralých forem.
Jako varianta evakuace molárního těhotenství se uvádí v Japonsku do týdne prováděná povinná revize každé moly [48, 61]. Referován byl i příznivý vliv rekyretáže při ultrasonograficky prokázané perzistenci reziduí na snížení počtu aplikovaných cyklů chemoterapie k dosažení remise [51].
Některé zahraniční zdroje nicméně paušální rekyretáže považují za kontroverzní [11, 39], separované kyretáže nezmiňují a rozsah histologických diagnostických možností zpochybňují [15]. Podle nich histologické vyšetření materiálu z kyretáže může identifikovat hydatidózní molu (kompletní nebo parciální) nebo choriokarcinom. Zcela výjimečně může být z materiálu histopatologem identifikována proliferující mola (chorioadenoma destruens), která má obdobnou histopatologickou charakteristiku jako hydatidózní mola, ale vykazuje známky destruktivní invaze trofoblastů do myometria s nekrózami a krvácením nebo přítomností plicních metastáz. Jedná se prakticky o agresivně se chovající kompletní molu [21]. Je ale běžnou zkušeností histologa, že v materiálu z kyretáže není myometrium zachyceno nebo jen minimálně. Vzácně může histolog stanovit z materiálu kyretáže diagnózu PSTT (placental site trophoblastic tumor), což je vzácná varianta nízce difencovaného maligního trofoblastického tumoru vznikajícího v místě implantace, protože tato diagnóza je definována extenzivní infiltrací intermediárních trofoblastů (liší se od trofoblastů choriových klků) [21] mezi vlákna endomyometria bez známek tkáňové destrukce [15], podobné charakterem perzistující trofoblastické invazi [61]. Jde o tumor nejisté biologické povahy s možnou benigní a maligní variantou (s rozlišením na základě přítomnosti jaderných atypií) [28], doprovázený obvykle velmi nízkými hodnotami hCG ve srovnání s klasickou formou choriokarcinomu [19].
Základní vlastností trofoblastické tkáně je schopnost invaze do děložní stěny, do myometria a cévního řečiště. V případě ultrazvukového nálezu neohraničeného ložiska s jasnou propagací do děložní stěny se opakování kyretáže či pokus o hysteroskopickou resekci jeví jako krajně rizikové. Tkáň tumoru je obvykle tvořena četnými nekrotickými okrsky a bývá zároveň silně perfundována. Výkon by tedy mohl být doprovázen silným krvácením a/nebo perforací dělohy či infekční komplikací, v některých případech s následnou nutností provedení akutní hysterektomie [18].
V neposlední řadě tkví riziko rekyretáží ve vzniku následných intrauterinních adhezí s rozvojem Ashermanova syndromu s možnou a obtížně řešitelnou amenoreou nebo hypomenoreou, dysmenoreou, event. s poruchami fertility a častějšími spontánními potraty.
Na druhé straně požadovaný a spádovým gynekologem provedený precizní odběr materiálu, včetně sofistikované histopatologické diagnostiky (pokud se nejedná o vlastní diagnózu choriokarcinomu), v zásadě nemění zavedený standardní klinický observační přístup ve sledování sérových hladin hCG a klinického stavu pacientky s trofoblastickou nemocí, včetně vyloučení metastáz. Otázkou je také v reálné praxi možnost definování stupně a atypií trofoblastické invaze. Diskutabilní je také dostupnost a event. smysluplnost literárně zmiňovaných cytogenetických či imunohistochemických [15, 18] vyšetření, jako je stanovení proliferačních markerů, apoptoických indexů, stupně denzity trofoblastocytů atd. [61].
Ve sporných případech je možné materiál zaslat do specializované laboratoře k molekulárně genetickému vyšetření [61] a k provedení karyotypizace. Nevýhodou těchto vyšetření jsou nároky na kvalitu dodaného vzorku. Ne vždy se ze zaslaného materiálu podaří DNA izolovat. K izolaci DNA se nejlépe hodí čerstvá tkáň, tedy taková, která nebyla fixována v médiu [18]. Tato vyšetření jsou nejčastěji využívána k odlišení triploidní parciální moly od diploidní moly kompletní, kdy nejsou histologicky vyjádřeny všechny typické změny [18]. Tato diagnostika není běžnou praxí, ale je indikována u opakujících se mol, event. z výzkumných důvodů [61].
Běžnou realitou je fakt, že dnešní moderní a dostupná ultrazvuková technika umožňuje zjistit absenci embrya již od 6. týdne. Nezralé kompletní moly bývají často mylně biopticky diagnostikovány jako parciální moly nebo hydropické aborty [59]. Makroskopický i mikroskopický obraz je v tomto vývojovém stadiu mnohem méně charakteristický, ultrazvuková a bioptická diagnostika moly je obtížnější [59]. V každodenní praxi tak uniká ze statistiky řada kompletních nebo parciálních mol pod diagnózou spontánního abortu [61] nebo dochází k záměně kompletní moly za parciální molu [60], často při nedostupnosti relevantního reprezentativního materiálu bez příslušných dispenzárních konsekvencí.
Incidence kompletních mol v České republice je jedna na jeden tisíc až čtyři tisíce těhotenství [28, 40, 61].
Etiopatogeneze kompletní moly
Kompletní hydatidózní mola neobsahuje fetální tkáň, 90 % tvoří 46 XX, 10 % 46 XY [45, 57].
Kompletní moly lze dělit na dva typy – androgenní kompletní mola a biparentální kompletní mola [33].
U androgenní kompletní moly rozlišujeme homozygotní a heterozygotní variantu. Homozygotní tvoří 80 % kompletních mol. Je definována dvěma identickými paternálními chromozomy, které jsou vytvořeny možnou duplikací paternálního haploidního chromozomu. Postiženy jsou vždy ženy; kombinace 46 YY je patrně letální kombinací a nebyla nikdy prokázána [33, 61].
Heterozygotní varianta tvoří 20 % kompletních mol. Postižení jedinci mohou být mužského i ženského pohlaví. Všechny chromozomy jsou paternálního původu, hypoteticky např. oplozením dvěma spermiemi.
Nicméně mechanismus vzniku diploidního mužského genomu (diandrie) není zcela jasný. Duplikace genomu spermie i oplození dvěma spermiemi jsou teoreticky možné, ale relativně málo pravděpodobné. Daleko pravděpodobnější je oplození diploidní spermií, které se vyskytují relativně často (asi 0,1 % u normospermiků a přibližně 3 % u oligoastenospermiků).
Koncept prázdného vajíčka (empty egg), který je při vzniku kompletní moly v české odborné literatuře opakovaně referován [21, 28, 40, 61], není všeobecně přijímán. Neexistují publikace, které by vysvětlovaly jeho vznik, i když teoreticky můžeme předpokládat např. chybu v telofázi meiózy vedoucí k tomu, že všechny chromozomy oocytu přejdou do pólového tělíska. Lze předpokládat, že stejný efekt může nastat, když dojde ke ztrátě mateřských chromozomů při prvním rýhovacím dělení, nezformuje se ženské prvojádro apod. Těchto možných mechanismů je pravděpodobně více, ale je obtížné je zpětně identifikovat.
Biparentální kompletní mola je vzácná. Přítomna je paternální i maternální genetická výbava, porucha maternálního imprintingu je příčinou exprese pouze paternálního genomu [8].
Popsána je recidivující forma biparentální moly familiárního původu, s předpokládaným autozomálně recesivním charakterem přenosu. Al-Hussaini referoval u skupiny pěti žen devět opakujících se molárních těhotenství [1, 6].
Byla identifikována mutace NLRP7 na pozici 19q13.4 jako kauzální důvod opakujících se molárních těhotenství [5, 16, 29], vzácněji KHDC3L [18].
U žen s familiárně vázanou molou připadá jako řešení v úvahu dárcovství oocytu [18].
Kdy otěhotnět po kompletní mole
Doporučení, kdy otěhotnět po kompletní mole formují dva aspekty, kromě rizika recidivy v zásadě skutečnost, zda se jednalo o kompletní hydatidózní molu bez léčby, či zda se jedná o uvažované těhotenství po chemoterapii pro maligní GTN (event. v kontextu jejího závažnosti) [26, 46]. Samotná etiopatogeneze kompletní moly má spíše charakter statistické nahodilosti a jakékoli předepisované časové limity do další koncepce jen z důvodu absolvované kompletní moly nejsou racionální.
Určitým omezením před další graviditou může být časová délka doporučované dispenzarizace, která je založena na pravidelných kontrolách hladin sérového hCG. Předčasné následné těhotenství tento monitoring a kontrolu stavu nemoci prakticky znemožní [15].
Po kompletní mole bez léčby nemusí být ukončení monitoringu sérových hladin hCG po šesti měsících od dosažení laboratorně negativních hodnot postupem non lege artis. Riziko recidivy základního onemocnění je u této benigní formy enormně nízké [14, 43]. Chtěné těhotenství v kratším intervalu negativity hCG nemusí být indikací k ukončení těhotenství, je-li ultrasonografie nového těhotenství v normě [40].
Po kompletní mole po chemoterapii pro maligní GTN je doporučovaná délka monitoringu hCG jeden rok, ve IV. stadiu onemocnění (metastázy v jiných lokacích, než jsou plíce a dolní genitální trakt) po dobu dvou let od dosažení negativních hodnot hCG [15]. Pravděpodobnost pozdní rekurence u maligní formy trofoblastického onemocnění je u pacientek s rok trvající remisí méně než 1 % [15].
Diskutabilní je, kdy po absolvování chemoterapie trofoblastické nemoci otěhotnět při minimalizování negativního vlivu této léčby na vývoj nového ova. Většina lhůt je málo racionální. Oocyty, vajíčka, jsou od narození až do období asi jednoho roku před ovulaci uložena ve vaječníku v primordiálnich folikulech a jsou po celou dobu v profázi I. meiotického dělení. Protože v nich v tomto období neprobíhá syntéza DNA ani RNA, jsou relativně odolné vůči působení chemických mutagenů (mohou být ale poškozeny fyzikálními vlivy). Zhruba rok před ovulaci je vybrána skupina folikulů (nábor – recruitment), z nichž zpravidla jeden se stane dominantním a bude ovulovat. Po náboru folikulů začínají folikuly růst a aktivuje se genom oocytů (syntéza RNA). Po ukončení růstu folikulu (těsně před ovulací) se dokončuje meiotické dělení a v tomto období se mohou negativně uplatnit látky působící na složky cytoskeletu (aktin, tubulin) a vyvolat vznik chromozomových anomálií [50]. Vzhledem k tomu, že drtivá většina oocytů je v primordiálních folikulech, kde jsou metabolicky téměř inaktivní, mohly by být spíše ovlivněné oocyty, které byly v době chemoterapie v rostoucích a antrálních folikulech, tedy zhruba rok staré (preantrální fáze folikulogeneze 290 dní, antrální fáze 60 dní) [56]. I tam ovlivní chemoterapie hlavně folikulární buňky, výsledkem je pak spíše atrézie než mutace, hlavním efektem je pak zmenšení ovariální rezervy. Rozsah poškození ovariální rezervy je významnější u starších pacientek [49], které navíc mají primárně ovariální rezervu sníženou věkem [52]. Nejvýznamněji ovlivňuje ztrátu ovariálních funkcí cyklofosfamid, který má silný dopad na ovariální rezervu. Čtyřicet osm hodin po jeho aplikaci byla pozorována 90% redukce množství folikulů [4].
V literatuře se uvádí vyšší podíl abnormálních těhotenství (spontánních potratů, mrtvorozených, opakované trofoblastické nemoci), pokud k následnému otěhotnění dojde do šesti měsíců po zakončení chemoterapie, ve srovnání s výsledky těhotenství, kde ke koncepci dojde po 12 měsících po dokončení chemoterapie [31]. V případě asistované reprodukce s odběrem oocytů po absolvování chemoterapie trofoblastického onemocnění, lze samozřejmě uvažovat o selekci embryí pomocí preimplantačního genetického screeningu aneuploidií (PGS) [52].
V neposlední řadě, přes různě koncipovaná odborná doporučení, závisí konečné rozhodnutí, kdy otěhotnět a zda si těhotenství ponechat, na svobodné vůli samotné pacientky.
ZÁVĚR
Po evakuaci a histologickém potvrzení kompletní hydatidózní moly striktně, i v rámci spádové ambulance, každý týden provádět kontrolní odběry sérového hCG.
V případě zaznamenání plateau nebo vzestupu sérových hodnot hCG a/nebo zjištění metastáz v plicích či pochvě, je nutno vyslovit podezření na maligní zvrat a pacientku konzultovat a předat do péče Centra pro trofoblastickou nemoc, včetně kopie klinické, ultrazvukové a histologické dokumentace (v ideálním případě současně s histologickými preparáty nebo fotodokumentací). V rámci následné dispenzarizace v CTN spolupracovat s dispenzarizujícím pracovištěm při každotýdenních kontrolních odběrech hCG a v základní péči o pacientku.
Při perzistujících hladinách sérového hCG po 30 dnech od evakuace moly, i za situace jejich setrvalého klesání, konzultovat s Centrem pro trofoblastickou nemoc časový limit pasivního vyčkávání, respektovat přání pacientky.
Klinický přínos separovaných abrazí a paušálních rekyretáží do sedmi až deseti dnů při ultrazvukově čisté děloze, negativní klinice a klesajících hodnotách hCG, je sporný. Rekyretáže spádovým pracovištěm jsou indikované většinou jen pro jasně prokázaná nitroděložní rezidua bez propagace do děložní stěny. Opakované nebo přetrvávající metroragie s nejednoznačným UZ nálezem a přetrvávajícími hodnotami hCG konzultovat s CTN, se zvážením primárního zaléčení chemoterapií.
Spíše výjimečný histologický záchyt proliferující moly či PSTT následný standardní klinický observační přístup nezmění s ohledem k možnosti benigního spontánního ústupu těchto variant trofoblastické nemoci.
Případné včasné nasazení hormonální antikoncepce (orální kontraceptiva nebo depotní medroxyprogesteronacetát) po evakuaci moly je po dobu monitoringu vhodné, v odborné literatuře ale nepanuje shoda, zda je podmínkou dosažení laboratorně definovaných negativních hodnot sérového hCG.
Pro možnost dalšího těhotenství po kompletní mole s cílem minimalizovat možná rizika je zásadní, zda se jedná o těhotenství po mole bez léčby, či o těhotenství po chemoterapii pro maligní GTN.
Pro těhotenství po mole bez léčby dochází ke změkčení pravidel. Délku monitoringu (po dosažení dvou až čtyř jednotýdenních nulových hodnot hCG po evakuaci, následované pravidelnými měsíčními kontrolami) lze zkrátit na šest měsíců. Chtěné těhotenství v kratším intervalu negativity hCG nemusí být indikací k ukončení těhotenství, je-li ultrasonografie nového těhotenství v normě. Riziko recidivy základního onemocnění je u této benigní formy enormně nízké.
Pro možnost dalšího otěhotnění po chemoterapii pro maligní GTN je zásadní úvahou závažnost GTN, riziko relapsu a potenciálně negativní vliv chemoterapie na vývoj ova. Mimo těžké formy GTN je doporučovaná délka monitoringu hCG (po dosažení dvou až čtyř jednotýdenních nulových hodnot hCG po evakuaci, následované pravidelnými měsíčními kontrolami) a neotěhotnění po chemoterapii pro maligní GTN jeden rok, a prakticky se kryje s délkou přípravy ova k ovulaci (350 dní). Riziko relapsu s rok trvající remisí je v této skupině nižší než jedno procento. Samozřejmě i zde se jedná o projekci potenciálních rizik, časnější těhotenství nemusí nutně znamenat nekvalitní graviditu či relaps základního onemocnění.
Dvouletý interval dispenzarizace s měsíčními kontrolami hladin hCG je indikován v odborné literatuře [15] spíše pro IV. stupeň gestačního trofoblastického tumoru (všechny typy choriokarcinomu a metastázující proliferující mola), většinou po ukončené polychemoterapii s prokázanými metastázami i mimo plíce a genitální trakt.
Paušálně citovaná podmínka neotěhotnět dva roky po evakuaci kompletní moly, deklarovaná některými publikacemi [38, 60] a na některých sociálních sítích, nemá jednoznačné opodstatnění.
Vhodné je ve spádové ambulanci provést kontrolní odběry sérových hladin hCG u pacientek s historií gestačního trofoblastického onemocnění vždy šest týdnů po každém následném těhotenství s ohledem na riziko spící trofoblastické nemoci (quiescent trophoblastic disease), či hypotetické možnosti relapsu [20, 53]. Někteří autoři doporučují celoživotní dispenzarizaci [17]. Výskyt choriokarcinomu v delším než dvouletém intervalu po předcházejícím těhotenství je ale raritní [40].
S ohledem na možnost histopatologického podhodnocení nezralé kompletní moly nemusí být bez ratia kontrolní odběr hCG šest týdnů po evakuaci malých neprosperujících afetálních gravidit, a to i bez ohledu na následné menstruační krvácení.
Kompletní mola hydatidosa může být i biparentální, uplatňuje se ale pouze mužský genom.
Je třeba vnímat fakt, že větší část rodiček se za poslední desetiletí v České republice posunula do věkového skupiny 28–35 let, v roce 2014 dosáhl v době prvního porodu průměrný věk matky 28 let, s podílem 14 % rodiček, které porodily po završení 35. roku věku. U mnoha žen, které budují pevnější perspektivní vztahové vazby kolem 30. roku věku, pak může mít dvouleté až tříleté (ale i delší) období, kdy nečekaně absolvují kompletní molu, její řešení a následnou dispenzarizaci (zvláště při nuliparitě), negativní matrimoniálněsociální konsekvence. Zároveň žena i její okolí často vnímají psychologický tlak „tikajících biologických hodin“ a zužující se možnosti partnerského výběru. Tyto ženy brzké nové těhotenství ve svém životě předpokládají a souhlasu se u klinického i spádového gynekologa dožadují.
Pro tyto specialisty je pak výzvou u konkrétní pacientky hledat optimální řešení (tailoring) a někdy i kriticky přehodnocovat některá publikovaná, tradovaná či přepisovaná učebnicová doporučení.
Bez ohledu na kruciální úlohu Center pro trofoblatickou nemoc v dispenzarizaci a péči o pacientku s vážnější formou trofoblastické nemoci, je to v zásadě spádový gynekolog, který pravidelné náběry hCG provádí a může prakticky okamžitě vyhodnocovat trendy a rizika, a obratem konzultovat řešení. Zároveň je to často spádový gynekolog, který rozhoduje o předání pacientky do CTN, event. realizuje celoživotní dispenzarizaci.
PODĚKOVÁNÍ
Nezanedbatelnou a vděčnou skutečností v této kazuistice byla možnost konzultace Centra pro trofoblastickou nemoc při FN Motol Praha a prakticky tak možnost úspěšného a rychlého doléčení. Práce je poděkováním prof. MUDr. Lukáši Robovi, CSc., doc. MUDr. Heleně Robové, Ph.D., MUDr. Markovi Plutovi, Ph.D., a jejich spolupracovníkům za profesionálně odvedenou péči.
MUDr. Stanislav Zeman
Gynekologická ambulance
Vrchovecká 1
594 01 Velké Meziříčí
e-mail: dr.szeman@seznam.cz
Zdroje
1. Al-Hussaini, TK., Abd el-Aal, DM., Van den Veyver, IB. Recurrent pregnancy loss due to familial and non-familial habitual molar pregnancy. Int J Gynaecol Obstet, 2003, 83(2), p. 179–186.
2. Alifrangis, C., Agarwal, R., Short, D., et al. EMA/CO for high-risk gestational trophoblastic neoplasia: Good outcomes with induction low-dose etoposide-cisplatin and genetic analysis. J Clin Oncol, 2012, 1(2), p. 280–286.
3. Cole, LA., Miller, CY. Hyperglycosylated hCG in the management of quiscent and chemorefractory gestational trophoblastic disease. Gynecol Oncol, 2010, 116(1), p. 3–9.
4. de Pedro, M., Otero, B., Martin, B. Fertility preservation and breast cancer: a review. Ecancemedicalscience, 2015, 9, p. 503.
5. Deveault, C., Qian, JH., Chebaro, W., et al. NLRP7 mutations in women with diploid androgenetic and triploid moles: a proposed mechanism for mole formations. Hum Mol Genet, 2009, 18(5), p. 888–897.
6. Fallahian, M. Familial gestational trophoblastic disease. Placenta, 2003, 24(7), p. 797–799.
7. Familliari, G., Caggiati, A., Nottola, SA., et al. Ultrastructure of human ovarian primordial follicles after combination chemotherapy for Hodgkin´s disease. Hum Reprod, 1993, 8(12), p. 2080–2087.
8. Fisher, RA., Hodges, MD. Genomic imprinting in gestational trophoblastic disease – a review. Placenta, 2003, Suppl. A:S, p. 111–118.
9. Fong, PY., Xue, WC., Ngan, HY., et al. Mcl-1 expression in gestational trophoblastic disease correlates with cloníc aoutcome: a differential expression study. Cancor, 2005, 103(2), p. 268–276.
10. Fulop, V., Mok, SC., Berkowitz, RS. Molecular biology of gestational trophoblastic neoplasia: a review. J Repris Med, 2004, 49(6), p. 415–422.
11. Garner, EI., Felmate, CM., Goldstein, DP., et al. The curative effect of second curettage in persistent trophoblastic disease: a retrospective cohort survey. Gynecol Oncol, 2005, 99(1): p. 3–5.
12. Garner, EI., Garrett, A., Goldstein, DP., et al. Significance of chest computed tomography findings in the evaluation and treatment of persistent gestational trophoblastic neoplasia. J Reprod Med, 2004, 49(6): p. 411–414.
13. Goldstein, DP., Zanten-Przybysz, I., Bernstain, MR., et al. FIGO staging system for gestational trophoblastic tumors. J Reprod Med, 1998, 43, p. 37–43.
14. Hancock, BW., Nazir, K., Everard, JE. Persistent gestational trophoblastic neoplasia after partial hydatidiform mole – Incidence and outcome. J Reprod Med, 2006, 51(10), p. 764–766.
15. Hernandez, E. Gestational Trophoblastic Neoplasia. http://emedicine.medscape.com/article/279116-overview. Updated: Mar 05,2015
16. Hodges, MD., Rees, HC., Seckl, MJ., et al. Genetic refinement and physical mapping of a biparental complete hydatiform mole locus on chromosome 19q13.4. J Med Genet, 2003, 40(8):e p. 95.
17. Hron, F., Feyereisl, J., Korbel, M. Perzistující trofoblastická nemoc – diagnostika a léčba. http://zdravi.euro.cz/clanek/postgradualni-medicina/perzistujici-trofoblasticka-nemoc-diagnostika-a-lecba-478298. 18.3.2015
18. Hron, F., Feyereisl, J., Korbel, M., Šafář, P. Současné trendy v diagnostice a léčbě trofoblastické nemoci. Actual Gyn, 2014, 6, s. 63–66.
19. Hron, F., Hejda, V., Feyereisl, J., et al. Neinvazivní trofoblastická nemoc. Čes Gynek, 2011, 76, 6, s. 443–446.
20. Hron, F., Hejda, V., Feyereisl, J., et al. Quiescent trophoblastic disease. Čes Gynek, 2011, 76, s. 443–446.
21. Ježová, M., Hotárková, S., Můčková, K., et al. Fetopatologie a vývojová patologie embrya a plodu. Gestační trofoblastická nemoc. http://atlases.muni.cz. Atlas fetální patologie.
22. Kashimura, Y., Kashimura, M., Sugimori, H., et al. Prophylactic chemotherapy for hydatidiform mole. Five to 15 years follow-up. Cancer, 1986, 58(3), p. 624–629.
23. Khanlian, SA., Cole, LA. Management of gestational trophoblastic disease and other cases with low serum levels of human chorionic gonadotropin. J Reprod Med, 2006, 51(10), p. 812–818.
24. Kim, SJ., Park, SE., Lee, C., et al. Altered imprinting, promoter usage, and expression of insulin-like growth factor-II gene in gestational trophoblastic diseases. Gynecol Oncol, 2003, 88(3), p. 411–418.
25. Kohorn, EI. Dynamic staging and risk factor scoring for gestational trophoblastic disease. Int J Gynecol Cancer, 2007, 17, p. 1–7.
26. Kohorn, EI. Negotiating a staging and risk factor scoring system for gestational trophoblastic neoplasia. A progress report. J Repris Med, 2002, 47(6), p. 445–450.
27. Kohorn, EI. The FIGO 2000 staging and risk factors scoring systém for gestational trophoblastic neoplasia; A critical analysis. Int J Gynecol Cancer, 2001, 11, p. 205–215.
28. Kolařík, D., Halaška, M., Feyereisl, J. Repetitorium Gynekologie. 2. rozšířené vydání. Praha: Maxdorf Jessenius, 2011, s. 904–914.
29. Lawler, SD., Fisher, RA., Dent, JA. A prospective genetic study of complete and partial hydatiform loles. Am J Obstet Gynecol, 1991, 164(5Pt1), p. 1270–1277.
30. Massad, LS., Abu-Rustum, NR., Lee, SS., et al. Poor compliance with postmolar surveillance and treatment protocols by indigent women. Obstet Gynecol, 2000, 96(6), p. 940–944.
31. Matsui, H., Iitsuka, Y., Suzuka, K., et al. Risk of abnormal pregnancy completing chemotherapy for gestational trophoblastic tumor. Gynecol Onkol, 2003, 88(2), p. 104–107.
32. Meirow, D., Dor, J., Kaufman, B., et al. Cortical fibrosis and blood-vessels damage in human ovaries exposed to chemotherapy. Potential mechanisms of ovaria injury. Hum Reprod, 2007, 22(6), p. 1626–1633.
33. Moore, LE., Hernandez, E. Hydatiform Mole: Background, Pathophysiology, Epidemiology. http://emecinine.medscape.com/article/254657.overview. Updated: Nov 30, 2015.
34. Ngan, HY. The FIGO staging for gestational trophoblastic neoplazm 2000. FIGO Report. Int J Gynecol Obstet, 2000, 77, p. 285–287.
35. Ngan, HY., Chan, FL., Au, VW., et al. Clinical outcome of micrometastasis in the lung in stage IA persistent gestational trophoblastic disease. Gynecol Oncol, 1998, 70(2), p. 192–194.
36. Olsen, TG., Barnes, AA., King, JA. Elevated hCG outside of pregnancy-diagnostic considerations and laboratory evaluation. Obstet Gynecol Surv, 2007, 62(10), p. 669–674; quiz p. 691.
37. Olsen, TG., Hubert, PR., Nycum, LR. Falsely elevated human chorionic gonadotropin leading to unnecessary therapy. Obstet Gynecol, 2001, 98(5 Pt 1), p. 843–845.
38. Pařízek, A. Kniha o těhotenství a dítěti. Praha: Galén, 2009, 776 s.
39. Pezeshki, M., Hancock, BW., Silcocks, P., et al. The role of repeat uterine evacuation in the management of persistent gestational trophoblastic disease. Gynecol Oncol, 2004, 95(3), p. 423–429.
40. Rob, L. Gestační trofoblastická nemoc. Linkos>> Pro pacienty>> Diagnózy>> Gynekologické nádory (C51-54.C56-57) Datum vytvoření 4. 1. 2007.
41. Rob, L., Martan, A., Cittebart, K. Gynekologie. 2. vyd. Praha: Galén, 2008, 390 s. ISBN 978-80-7262-501-7.
42. Rustin, GJ., Newlands, ES., Lutz, JM., et al. Combination but not single-agent methotrexate-chemotherapy for gestational trophoblastic tumors increases the incidence of second tumors. J Clin Oncol, 1996, 14(10), p. 2769–2773.
43. Seckl, MJ., Fisher, RA., Salerno, GA., et al. Choriocarcinoma and partial hydatidiform moles. Lancet, 2000, 356(9223), p. 36–39.
44. Seckl, MJ., Sebire, NJ., Fisher, RA., et al. Gestational trophoblastic disease: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 2013, 24, p. 39–50.
45. Slim, R., Mehio, A. The genetics of hydatiform moles: new lights on an ancient disease. Clin Genet, 2007, 71(1), p. 25–34.
46. Smith, HO., Kohorn, E., Cole, LA. Choriocarcinoma and gestational trophoblastic disease. Obstet Gynecol Clin North Am, 2005, 32(4), p. 661–684.
47. Soper, JT. Gestational trophoblastic disease. Obstet Gynecol, 2006, 108(1), p. 176–187.
48. Takenchi, S. The report of the Registration Committee of the Japan Society of Gestational Trophoblastic Diseases. Acta Obstet Gynecol Japonica, 1987, 39, p. 871–880.
49. Tham, YL., Sexton, K., Weiss, H., et al. The rates of chemotherapy-induced amenorrhea in patients treated with adjuvant doxorubicin and cyclophosphamide followed by a taxane. Am H Clin Oncol, 2007, 30(2), p. 126–132.
50. Trávník, P. Embryonální vývoj člověka a jeho ovlivnění léčivými látkami I. Charakteristika etap vývoje a enviromentálních vlivů na zárodek. Prakt Lékáren, 2011, 7(1), s. 17–19.
51. van Trommel, NE., Massuger, LF., Verheijen, RH., et al. The curative effect of a second curettage in persistent trophoblastic disease: a retrospective cohort survey. Gynecol Oncol, 2005, 99(1), p. 6–13.
52. Veselá, K., Kocur, T., Horák, J., et al. Asistovaná reprodukce a preimplantační genetická diagnostika u pacientek ohrožených karcinomem prsu. Klin Onkol, 2016, 29 (Suppl. 1), s. 93–99.
53. Vojtaššák, J., Vojtaššák, B. Genetické aspekty gestačních trofoblastových tumorov. Gynekol Prax, 2014, 12, s. 145–114.
54. Wiesma, S., Kerkmeijer, L., Bekkers, R., et al. Guidelines following hydatidiform mole: a reappraisal. Austral New Zealand J Obstet Gynaecol, 2006, 46(2), p. 112–118.
55. Wiesma, S., Kerkmeijer, L., Bekkers, R., et al. Persistent trophoblast disease following partial molar pregnancy. Austral New Zealand J Obstet Gynaecol, 2006, 46(2), p. 119–123.
56. Williams, CJ., Erickson, GE. Morphology and physiology of the ovary. In: Robert Rebar (Ed.) Endocrinology of female reproduction. Endotext, 2012. 45 pp.
57. Wolf, NG., Lage, JM. Genetic analysis of gestational trophoblastic disease: a review. Semin Oncol, 1995, 22(2), p. 113–120.
58. Zavadil, M. Trofoblastická nemoc. Kapitola 24. In Roztočil, A. Moderní gynekologie. Praha: Grada Publishing, 2009.
59. Zavadil, M., Feyereisl, J., Krofta, L., et al. Nové diagnostické přístupy k různým typům hydatidózních mol, hydropickým abortům a příslušné klinické postupy. Čes Gynek, 2009, 74, 3, s. 177–182.
60. Zavadil, M., Feyereisl, J., Krofta, L., et al. Perzistující trofoblastická nemoc v Centru pro trofoblastickou nemoc v ČR v letech 1955–2007. Čes Gynek, 2008, 73, 2, s. 73–79.
61. Zavadil, M., Feyereisl, J., Krofta, L., et al. Trofoblastická nemoc. Postgrad Med, 2007, 1.
62. Zavadil, M., Feyereisl, J., Šafář, P., et al. Syndrom perzistujících nízkých hladin humánních choriových gonadotropinů (hCG). Etiologie, klasifikace, diagnostika, postupy. Čes Gynek, 71, 2006, 2, s. 136–142.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2017 Číslo 5
Nejčtenější v tomto čísle
- Jaké je riziko recidivy sestupu pánevních orgánů po vaginální hysterektomii s poševními plastikami?
-
Screeningové vyšetření endometriálních NK buněk u vybraných infertilních pacientek
1. část – metodika a průběžné výsledky - Selektivní fetoredukce u monochoriálních gravidit komplikovaných vrozenou vývojovou vadou jednoho z plodů: management a výsledky péče
- Endometrióza a kvalita života
