Aspekty výběru embryí a jejich příprava pro vznik lidských embryonálních kmenových buněk určených k humánní terapii
Aspects of embryo selection and their preparation for the formation of human embryonic stem cells intended for human therapy
Objective: The work deals with a clinical part of human embryonic stem cell (hESC) research. The aim of the project is the differentiation of somatic cell types, useful in drug development, regenerative medicine and cell therapy. The aim of this work is to enable targeted therapy of yet incurable diseases. The pluripotent hESCs have unlimited self-renewal capacity. This ability is used in therapy to create missing or damaged cells in the human body. It is of interest to develop clinical-grade hESC lines useful in preclinical and clinical studies.
Methods: The derivation of the hESC must respect the legislation of the Czech Republic and the EU. The aim was to develop an informed consent of both donors for donated discarded embryos that are not suitable for treatment by in vitro fertilization according to Directive 2004/23/EC. The FNB‘s Center for Assisted Reproduction (CAR) participates in oocyte collection, cultivation and cryopreservation of embryos, communication with clients and ensuring the informed consent of embryo donors. A transport protocol and a methodology for handing over the thawed embryos with the original numerical code were developed. Before the embryos are handed over to the ICRC co-author‘s workplace (CTEF), they are thawed and, if necessary, recultivated to the blastocyst stage; afterwards, assisted hatching is performed.
Results: In the period from January 2018 to July 2020, 138 selected suitable clients were asked for donations, with 52 not responding, 19 terminating and 29 extending the embryo storage. Only 38 clients, i.e. 27.5%, agreed with the usage of their embryos for the preparation of hESCs. In the same period, personal communication with suitable CAR clients took place and another 17 embryo donors were obtained. A total of 160 embryos were obtained from 55 donors aged 26 to 42 years. The embryos were most often frozen in the blastocyst (53 embryos – 33.1%) and morula (74 embryos – 46.3%) stages. Of the 29 genetically examined embryos, only 5 are euploid (17.2%), 2 are mosaic and 22 are aneuploid or with translocations or carriers with a monogenic defect.
Conclusion: We have an informed consent prepared and approved by the Ethics Committee of the Masaryk University and the University Hospital Brno; 160 donated embryos have been selected and secured. A transport protocol and handover methodology are developed. The plan for the transfer of thawed anonymized embryos in the first phase, October – December 2020, includes approximately 5 thawed blastocysts per week with assisted hatching. After their transfer to the CTEF, the embryoblast will be isolated with subsequent cultivation. The established hESCs must meet the specified criteria of safety, stability and pluripotency. We believe that, in accordance with the project plan, we will obtain at least 3 clinical-grade hESC lines, the first created in the Czech Republic, respecting the requirements for Advanced Medicinal Therapy Products (AMTP).
Keywords:
embryo selection – IVF – donation – blastocyst – vitrification – embryoblast – human embryonic stem cells – cell therapy
Autoři:
Ventruba P. 1; Žáková J. 1; Ješeta M. 1; Lousová E. 1; Hampl A. 2; Souralová T. 2,3; Koutná I. 2,3
Působiště autorů:
Gynekologicko-porodnická klinika LF MU a FN Brno
1; Ústav histologie a embryologie, LF MU Brno
2; Centrum buněčného a tkáňové inženýrství, ICRC, FN u sv. Anny v Brně
3
Vyšlo v časopise:
Ceska Gynekol 2021; 86(1): 5-10
Kategorie:
Původní práce
doi:
https://doi.org/10.48095/cccg20215
Souhrn
Cíl práce: Práce se zabývá klinickou částí výzkumu lidských embryonálních kmenových buněk (hESC). Cílem projektu je vznik somatických buněčných typů použitelných ve vývoji léčiv, regenerativní medicíně a buněčné terapii. Výhledem je umožnit cílenou terapii dosud nevyléčitelné nemoci. Pluripotentní hESC mají neomezenou kapacitu pro sebeobnovu. Této vlastnosti se využívá v terapii, kdy jsou z hESC vytvořeny chybějící nebo poškozené buňky v lidském těle. Je zájem vytvořit hESC linie v klinické kvalitě, použitelné v předklinických a klinických studiích.
Metodika: Vytvoření hESC musí respektovat legislativu ČR a EU. Podmínkou bylo vypracovat informovaný souhlas obou dárců pro darovaná vyřazená embrya, která nejsou vhodná pro léčbu oplodněním in vitro dle směrnice 2004/23/ES. Centrum asistované reprodukce (CAR) FN Brno se podílí na odběru oocytů, kultivaci a kryokonzervaci embryí, komunikaci s klienty a zajišťování informovaných souhlasů dárců embryí. Byl vypracován předávací protokol a metodika předávání rozmrazených embryí s originálním číselným kódem. Před předáním embryí na spoluautorské pracoviště – Centrum buněčného a tkáňového inženýrství (CTEF) ICRC FN u sv. Anny – je provedeno jejich rozmrazení, v případě potřeby dokultivování do stadia blastocysty, a následně je proveden asistovaný hatching.
Výsledky: V období leden 2018 až červenec 2020 bylo obesláno 138 vybraných vhodných klientek na dárcovství, z nichž 52 nereagovalo, 19 ukončilo a 29 prodloužilo skladování embryí. Pouze 38 klientek, tj. 27,5 %, souhlasilo s jejich využitím na přípravu hESC. Ve stejném období probíhala osobní komunikace s vhodnými klienty CAR a bylo získáno dalších 17 dárců embryí. Celkem bylo získáno 160 embryí od 55 dárkyň ve věku 26–42 let. Nejčastěji byla embrya zamrazena ve stadiu blastocysty (53 embrií – 33,1 %) a moruly (74 embrií – 46,3 %). Z 29 geneticky vyšetřených embryí je 5 euploidních (17,2 %), 2 mozaiky a 22 aneuploidních nebo s translokací či přenašečů s monogenní vadou.
Závěr: Byl vypracován a Etickou komisí LF MU a FN Brno schválen informovaný souhlas, bylo vybráno a zajištěno 160 darovaných embryí. Je vypracován předávací protokol a metodika předávání. Plán předávání rozmrazených anonymizovaných embryí zahrnuje cca 5 rozmrazených blastocyst týdně s provedeným asistovaným hatchingem. Po předání embryí na CTEF probíhá izolace embryoblastu s následnou kultivací. Ustanovené buněčné linie hESC musí splnit specifikovaná kritéria bezpečnosti, stability a pluripotence. Věříme, že v souladu s plánem projektu získáme nejméně tři linie hESC v klinické kvalitě, poprvé vytvořené v ČR, respektující požadavky na léčivé přípravky Advanced Medicinal Therapy Products (AMTP).
Klíčová slova:
výběr embryí – IVF – dárcovství – blastocysta – vitrifikace – embryoblast – lidské embryonální kmenové buňky – buněčná terapie
Úvod
Práce se zabývá klinickou částí výzkumu lidských embryonálních kmenových buněk (hESC). Cílem celého projektu je vznik somatických buněčných typů použitelných ve vývoji léčiv, regenerativní medicíně a buněčné terapii. Výhledem je umožnit cílenou terapii dosud nevyléčitelné nemoci, např. diabetes mellitus, poranění míchy či Parkinsonovy choroby.
Pluripotentní hESC mají neomezenou kapacitu pro sebeobnovu. Této vlastnosti se využívá v terapii, kdy jsou z hESC vytvořeny chybějící nebo poškozené buňky v lidském těle. Je zájem vytvořit hESC linie v klinické kvalitě použitelné v předklinických a klinických studiích, jak jsme uváděli v našich předchozích publikacích [1,2].
Úkolem klinické části projektu je výběr a zajištění dostatečného počtu darovaných embryí. Vědeckovýzkumná činnost využívající lidská embrya je upravena zákony č. 227/2006 Sb., o výzkumu na lidských embryonálních buňkách, a č. 373/2011 Sb., o specifických zdravotních službách [3,4].
Metodika izolace a kultivace hESC podléhá přísným regulím Ministerstva školství, mládeže a tělovýchovy (MŠMT ČR) a její schválení bylo podmínkou řešení našeho projektu. Podmínkou úspěšné realizace projektu je mezioborový tým zvládající lékařské, technologické a instrumentální postupy a protokoly, nezbytné pro navrhovaný výzkum.
Materiál a metodika
Vytvoření hESC musí respektovat legislativu ČR a EU. Podmínkou bylo vypracovat informovaný souhlas obou dárců pro darovaná vyřazená embrya, která nejsou vhodná pro léčbu oplodněním in vitro dle směrnice 2004/23/ES. Centrum asistované reprodukce (CAR) FN Brno se podílí na odběru oocytů, kultivaci a kryokonzervaci embryí, komunikaci s klienty a zajišťování informovaných souhlasů dárců embryí.
Byl vypracován předávací protokol a metodika předávání rozmrazených embryí s originálním číselným kódem. Před předáním embryí na spoluautorské pracoviště Centrum buněčného a tkáňového inženýrství (CTEF) ICRC FN u sv. Anny je provedeno jejich rozmrazení, v případě potřeby kultivace do stadia blastocysty, a následně byl proveden asistovaný hatching pomocí laseru [5].
Aspekty výběru embryí
Anabáze výběru embryí začala procházením protokolů laboratoře CAR s kryokonzervacemi embryí. Byla nutná kontrola adres klientů, včetně jejich poměrně složitého dohledávání, úhrady skladování, stávajícího počtu a stadia embryí. Vytvořená základní databáze potenciálních dárců zahrnovala kontaktní údaje pacientů, věk, datum zamrazení, počet a stadium embryí, počet embryí v jedné pejetě a informaci o genetickém vyšetření.
Vytvoření informovaného souhlasu vyžadovalo spolupráci s právníkem a schválení Etickou komisí komisí LF MU a FN Brno. Poté byla připravena česká a anglická verze. Připravený dopis se základními informacemi a požadavkem na vyjádření jak naložit s kryokonzervovanými embryi byl rozeslán spolu se zpáteční obálkou. Následná komunikace probíhala pomocí telefonátů, e-mailů, dopisů a osobních jednání.
Na základě zákona č. 373/2011 Sb., o specifických zdravotních službách, je možné s embryi naložit takto:
- uchovat pro další použití u příjemkyně, tzn. prodloužit skladování embryí na základě žádosti obou partnerů;
- udělit souhlas s jejich využitím pro výzkum na lidských embryonálních kmenových buňkách;
- udělit písemný souhlas s likvidací embryí. Na základě souhlasu jsou embrya následně rozmrazena a zlikvidována [4].
Příprava embryí
Embrya určená na stanovený termín předání do CTEF rozmrazujeme pomocí médií Warm Cleave (Vitrolife, Švédsko) či Warm Blast (Vitrolife, Švédsko) dle zamrazených stadií [6].
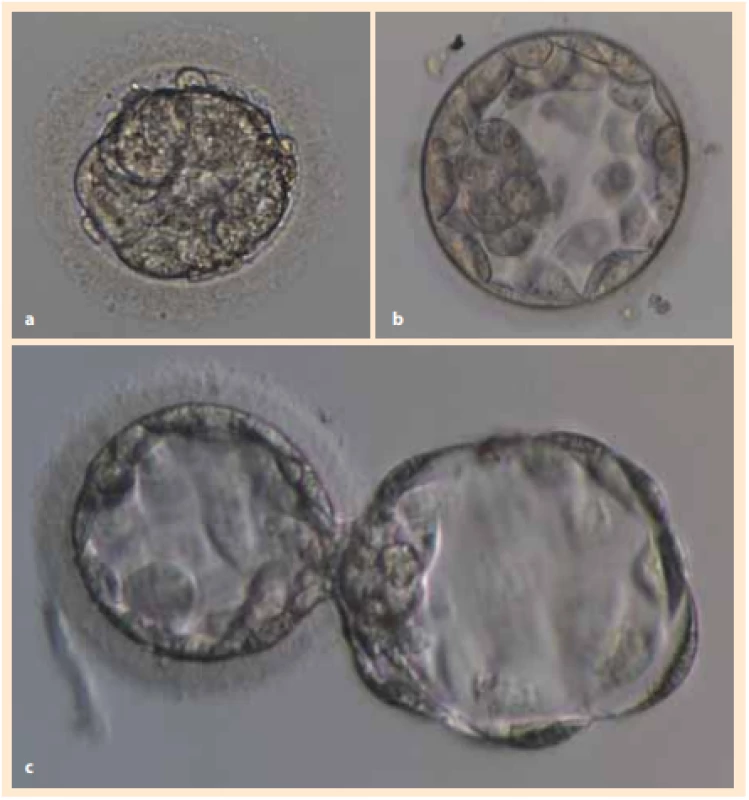
U nižších stadií embryí provádíme dokultivování do stadia blastocysty v médiu (Blastocyst Medium, COOK) v prostorách embryologické laboratoře CAR FN Brno. Po dosažení blastocysty je pomocí laseru (OCTAX NaviLase) proveden asistovaný hatching (obr. 1a–c).
Fig. 1. Preparation of donated embryos before embryoblast isolation and subsequent cultivation of the hESC cell line: a) embryo after thawing in the morula
stage, b) blastocyst after recultivation, c) blastocyst with assisted hatching.
Předání embryí a izolace embryoblastu na CTEF
Připravená embrya ve stadiu hatchující blastocysty jsou přenesena do transportního média a pomocí transportního inkubátoru s regulovanou teplotou na 37 °C (inkubátor přenosný ICT-P, výrobce Falc) jsou převezeny do laboratoře CTEF. Bezprostředně poté zde probíhá izolace embryoblastu s následnou kultivací buněčné linie hESC [2].
Embryoblast je izolován mechanicky s použitím mikroskopu (Nikon Eclipse Ti) s připojenými mikromanipulátory (Eppendorf), olejovým a vzduchovým mikroinjektorem (CellTram® 4r Air/Oil). Blastocysta je před izolací embryoblastu umístěna do média (Sydney IVF Gamete Buffer, výrobce COOK) pokrytého kultivačním olejem (Sydney IVF Culture Oil, výrobce COOK) pomocí denudačních mikropipet (Microtech IVF). Pro následnou izolaci je použita bioptická a fixační mikropipeta (Microtech IVF). Každý embryoblast je izolován samostatně, sterilně a jsou vedeny podrobné záznamy popisující derivaci a všechny následné kroky výroby [7].
Výroba hESC
Výroba je prováděna v čistých prostorách oddělení CTEF ve třídě čistoty A na pozadí třídy čistoty B dle současné správné výrobní praxe. Jsou popsány standardními operačními postupy, je prováděn mikrobiologický a částicový monitoring. Každá linie je vedena jako samostatná šarže, která je v průběhu výroby i jako finální produkt hodnocena pracovníky kontroly kvality na sterilitu, kvalitu, bezpečnost a další kritické parametry. Každému finálnímu produktu, tj. linii hESC v klinické kvalitě, je vytvořen analytický certifikát.
Výsledky
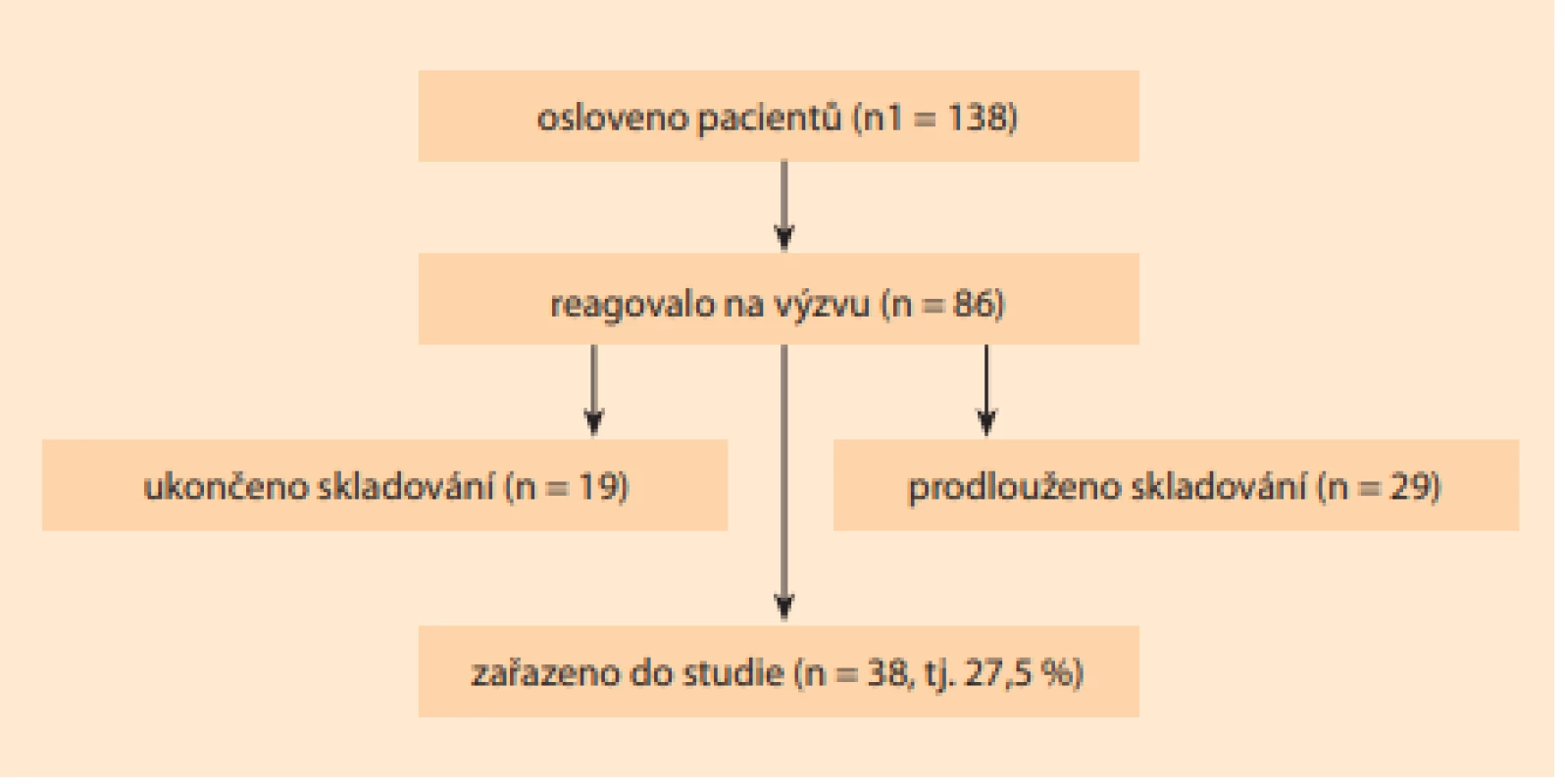
V období leden 2018 až červenec 2020 bylo obesláno 138 vybraných vhodných klientek na dárcovství, které měly zamrazena embrya v letech 2014–2017. Z toho 52 žen (37,7 %) nereagovalo na dopis, 19 (13,8 %) ukončilo a 29 pacientek (21,0 %) prodloužilo skladování embryí (tab. 1). Pouze 38 párů, tj. 27,5 %, souhlasilo s jejich využitím na přípravu hESC (obr. 2).
Fig. 2. Scheme of addressed donors of frozen embryos in 2013–2017.
Tab. 1. Composition of embryo donors addressed in the period from January 2018 to July 2020
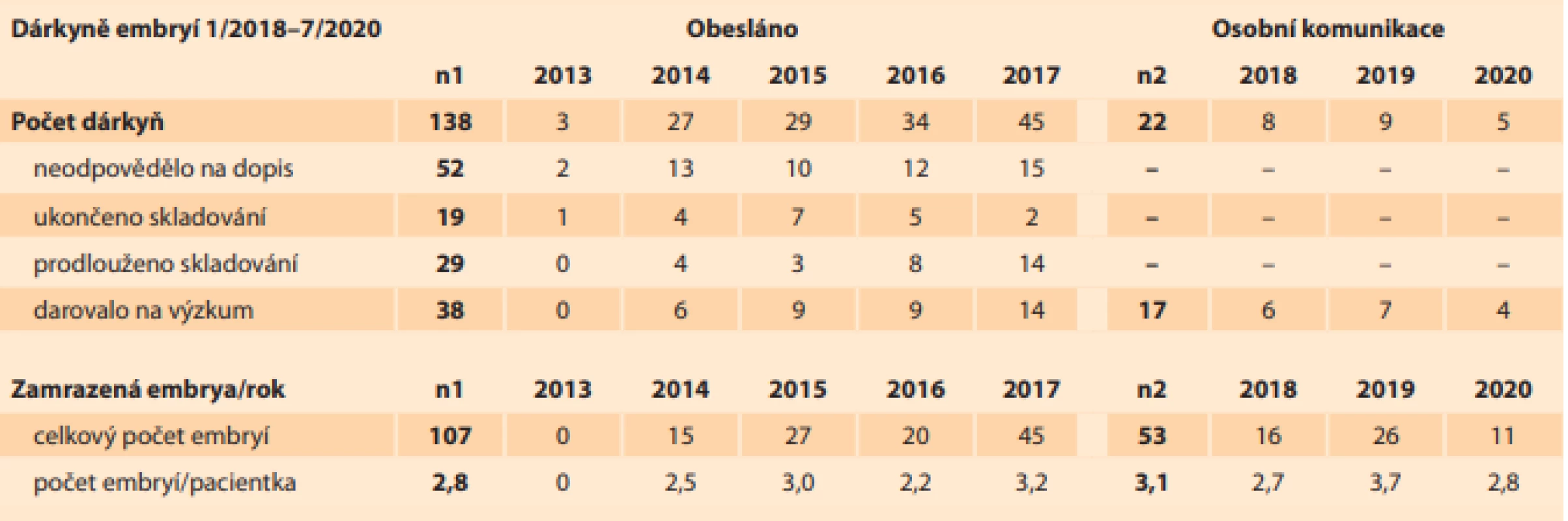
Ve stejném období probíhala osobní komunikace s vhodnými klienty CAR. Z 22 osobně oslovených párů na CAR, které měly zamrazena embrya v období leden 2018 až červenec 2020, bylo získáno dalších 17 dárců embryí (77,3 %). Výrazně vyšší podíl dárců z přímo oslovených klientů proti souboru obeslaných žen (27,5 %) byl zjevně ovlivněn osobním projednáním u vybrané skupiny párů – zejména u případů s geneticky vyšetřenými embryi nevhodnými na transfer (6 párů, tj. 27,3 %). Zbývající část oslovených se rekrutovala z klientů, kteří neuvažovali o kryokonzervaci všech embryí (6 párů, tj. 27,3 %) nebo ji chtěli ukončit (10 párů, tj. 45,4 %). Nezanedbatelný vliv může mít i časový odstup, situace ve společnosti a vývoj názoru na potřebu medicínského výzkumu. Z osobní komunikace s 22 páry byla ukončena kryokonzervace v 5 případech (22,7 %) rozmrazením a likvidací embryí.
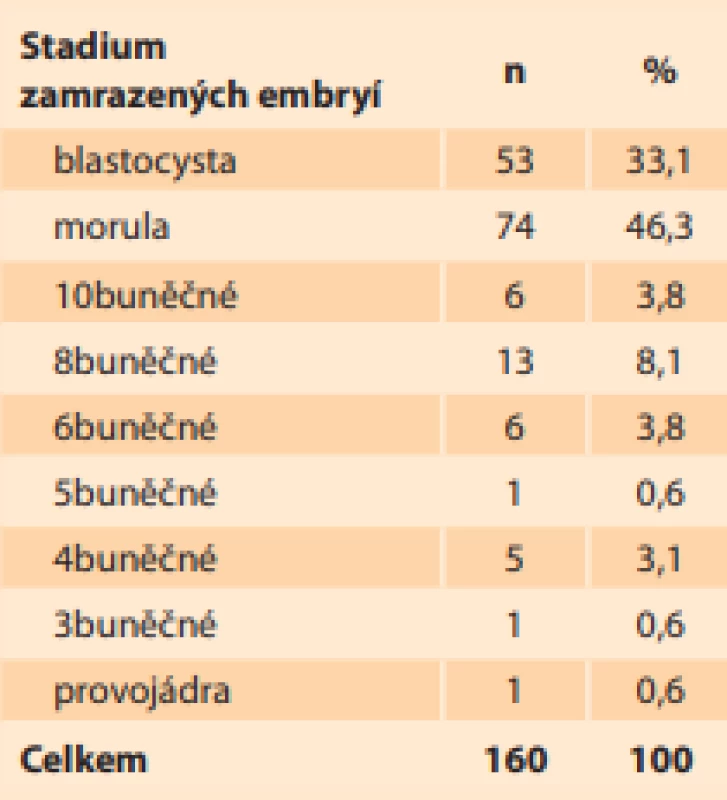
Celkem bylo získáno 160 embryí od 55 dárců ve věku 26–42 let. Nejčastěji byla embrya zamrazena ve stadiu moruly (74 embryí, tj. 46,3 %) a blastocysty (53 embryí, tj. 33,1 %). Skladba stadií embryí je uvedena v tab. 2. Počet zamrazených embryí v pejetě byl 1 nebo 2 embrya a respektoval požadavek pacientky. Náš doporučovaný standard je 1 embryo/pejeta a v našem souboru činil 61,2 % embryí (98 pejet). Dále bylo 62 (38,8 %) embryí zamrazeno po dvou v pejetě (31 pejet).
Tab. 2. Composition of the stages
of frozen donor embryos in
2014–2020.
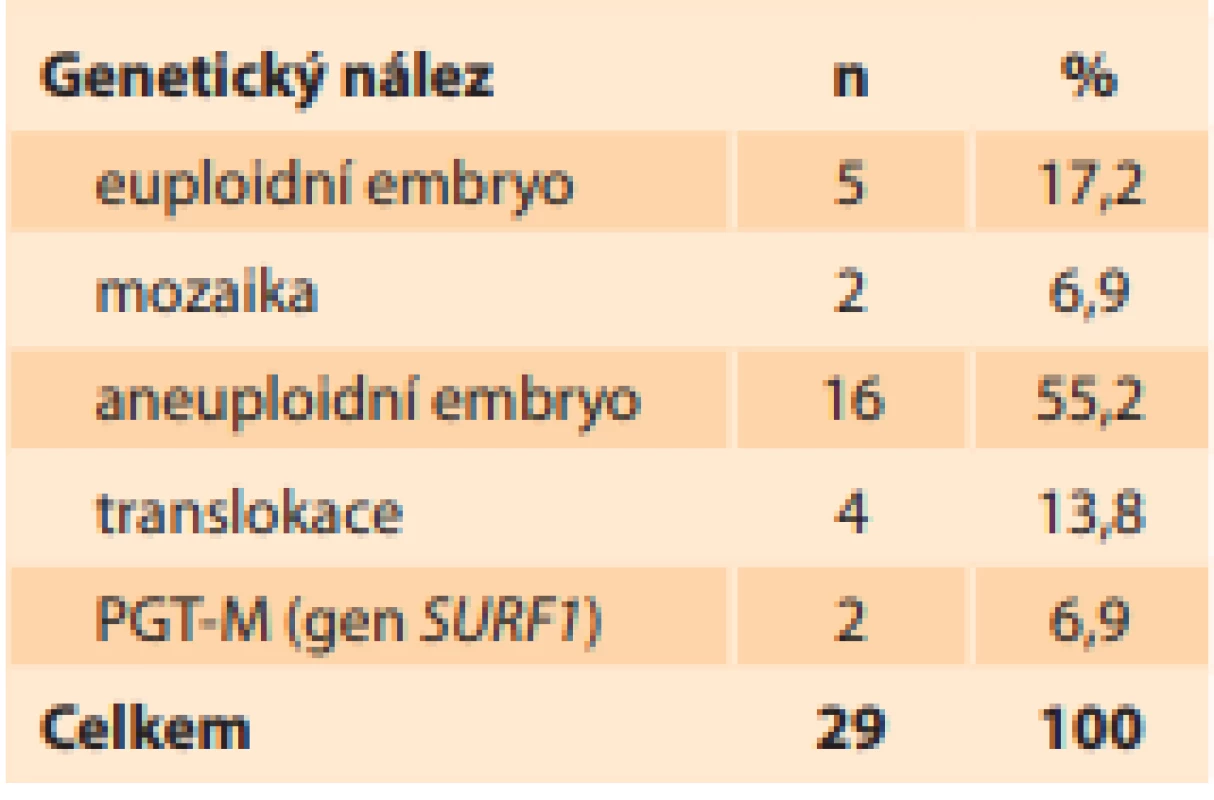
Z 29 geneticky vyšetřených embryí je 5 euploidních (17,2 %), 2 mozaiky (7,9 %), 16 aneuploidních (55,2 %) a 6 embryí s translokací či přenašečů s monogenní vadou (20,7 %) (tab. 3). Poměrně malý počet geneticky vyšetřených embryí z celého souboru (18,1 %) je dán převážným složením ze zdravých embryí. I tak je tento podíl vyšší než průměr na našem pracovišti.
Tab. 3. Genetic testing of donated
embryos.
V období listopad až prosinec 2020 bylo zahájeno předávání rozmrazených dokultivovaných životaschopných blastocyst s provedeným asistovaným hatchingem do CTEF. Z celkem 12 rozmrazených embryí od 6 dárkyň bylo ve 2 dávkách předáno 9 blastocyst (75,0 %). Po převzetí embryí proběhla v laboratoři CTEF mechanická izolace embryoblastu a následná kultivace buněčné linie hESC.
Diskuze
Podmínkou úspěšné realizace našeho projektu bylo vytvoření plně operativního týmu pokrývajícího lékařské, technologické a instrumentální aspekty, které jsou nezbytné pro navrhovaný výzkum a vývoj. Patří mezi ně:
- prokázané odborné znalosti v derivaci hESC;
- přímý přístup do zařízení cGMP s odpovídající odborností ve vývoji lékařské aplikace ATMP;
- zapojení CAR s odbornými znalostmi v oblasti manipulace s lidskými embryi a přístupu k potenciálním dárcům [1,8].
Zákon 227/2006 Sb., o výzkumu na lidských embryonálních kmenových buňkách (hESC):
- umožňuje jen výzkum prováděný na liniích hESC (§2a);
- liniemi hESC jsou všechny hESC, které jsou uchovávané v kulturách nebo jsou v návaznosti na ně skladovány v kryokonzervované formě (§2c);
- hESC jsou všechny pluripotentní kmenové buňky pocházející z lidských preimplantačních embryí vytvořených mimotělně (§2b);
- lze použít jen embrya, která nejsou starší než 7 dní (bez doby kryokonzervace) (§ 8/3).
Úmluva o lidských právech a biomedicíně (Výzkum na embryích in vitro: čl. 18/1 „Pokud zákon umožňuje provádět výzkum na embryích in vitro, musí být zákonem zajištěna odpovídající ochrana embrya.“) nerozlišuje mezi embryem a hESC, požaduje pouze zákonnou ochranu embrya při povoleném výzkumu. Důvodová zpráva k zákonu o výzkumu na lidských embryonálních kmenových buňkách uvádí, že „návrh zákona se netýká výzkumu na embryích, ale výzkumu pouze na lidských embryonálních kmenových buňkách, je v souladu s principy Úmluvy o lidských právech a biomedicíně“ [4].
Problematikou rozmrazování embryí v rozdílných kultivačních podmínkách dle zamrazených stadií jsme se zabývali v našich předchozích studiích [6,9]. Pro moruly využíváme dle doporučení výrobce médium Warm Cleave a pro rozmrazení blastocyst médium Warm Blast. Již v roce 2007 se problematikou metabolizmu lidských embryí po kryokonzervaci zabývali Stokes et al [10].
Nejstarší embrya vhodná k dárcovství pro základní výzkum máme z roku 1997. Problémem je, že u většiny dárců z tohoto období je přerušena komunikace s CAR a na skladování embryí nehradí. Dosud však nebyly dořešeny všechny etické aspekty a u těchto embryí nebylo Etickou komisí FN Brno schváleno ukončení skladování.
Na zaslanou výzvu nereagovalo téměř 38 % respondentů, u části obeslaných (7 %) bylo nutno znovu dohledat či telefonicky zjistit aktuální adresu. Téměř 20 % klientů reagovalo na dopis pozitivně, o embrya nechtěli přijít a chtěli domluvit termín transferu. Poměrně velká část obeslaných (14 %) chtěla ukončit skladování bez účasti ve výzkumném projektu. U některých párů tato informace vyvolala rozporuplné reakce a názorové střety mezi partnery, pro kterou variantu se rozhodnout.
Při osobní komunikaci byly zmiňovány tři nejvýznamnější důvody pro darování embryí pro výzkumné účely. První byl názor, že je vhodnější používat embrya k výzkumu, než je ničit nebo jimi plýtvat. Řada respondentů byla pozitivně nakloněna a učinila pozitivní obecná prohlášení o výzkumu. Třetím důvodem byl altruizmus vyjádřený jako touha pomáhat jiným neplodným párům a rozvíjet vědecké a lékařské znalosti.
Důvodů k odmítnutí využití embryí pro výzkumné účely je mnoho. Nejčastější je pohled na embryo jako na potenciální dítě. Někteří pacienti silně emocionálně prožívali představu darování embryí pro lékařský výzkum a jiní odkazovali na děti, kterými se embrya mohou stát. Tyto důvody jsou časté a podobné těm, jež uváděli pacienti i v předchozích studiích [11]. V australské studii rodiče 5letých dětí po IVF, kteří byli dotazováni ohledně využití zamrazených embryí pro výzkumné účely, často o těchto embryích hovořili jako o sourozencích narozených dětí a komentovali psychologické dopady manipulace s embryi pod mikroskopem [12].
Závěr
Etickou komisí LF MU a FN Brno byl vypracován a schválen informovaný souhlas. Je vybráno a zajištěno 160 darovaných embryí. Je vypracován předávací protokol a metodika předávání. Plán předávání rozmrazených anonymizovaných embryí zahrnuje cca 5 rozmrazených blastocyst týdně s provedeným asistovaným hatchingem.
Po předání embryí na CTEF probíhá izolace embryoblastu s následnou kultivací. Ustanovené buněčné linie hESC musí splnit specifikovaná kritéria bezpečnosti, stability a pluripotence. Věříme, že v souladu s plánem projektu získáme nejméně 3 linie hESC v klinické kvalitě, poprvé vytvořené v ČR, respektující požadavky na léčivé přípravky Advanced Medicinal Therapy Products (AMTP).
Obdrženo/Submitted: 11. 12. 2020
Přijato/Accepted: 8. 1. 2021
prof. MUDr. Pavel Ventruba, DrSc., MB
Gynekologicko-porodnická klinika
LF MU a FN Brno
Obilní trh 11
602 00 Brno
Zdroje
1. Hampl A, Ješeta M, Koutná I et al. The first ever effort to establish clinical grade human embryonic stem cells in the Czech Republic. In: Sborník abstrakt 17. česko-slovenské konference reprodukční gynekologie a 28. sympozia asistované reprodukce SAR ČGPS ČLS JEP, 13.–14.11.2018. Brno: 24–25.
2. Souralová T, Hampl A, Koutná I et al. Clinical-grade human embryonic stem cells: derivation and characterization. In: Sborník abstrakt 29. sympozia asistované reprodukce SAR ČGPS ČLS JEP a 18. česko–slovenské konference reprodukční gynekologie, 12.–13.11.2019. Brno: 35–36.
3. Zákon č. 227/2006 Sb. O výzkumu na lidských embryonálních kmenových buňkách. [online]. Dostupné z: https: //zakonyprolidi.cz/cs/2006-227.
4. Zákon č. 373/2011 Sb. O specifických zdravotních službách. [online]. Dostupné z: https: //www.zakonyprolidi.cz/cs/2011-373.
5. Ventruba P, Žáková J, Ješeta M et al. Výběr a příprava embryí pro vznik lidských embryonálních kmenových buněk určených k humánní terapii. In: Sborník abstrakt 30. sympozium asistované reprodukce SAR ČGPS ČLS JEP a 19. česko-slovenská konference reprodukční gynekologie, 10.–11.11.2020. Brno: 30–31.
6. Ješeta M, Celá A, Žáková J et al. Metabolic activity of human embryos after thawing differs in atmosphere with different oxygen concentrations. J Clin Med 2020; 9 (8): 2609. doi: 10.3390/jcm9082609.
7. Chmeliková E, Sedmíková M, Ješeta M et al. Suitability of 3D culture system with GrowDex for long-term culture of granulosa cells. ESHRE´s virtual annual meeting 5.–8.7.2020. Hum Reprod Arch 2020; 35 (S1): 1243–1244.
8. Zákon č. 96/2001 Sb. m. s. Úmluva na ochranu lidských práv a důstojnosti lidské bytosti v souvislosti s aplikací biologie a medicíny. [online]. Dostupné z: https: //www.zakonyprolidi.cz/ms/2001-96.
9. Celá A, Madr A, Ješeta M et al. Study of metabolic activity of human embryos focused on amino acids by capillary electrophoresis with light-emitting diode-induced fluorescence detection. Electrophoresis 2018; 39 (23): 3040–3048. doi: 10.1002/elps.201800 265.
10. Stokes PJ, Hawkhead JA, Fawthrop RK et al. Metabolism of human embryos following cryopreservation: implications for the safety and selection of embryos for transfer in clinical IVF. Hum Reprod 2007; 22 (3): 829–835. doi: 10.1093/humrep/del447.
11. McMahon CA, Gibson FL, Leslie GI et al. Embryo donation for medical research: attitudes and concerns of potential donors. Hum Reprod 2003; 18 (4): 871–877. doi: 10.1093/humrep/deg167.
12. McMahon CA, Gibson FL, Cohen J et al. Mothers conceiving through in vitro fertilization: siblings, setbacks, and embryo dilemmas after five years. Reprod Technol 2000; 10: 131–135.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2021 Číslo 1
Nejčtenější v tomto čísle
- Nežádoucí účinky PARP inhibitorů
- Kombinovaná peripartálna separácia symfýzy a sakroiliakálneho kĺbu
- Aspekty výběru embryí a jejich příprava pro vznik lidských embryonálních kmenových buněk určených k humánní terapii
- Poruchy příjmu potravy v ambulanci gynekologa pro děti a dospívající
