Obštrukcia dolného močového traktu plodu: aktuálny prehľad možnosti intrauterinnej diagnostiky a liečby
Fetal lower urinary tract obstruction: a current overview of intrauterine diagnosis and treatment
Objective: The aim of this review article is to provide a practical and concise overview of diagnosis and management of pregnancy with fetal lower urinary tract obstruction. Methods: Review of literature and current studies. Conclusion: Proper diagnosis and management of isolated fetal lower urinary tract obstruction with oligohydramnios allows appropriate implementation of intrauterine treatment in indicated cases. The treatment is a prevention of pulmonary hypoplasia and also improves renal function; this finally contributes to the improvement of overall perinatal morbidity and mortality.
Keywords:
fetal lower urinary tract obstruction – posterior urethral valve – vesicoamniotic shunting – fetal cystoscopy
Autoři:
Kunochová I.; M. Gábor
; Jr Križko M.; Alföldi M.; Totka A.; Ferianec V.
Působiště autorů:
II. gynekologicko-pôrodnícka klinika LF UK a UN Bratislava, Slovenská republika
Vyšlo v časopise:
Ceska Gynekol 2021; 86(2): 133-139
Kategorie:
Přehledový článek
doi:
https://doi.org/10.48095/cccg2021133
Souhrn
Cieľ štúdie: Cieľom článku je ponúknuť praktický a stručný prehľad diagnostiky a manažmentu tehotnosti s intrauterinne zachytenou obštrukciou dolného močového traktu plodu. Metodika: Spracovanie údajov z literatúry a aktuálnych štúdií. Záver: Správna diagnostika a manažment izolovanej obštrukcie dolného močového traktu plodu s patologicky zníženým objemom plodovej vody umožňuje v indikovaných prípadoch realizáciu vhodnej intrauterinnej liečby. Snahou liečby je prevencia pľúcnej hypoplázie a zlepšenie renálnych funkcií, ktoré v konečnom dôsledku zlepšujú celkovú perinatálnu morbiditu a mortalitu.
Klíčová slova:
obštrukcia dolného močového traktu plodu – chlopňa zadnej uretry – vezikoamniálny shunt – fetálna cystoskopia
Úvod
Obštrukcia dolného močového traktu (LUTO – lower urinary tract obstruction) zahŕňa spektrum patológií, ktorých spoločným znakom je zväčšený močový mechúr s bilaterálnou hydronefrózou v dôsledku prekážky v dolnej časti močového traktu. Prekážka môže byť čiastočná alebo úplná, pričom rozsah obštrukcie výrazne koreluje so závažnosťou ochorenia. Ľahšie formy obštrukcie majú menší klinický význam a vedú skôr k funkčným poruchám obličiek po pôrode [1]. Pri závažnejších formách obštrukcie je prítomný oligohydramnion, ktorého manifestácia medzi 16. a 24. gestačným týždňom je spájaná so zvýšeným rizikom rozvoja pľúcnej hypoplázie [2]. Dlhodobá distenzia močového traktu pôsobí aj na močový mechúr, dochádza k hypotrofii krčka močového mechúra, k zhrubnutiu jeho steny a k fibrotickým zmenám [3]. Rozsah a závažnosť poškodenia LUTO závisí od etiológie, dĺžky trvania obštrukcie a od gestačného týždňa nástupu obštrukcie. Dlhodobá distenzia močového traktu vedie k poškodeniu renálneho parenchýmu a k rôznym formám dysplázie obličiek, čo spolu s pľúcnou hypopláziou zvyšuje perinatálnu morbiditu a mortalitu [4].
Snahou prenatálnej in utero liečby je vo vybraných prípadoch zlepšenie prežívania po pôrode a zmiernenie sekundárnych vývojových abnormalít v dôsledku dlhodobého účinku obštrukcie. Intrauterinna liečba v súčasnosti zahŕňa opakované vezikocentézy, vezikoamniálny shunting a fetálnu cystoskopiu. Pomocou ultrasonografických a biochemických ukazovateľov sa hodnotí funkcia obličiek u plodu, na základe ktorých je vyhodnotená potreba intrauterinnej liečby. Tieto ukazovatele majú však neurčitú prognostickú hodnotu. Intrauterinna liečba nie je zárukou úplného vyliečenia ochorenia. Jej účinnosť je následne vyhodnotená po pôrode [5].
Incidencia
Incidencia LUTO je 3,43 (2,95–3,72) prípadov na 10 000 narodených detí. Toto číslo môže byť čiastočne podhodnotené počtom nezaevidovaných indukovaných potratov a intrauterinnych úmrtí [6]. Najčastejšia príčina LUTO je chlopňa zadnej uretry (PUV – posterior urethral valve) v 64 %, atrézia uretry v 39 % a Prune belly syndróm v 4 %. PUV sa objavuje približne u 1 na 8 000 živorodených chlapcov. Prune belly syndróm postihuje 1 z 30 000–40 000 plodov, z toho 97 % sú postihnutí chlapci a odhadovaná prevalencia je 3,8 prípadov na 100 000 živorodených chlapcov. Atrézia uretry sa vyskytuje v 0,3 prípadov na 10 000 živorodených detí, ktorých prognóza je infaustná [4].
Diferenciálna diagnostika
Dilatácia dolného močového traktu a močového mechúra ako dôsledok obštrukčnej uropatie má rôznu etiológiu. PUV a atrézia uretry postihuje zvyčajne chlapcov, u dievčat s LUTO ide častejšie o komplexnejšie ochorenie rôznych kloakálnych anomálií alebo je častejšie prítomná stenóza uretry. Močový trakt je zriedkavejšie obštruovaný pri chlopni prednej uretry (AUV – anterior urethral valve) alebo pri ureterokéle. V niektorých prípadoch má dilatácia dolného močového traku neobštrukčnú etiológiu, ako napríklad megavezika, megaureter, Berdonov syndróm (MMIH – Megacystis-microcolon-intestinal hypoperistalsis syndrome) alebo Prune belly syndróm (PBS). PBS je vzácne genetické ochorenie močového traktu, charakterizované triádou symptómov: kryptorchizmus, defekty brušnej steny (nedostatok svalov brušnej steny) a genitourinárne defekty [4,7–9].
Stanovenie pohlavia plodu a vizualizácia genitálu zužuje diagnostické spektrum ochorení pre dané pohlavie a urýchľuje diferenciálnu diagnostiku, keďže niektoré ochorenia sa vyskytujú skôr u chlapcov a niektoré skôr u dievčat. Cystický útvar v malej panve je typický pre ženské plody. Pri ultrasonografickom vyšetrení možno pozorovať postupné naplnenie močového mechúra s obrazom dvoch anechogénnych cystických útvarov [10,11]. Prune belly syndróm sa vyskytuje skôr u plodov mužského pohlavia, ultrasonografický obraz je rovnaký ako pri PUV naviac je prítomná dilatácia uretry. Objem plodovej vody môže byť normálny.
Prenatálna diagnostika LUTO prostredníctvom ultrasonografie má vysokú špecificitu (až 80 %), avšak definitívne je príčina LUTO a konečná diagnóza stanovená až po pôrode. Fetálna cystoskopia umožňuje správnu prenatálnu diagnostiku LUTO až v 90 % [12].
Prenatálne vyhodnotenie funkčnosti močového traktu
Ultrasonografické vyšetrenie močového traktu plodu je komplexným vyšetrením a vyžaduje systematickosť. Vizualizujú sa obličky, ich lokalizácia a počet, močový mechúr a genitál. Množstvo plodovej vody sa objektívne vyhodnocuje pomocou indexu množstva plodovej vody (AFI – amniotic fluid index) alebo najhlbším vertikálnym depom plodovej vody (DVP – deepest vertical pool) [13].
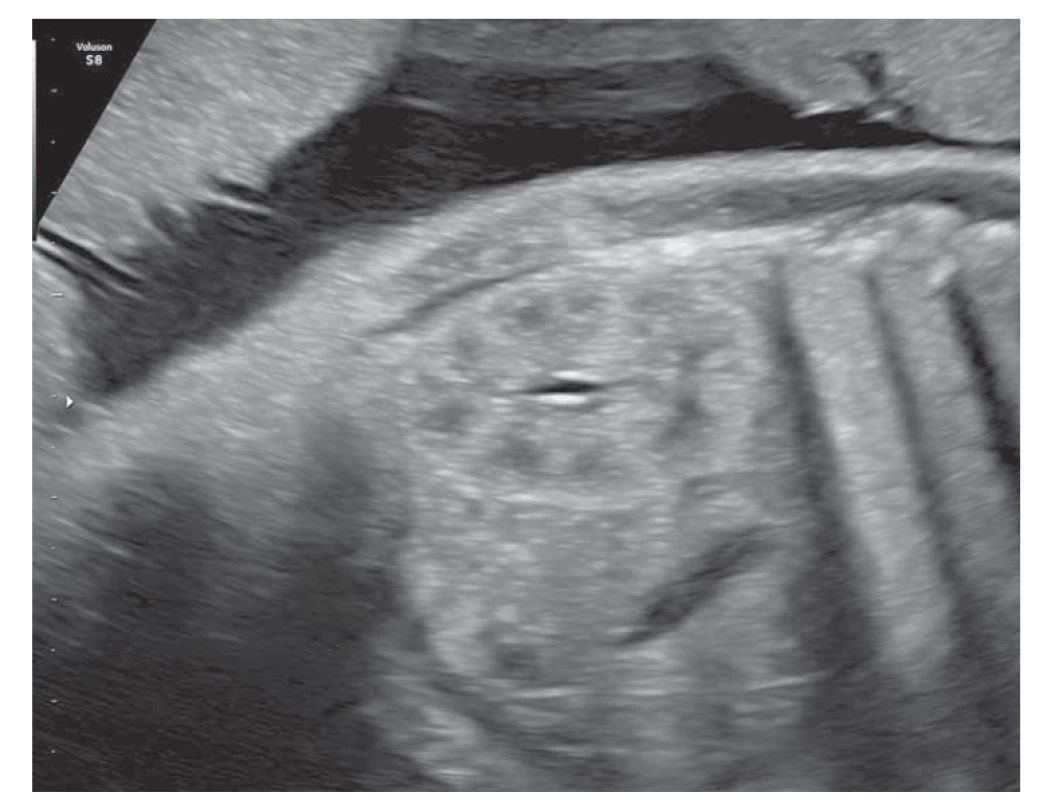
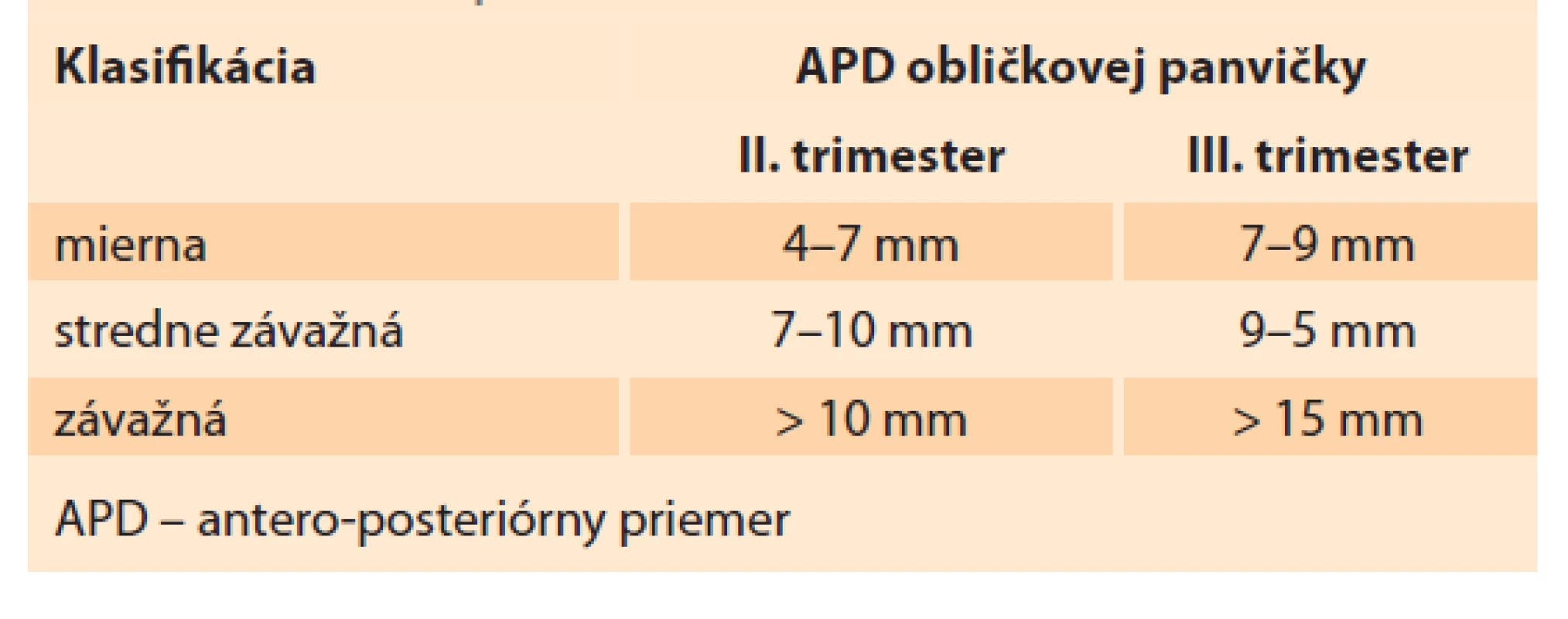
Obličky sú sonograficky viditeľné približne už od 9. gestačného týždňa vaginálnym sonografickým vyšetrením a od 12.–14. gestačného týždňa abdominálnym sonografickým vyšetrením. Obvyklá lokalizácia je v paravertebrálnej oblasti vo fossae renales. Hodnotí sa parenchým obličky a jej dutý systém. V skorých gestačných týždňoch majú obličky hyperechogénny obraz s postupným diferencovaním renálneho parenchýmu do svojej kortiko-medulárnej štruktúry, ktorá je ultrasonograficky viditeľná medzi 15. a 24. gestačným týždňom (obr. 1) [13]. Dutý systém obličky a prítomnosť hydronefrózy je hodnotený na základe antero-posteriórneho priemeru (APD – antero-posterior diameter) obličkovej panvičky (RPD – renal pelvis diameter). Hydronefróza je charakterizovaná, ak RPD je ≥ 4 mm v II. trimestri a ≥ 7 mm v III. trimestri. Následne na základe veľkosti RPD je hydronefróza rozdelená na miernu, stredne závažnú a závažnú (tab. 1) [1]. Grignon rozdeľuje antenatálnu hydronefrózu do piatich stupňov, zohľadňujúce APD a dilatáciu obličkovej panvičky a kalichov (tab. 2) [14]. Klasifikačný systém Spoločnosti pre fetálnu urológiu (SFU – Society for Fetal Urology) poskytuje kvalitatívne hodnotenie hydronefrózy na základe rozsahu dilatácie obličkových kalichov a redukcie parenchýmu obličky. Klasifikácia je rozdelená do štyroch stupňov, v poslednom štádiu s atrofiou renálneho parenchýmu. Schematicky spolu s ultrasonografickými obrazmi sú spoločne zobrazené jednotlivé klasifikácie v schéme (schéma 1). V hodnotení antenatálnej hydronefrózy sú štandardne používané APD hodnotenie a SFU klasifikácia. Ich súčasná aplikácia zvyšuje predikciu pravdepodobnosti chirurgického zákroku po pôrode [1,6,15].
Fig. 1. Physiological picture of the fetal kidney in the 31st week of pregnancy
(photo by the authors).
Tab. 1. Antenatal classification of hydronephrosis using
APD of the renal pelvis.
Tab. 2. Grignon classification.
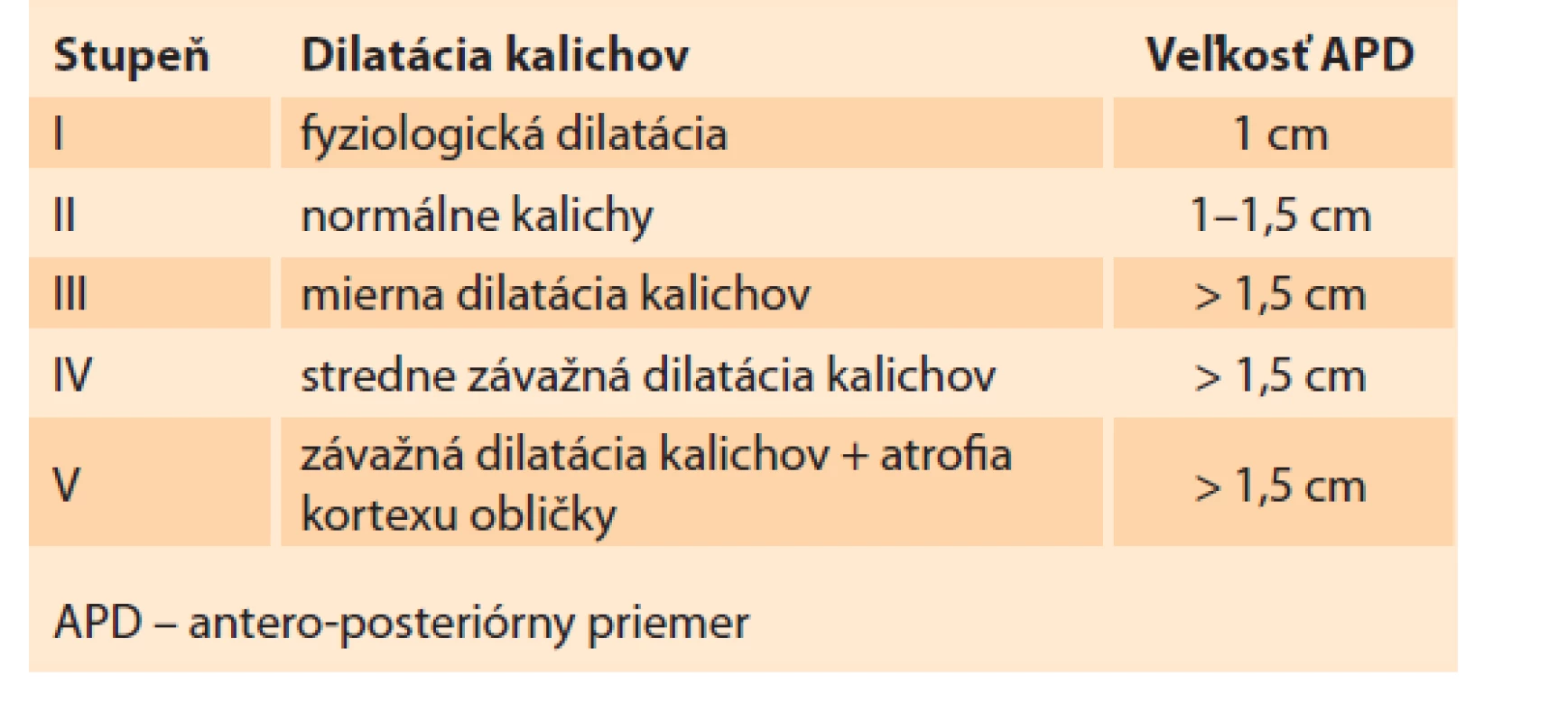
APD – antero-posterior diameter, SFU – Spoločnost pre fetalnu urologiu, US – ultrasonografia
Scheme 1. Schematic representation of the degrees of individual classifications of antenatal hydronephrosis together with
the corresponding ultrasonographic image (diagram by the authors).

Močový mechúr je ultrasonograficky viditeľný od 11. gestačného týždňa ako anechogénna štruktúra v malej panve plodu medzi dvomi umbilikálnymi artériami. Hodnotenie močového mechúra pri vyšetrení by malo zahŕňať polohu, veľkosť a hrúbku jeho steny [13]. Ultrasonografické znaky obštrukčnej uropatie zahŕňajú zväčšený močový mechúr, často so zhrubnutím jeho steny (viac ako 3 mm). Megavezika je v I. trimestri charakterizovaná zväčšením močového mechúra v pozdĺžnom reze ≥ 7 mm a v II. a III. trimestri poruchou vyprázdnenia močového mechúra počas rozšíreného ultrasonografického vyšetrenia [3,16,17]. Prítomný je typický tvar „keyhole sign” zväčšeného močového mechúra (obr. 2) s dilatáciou proximálnej časti močového traktu – dilatácia ureterov a hydronefróza. Stanovenie príčiny megaveziky vo včasných štádiách tehotnosti ako dôsledok LUTO alebo v prípadoch neobštrukčnej príčiny uropatie je náročná. Pri obštrukčnej uropatií je pozorované zväčšenie močového mechúra, porucha a zlyhanie jeho vyprázdnenia po dobu 30–45 min počas ultrasonografického vyšetrenia a oligo až anhydramniom [16]. Po 16. gestačnom týždni je množstvo plodovej vody ovplyvnené tvorbou a vylúčeným množstvom fetálneho moču. Megavezika spolu s oligohydramniom sú znakom závažnej obštrukcie. Oligohydramnion vzniká jednak v dôsledku nedostatku tvorby fetálneho moču pri renálnej insuficiencií a samotnou obštrukciou. Izolovaný oligo až anhydramnion je prítomný aj pri iných vrodených vývojových malformáciách uropoetického traktu [10]. Zvýšená echogenita a mikrocystický vzhľad obličky sú znakmi jej dysplastických zmien [5,10]. Oligohydramnion a ultrasonografické znaky renálnej dysplázie sú významným prognostickým faktorom zlej postnatálnej funkcie obličiek. Neliečená prenatálne diagnostikovaná obštrukcia dolného močového traktu je spájaná so zlou perinatálnou prognózou. Normálna funkcia obličiek a celkové postnatálne prežívanie v neliečených prípadoch je iba 4,2–6,3 % [18].
#715722
Hodnotenie pred intrauterinnou liečbou
Pri samotnom ultrasonografickom vyšetrení plodu s LUTO je potrebné vylúčiť prípadné iné koexistujúce štrukturálne a genetické abnormality. Echokardiografické vyšetrenie vylúči vrodené srdcové chyby. Genetickým vyšetrením plodov s LUTO bolo zistených približne 15 % prípadov trizómie 13, 18 alebo 21 [3,7]. Preto by v rámci diagnostického procesu a pred samotnou terapiou mala byť rodičom navrhnutá genetická konzultácia, pričom genetické ochorenia predstavujú prekážku in utero intervencie.
Aj v miernejších formách LUTO s normálnym množstvom plodovej vody by mala byť vykonaná amniocentéza s vylúčením genetických abnormalít. LUTO s normálnym množstvom plodovej vody predstavuje miernu formu ochorenia bez potreby intrauterinnej intervencie. V tomto prípade sú taktiež potrebné opakované ultrasonografické kontroly (každé 1–2 týždne) hodnotiace rozvoj oligohydramnia a neskoré vývojové abnormality ako je renálna dysplázia [5].
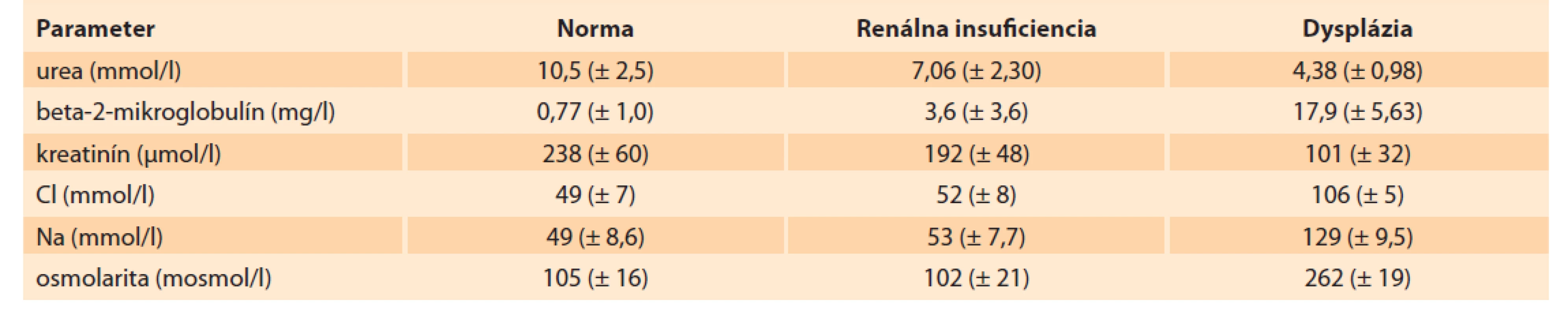
Manažment izolovaného výskytu LUTO s prítomným oligohydramniom po súhlase rodičov s intrauterinnou intervenciou zahŕňa už spomínané genetické testovanie a vyhodnotenie renálnych funkcií [19]. Ruano et al navrhli po splnení viacerých kritérií štandardizovaný postup výberu plodov s LUTO k intrauterinnej liečbe. Kritéria zohľadňujú množstvo plodovej vody, ultrasonografický obraz parenchýmu obličiek a hodnotenie koncentrácie elektrolytov v moči plodu [20]. Samotné hodnotenie renálnych funkcií spočíva v rozbore dvoch vzoriek fetálneho moču získaného vezikocentézou. Keďže pri závažnom oligohydramniu až anhydramniu je náročné vykonať amniocentézu, vzorka moču by mala byť odoslaná aj na genetické vyšetrenie. Získaný moč je tiež odoslaný na elektrolytovú analýzu a vyšetrenie beta-2-mikroglobulínu, pričom nepriaznivý výsledok nemusí znamenať automaticky vylúčenie podstúpenia intrauterinnej liečby [21–23]. Stagnujúci moč v prvej vzorke často nemusí presne odrážať správnu funkciu obličiek, preto sa po 24–48 hod odosiela druhá vzorka na opakovanú analýzu. V moči je vyšetrovaná koncentrácia sodíka (Na), chloridu (Cl), osmolarita, kalcium (Ca) a beta - -2-mikroglobulín (tab. 3) [21–23]. Po stanovení koncentrácií elektrolytov vo fetálnom moči a vyhodnotení ultrasonografického obrazu obličiek môže plod podstúpiť intrauterinnu liečbu [4,18,24]. Limitujúcim faktorom je, že získané hodnoty nie sú špecifické pre daný gestačný týždeň a nekorelujú s funkciou obličiek po pôrode. Z tohto dôvodu intrauterinna intervencia nie je zárukou dobrej funkcie obličiek po pôrode [23].
Tab. 3. Biochemical parameters in fetal urine according to Cald.
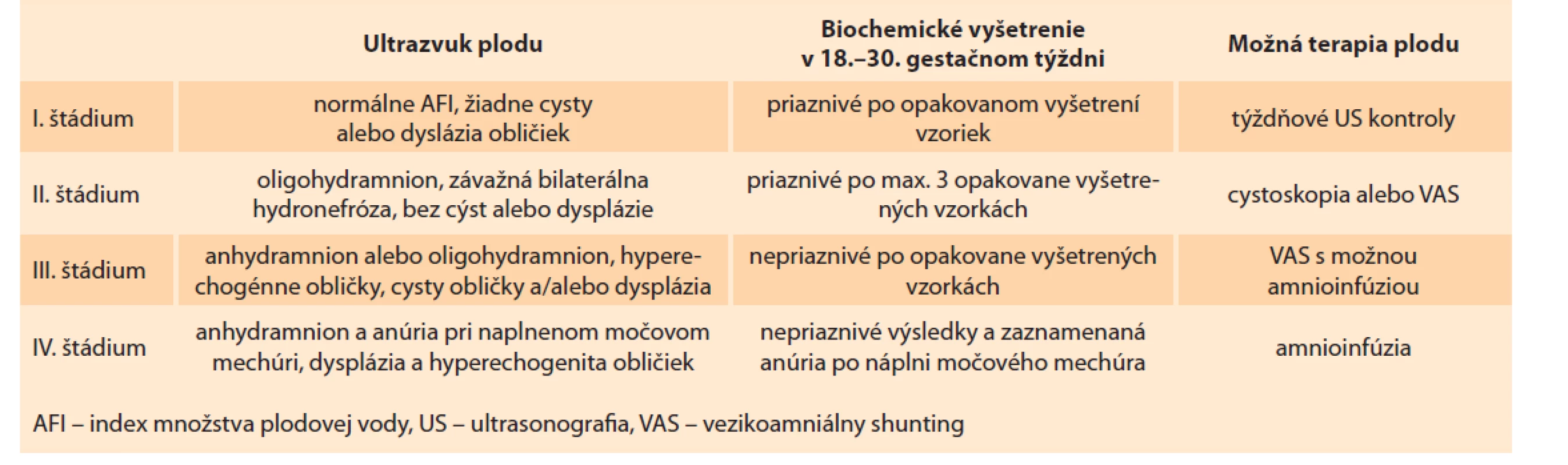
Ruano et al ponúka multidisciplinárny prístup v manažmente LUTO, ktorý na základe klasifikačného systému diferencuje závažnosť ochorenia podľa ultrasonografického obrazu a biochemickej analýzy. Následne je v indikovaných prípadoch ponúknutá intervencia (tab. 4) [9,20,25].
Tab. 4. Evaluation of LUTO stages and management according to Ruan.
Intrauterinna liečba
Po splnení kritérií je liečba zameraná predovšetkým na obnovenie normálneho množstva plodovej vody, čo slúži hlavne ako prevencia pľúcnej hypoplázie. Cieľom dekompresie močového mechúra je zmierniť chronický vplyv útlaku obštruovaného systému a znížiť mieru renálneho poškodenia. Liečba spočíva v opakovaných vezikocentézach alebo progresívnejšie v zavedení vezikoamniálneho shuntu s kontinuálnou drenážou moču do amnionovej dutiny. Možnosťou je tiež priama ablácia chlopne pomocou cystoskopie alebo vezikostómia [17,18,20,26,27].
Vezikocentéza je bezpečný výkon vykonávaný pod neustálou ultrasonografickou kontrolou. Močový mechúr je vizualizovaný v jeho najväčšom rozmere s miestom vpichu v jeho distálnej časti. Aby nedošlo k poškodeniu vnutrobrušných štruktúr, ako napríklad pupočníkových artérií, je potrebné použitie farebného Dopplera [4,17,27].
Vezikoamniálny shunting (VAS – vesicoamnial shunting) je perkutánny výkon uskutočnený pod ultrasonografickou kontrolou pri lokálnej anestézií matky [28]. Anestézia plodu môže byť dosiahnutá intraumbilikálnym alebo intramuskulárnym podaním Fentanylu (15 mg/ kg) alebo pankorunia (0,5–2 mg/ kg). Pred samotným výkonom je potrebná amnioinfúzia (temperovaný roztok s pridaným antibiotikom) k vytvoreniu pracovného priestoru pre zavedenie shuntu. Shunt (Rodeck/ Rocket, Harrison alebo Somatex shunt) je umiestnený svojou distálnou časťou do močového mechúra a proximálnou do amnionovej dutiny [27,29]. Samotné zavedenie shuntu nie je kauzálnou liečbou LUTO, ale prevenciou pľúcnej hypoplázie so zlepšením perinatálnych výsledkov. Zvyšuje dvojročnú mieru prežívania [9], ale úplne nezabráni renálnemu poškodeniu a potrebe možnej chirurgickej liečby v detstve. Medzi časté komplikácie VAS patrí vypadnutie katétra, migrácia alebo jeho uzáver s potrebou ďalšej intervencie [2,4,5,17].
Fetálna cystoskopia je novou možnosťou liečby LUTO. Ide o technicky náročnejší výkon ako je VAS, s možnosťou priamej vizualizácie obštrukcie a tiež presného stanovenia diagnózy [30]. Vzhľadom na invazívnosť výkonu a jeho celkové trvanie sa odporúča podanie regionálnej (spinálnej alebo epidurálnej) anestézie matke a tiež aplikácia anestetík plodu, podobne ako pri VAS [29]. Cez troakar je fetoskop perkutánne zavedený do močového mechúra plodu, ten sa postupne posúva smerom k jeho hrdlu a dilatovanej zadnej uretre. PUV je potvrdená v prípade prítomnosti membrány, ktorá je následne odstránená laserom. Ak fetoskopicky nie je potvrdená membrána ani pri irigácií kontrastnej látky, ide o atréziu uretry [9,24,29]. K realizácií festoskopie je nevyhnutná dostatočná skúsenosť špecialistu a technické vybavenie k uskutočneniu výkonu. Neúspešnosť výkonu a znovuobjavenie LUTO po výkone môže byť spôsobené nedostatočnou abláciou, reobštrukciou uretry alebo sekundárne v dôsledku fibrotickej stenózy [12]. Nevyhnutnosťou výkonu je multidisciplinárny tím lekárov so špecializáciou v materno-fetálnej medicíne, v rádiológií a detskej urológií v perinatologických centrách s neonatologickou expertnou starostlivosťou [4].
Napriek uvedenému treba brať do úvahy, že aj napriek zlepšeniu perinatálneho prežívania je riziko detskej morbidity zvýšené (chronické poškodenie obličiek) s čím by mali byť rodičia v čase diagnózy oboznámení [28,31].
Expektačný manažment
Expektačný manažment v prípade LUTO s normálnym množstvom plodovej vody je predpokladom zabezpečenia dobrého vývoja pľúc. Aj v takejto situácií musia byť rodičia oboznámení s možnou chirurgickou liečbou alebo potrebou dialýzy po pôrode. V prípade LUTO s oligohydramniom/ anhydramniom a expektačným manažmentom sú rodičia oboznámení s očakávanými komplikáciami ako je pľúcna hypoplázia. Rodičia sú tiež oboznámení o možnosti paliatívnej starostlivosti po pôrode [7].
Časovanie a manažment pôrodu
Po stanovení diagnózy a splnení kritérií intrauterinnej liečby je potrebné zvážiť riziká, ktoré súvisia s intrauterinnou intervenciou. Invazívny výkon zvyšuje riziko predčasného pôrodu, predčasného odtoku plodovej vody, chorioamnionititídy a intrauterinneho úmrtia. Preto je potrebné výkon starostlivo zvážiť. Intervenciu by mali postúpiť iba tie plody, ktoré môžu mať z neho benefit [2,6]. Výkon je po správnej indikácií realizovaný medzi 16.–34. gestačným týždňom [9,18,20]. V prípade expektačného manažmentu je tehotenstvo ukončené po 34. gestačnom týždni, prednostne krátko pred termínom [32]. U plodov s LUTO po intrauterinnom výkone je tehotenstvo ukončované na základe štandardných pôrodníckych princípov približne v 35. a 36. gestačnom týždni vaginálne, ak nie je indikovaný cisársky rez zo strany matky alebo na základe iných dôvodov. Po pôrode sú novorodenci odovzdaní do starostlivosti neonatológov, detských urológov a nefrológov [7,20].
Záver
Obštrukcia dolného močového traktu plodu s oligohydramniom/ anhydramniom zvyšuje perinatálnu mortalitu v dôsledku rozvoja pľúcnej hypoplázie. Pri obštrukcií sú v dôsledku dlhodobej distenzie močového traktu poškodzované obličky plodu. Rozsah obštrukcie a jej trvanie výrazne koreluje s dysplastickými zmenami na obličkách a jej chronického poškodenia ich funkcie. Včasná a korektná diagnostika príčiny LUTO umožňuje jej skorý záchyt a taktiež možnosť poskytnutia liečby plodu in utero. Intrauterinna liečba zlepšuje perinatálne prežívanie a zlepšuje funkciu obličiek po pôrode.
Doručené/ Submitted: 22. 6. 2020
Prijaté/ Accepted: 30. 3. 2021
MU Dr. Ivana Kunochová
II. gynekologicko-pôrodnická klinika
LF UK a UN Bratislava
Ružinovská 6
826 06 Bratislava
Slovenská republika
Publikačné etika: Redakčná rada potvrdzuje, že rukopis práce splnil ICMJE kritériá pre publikácie zasielané do biomedicínskych časopisov.
Publication ethics: The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Konflikt záujmov: Autori deklarujú, že v súvislosti s predmetom štúdie/ práce nemajú žiadny konflikt záujmov.
Conflict of interests: The authors declare they have no potential conflicts of interest concerning the drugs, products or services used in the study.
Zdroje
1. Nguyen HT, Herndon CD, Cooper C et al. The Society for Fetal Urology consensus statement on the evaluation and management of antenatal hydronephrosis. J Pediatr Urol 2010; 6(3): 212–231. doi: 10.1016/ j.jpurol.2010.02.205.
2. Morris RK, Malin GL, Quinlan-Jones E et al. Percutaneous vesicoamniotic shunting versus conservative management for fetal lower urinary tract obstruction (PLUTO): a randomised trial. Lancet 2013; 382(9903): 1496–1506. doi: 10.1016/ S0140-6736(13)60992-7.
3. Taghavi K, Sharpe C, Stringer MD. Fetal megacystis: a systematic review. J Pediatr Urol 2017; 13(1): 7–15. doi: 10.1016/ j.jpurol.2016.09.003.
4. Clayton DB, Brock JW. Current state of fetal intervention for lower urinary tract obstruction. Curr Urol Rep 2018; 19(1): 12. doi: 10.1007/ s11934-018-0760-9.
5. Lissauer D, Morris RK, Kilby MD. Fetal lower urinary tract obstruction. Semin Fetal Neonatal Med 2007; 12(6): 464–470. doi: 10.1016/ j.siny.2007.06.005.
6. Sinha A, Bagga A, Krishna A et al. Revised guidelines on management of antenatal hydronephrosis. Indian Pediatr 2013; 50(2): 215–231. doi: 10.1007/ s13312-013-0064-6.
7. Haeri S. Fetal Lower Urinary Tract Obstruction (LUTO): a practical review for providers. Matern Health Neonatol Perinatol 2015; 1(1): 26. doi: 10.1186/ s40748-015-0026-1.
8. Moscardi PR, Katsoufis CP, Jahromi M et al. Prenatal renal parenchymal area as a predictor of early end-stage renal disease in children with vesicoamniotic shunting for lower urinary tract obstruction. J Pediatr Urol 2018; 14(4): 320.e1–320.e6. doi: 10.1016/ j.jpurol.2018.07.004.
9. Ruano R, Sananes N, Sangi-Haghpeykar H et al. Fetal intervention for severe lower urinary tract obstruction: a multicenter case-control study comparing fetal cystoscopy with vesicoamniotic shunting. Ultrasound Obstet Gynecol 2015; 45(4): 452–458. doi: 10.1002/ uog.14823.
10. Ferianec V, Redecha M, Martanvič P et al. Fetal urinoma: an alternative intrauterine management. In: Puertas A et al (eds). Advances in Perinatal Medicine. 22nd European Congress of Perinatal Medicine, May 26–29, 2010, Granada. Bologna: Monduzzi Editore 2010 : 203–207.
11. Marco BB, González R, Ludwikowski B et al. Effectiveness of prenatal intervention on the outcome of diseases that have a postnatal urological impact. Front Pediatr 2019; 7 : 118. doi: 10.3389/ fped.2019.00118.
12. Sananes N, Cruz-Martinez R, Favre R et al. Two‐year outcomes after diagnostic and therapeutic fetal cystoscopy for lower urinary tract obstruction. Prenat Diagn 2016; 36(4): 297–303. doi: 10.1002/ pd.4471.
13. Down CJ, Burns JK, Woodward MN et al. Practical management of fetal obstructive uropathy. J Fetal Med 2018; 5(1): 37–44. doi: 10.1007/ s40556-017-0147-x.
14. Degl’innocenti ML, Piaggio G. Children’s kidney and urinary tract congenital anomalies. In: Martino P, Galosi AB (eds) Atlas of ultrasonography in urology, andrology, and nephrology. Cham: Springer 2017 : 107–127.
15. Dos Santos J, Parekh RS, Piscione TD et al. A new grading system for the management of antenatal hydronephrosis. Cli J Am Soc Nephrol 2015; 10(10): 1783–1790. doi: 10.2215/ CJN.12861214.
16. Fontanella F, Maggio L, Verheij JB et al. Fetal megacystis: a lot more than LUTO. Ultrasound Obstet Gynecol 2018; 53(6): 779–787. doi: 10.1002/ uog.19182.
17. Stadié R, Strizek B, Gottschalk I et al. Intrauterine vesicoamniotic shunting for fetal megacystis. Arch Gynecol Obstet 2016; 294(6): 1175–1182. doi: 10.1007/ s00404-016-4152-4.
18. Spaggiari E, Faure G, Dreux S et al. Sequential fetal serum â2‐microglobulin to predict postnatal renal function in bilateral or low urinary tract obstruction. Ultrasound Obstet Gynecol 2017; 49(5): 617–622. doi: 10.1002/ uog.15968.
19. Morris RK, Middleton LJ, Malin GL et al. Outcome in fetal lower urinary tract obstruction: a prospective registry. Ultrasound Obstet Gynecol 2015; 46(4): 424–431. doi: 10.1002/ uog.14808.
20. Ruano R, Sananes N, Wilson C et al. Fetal lower urinary tract obstruction: proposal for standardized multidisciplinary prenatal management based on disease severity. Ultrasound Obstet Gynecol 2016; 48(4): 476–482. doi: 10.1002/ uog.15844.
21. Craparo FJ, Rustico M, Tassis B et al. Fetal serum beta2-microglobulin before and after bladder shunting: a 2-step approach to evaluate fetuses with lower urinary tract obstruction. J Urol 2007; 178(6): 2576–2579. doi: 10.1016/ j.juro.2007.08.052.
22. Keswani SG, Wilson RD, Johnson MP. 10 Percutaneous intrauterine fetal shunting. In: Apuzzio JJ, Vintzileos AM, Berghella V et al (eds). Operative Obstetrics. 4th ed. UK: CRC Press 2017 : 123–136.
23. Nassr AA, Shazly SA, Abdelmagiet AM et al. Effectiveness of vesicoamniotic shunt in fetuses with congenital lower urinary tract obstruction: an updated systematic review and meta‐analysis. Ultrasound Obstet Gynecol 2017; 49(6): 696–703. doi: 10.1002/ uog.15988.
24. Calda P, Břešťák M, Fischerová D. Vrozené vady uropoetického traktu. In: Calda P (ed). Ultrazvuková diagnostika v těhotenství a gynekologii. Praha: Aprofema 2010 : 247–256.
25. Ruano R, Yoshisaki CT, Salustiano EM et al. Early fetal cystoscopy for first-trimester severe megacystis. Ultrasound Obstet Gynecol 2011; 37(6): 696–701. doi: 10.1002/ uog.8963.
26. Ruano R, Safdar A, Au J et al. Defining and predicting ‘intrauterine fetal renal failure’ in congenital lower urinary tract obstruction. Pediatr Nephrol 2016; 31(4): 605–612. doi: 10.1007/ s00467-015-3246-8.
27. Ferianec V. Fetálna terapia. Bratislava: Univerzita Komenského 2014 : 43–48.
28. Ferianec V, Križko M Jr, Gábor M et al. Ultrasound guided procedures at the 2nd department of obstetrics and gynecology-12-year retrospective overview. Slov Gynek Pôrod 2018; 24 : 189–196.
29. Kilby MD, Morris RK. Fetal therapy for the treatment of congenital bladder neck obstruction. Nat Rev Urol 2014; 11(7): 412–419. doi: 10.1038/ nrurol.2014.132.
30. Ruano R. Fetal surgery for severe lower urinary tract obstruction. Prenat Diagn 2011; 31(7): 667–674. doi: 10.1002/ pd.2736.
31. Morris RK, Ruano R, Kilby MD. Effectiveness of fetal cystoscopy as a diagnostic and therapeutic intervention for lower urinary tract obstruction: a systematic review. Ultrasound Obstet Gynecol 2011; 37(6): 629–637. doi: 10.1002/ uog.8981.
32. Mathis J, Raio L, Baud D. Fetal laser therapy: applications in the management of fetal pathologies. Prenat Diagn 2015; 35(7):. 623–636. doi: 10.1002/ pd.4587.
33. Ruano R, Dunn T, Braun MC et al. Lower urinary tract obstruction: fetal intervention based on prenatal staging. Pediatr Nephrol 2017; 32(10): 1871–1878. doi: 10.1007/ s00467-017-3593-8.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2021 Číslo 2
Nejčtenější v tomto čísle
- Současné možnosti prevence a terapie ovariálního hyperstimulačního syndromu
- Obrovský fibroadenom prsu v těhotenství
- Poranění análního sfinkteru při porodu a anální inkontinence
- Nový nástroj pro personalizaci ovariální stimulace: výsledky studie CERES při použití nového gonadotropinu – folitropinu delta
