Význam měření pupečníkového interleukinu-6, prokalcitoninu a C-reaktivního proteinu v diagnostice systémové zánětlivé odpovědi plodu
Role of umbilical interleukin-6, procalcitonin and C-reactive protein measurement in the diagnosis of fetal inflammatory response syndrome
Objective: Fetal Inflammatory Response Syndrome (FIRS) is a serious complication accompanied by increased neonatal mortality and morbidity. Early diagnosis of FIRS is essential to detect high risk infants. The aim of the study was to evaluate the correlation between interleukin-6 (IL-6), procalcitonin (PCT), C-reactive protein (CRP) in cord blood and histologically proven funisitis/ chorioamnionitis in high-risk infants after preterm birth. Methods: Blood sampling for the measurement of inflammatory biomarkers was performed immediately after placental delivery and umbilical cutting. Umbilical and placental inflammatory changes were assessed using a recently released scoring system (Amsterdam Placental Workshop Group Consensus). Results: One hundred preterm infants (30.5 ± 2.5 gestational week, birth weight 1,443 ± 566 grams) and 21 health term infants were analyzed. Histologic chorioamnionitis was confirmed in 19% cases and chorioamnionitis with funisitis in 7% cases. Thirty-three infants (33%) fulfilled criteria of FIRS (funistis and/ or umbilical IL-6 > 11 ng/ L). The presence of FIRS correlated significantly with maternal leukocytosis (P < 0.001), preterm premature rupture of membrane (P < 0.001) and preterm uterine contraction (P < 0.0001). In comparison to preterm and healthy term infants we found statistically significant higher levels of umbilical inflammatory biomarkers (IL-6, PCT, CRP) in FIRS group (P < 0.0001). Composite mortality and morbidity (bronchopulmonary dysplasia, intraventricular haemorrhage, periventricular leukomalacia) was higher in FIRS group (28.1 vs 22.4% in preterm group). However, the difference was not statistically significant (P = 0.53). Conclusion: Our study confirmed the correlation of umbilical inflammatory biomarkers levels (IL-6, PCT, CRP) and the presence of FIRS. We did not find significant adverse impact of FIRS on neonatal mortality and morbidity. Nevertheless, our results could be influenced by the size of study group and strict inclusion criteria (only cases after C-section were analyzed).
Keywords:
fetal inflammatory response syndrome – neonatal mortality – morbidity – interleukin-6 – C-reactive protein – procalcitonin – chorioamnionitis and funisitis
Autoři:
Straňák Z. 1,2; Berka I. 1,2; Širc J. 1,2; Urbánek J. 1; Feyereisl J. 1,2; Korček P. 1,2
Působiště autorů:
Ústav pro péči o matku a dítě, Praha
1; 3. LF UK, Praha
2
Vyšlo v časopise:
Ceska Gynekol 2021; 86(2): 80-85
Kategorie:
Původní práce
doi:
https://doi.org/10.48095/cccg202180
Souhrn
Cíl studie: Systémová zánětlivá odpověď plodu (FIRS – fetal inflammatory response syndrome) je závažná komplikace asociovaná se zvýšenou neonatální morbiditou a mortalitou. Včasná diagnostika FIRS je zásadní pro detekci rizikových skupin novorozenců. Cílem práce bylo zhodnotit korelaci hladin interleukinu-6 (IL-6), prokalcitoninu (PCT) a C-reaktivního proteinu (CRP) v pupečníkové krvi s histologicky prokázanou funisitidou/ chorioamnionitidou u vysoce rizikové populace novorozenců po předčasném porodu. Metodika: Odběr pupečníkové krve ke stanovení zánětlivých biomarkerů byl proveden okamžitě po porodu placenty a přerušení pupečníku. Zánětlivé změny v pupečníku a placentě byla hodnoceny recentním skórovacím systémem (Amsterdam Placental Workshop Group Consensus). Výsledky: Do studie bylo zařazeno 100 novorozenců (30,5 ± 2,5 týden těhotenství, porodní hmotnost 1 443 ± 566 g) po předčasném porodu a 21 zdravých donošených novorozenců. Histologicky byla chorioamnionitida diagnostikována u 19 % a chorioamnionitida s funisitidou u 7 % případů. Kritéria FIRS (funistis a/ nebo umbilikální IL-6 > 11 ng/ l) splnilo 33 novorozenců (33 %). FIRS statisticky signifikantně koreloval s leukocytózou u matky (p < 0,001), předčasným odtokem plodové vody (p < 0,001) a předčasnou děložní aktivitou (p < 0,0001) ve srovnání se skupinou bez FIRS. Hladiny zánětlivých parametrů (IL-6, PCT, CRP) v pupečníkové krvi byly statisticky signifikantně vyšší u skupiny FIRS pozitivní ve srovnání s nedonošenými a donošenými kontrolami (p < 0,0001). Kombinovaná mortalita a morbidita (bronchopulmonální dysplazie, intraventrikulární krvácení, periventrikulární leukomalacie) byla vyšší u novorozenců s FIRS (28,1 %) ve srovnání s novorozenci bez FIRS (22,4 %). Rozdíl však nebyl statisticky významný (p = 0,53). Závěr: Studie potvrdila korelaci mezi hladinami zánětlivých biomarkerů (IL-6, PCT, CRP) v pupečníkové krvi a přítomnost FIRS. Nebyl potvrzen signifikantně negativní vliv FIRS na neonatální morbiditu a mortalitu. Výsledek může být ovlivněn velikostí souboru a designem studie (zařazení pouze případů po porodu císařským řezem).
Klíčová slova:
systémová zánětlivá odpověď plodu – neonatální mortalita – morbidita – interleukin-6 – C-reaktivní protein – prokalcitonin – chorioamnionitida a funisitida
Úvod
Systémová zánětlivá odpověď plodu (FIRS – fetal inflammatory response syndrome) je dominantně reakcí plodu na infekční inzult při mikrobiální invazi do amniální dutiny. Mikrobiální organizmy mohou expandovat z amniové dutiny do orgánů a systémové cirkulace plodu s následným rozvojem FIRS [1].
FIRS je ekvivalentem systémové zánětlivé odpovědi (SIRS – systemic inflammatory response syndrome), ale na rozdíl od SIRS nelze u FIRS definovat klinické symptomy sepse a multiorgánové dysfunkce. FIRS můžeme diagnostikovat prenatálně – odběr krve plodu při kordocentéze a stanovení hladiny interleukinu-6 v krvi plodu (IL-6 > 11 ng/ ml). Postnatální diagnostika FIRS může být provedena stanovením koncentrace IL-6 v pupečníkové krvi odebrané po porodu plodu nebo histopatologickým vyšetřením placenty, pupečníku a plodových obalů. Histopatologickým obrazem FIRS je nález zánětu v pupečníku (funisitida) a/ nebo perivaskulární infiltrace na choriové plotně [2].
FIRS je asociován se signifikantně zvýšeným rizikem časné novorozenecké sepse (relativní riziko, RR = 3,1) a závažnými neonatálními komplikacemi: syndrom dechové tísně (RR = 2,4), intraventrikulární krvácení (RR = 4,9), periventrikulární leukomalacie (RR = 3,3), bronchopulmonální dysplazie (RR = 5,9) včetně zvýšeného rizika úmrtí (RR = 7,0). FIRS je spojen i s vyšším rizikem vzniku progresivních forem retinopatie nedonošených a neonatální systémové zánětlivé odpovědi, která se manifestuje klinicky jako neonatální sepse s negativní hemokulturou a negativní kultivací mozkomíšního moku [2,3].
Diagnostika FIRS je relativně obtížná (IPD – invazivní prenatální diagnostika), ale zásadní pro detekci vysoce rizikových skupin novorozenců k rozlišení FIRS a neonatálního SIRS.
Cílem práce bylo zhodnotit neonatální morbiditu u FIRS a korelaci hladin zánětlivých parametrů (IL-6, prokalcitonin, C-reaktivní protein) v pupečníkové krvi s histologicky prokázanou funisitidou/ chorioamnionitidou u novorozenců po předčasném porodu.
Soubor a metodika
Prospektivní kohortová studie byla realizována v perinatologickém centru Ústavu pro péči o matku a dítě (ÚPMD) v období 1/ 2017–12/ 2019. Kritériem pro zařazení do studie byl plánovaný porod císařským řezem ≤ 34. týden těhotenství. Indikacemi k operativnímu porodu byly maternální, fetální a/ nebo kombinované komplikace. Do studie nebyly zařazeny případy s prenatálně diagnostikovanými vrozenými vývojovými vadami, vaginálně vedené předčasné porody, mrtvěrození novorozenci a novorozenci s nutností resuscitace na porodním sále. Informovaný souhlas se zařazením do studie (schválený etickou komisí ÚPMD, no. 2015/ 06-02-4) byl získán před plánovaným porodem u všech hodnocených subjektů. Klinická data byla hodnocena z denních záznamů a klinické databáze perinatologického centra.
Histopatologické hodnocení závažnosti chorioamnionitidy a funisitidy
Placenty byly okamžitě po vybavení fixovány ve fosfátovém formolu (4% formaldehyd ve fosfátovém pufru) a dále zpracovány standardním způsobem certifikovaným patologem. Při histologickém vyšetření byly akutní zánětlivé změny v placentě, pupečníku a obalech definovány přítomností neutrofilní zánětlivé celulizace.
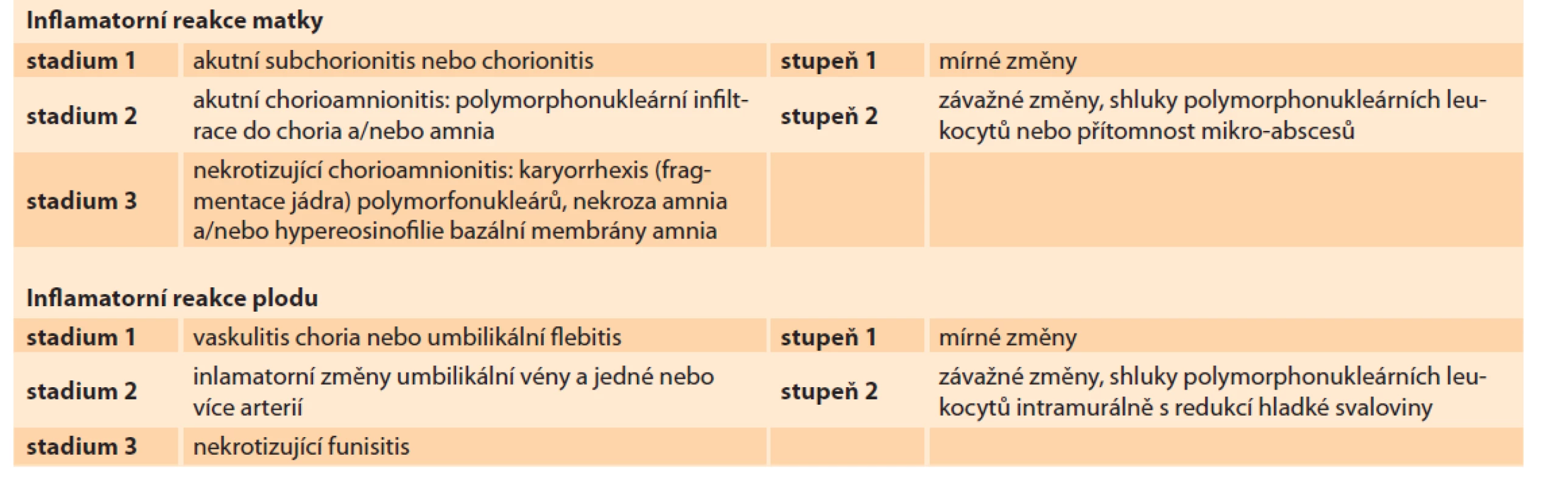
Pro histopatologické hodnocení závažnosti zánětlivých změn v pupečníku a placentě byla použita recentní klasifikace Amsterdam Placental Workshop Group Consensus Statement [4]. Klasifikační systém je založen na rozdělení zánětlivé odpovědi na maternální a fetální část, podle původu hodnocených neutrofilních granulocytů. U maternální zánětlivé odpovědi je hodnocen rozsah zánětlivých změn placentárních struktur s mateřskými neutrofilními granulocyty (které jsou původem z vén deciduy a z krve intervilózních prostorů). U fetální zánětlivé odpovědi se jedná o hodnocení přítomnosti a množství fetálních neutrofilních granulocytů (z fetální cirkulace) ve stěně povrchových cév choriové plotny (chorionická vaskulitida), ve stěně jednotlivých cév pupečníku, případně ve Whartonově rosolu. Klasifikační systém ukazuje tab. 1.
Tab. 1. International classifi cation of infl ammatory changes in the placenta, amniotic sac and umbilical cord (Amsterdam
Placental Workshop Group Consensus Statement: Sampling and Defi nitions of Placental Lesions).
Odběr pupečníkové krve
Odběr pupečníkové krve (1 ml) byl proveden venepunkcí umbilikální vény okamžitě po porodu placenty a přerušení pupečníku. Krevní elementy byly měřeny automatickým hematologickým analyzátorem (Nihon Kohden Celltac G, Tokyo, Japan), elementy bílé řady byly detekovány manuálně. Hladina CRP byla měřena immune-turbidometricky (Cobas 6000, c501 module, Roche Diagnostics, Mannheim, Germany). Dolní limit pro stanovení CRP byl 0,3 mg/ l. Sérové hladiny IL-6 a PCT (prokalcitonin) byly stanoveny pomocí metody elektrochemiluminiscentního immunoassay (Cobas 6000, e601 module, Roche Diagnostics, Mannheim, Germany). Zánětlivé parametry byly u kontrolní skupiny měřeny pouze z pupečníkové krve.
Kritéria systémové zánětlivé odpovědi plodu (FIRS)
Do skupiny FIRS pozitivní byli zařazeni novorozenci s koncentrací IL-6 > 11 ng/ l v pupečníkové krvi odebrané po porodu a novorozenci s prokázaným histopatologickým nálezem zánětu v pupečníku (funisitida).
Diagnostika časné novorozenecké sepse (EOS – early onset sepsis)
Časná novorozenecká sepse (v prvních 72 hod života) byla diagnostikována na základě vyšetření hemokultury, klinických příznaků a laboratorních biomarkerů sepse. Novorozenci s pozitivní hemokulturou a pozitivními klinickými známkami infekce byli klasifikováni jako skupina „prokázaná sepse“, novorozenci s negativní hemokulturou, ale s přítomností klinických známek infekce a pozitivitou alespoň dvou z následujících laboratorních biomarkerů infekce (leukocytóza > 20 000/ μl, leukopenie < 5 000/ μl, trombocytopenie < 100/ μl, poměr I/ T > 0,2, CRP ≥ 10 mg/ l) byli klasifikováni jako „klinická sepse“. Skupina „neprokázaná sepse“ zahrnuje pacienty s negativní hemokulturou, bez klinických nebo laboratorních známek infekce, a dále novorozence nesplňující výše uvedená kritéria sepse.
Neonatální morbidita
Neonatální komplikace (syndrom dechové tísně, patent ductus arteriosus, intraventrikulární krvácení, nekrotizující enterokolitida, periventrikulární leukomalacie, retinopatie nedonošených, bronchopulmonální dysplazie) byly definovány podle databáze Vermont Oxford [5].
Statistická analýza
Data byla statisticky analyzována softwarem IBM SPSS Statistics 23.0.0.0 (IBM Corp., Armonk, NY, USA). Demografické a klinické parametry jsou vyjádřeny deskriptivními statistickými metodami (procenta, medián s minimálními a maximálními hodnotami, průměry se standardní odchylkou). Chí-kvadrát a Mann-Whitneyho U test byly použity při srovnání nerovnoměrně rozložených proměnných. Statistická signifikance byla vyjádřena hladinou významnosti p < 0,05.
Výsledky
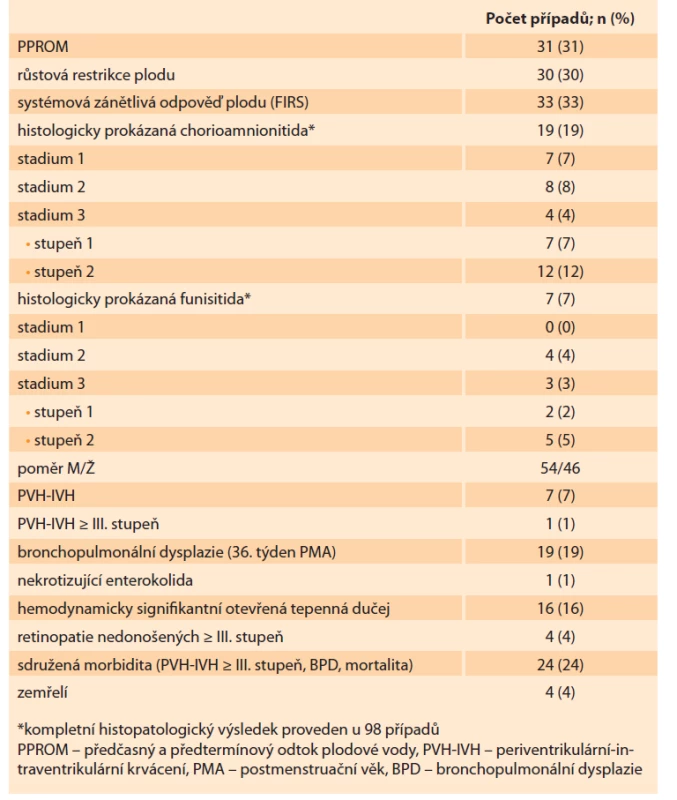
V rámci prospektivní observační studie bylo zhodnoceno 100 novorozenců (průměrný týden těhotenství 30,5 ± 2,5, průměrná porodní hmotnost 1 443 ± 566 g). Histologicky byla chorioamnionitida diagnostikována u 19 % a chorioamnionitida s funisitidou u 7 % případů. Jedno a/ nebo dvě kritéria FIRS (funisitida + IL-6 pozitivita) splnilo 33 novorozenců (33 %). Histopatologické nálezy v placentě a základní charakteristika souboru jsou uvedeny v tab. 2.
Tab. 2. Characteristics of the study group (N = 100) and histopathological changes
in the placenta (chorioamnionitis and funisitis).
Kontrolní skupinou byla kohorta 21 zdravých donošených novorozenců (gestační stáří 39,0 ± 0,5 týden těhotenství, porodní hmotnost 3 420 ± 370 g, medián ± SD), kteří se narodili elektivním císařským řezem z indikace matky a/ nebo patologické polohy plodu.
FIRS statisticky signifikantně koreloval s leukocytózou u matky (36 vs. 15 %; p < 0,001), předčasným odtokem plodové vody (42 vs. 25 %; p < 0,001) a předčasnou děložní aktivitou (45 vs. 22 %; p < 0,0001) ve srovnání se skupinou non-FIRS. Nebyl nalezen signifikantní rozdíl ve frekvenci fetální růstové restrikce (24 % ve skupině FIRS vs. 32 % ve skupině non-FIRS).
Měřené zánětlivé parametry (IL-6, PCT, CRP) v pupečníkové krvi byly statisticky signifikantně vyšší u skupiny FIRS pozitivní ve srovnání s nedonošenými a donošenými kontrolami. Průměrná hodnota pupečníkového IL-6 byla u kontrolní skupiny 5,5 ± 2,9 ng/ l. Srovnání koncentrace IL-6 v pupečníkové krvi prezentuje graf 1. Nebyl nalezen statisticky významný rozdíl mezi hodnotami pupečníkového IL-6, PCT a CRP u kontrolní skupiny a skupiny nedonošených. Skupina FIRS pozitivní měla signifikantně nižší gestační stáří novorozenců, ale nelišila se statisticky signifikantně v porodní hmotnosti (tab. 3).
Graph 1. Comparison of umbilical cord IL-6 values in FIRS-positive neonates with
umbilical cord IL-6 values of premature and full-term controls.

Tab. 3. Comparison of the levels of umbilical and neonatal parameters of infl ammatory response in individual groups
of patients (FIRS, premature and full-term neonatal).
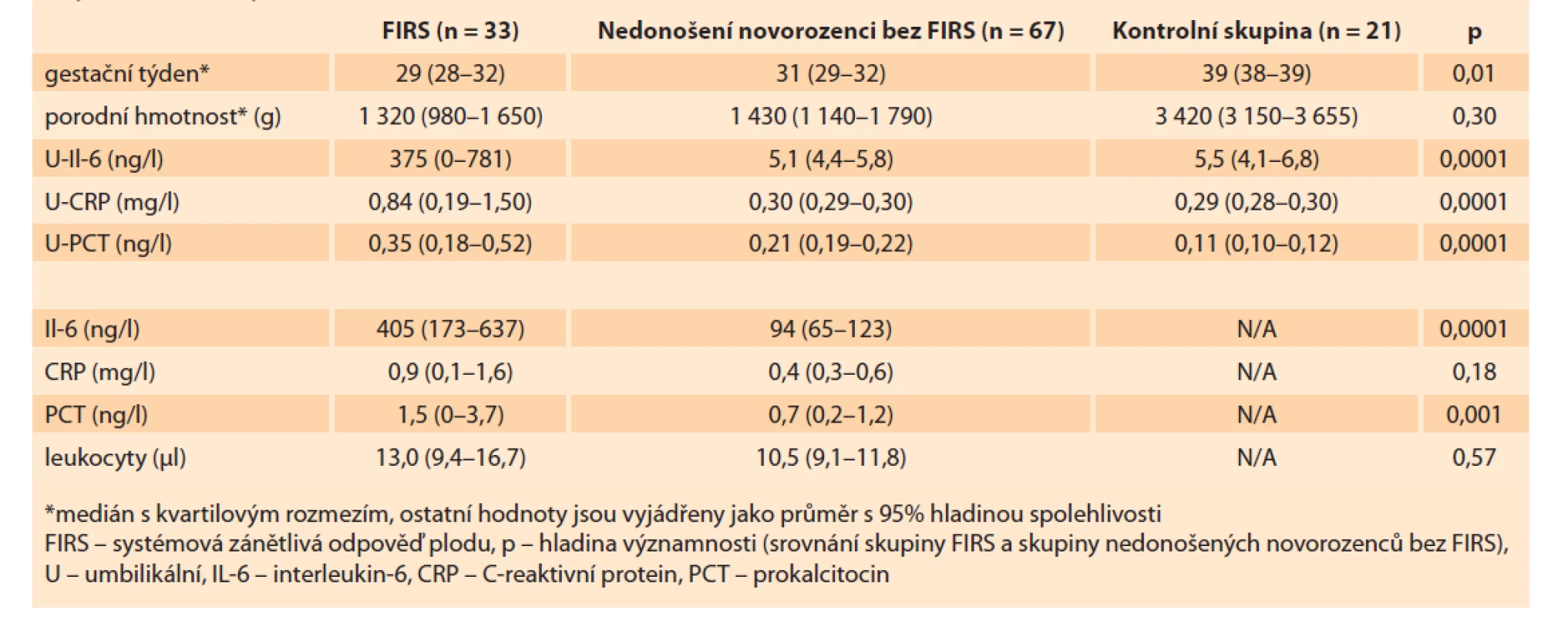
Zvýšené hodnoty zánětlivých parametrů (IL-6, PCT, CRP) v pupečníku korelovaly s histologicky prokázanou chorioamnitidou a se zvýšením zánětlivých parametrů u novorozenců při prvním vyšetření po narození (tab. 3).
Celková mortalita (4 %) a incidence závažné neonatální morbidity byly relativně nízké (1 % intraventrikulární krvácení ≥ III. stupně, 0 % periventrikulární leukomalacie, 19 % bronchopulmonální dysplazie, 0 % prokázaná časná novorozenecká sepse). Vzhledem k nízké četnosti jednotlivých komplikací byla hodnocena kombinovaná morbidita.
Kombinovaná mortalita a morbidita (bronchopulmonální dysplazie, intraventrikulární krvácení, periventrikulární leukomalacie) byla vyšší u novorozenců s FIRS (28,1 %) ve srovnání s novorozenci bez FIRS (22,4 %). Rozdíl však nebyl statisticky významný (p = 0,53).
Diskuze
Systémová zánětlivá odpověď plodu (FIRS) je závažná zánětlivá komplikace, která může signifikantně ovlivnit výsledky perinatální péče. Racionální a včasná diagnostika FIRS zůstává nadále jednou z nejdůležitějších oblastí fetomaternální medicíny. Histopatologické vyšetření placenty se stanovením stadia a stupně zánětlivého procesu je zásadní diagnostická metoda s jednoznačnými klinickými, ale i forenzními konsekvencemi.
Pro histopatologické hodnocení závažnosti akutní chorioamnionitidy existuje několik možných klasifikací. V rámci studie byla zavedena recentní histopatologická klasifikace dle Amsterdam Placental Workshop Group Consensus Statement [4]. Klasifikační systém je založen na rozdělení zánětlivé odpovědi na maternální a na fetální část, dle původu hodnocených neutrofilních granulocytů. Chorioamnionitida byla identifikována v 19 % případů, ale funisitida pouze v 7 %. Prevalence chorioamnionitidy odpovídá publikovaným studiím, ale podíl funisitidy byl v naší skupině relativně nízký [6]. Důvodem nižšího zastoupení funisitidy je pravděpodobně design studie, který byl zaměřen primárně na hodnocení zánětlivých biomarkerů a histopatologické vyšetření bylo pouze komplementární ke stanovení diagnózy FIRS.
Z metodických důvodů (minimalizace negativního vlivu vaginálního porodu na hladiny biomarkerů) byly zařazeny pouze případy po porodu per sectionem caesaream, ale s variabilním rizikem infekčních komplikací (preeklampsie, růstová restrikce plodu, předčasný odtok plodové vody). Studie potvrdila korelaci FIRS s leukocytózou matky, předčasným a předtermínovým odtokem plodové vody a nástupem předčasné děložní aktivity [2].
Zásadním problémem histopatologického vyšetření placenty a pupečníku pro klinickou praxi je doba pro zpracování biologického materiálu a získání definitivního výsledku. Logickou a racionální možností je stanovení koncentrace validních biomarkerů (biologických ukazatelů) zánětu, které jsou dostupné, spolehlivé, minimálně náročné, rychle proveditelné a s příznivým poměrem výkon/ cena.
V oblasti feto-maternální medicíny je nejvíce studovaným biomarkerem IL-6 [7]. IL-6 je typický pleiotropní cytokin produkovaný různými buňkami při infekci a poškození tkání. Indukuje syntézu proteinů akutní fáze (např. CRP, LBP). Při infekci dochází k rychlému vzestupu koncentrace IL-6, který je patrný během 2–4 hod po stimulu (s maximem v 6.–8. hod). Signifikantní vzestup koncentrace IL-6 předchází vzestupu CRP. Kombinace vyšetření IL-6 a CRP může výrazně zpřesnit diagnostiku FIRS. Naše studie potvrdila korelaci IL-6 a CRP u pacientů s FIRS. CRP je dostupný a vysoce specifický biomarker těžkých forem funisitidy. Klinicky použitelná hladina CRP pro diagnostiku závažné funisitidy je 200 ng/ ml [8].
Relativně novým biomarkerem v diagnostice FIRS je prokalcitonin (PCT), který je produkovaný za fyziologických podmínek C-buňkami štítné žlázy jako prekurzor hormonu kalcitoninu. V případě infekce je PCT produkován v parenchymatózních orgánech a buňkách neuroendokrinního systému, predominantně v hepatocytech (po stimulaci IL-6 a tumor necrosis factor á (TNFá)) a monocytech (po stimulaci lipopolysacharidy (LPS)). Hladina PCT vzrůstá 3–4 hod po expozici bakteriálním endotoxinem s maximem v 8.–12. hod. Po vzestupu hladiny PCT následuje fáze plateau (přibližně do 24. hod po inzultu). Biologický poločas PCT je 25–30 hod. PCT velmi rychle klesá během terapie antibiotiky, a proto je vhodný k monitorování úspěšnosti léčby. PCT je v kombinaci s IL-6 a CRP vhodným komplementárním biomarkerem FIRS. Naše analýza potvrdila, že hladiny PCT statisticky korelují s hladinami ostatních biomarkerů, ale skutečná hladina významnosti PCT pro klinické použití musí být předmětem dalšího výzkumu [9].
Studie neprokázala signifikantní negativní vliv FIRS na neonatální morbiditu [6,10,11]. Prevalence kraniální morbidity (intraventrikulární krvácení ≥ III. stupně, periventrikulární leukomalacie) a bronchopulmonální dysplazie však byla velmi nízká a pravděpodobně souvisí s designem studie. Kombinovaná morbidita však byla vyšší u novorozenců s FIRS, ale rozdíl nebyl statisticky významný.
Závěr
Hodnoty zánětlivých biomarkerů (IL-6, PCT, CRP) v pupečníkové krvi okamžitě po porodu korelují s histologicky prokázanou chorioamnionitidou a systémovou zánětlivou odpovědí plodu. Stanovení zánětlivých biomarkerů v pupečníku je ve srovnání s histopatologickým vyšetřením placenty rychlé a relativně levné. Včasná diagnostika FIRS může zásadně ovlivnit management u rizikových skupin novorozenců (preventivní podávání antibiotik a plánování kontrolních odběrů zánětlivých biomarkerů).
Doručeno/ Submitted: 8. 3. 2021
Přijato/ Accepted: 11. 3. 2021
prof. MU Dr. Zbyněk Straňák, CSc.
Ústav pro péči o matku a dítě
Podolské nábřeží 157
147 00 Praha 4
Publikační etika: Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bio medicínských časopisů.
Publication ethics: The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for bio medical papers.
Konflikt zájmů: Autoři deklarují, že v souvislosti s předmětem studie/ práce nemají žádný konflikt zájmů.
Confl ict of interests: The authors declare they have no potential confl icts of interest concerning the drugs, products or services used in the study.
Dedikace: Práce vznikla za podpory projektu NV 17-31403A a PROGRES Q34.
Dedication: The work was supported NV 17-31403A and PROGRES Q34.
Zdroje
1. Gomez R, Romero R, Ghezzi F et al. The fetal inflammatory response syndrome. Am J Obstet Gynecol 1998; 179(1): 194–202. doi: 10.1016/ s0002-9378(98)70272-8.
2. Jung E, Romero R, Yeo L et al. The fetal inflammatory response syndrome: the origins of a concept, pathophysiology, diagnosis, and obstetrical implications. Semin Fetal Neonatal Med 2020; 25(4): 101146. doi: 10.1016/ j.siny.2020.101146.
3. Hofer N, Kothari R, Morris N et al. The fetal inflammatory response syndrome is a risk factor for morbidity in preterm neonates. Am J Obstet Gynecol 2013; 209(6): 542.e1–542.e11. doi: 10.1016/ j.ajog.2013.08.030.
4. Khong TY, Mooney EE, Ariel I et al. Sampling and definitions of placental lesions: Amsterdam placental workshop group consensus statement. Arch Pathol Lab Med 2016; 140(7): 698–713. doi: 10.5858/ arpa.2015-0225-CC.
5. Vtoxfor.zendesk.com. Manuals and forms. 2020 [online]. Available from: https:/ / vtoxford.zendesk.com/ hc/ en-us/ categories/ 360 000861394-Manuals-and-Forms.
6. Maisonneuve E, Ancel PY, Foix-L’Hélias L et al. Impact of clinical and/ or histological chorioamnionitis on neurodevelopmental outcomes in preterm infants: a literature review. J Gynecol Obstet Hum Reprod 2017; 46(4): 307–316. doi: 10.1016/ j.jogoh.2017.02.007.
7. Chiesa C, Pacifico L, Natale F et al. Fetal and early neonatal interleukin-6 response. Cytokine 2015; 76(1): 1–12. doi: 10.1016/ j.cyto.2015.03.015.
8. Oh JW, Park CW, Moon KC et al. The relationship among the progression of inflammation in umbilical cord, fetal inflammatory response, early-onset neonatal sepsis, and chorioamnionitis. PloS One 2019; 14(11): e0225328. doi: 10.1371/ journal.pone.0225328.
9. Ruan L, Chen GY, Liu Z et al. The combination of procalcitonin and C-reactive protein or presepsin alone improves the accuracy of diagnosis of neonatal sepsis: a meta-analysis and systematic review. Crit Care 2018; 22(1): 316. doi: 10.1186/ s13054-018-2236-1.
10. Sarno L, Della Corte L, Saccone G et al. Histological chorioamnionitis and risk of pulmonary complications in preterm births: a systematic review and meta-analysis. J Matern Fetal Neonatal Med 2019: 1–10. doi: 10.1080/ 14767058.2019.1689945.
11. Shi Z, Ma L, Luo K et al. Chorioamnionitis in the development of cerebral palsy: a meta-analysis and systematic review. Pediatrics 2017; 139(6): e20163781. doi: 10.1542/ peds.2016-3781.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2021 Číslo 2
Nejčtenější v tomto čísle
- Současné možnosti prevence a terapie ovariálního hyperstimulačního syndromu
- Obrovský fibroadenom prsu v těhotenství
- Poranění análního sfinkteru při porodu a anální inkontinence
- Nový nástroj pro personalizaci ovariální stimulace: výsledky studie CERES při použití nového gonadotropinu – folitropinu delta
