Adenomyóza – možný vliv na funkci a receptivitu endometria
Adenomyosis – its possible effect on endometrial function and receptivity
Objective: There have been many studies on adenomyosis, which can impair the quality of life of a woman. There are various kinds of opinions on the pathogenesis, diagnostics and treatment of adenomyosis. The goal of this article is to present the current knowledge of adenomyosis and its impact on the endometrial function and receptivity.
Methods: PubMed/Medline, Web of Sciences and Scopus were searched for the articles in English indexed until February 2021 with terms of: adenomyosis, endometrial receptivity, and infertility.
Results: Recent studies on angiogenesis and epithelial-mesenchymal transition in the endometrium bring new information on the ethiology and pathogenesis of adenomyosis. In clinical practice, the main diagnostic methods of adenomyosis include transvaginal ultrasound, magnetic resonance imaging or hysteroscopy, although the definitive confirmation is set by histopathological examination. The rules of #Enzian classification of endometriosis should be applied for the classification of adenomyosis. The treatment of adenomyosis should consider individual clinical presentation and reproductive plans of a patient and should be performed in centers for the treatment of endometriosis.
Conclusion: Adenomyosis affects endometrial vascularisation and epithelial-mesenchymal transition/mesenchymal-epithelial transition; thus, it can be the cause of irregular uterine bleeding or embryo implantation failure. The research and analysis of endometrial proteome could lead to the new ways of adenomyosis treatment.
Keywords:
adenomyosis – infertility – endometrial receptivity – proteome – pelvic pain
Autoři:
Crha Karel 1; Ješeta Michal 1; Pilka Radovan 2; Ventruba Pavel 1; Žáková Jana 1; Vodička Jan 2; Crha Tomáš 1
Působiště autorů:
Gynekologicko-porodnická klinika LF MU a FN Brno
1; Porodnicko-gynekologická klinika LF UP a FN Olomouc
2
Vyšlo v časopise:
Ceska Gynekol 2021; 86(3): 205-209
Kategorie:
Přehledový článek
doi:
https://doi.org/10.48095/cccg2021205
Souhrn
Cíl studie: V současné době rychle přibývá nových studií o adenomyóze, která může výrazně zhoršovat kvalitu života ženy. Názory na patogenezi, diagnostiku a možnosti účinné léčby nejsou jednotné. Cílem práce je prezentovat současné poznatky o adenomyóze a jejím vlivu na funkci a receptivitu endometria.
Metodika: Rešerše relevantní literatury v databázích Web of Science, Scopus, PubMed/Medline.
Výsledky: Nové poznatky o patogenezi adenomyózy přináší především molekulárně genetické studie angiogeneze a tranzice epiteliálních a stromálních buněk endometria. Základní klinickou vyšetřovací metodou je transvaginální ultrazvuk, ve specifických případech magnetická rezonance nebo hysteroskopie. Klasifikace adenomyózy by měla důsledně využít pravidla klasifikace #Enzian. Léčba adenomyózy by měla respektovat její klinické projevy a reprodukční plán pacientky, optimálně v centrech pro léčbu endometriózy.
Závěr: Selhání implantace a nepravidelné děložní krvácení mohou být způsobeny vlivem adenomyózy na vaskularizaci endometria a epitelově-mezenchymová tranzice/mezenchymově-epitelová tranzice. Nové poznatky v této oblasti, např. analýza proteomu endometriálního sekretu, by mohly přinést nové možnosti efektivní terapie a objektivní hodnocení jejího efektu.
Klíčová slova:
adenomyóza – poruchy plodnosti – receptivita endometria – proteom – pánevní bolest
Úvod
V současné době rychle přibývá nových studií o adenomyóze, která může výrazně zhoršovat kvalitu života ženy – pánevní bolestí, nepravidelným děložním krvácením a poruchami plodnosti. Názory na patogenezi, diagnostiku a možnosti účinné léčby nejsou jednotné. Cílem této práce je prezentovat současné poznatky o adenomyóze a jejím vlivu na funkci a receptivitu endometria.
Definice, epidemiologie
Adenomyóza je ektopický výskyt endometriální tkáně v myometriu. Historicky byla diagnostikována většinou až histologickým vyšetřením odstraněné dělohy. Hlavním histologickým rysem je přítomnost endometriálních žlázek a stromatu ve stěně děložní, většinou provázená hyperplazií buněk hladkého svalstva. Současné zobrazovací metody s vysokým rozlišením – především ultrazvuk (UZ) a magnetická rezonance (MR) – umožňují neinvazivní a snadno dostupnou diagnostiku ložisek adenomyózy. Byla prezentována řada studií hodnotících podíl adenomyózy na nepravidelném krvácení, poruchách plodnosti a dalších děložních patologiích [1,2].
Prevalence adenomyózy v jednotlivých studiích se pohybuje ve velmi širokém rozmezí v závislosti na mnoha faktorech – použité diagnostické metody, výběr vyšetřovaných žen, jejich věk a indikace k vyšetření. Nejsou také jednotná přesná diagnostická kritéria pro UZ a MR vyšetření nebo laparoskopický nález. U žen ve věku do 40 let byla prokázána ve 20 %, u žen nad 40 let přibližně v 80 % [3]. V retrospektivní studii 945 pacientek, které podstoupily hysterektomii, byla prokázána pozitivní korelace mezi přítomností adenomyózy a celkovým počtem těhotenství – abortů i porodů, které žena měla [4].
Patogeneze
Patogeneze adenomyózy zůstává stále nejasná, nové poznatky přináší především molekulárně genetické studie [5]. Předpokládá se několik mechanizmů vzniku podobně jako u endometriózy [4]. Může vznikat de novo metaplastickou transformací v myometriu rozptýlených embryonálních pluripotentních buněk derivovaných z paramezonefrických mülleriánských duktů [6].
Další hypotéza předpokládá invazi buněk bazálního endometria do myometria při defektu junkční zóny mezi těmito tkáněmi. Tento průnik může být podmíněn její traumatizací – tzv. tissue injury and repair (TIAR) – zvýšením intrauterinního tlaku při spontánních kontrakcích dělohy např. v průběhu menstruačního krvácení nebo v souvislosti s nitroděložními výkony. Při reparaci dochází v místě poranění ke zvýšené expresi aromatázy a ke zvýšené koncentraci estrogenů, které endometriální buňky stimulují.
Molekulární aspekty patogeneze adenomyózy
Při vzniku a rozvoji adenomyózy se uplatňuje řada signálních molekul – hormonů a cytokinů a jejich vzájemná souhra. Zvýšená koncentrace estrogenů a jejich receptorů podporuje expresi interleukinu (IL) 10, který potlačuje imunitní dozor v myometriu a podílí se na dalším růstu ektopicky uložených endometriálních buněk. IL-1 a IL-6 navozují zánětlivou reakci s produkcí ROS (reactive oxygen species). Vlivem této dysbalance může docházet k metaplazii buněk hladkého svalstva na fibroblasty a naopak.
Zajímavé výsledky přináší studie exprese RNA (ribonukleová kyselina) ve tkáni adenomyózy. Bylo prokázáno, že v ektopicky uložené endometriální tkáni je signifikantně vyšší exprese lncRNA (long non coding RNA) v porovnání s eutopickým endometriem, což ovlivňuje funkci NRP2 (neuropilin 2) a novotvorbu cév [7,8].
Klinické projevy
K typickým projevům adenomyózy patří zvětšení dělohy, pánevní bolest, hypermenorea, reprodukční potíže vč. zvýšeného rizika předčasného odtoku plodové vody a předčasného porodu. Odhaduje se, že v jedné třetině případů je asymptomatická [9]. V metaanalýze byl také prokázán nepříznivý vliv na výsledky léčby poruch plodnosti metodami asistované reprodukce. Často je adenomyóza spojena s dalšími projevy hyperestrinizmu – endometriózou, hyperplazií endometria a děložními myomy [1,10].
Diagnostika
Přestože definitivní potvrzení adenomyózy je možné jen histopatologickým vyšetřením dělohy, jsme v dnešní době schopni s vysokou přesností popsat adenomyózu zobrazovacími metodami. Základní vyšetřovací metodou je transvaginální UZ [11,12]. K nejčastějším ultrazvukovým známkám adenomyózy patří zvětšení dělohy, asymetrické ztluštění myometria přední nebo zadní stěny děložní, anechogenní ložiska v myometriu a neostrá endomyometrální junkce (JZ – junkční zóna). V UZ obraze má JZ podobu hypoechogenní vrstvy (myometria) lemující endometrium. Ztluštění JZ je známkou endometriální invaze do myometria. Šíře JZ > 12 mm bývá typická u nálezu adenomyozy.
Vyšetření MR je další vhodnou zobrazovací metodou, avšak vzhledem k omezené dostupnosti méně využívanou. V T2 obraze bývá typické rozšíření JZ, která má podobu neostře ohraničené hypointenzní vrstvy (představující hyperplastické myometrium s heterotopickou endometriální tkání). S tímto obrazem bývá často spojen i nález hyperintenzních ložisek v myometriu, cysticky dilatovaných endometriálních žláz nebo hemoragických ložisek [6].
Hysteroskopie může přispět k diagnostice ložisek endometriózy uložených do 2 mm od hranice mezi endometriem a myometriem – označuje se jako adenomyosis subbasalis. K hysteroskopickému obrazu patří modře prosvítající cysty vyplněné čokoládově hnědým obsahem, biopsie může potvrdit diagnózu [13].
Klasifikace
Klasifikace adenomyózy by měla důsledně respektovat pravidla klasifikace #Enzian, která byla na základě mezinárodního a mezioborového konsenzu akceptována a prezentována [14]. Adenomyóza je klasifikována jako kompartment FA, při UZ diagnostice by měla být dodržena pravidla MUSA (Morphological Uterus Sonographic Assessment) [15].
Vliv adenomyózy na angiogenezi
Angiogeneze je proces, při kterém ze stávajících cév vyrůstají nové cévy. Je významnou součástí mnoha fyziologických i patologických procesů. Intenzivně probíhá při regeneraci endometria v proliferační fázi cyklu, je také nezbytná pro úspěšnou implantaci embrya.
Pro ložiska adenomyózy je charakteristické zmnožení cév v jejich okolí, je tak velmi pravděpodobné, že ektopické endometrium uvolňuje signální faktory, které vedou k tvorbě nových cév. Tento mechanizmus je dobře znám u zhoubných nádorů, kdy mutace nádorových buněk vede k produkci angiogenních faktorů a růstu tumoru.
Estrogeny, které jsou důležitým faktorem adenomyózy, mohou také stimulovat progenitorové endoteliální buňky a následně tvorbu nových kapilár. Nadměrná exprese genů řídících angiogenezi, např. VEGF (vascular endotelial growth factor), vede ke zvýšenému vytváření nových cév, snížení pevnosti cévní stěny a vyšší permeabilitě. Bylo také prokázáno, že polymorfizmus genu pro angiogenní faktor FGF 1, 2 (fibroblast growth factor) zvyšuje riziko vzniku adenomyózy a endometriózy [7]. Byla také prokázána zvýšená aktivita prozánětlivých cytokinů IL-6, IL-22, které výrazně regulují angiogenezi. Přehled je uveden v tab. 1. Abnormální vaskularizace ložisek adenomyózy může těmito signálními drahami působit na eutopické endometrium a jeho fyziologickou funkci. Klinickým projevem může být porucha jeho receptivity a nepravidelné krvácení.
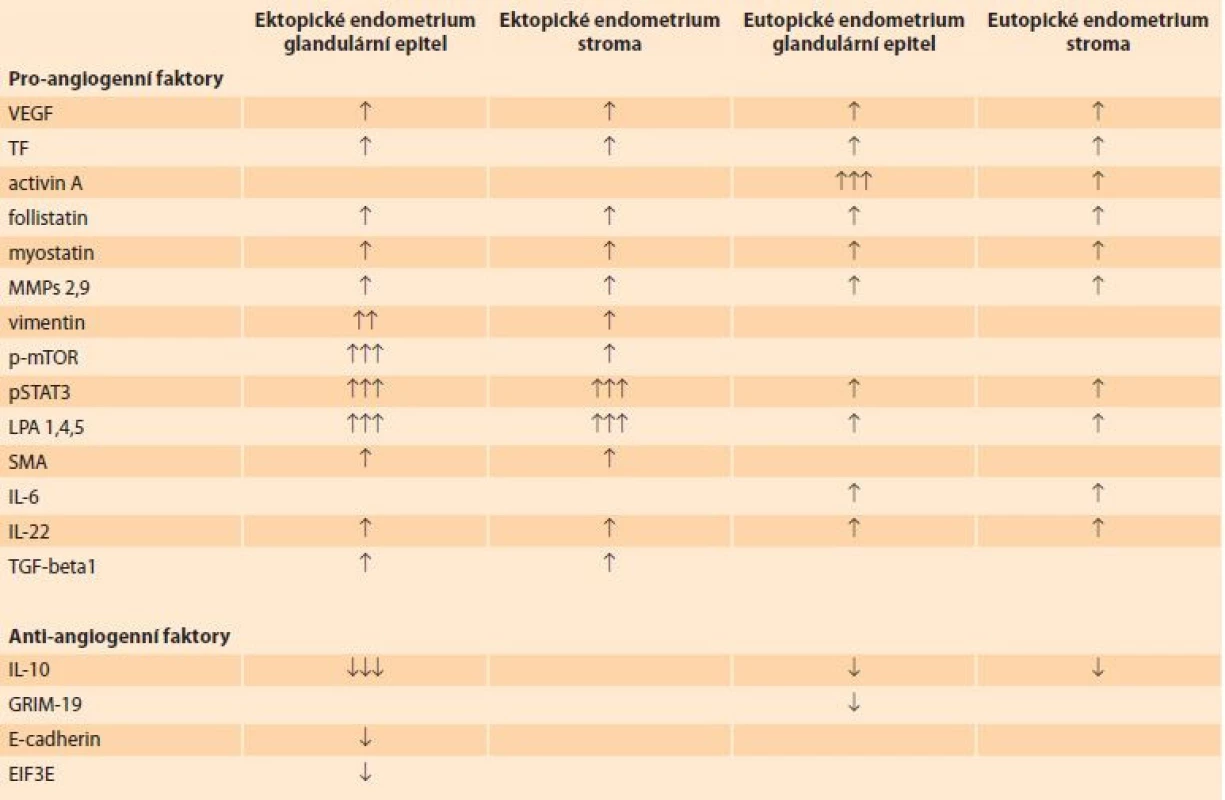
Zajímavé výsledky přinesly studie hodnotící mikroskopickou vaskularitu ektopického a eutopického endometria (MVD – microvascular density), při kterých byly endoteliální buňky značeny protilátkami proti CD31, CD34 a dalšími charakteristickými markery endoteliálních buněk. V porovnání s kontrolními vzorky z děloh bez adenomyózy byla MVD signifikantně vyšší v eutopickém i ektopickém endometriu [2].
Vliv adenomyózy na přeměnu epiteliálních a mezenchymálních buněk endometria
Schopnost regenerace, remodelace a diferenciace buněk je předpokladem receptivity endometria, implantace a vývoje embrya. Důležitým faktorem těchto procesů je vzájemná přeměna mezenchymálního a epiteliálního fenotypu endometriálních buněk – epiteliálně-mezenchymální tranzice (EMT – epitelial-mezenchymal transition) a mezenchymálně-epiteliální tranzice (MET – mezenchymal-epithelial transition). Mechanizmy řídící tvorbu a zánik cévních pletení úzce souvisí se vzájemnou přeměnou jednotlivých buněk endometria a fyziologickou funkcí. Bylo prokázáno, že obnovu děložní sliznice a její struktury zajišťují kmenové buňky. Endometriální mezenchymální kmenové buňky (eMSCs – endometrial mezenchymal stem cells) se nachází perivaskulárně ve funkční a bazální vrstvě při hranici s myometriem. Mnohé faktory klíčové pro fyziologickou tranzici – např. vimentin, cadherin, SMA (smooth muscle activin) – mají v endometriu dělohy s adenomyózou odlišnou aktivitu než v děloze bez adenomyózy. Abnormní vaskularizace, TIAR a endokrinní disruptory tak mohou vést k poruchám receptivity a metroragii [16–18]. Přehled EMT/MET byl publikován nedávno [19].
Terapie adenomyózy
Léčba adenomyózy by měla respektovat její klinické projevy a reprodukční plán pacientky. Medikamentózní léčba je podobná jako u endometriózy – blokáda ovarií agonisty gonadotropiny uvolňujícího hormonu (GnRH), dlouhodobé podávání progestinů, kombinovaná nízkodávkovaná hormonální antikoncepce, symptomatická léčba pánevní bolesti nesteroidními analgetiky [20–22].
U žen plánujících těhotenství je chirurgická léčba problematická, rozsáhlá traumatizace dělohy znamená riziko pro těhotenství a porod. V literatuře jsou uvedeny možnosti resekce ložisek, elektrokoagulace či destrukce metodou „high-intensity focused ultrasound“. Subbazální ložiska mohou být odstraněna hysteroskopicky [6,13,23]. U žen, které neplánují těhotenství, je pro odstranění symptomů nejúčinnější hysterektomie. Nepravidelné krvácení může být řešeno také ablací endometria [24].
Závěr
Z poznatků o adenomyóze vyplývá, že selhání implantace a nepravidelné krvácení mohou být způsobeny jejím vlivem na vaskularizaci endometria a EMT/MET. Nové poznatky v této oblasti, např. analýza proteomu endometriálního sekretu, by mohly přinést nové možnosti efektivní terapie a objektivní hodnocení jejího efektu.
Publikační etika: Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bio medicínských časopisů.
Konflikt zájmů: Autoři deklarují, že v souvislosti s předmětem studie/ práce nemají žádný konflikt zájmů.
Dedikace: Práce vznikla za podpory projektu MZ ČR – RVO (FNBr: 65269705) a AZV NV-18-08-00291.
Zdroje
1. Younes G Tulandi T. Effects of adenomyosis on in vitro fertilization treatment outcomes: a meta-analysis. Fertil Steril 2017; 108 (3): 483– –490. doi: 10.1016/j.fertnstert.2017.06.025.
2. Harmsen MJ, Wong CF, Mijatovic V et al. Role of angiogenesis in adenomyosis-associated abnormal uterine bleeding and subfertility: a systematic review. Hum Reprod Update 2019; 25 (5): 647–671. doi: 10.1093/humupd/dmz024.
3. Harada T, Khine YM, Kaponis A et al. The impact of idenomyosis on women’s fertility. Obstet Gynecol Surv 2016; 71 (9): 557–568. doi: 10.1097/OGX.0000000000000346.
4. Genc M, Genc B, Cengiz H. Adenomyosis and accompanying gynecological pathologies. Arch Gynecol Obstet 2015; 291 (4): 877–881. doi: 10.1007/s00404-014-3498-8.
5. Mullen RD, Behringer RR. Molecular genetics of Müllerian duct formation, regression and differentiation. Sex Dev 2014; 8 (5): 281–296. doi: 10.1159/000364935.
6. Szubert M, Koziróg E, Olszak O et al. Adenomyosis and infertility-review of medical and surgical approaches. Int J Environ Res Public Health 2021; 18 (3): 1235. doi: 10.3390/ijerph18031235.
7. Yen CF, Huang SJ, Lee CL et al. Molecular characteristics of the endometrium in uterine adenomyosis and its biochemical microenvironment. Reprod Sci 2017; 24 (10): 1346–1361. doi: 10.1177/1933719117691141.
8. Zhou C, Zhang T, Liu F et al. The differential expression of mRNAs and long noncoding RNAs between ectopic and eutopic endometria provides new insights into adenomyosis. Mol Biosyst 2016; 12 (2): 362–370. doi: 10.1039/c5mb00733j.
9. Juang CM, Chou P, Yen MS et al. Adenomyosis and risk of preterm delivery. BJOG 2007; 114 (2): 165–169. doi: 10.1111/j.1471-0528. 2006.01186.x.
10. Vercellini P, Consonni D, Dridi D et al. Uterine adenomyosis and in vitro fertilization outcome: a systematic reviewand meta-analysis. Hum Reprod 2014; 29 (5): 964–977. doi: 10.1093/humrep/deu041.
11. Van den Bosch T, de Bruijn AM, de Leeuw RA et al. A sonographic classification and reporting system for diagnosing adenomyosis. Ultrasound Obstet Gynecol 2019; 53 (5): 576–582. doi: 10.1002/uog.19096.
12. Dolná Z, Hašlík L, Frydrach J et al. Porovnání ultrazvuku a magnetické rezonance v diagnostice hluboké infiltrující endometriózy. Gyn Por 2020; 4 (3): 149–153.
13. Kovář P, Daňková Kučerová J, Dvořáčková J et al. Adenomyóza. Gyn Por 2020; 4 (3): 138–144.
14. Keckstein J, Saridogan E, Ulrich UA et al. The #Enzian classification: a comprehensive non-invasive and surgical description system for endometriosis. Acta Obstet Gynecol Scand 2021. Online ahead of print. doi: 10.1111/aogs.14 099.
15. Van den Bosch T, Dueholm M, Leone FP et al. Terms, definitions and measurements to describe sonographic features of myometrium and uterine masses: a consensus opinion from the Morphological Uterus Sonographic Assessment (MUSA) group. Ultrasound Obstet Gynecol 2015; 46 (3): 284–298. doi: 10.1002/uog.14806.
16. Owusu-Akyaw A, Krishnamoorthy K, Goldsmith LT et al. The role of mesenchymal-epithelial transition in endometrial function. Human Reprod Update 2019; 25 (1): 114–133. doi: 10.1093/humupd/dmy035.
17. Ješeta M, Crha T, Žáková J et al. Bisfenoly v patologii reprodukce. Ceska Gynekol 2019; 84 (2): 161–165.
18. Vodička J, Dvořan M, Smékalová K et al. Možnosti přípravy endometria ke kryotransferu. Ceska Gynekol 2018; 83 (1): 24–28.
19. Crha K, Ventruba P, Žáková J et al. The role of uterine microbiome and epithelial-mesenchymal transition in endometrial function. Med J Cell Biol 2019; 7 (3): 146–151. doi: 10.2478/acb-2019-0020.
20. Hudeček R, Ventruba P, Gazárková E et al. Konzervativní terapie klinických projevů endometriózy v reprodukční gynekologii. Bolest 2019; 22 (2): 60–69.
21. Papíková Z, Hudeček R, Ventruba P et al. Účinnost dienogestu v terapii klinických symptomů endometriózy rektovaginálního septa. Ceska Gynekol 2019; 84 (5): 331–336.
22. Ventruba P, Žáková J, Ješeta M et al. Současná témata reprodukční medicíny v České republice. Ceska Gynekol 2016; 81 (3): 234–240.
23. Zhang L, Rao F, Setzen R. High intensity focused ultrasound for the treatment of adenomyosis: selection criteria, efficacy, safety and fertility. Acta Obstet Gynecol Scand 2017; 96 (6): 707–714. doi: 10.1111/aogs.13159.
24. Huser M, Papíkova Z, Dziaková M et al. Radiofrekvenční ablace endometria – nová možnost konzervativní léčby silného menstruačního krvácení. Ceska Gynekol 2018; 83 (6): 418–423.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2021 Číslo 3
Nejčtenější v tomto čísle
- Estetrol a možnosti jeho klinického využití
- Adenomyóza – možný vliv na funkci a receptivitu endometria
- Vrozený deficit antitrombinu a gravidita – závažný trombofilní stav ohrožující matku i plod
- Změny kvality sexuálního života po operacích pro sestup pánevních orgánů
