Estetrol a možnosti jeho klinického využití
Estetrol and the possibilities of its clinical use
Combined hormonal contraceptive methods are one of the most commonly used methods of planned parenthood. They show high contraceptive effectiveness, reasonable cycle control and bring several non-contraceptive benefits. A limitation of the widespread use of combined hormonal contraception is the risk of cardiovascular complications in individuals with specific risk factors. The risk of cardiovascular complications is related to the used estrogen component. Currently, the most common use of estrogen in combined hormonal contraception is ethinyl estradiol and estradiol valerate. The good estrogenic part of combined oral contraceptives is estetrol, a hormone produced exclusively by the fetal liver. Estetrol exhibits a tissue-selective receptor activity. Unlike previously used estrogens, it does not negatively affect the production of liver proteins and blood clotting parameters. Estetrol is not a perspective for combined hormonal contraception only. It is also promising for treating and preventing osteoporosis, hormonal therapy of menopausal syndrome, and vulvovaginal atrophy syndrome.
Keywords:
estetrol – hormonal contraception – Estrogens – drospirenone – complications of hormonal contraception
Autoři:
Křepelka Petr
Působiště autorů:
Ústav pro péči o matku a dítě, Praha Katedra gynekologie a porodnictví IPVZ, Praha 3. LF UK, katedra gynekologie a porodnictví, Praha
Vyšlo v časopise:
Ceska Gynekol 2021; 86(3): 217-221
Kategorie:
Lékový profil
doi:
https://doi.org/10.48095/cccg2021217
Souhrn
Metody kombinované hormonální antikoncepce představují jednu z nejčastěji používaných metod plánovaného rodičovství. Vykazují vysokou antikoncepční efektivitu, dobrou kontrolu cyklu a přináší řadu nekontracepčních benefitů. Limitem širokého použití kombinované hormonální antikoncepce je riziko kardiovaskulárních komplikací u jedinců se specifickými rizikovými faktory. Bylo prokázáno, že riziko kardiovaskulárních komplikací souvisí s použitou estrogenní komponentou. V současné době je nejčastěji používaným estrogenem v kombinované orální antikoncepci ethinylestradiol nebo estradiol-valerát. Perspektivní estrogenní komponentou kombinované orální antikoncepce je estetrol, hormon produkovaný výlučně fetálními játry. Vykazuje tkáňově selektivní receptorovou aktivitu. Na rozdíl od doposud užívaných estrogenů negativně neovlivňuje tvorbu jaterních proteinů a parametry krevní srážlivosti. Estetrol není perspektivní pouze jako estrogenní komponent kombinované orální antikoncepce, ale je vhodný i pro léčbu a prevenci osteoporózy, hormonální terapii klimakterického syndromu a syndromu vulvovaginální atrofie.
Klíčová slova:
estetrol – hormonální antikoncepce – estrogeny – drospirenon – komplikace hormonální antikoncepce
Objev estetrolu
Estetrol (E4) byl izolován Egonem Diczfalusy a spolupracovníky v Karolinska Institutu ve Stockholmu v roce 1965. Byl získán extrakcí z 200 litrů moči žen v pokročilém stadiu gravidity [1]. Základní výzkum byl proveden do roku 1984. V roce 2001 zahájila společnost Pantarhei Bioscience svůj výzkum aktivity E4. Motivací byla skutečnost, že se jedná o hormon produkovaný pouze lidským plodem a nemá negativní biologický účinek na mateřský organizmus. Nový výzkum odhalil, že E4 je bezpečným hormonem se selektivní vazbou na oba estrogenové receptory a mírnou preferencí pro receptor ERaa proti ERb.
Struktura a farmakokinetika E4
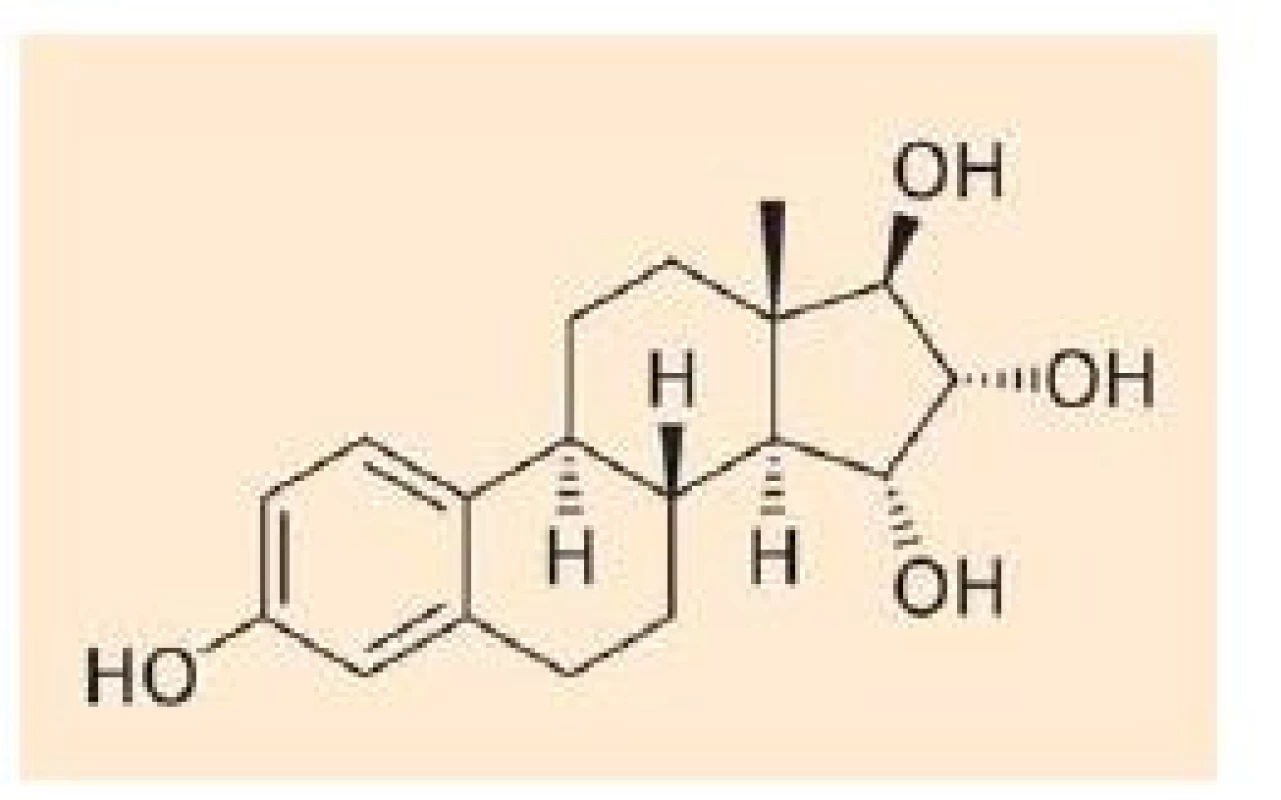
E4 je unikátní estrogen se čtyřmi hydroxylovými skupinami (obr. 1). Bylo prokázáno, že je syntetizován výhradně fetálními játry v průběhu těhotenství a přechází transplacentárně do mateřského oběhu. Farmakokinetické studie analyzující absorpci, distribuci, metabolizmus a exkreci E4 u žen ve III. trimestru gravidity a žen postmenopauzálních prokázaly jeho minimální metabolizmus [2]. Nedochází k jeho konverzi zpět na estradiol (E2) nebo estriol (E3) a po parenterálním podání je nezměněný vyloučen močí ve formě monoglukuronidu. Prakticky vůbec nevstupuje do enterohepatální cirkulace [3].
E4 je detekován v moči těhotných žen od 9. týdne gravidity. Jeho plazmatická koncentrace se zvyšuje ve druhém trimestru, kdy dosahuje setrvalé hodnoty kolem 43 nmol/l až do konce gravidity [4,5]. Koncentrace konjugovaného E4 je sedmkrát vyšší než jeho forma nekonjugovaná. Ve fetální plazmě je koncentrace nekonjugovaného E4 12–19× vyšší než v mateřské plazmě [6]. Koncentrace E4 v plodové vodě představuje přibližně 30 % koncentrace ve fetální plazmě a je 5–6× vyšší než koncentrace v mateřské plazmě [7]. Mateřská močová exkrece ve třetím trimestru se pohybuje mezi 0,5 a 2,3 mg [8]. Plazmatická koncentrace E4 u těhotných žen vykazuje velké interindividuální rozdíly a předpokládá se, že jeho sledování není vhodné pro diagnostiku těhotenských patologií [6]. Při perorálním podání ženám ve čtyřech různých dávkách 0,1, 1, 10 a 100 mg E4 byla prokázána jeho velmi dobrá biologická dostupnost s velmi malou variabilitou dosažených plazmatických koncentrací mezi jednotlivými ženami. Biologický poločas E4 byl stanoven na 28 hod, z čehož vyplývá jeho efektivita při jednodenním orálním podání [9]. Po orálním podání E4 postmenopauzálním ženám v denních dávkách 10, 20 a 40 mg po dobu 28 dnů byla prokázána jeho velmi rychlá absorpce z gastrointestinálního traktu s následným prvotním rychlým poklesem plazmatické koncentrace a postupné eliminace. Vyrovnaného stavu bylo dosaženo po 2 týdnech podávání a hodnota koncentrace byla závislá na podávané denní dávce. Plazmatická koncentrace byla mírně zvýšena proti 1. dni aplikace 28. den aplikace. Po rychlé absorpční fázi dochází k úvodnímu rychlému poklesu s pomalou terminální eliminací. Je vhodný pro perorální podání v jedné denní dávce [10].
Receptorová aktivita E4
Estrogeny působí na úrovni buňky genomickým a negenomickým mechanizmem. Genomický mechanizmus zajišťuje interakce estrogenů s receptory ERa a ERb. Negenomický účinek estrogenů je zprostředkován receptorem GPER (G protein-coupled estrogen receptor 1). E4 vykazuje mírnou afinitu k estrogenovým receptorům ERa a ERb, přičemž k receptoru ERa je afinita 4–5× větší. Jeho afinita k dalším receptorům steroidních hormonů (testosteron, glukokortikoidy, progesteron) je však extrémně nízká. Genomické klinické účinky E4 probíhají pouze na úrovni estrogenních receptorů. Afinita k estrogenovým receptorům E4 je vysoce selektivní, a tedy výhodná, neboť lze předpokládat nízký výskyt vedlejších účinků. Vazebné vlastnosti E4 jsou výhodné pro farmakodynamiku kontraceptiva, neboť nepůsobí jinou nežádoucí receptorovou aktivitu s předpokládaným nízkým výskytem vedlejších účinků [11]. E4 podobně jako E2 se váže na receptor ERa, aktivuje jeho dvě funkce AF-1 (ligand-independent activation function) a AF-2 (ligand-dependent activation function) a současně se podílí na rekrutování koaktivátoru SRC3 (koaktivátor steroidního receptoru 3). Estrogenní efekt je 10–20× slabší, než je účinek ethinylestradiolu (EE). Při podání vysokých dávek stimuluje E4 cestou ERa děložní genovou expresi, epiteliální proliferaci a vykazuje antiaterogenní účinek. E4 neovlivňuje endoteliální produkci oxidu dusnatého (NO) a neurychluje regeneraci endotelu, což jsou dva procesy závislé na membránou iniciované steroidní signalizaci (MISS). E4 antagonizuje účinky závislé na MISS E2 nejen v endotelu, ale i v buněčné linii karcinomu prsu MCF-7 (Michigan cancer foundation-7). Tímto účinkem se E4 chová jako typický selektivní modulátor estrogenových receptorů. Perspektivně je E4 zkoumán v souvislosti s autoimunitními chorobami souvisejícími s thymocyty, jako je roztroušená skleróza, revmatoidní artritida a Sjögrenův syndrom. Vzhledem k tomu, že se tato onemocnění zlepšují v průběhu gravidity, existuje hypotéza, že efektem klinického zlepšení je právě E4. Další oblasti, které jsou perspektivní pro výzkum, jsou vztah E4 a libida, atrofie tkání, migrény a kardiovaskulární morbidity u žen [12].
Jaterní metabolizmus E4 a jeho vazba na plazmatické proteiny
Při experimentu na animálním modelu je E4 velmi pomalu metabolizován jaterními buňkami, glukuronizován, sulfatizován a vylučován z organizmu. E4 je produkt konečné fáze metabolizmu, a nemá tedy žádné biologicky aktivní metabolity. Pokud je E4 ve vysoké koncentraci (10 mmol/l), neinhibuje jaterní enzymy cytochrom P450, CYP1A2, CYP2C9, CYP2C19, CYP2D6 a CYP 3A4. EE má silný inhibiční účinek na CYP3A4, E2 jej naopak stimuluje [11]. Lze tedy předpokládat, že E4 nebude na rozdíl od EE a E2 vykazovat významné interakce s jinými léky. E4 nestimuluje produkci globulinu vážícího pohlavní hormony (SHBG – sex hormone-binding globulin), a neovlivňuje tak jeho plazmatickou koncentraci. SHBG nejvíce zvyšuje E2, EE a E3 vykazují srovnatelnou stimulaci syntézy SHBG. E4 se navíc neváže na SHBG na vazebném místě pro estrogeny ani na vazebném místě pro androgeny. Testosteron a E2 mají vysokou vazebnou afinitu k SHBG, EE a E3 nižší. SHBG tedy nemá žádný vliv na distribuci E4 v plazmě, a není tudíž negativně ovlivněna jeho biologická dostupnost ve tkáních [13].
Působení E4 na kostní tkáň
Srovnání účinků E4 a EE na kostní metabolizmus bylo studováno na animálním modelu. E4 významně inhibuje odbourávání kostní tkáně. Denní dávka 2,5 mg/kg byla ekvivalentní tímto účinkem dávce 0,1 mg/kg EE. Z experimentu je možné vyvodit, že E4 působí prevenci osteoporózy a je perspektivní i pro léčbu osteoporózy a osteoporotických zlomenin [14].
Působení E4 na pochvu a dělohu
Vliv E4 na tkáně dělohy a pochvy byl testován na animálním modelu. Konkrétně byl hodnocen vliv na poševní epitel a hmotnost dělohy. E4 vede k proliferaci vaginální sliznice, endometria a zvyšuje hmotnost dělohy u experimentálních zvířat. Efekt je závislý na použité denní dávce. V porovnání s EE je tento proliferační účinek přibližně 20× slabší. Lze vyvodit závěr, že E4 je perspektivní v léčbě vulvovaginální atrofie. Proliferační efekt na endometrium je slabý, ale je třeba jej při léčbě E4 monitorovat [15].
Působení E4 na mléčnou žlázu
Pokus na zvířecím modelu srovnávající účinek E4 s tamoxifenem a EE na prsní žlázu prokázal, že experimentálně vyvolaný nádor mléčné žlázy u krysy reaguje po podání E4 podobně jako po podání tamoxifenu, tedy snížením počtu nádorů i zmenšením jejich velikosti. Tento účinek nebyl prokázán u EE. Efekt snížení počtu nádorů je závislý na dávce E4. E4 tedy působí jako selektivní modulátor estrogenových receptorů (SERM) a antagonista estrogenů a jeví se perspektivním v léčbě karcinomu prsu [16].
Působení E4 na kardiovaskulární ústrojí
Preklinický i klinický výzkum dokládá, že estrogeny modulují funkce kardiovaskulárního systému. 17b-estradiol brání ukládání lipidů do cévní stěny při experimentu na animálním modelu. Zatímco ERb hraje klíčovou roli u buněk myokardu, ERa se uplatňuje zejména svou protektivní funkcí vůči endotelu. Selektivní aktivace jaderného ERa pomocí E4 zabraňuje hypertenzi vyvolané angiotensinem II, podporuje regeneraci endotelu, a podílí se tak na prevenci aterogeneze [17]. E4 v kombinaci s progestinem nezvyšuje plazmatickou koncentraci koagulačních faktorů na rozdíl od perorálního E2 a EE. Při dlouhodobém podávání E4 laboratorním myším se prodlouží krvácivost a je omezena tvorba žilní i intraarteriální trombózy. E4 aktivuje epiteliální proliferaci cestou receptoru ERa. Na buněčném modelu s absencí ERa byla prokázána absence antitrombotického ochranného účinku E4, prodloužený čas krvácivosti však zůstal zachován [18]. E4 v kombinaci s drospirenonem (DRSP) má schopnost navodit anovulaci s minimálním vlivem na hemostatické parametry, jaterní, kostní metabolizmus a sekreci inzulinu podobných růstových faktorů ve srovnání s kombinací EE a DRSP. Ženám ve fertilním věku byla podávána kombinace E4 s DRSP nebo levonorgestrelem (LNG) v různých dávkách a poté byly hodnoceny definované metabolické parametry (plazmatické koncentrace globulin vázajícího pohlavního hormonu SHBG, lipoproteinů a triglyceridů). Kombinace E4 a DRSP i kombinace E4 a LNG ve srovnání s kombinací EE/DRSP vykazovaly jen minimální změny sledovaných parametrů. U kombinace E4 s DRSP a LNG nebyly prokázány žádné změny v plazmatické koncentraci inzulinu podobných růstových faktorů (ILGH) [19].
Perspektiva léčby deficitu estrogenů a E4
E4 byl testován v léčbě vazomotorického klimakterického syndromu. Na animálním modelu významně snižuje kožní teplotu. Účinek je závislý na použité dávce [20]. Podávání E4 v dávce 2 mg bylo komparováno s podáváním estradiol-valerátu ve stejné dávce po dobu 28 dnů. Následovala aplikace E4 v dávce 10 mg u žen s více než 35 návaly týdně a 20 a 40 mg E4 postmenopauzálním ženám po hysterektomii. Byly sledovány parametry vaginální cytologie, výskyt návalů horka a pocení a proliferace endometria. E4 ve všech aplikovaných denních dávkách vykazoval prokazatelný proliferační vliv na vaginální cytologii s nálezem zvýšení počtu superficiálních buněk. Výška endometria hodnocená ultrazvukem se zvyšovala při denní dávce 10 mg a vyšší. Snížení počtu a závažnosti návalů horka bylo pozorováno při dávkách 2 mg i 10 mg E4 a při dávce 2 mg estradiol-valerátu. E4 v dávkování 2–40 mg denně zlepšuje vaginální cytologii a redukuje výskyt vazomotorických symptomů u postmenopauzálních žen. Proliferace endometria nastává při denních dávkách 10 mg a vyšších. E4 je perspektivní v léčbě vazomotorických symptomů klimakterického syndromu a syndromu vulvovaginální atrofie [21].
Estetrolem navozená inhibice ovulace
E4 silně inhibuje sekreci LH (luteinizační hormon) a FSH (folikulostimulační hormon). Na zvířecím modelu účinně inhibuje ovulaci, a to v dávce 0,3 mg 2× denně a vyšší. V experimentu je v inhibici ovulace 18× méně účinný ve srovnání s EE. U člověka byl též prokázán ovulaci inhibující účinek E4, závislý na dávce. Anovulace je dosaženo mechanizmem centrální inhibice sekrece gonadotropinů. Hluboká a trvalá inhibice hladiny FSH trvající déle než 7 dní byla pozorována při denní dávce 100 mg E4 [22].
Kombinovaná hormonální antikoncepce a E4
Kombinovaná orální antikoncepce obsahující 15 mg E4/3 mg DRSP byla srovnávána s kombinovanou orální antikoncepcí s obsahem EE/LNG a EE/DRSP. Kombinace obsahující E4 má v šestém cyklu aplikace menší vliv na plazmatickou koncentraci gonadotropinů, plazmatická koncentrace FSH byla vyšší o 30,5 %, LH nižší o 7,5 %, u kombinace EE/LNG byly zaznamenány koncentrace FSH nižší o 84 % a LH o 90 %. U kombinace EE/DRSP se koncentrace FSH snížila o 64 % a LH o 90,0 %. Zvýšení plazmatické koncentrace kortisolu bylo u kombinace E4/DRSP o 26,0 % a u globulinu vázajícího kortisol (CGB – cortisol-binding globulin) o 40 %. Kombinace obsahující EE vykazují významně větší elevaci plazmatické koncentrace kortisolu i CBG, kombinace EE/LNG vykazuje zvýšení koncentrace kortisolu o 109 %, CBG o 152 % a kombinace EE/DRSP zvýšení kortisolu o 107 %, CBG o 140 %. Zvýšení sekrece angiotensinogenu byl u kombinace EE/DRSP o 75 %, u kombinace EE/LNG o 170 % a kombinace EE/DRSP o 206,5 %. SHBG se zvýšil u kombinace E4/DRSP o 55 %, u kombinace EE/LNG o 74 % a u kombinace EE/DRSP o 251 %. Triglyceridy se zvyšují u kombinace EE/DRSP o 24 %, EE/LNG o 28 % a EE/DRSP o 65,5 %. Kombinovaná orální antikoncepce s obsahem 15 mg E4/3 mg DRSP má příznivý metabolický profil a ovlivňuje syntézu jaterních proteinů méně než kombinovaná antikoncepce obsahující EE/LNG nebo EE/DRSP [23].
Kombinovaná orální antikoncepce s obsahem 15 mg E4/3 mg DRSP vykazuje silný inhibiční účinek na ovulaci. Během šesti cyklů nenastala ovulace ani u jednoho ze subjektů výzkumu, zatímco u kombinace EE/DRSP byla v jednom případě pozorována jedna a v dalším dvě ovulace. U většiny žen bylo Hogladnovo skóre 1, tedy žádná ovariální aktivita. Kombinace E4/DRSP ve srovnání s kombinací EE/DRSP vykazuje nižší míru suprese LH a srovnatelnou mírů suprese LH prokázanou u E2 a progesteronu [24]. Vliv kombinované orální antikoncepce s obsahem 15 mg E4/3 mg DRSP na hemokoagulační parametry byl testován stanovením endogenního trombinového potenciálu (ETP) a rezistence vůči aktivovanému proteinu C (APCR) během šesti cyklů ve srovnání s kombinovanou orální antikoncepcí s obsahem EE/LNG a EE/DRSP. Zatímco u kombinace E4/DRSP došlo k navýšení ETP o 30 %, u kombinace EE/LNG to bylo o 165 % a u kombinace EE/DRSP o 219 %. Protrombinový fragment 1+2 se zvýšil u kombinace E4/DRSP o 23 %, EE/LNG o 71 % a EE/DRSP o 64 %. SHBG se zvýšil u EE/DRSP o 55 %, u EE/LNG o 74 % a u EE/DRSP o 251 %. Studie prokazuje, že vliv kombinované orální antikoncepce na hemostázu je ovlivněn výhradně estrogenní komponentou [25]. Vliv kombinace různých dávek E4 ve výši 5 nebo 10 mg s DRSP v dávce 3 mg na plazmatickou koncentraci SHBG, angiotensinogenu a 12 dalších hemostatických markerů byl komparován s kombinací 20 μg EE s 3 mg DRSP. Vyšetření bylo provedeno 24. den podávání ve třetím cyklu. Kombinace s obsahem E4 vykazovala nižší estrogenní vliv v porovnání s kombinací s obsahem EE. Vliv na koncentraci SHBG a angiotensinogen byl u kombinace s E4 nižší o 15–20 % proti kombinaci s EE. Kombinace s E4 v dávce 5 a 10 mg redukují hladinu D-dimerů a kombinace s dávkou 5 mg E4 snižuje též protrombinový fragment 1+2 [26]. Kombinovaná orální antikoncepce s E4 je hodnocena uživatelkami vysokou mírou spokojenosti a velmi dobrou kontrolou tělesné hmotnosti. Dále byly srovnávány kombinace E4 v denní dávce 15 nebo 20 mg se 3 mg DRSP, nebo 150 μg LNG proti referenční kombinaci estradiol-valerátu s dienogestem. Nejvyšší podíl žen, které dokončily studii, byl ve skupině s kombinací 15 mg E4 se 3 mg DRSP (91,1 %) nejnižší u kombinace 20 mg E4 s LNG. Podobného výsledku bylo dosaženo v hodnocení míry spokojenosti, kdy s kombinací 15 mg E4 se 3 mg DRSP bylo spokojeno 73,1 % uživatelek a u kombinace 20 mg E4 s LNG to bylo pouze 50,6 % uživatelek. Ve skupině s kombinací 15 mg E4 se 3 mg DRSP byl i nejvyšší podíl žen ochotných pokračovat s metodou (82,1 %), ve skupině s kombinací 20 mg E4 s LNG chtělo pokračovat v metodě 58,3 % uživatelek [27].
Závěr
E4 je bezpečným hormonem se selektivní vazbou na oba estrogenové receptory a s mírnou preferencí pro receptor ERa proti ERb. Nebyla prokázána toxicita pro lidský organizmus ani při použití vysokých denních dávek 10 mg/kg po dobu 4 týdnů. Má vysokou biologickou dostupnost, a je tedy vhodný pro perorální podání. Neváže se na SHBG a má dlouhý eliminační poločas (28 hod). V dobře ověřených a prediktivních modelech potkanů se E4 chová jako agonista estrogenu ve všech vyšetřovaných tkáních (kost, vagina, myometrium, endometrium, mozek, inhibice ovulace). Ve tkáních nádoru mléčné žlázy se chová jako estrogenní antagonista. V játrech vykazuje pomalý metabolizmus, neinhibuje cytochrom P45036, a lze tedy předpokládat, že nebude interagovat s léky. Současně nestimuluje syntézu SHBG, z čehož vyplývá vysoká pravděpodobnost nízkého rizika ovlivnění hemokoagulace, a tedy i rizika hluboké žilní trombózy a plicní embolie.
Zdroje
1. Hagen AA, Barr M, Diczfalusy E. Metabolism of 17b-oestradiol-4-14C in early infancy. Acta Endocrinol 1965; 49: 207–220.
2. Fishman J, Solomon S. Metabolism, production and excretion rates of 15alpha-hydroxyestriol in late pregnancy. J Clin Endocrinol Metab 1972; 35 (3): 339–344. doi: 10.1210/jcem-35- 3-339.
3. Schut HA, Bowman JM, Solomon S. Precursor role of 15alpha-hydroxyestradiol and 15alpha-hydroxyandrostenedione in formation of estetrol. Can J Biochem 1978; 56 (2): 101–106. doi: 10.1139/o78-016.
4. Holinka CF, Diczfalusy E, Coelingh Bennink HJ. Estetrol: a unique steroid in human pregnancy. J Steroid Biochem Mol Biol 2008; 110 (1–2): 138–143. doi: 10.1016/j.jsbmb.2008.03.027.
5. Coelingh Bennink F, Holinka CF, Visser M et al. Maternal and fetal estetrol levels during pregnancy. Climacteric 2008; 11 (Suppl 1): 69–72. doi: 10.1080/13697130802056321.
6. Kundu N, Wachs M, Iverson GB et al. Comparison of serum unconjugated estriol and estetrol in normal and complicated pregnancies. Obstet Gynecol 1981; 58 (3): 276–281.
7. Sciarra JJ, Tagatz GE, Notation AD et al. Estriol and estetrol in amniotic fluid. Am J Obstet Gynecol 1974; 118 (5): 626–642. doi: 10.1016/ s0002-9378 (16) 33738-3.
8. Heikkilä J, Luukkainen T. Urinary excretion of estriol and 15alpha-hydroxyestriol in complicated pregnancies. Am J Obstet Gynecol 1971; 110 (4): 509–521. doi: 10.1016/0002-9378 (71) 90692-2.
9. Visser M, Holinka CF, Coelingh Bennink HJ. First human exposure to exogenous single-dose oral estetrol in early postmenopausal women. Climacteric 2008; 11 (Suppl 1): 31–40. doi: 10.1080/13697130802056511.
10. Coelingh Bennink HJ, Verhoeven C, Zimmerman Y et al. Pharmacokinetics of the fetal estrogen estetrol in a multiple-rising-dose study in postmenopausal women. Climacteric 2017; 20 (3): 285–289. doi: 10.1080/13697137. 2017.1291608.
11. Visser M, Foidart JM, Coelingh Bennink HJ. In vitro effects of estetrol on receptor binding, drug targets and human liver cell metabolism. Climacteric 2008; 11 (Suppl 1): 64–68. doi: 10.1080/13697130802050340.
12. Abot A, Fontaine C, Buscato M et al. The uterine and vascular actions of estetrol delineate a distinctive profile of estrogen receptor a modulation, uncoupling nuclear and membrane activation. EMBO Mol Med 2014; 6 (10): 1328–1346. doi: 10.15252/emmm.201404112.
13. Hammond GL, Hogeveen KN, Visser M et al. Estetrol does not bind sex hormone binding globulin or increase its production by human HepG2 cells. Climacteric 2008; 11 (Suppl 1): 41–46. doi: 10.1080/13697130701851814.
14. Coelingh Bennink HJ, Heegaard AM, Visser M et al. Oral bioavailability and bone-sparing effects of estetrol in an osteoporosis model. Climacteric 2008; 11 (Suppl 1): 2–14. doi: 10.1080/ 13697130701798692.
15. Heegaard AM, Holinka CF, Kenemans P et al. Estrogenic uterovaginal effects of oral estetrol in the modified Allen-Doisy test. Climacteric 2008; 11 (Suppl 1): 22–28. doi: 10.1080/ 13697130701842490.
16. Coelingh Bennink HJ, Singer C, Simoncini T et al. Estetrol, a pregnancy-specific human steroid, prevents and suppresses mammary tumor growth in a rat model. Climacteric 2008; 11 (Suppl 1): 29. doi: 10.1080/13697130802040 325.
17. Guivarc‘h E, Buscato M, Guihot AL et al. Predominant role of nuclear versus membrane estrogen receptor a in arterial protection: implications for estrogen receptor a modulation in cardiovascular prevention/safety. J Am Heart Assoc 2018; 7 (13): e008950. doi: 10.1161/JAHA. 118.008950.
18. Valéra MC, Noirrit-Esclassan E, Dupuis M et al. Effect of estetrol, a selective nuclear estrogen receptor modulator, in mouse models of arterial and venous thrombosis. Mol Cell Endocrinol 2018; 477: 132–139. doi: 10.1016/j.mce.2018.06.010.
19. Mawet M, Maillard C, Klipping C et al. Unique effects on hepatic function, lipid metabolism, bone and growth endocrine parameters of estetrol in combined oral contraceptives. Eur J Contracept Reprod Health Care 2015; 20 (6): 463–475. doi: 10.3109/13625187.2015.1068934.
20. Holinka CF, Brincat M, Coelingh Bennink HJ. Preventive effect of oral estetrol in a menopausal hot flush model. Climacteric 2008; 11 (Suppl 1): 15–21. doi: 10.1080/13697130701822807.
21. Coelingh Bennink HJ, Verhoeven C, Zimmerman Y et al. Clinical effects of the fetal estrogen estetrol in a multiple-rising-dose study in postmenopausal women. Maturitas 2016; 91: 93–100. doi: 10.1016/j.maturitas.2016.06.017.
22. Coelingh Bennink HJ, Holinka CF, Diczfalusy E. Estetrol review: profile and potential clinical applications. Climacteric 2008; 11 (Suppl 1): 47–58. doi: 10.1080/13697130802073425.
23. Klipping C, Duijkers I, Mawet M et al. Endocrine and metabolic effects of an oral contraceptive containing estetrol and drospirenone. Contraception 2021; 103 (4): 213–221. doi: 10.1016/j.contraception.2021.01.001.
24. Duijkers I, Klipping C, Kinet V et al. Effects of an oral contraceptive containing estetrol and drospirenone on ovarian function. Contraception 2021; 103 (6): 386–393. doi: 10.1016/j.contraception.2021.03.003.
25. Douxfils J, Klipping C, Duijkers I et al. Evaluation of the effect of a new oral contraceptive containing estetrol and drospirenone on hemostasis parameters. Contraception 2020; 102 (6): 396– –402. doi: 10.1016/j.contraception.2020.08.015.
26. Kluft C, Zimmerman Y, Mawet M et al. Reduced hemostatic effects with drospirenone-based oral contraceptives containing estetrol vs. ethinyl estradiol. Contraception 2017; 95 (2): 140– –147. doi: 10.1016/j.contraception.2016.08.018.
27. Apter D, Zimmerman Y, Beekman L et al. Estetrol combined with drospirenone: an oral contraceptive with high acceptability, user satisfaction, well-being and favourable body weight control. Eur J Contracept Reprod Health Care 2017; 22 (4) : 260–267. doi: 10.1080/ 13625187.2017.1336532.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2021 Číslo 3
Nejčtenější v tomto čísle
- Estetrol a možnosti jeho klinického využití
- Adenomyóza – možný vliv na funkci a receptivitu endometria
- Vrozený deficit antitrombinu a gravidita – závažný trombofilní stav ohrožující matku i plod
- Změny kvality sexuálního života po operacích pro sestup pánevních orgánů