Parazitární leiomyomy – kazuistika a rešerše článků
Parasitic leiomyoma – a case report and review of the literature
Objective: The aim of this study is to report a case of parasitic leiomyoma in a brief literature report. Case report: A 40-year-old woman was repeatedly examined for chronic abdominal pain in 2020. Lesions presented on CT images showed suspicion of carcinomatosis or endometriosis. Her past history is a laparoscopic myomectomy and hysteroscopic transcervical resection of myoma. Conclusion: Parasitic leiomyoma or leiomyomatosis peritonealis disseminata is an extremely rare variant of uterine leiomyoma occurring outside the uterus. According to the International Federation of Gynecology and Obstetric classification, parasitic leiomyoma has been classified as type 8. Previous laparoscopic myomectomy with intraperitoneal morcellation has been implicated in its etiology. The most common symptom – if present, is abdominal pain, pressure, bloating during eating or nausea.
Keywords:
parasitic leiomyoma – intraperitoneal morcellation – leiomyomatosis
Autoři:
K. Hlinecká 1
; A. Richtárová 1
; Z. Lisá 1
; D. Kužel 1
; Hanáček J. 2
Působiště autorů:
Gynekologicko-porodnická klinika 1. LF UK a VFN v Praze
1; Ústav pro péči o matku a dítě, Praha
2
Vyšlo v časopise:
Ceska Gynekol 2021; 86(6): 400-405
Kategorie:
Kazuistika
doi:
https://doi.org/10.48095/cccg2021400
Souhrn
Cíl: Prezentace pacientky s diagnózou parazitární leiomyomatózy, shrnutí současných poznatků o výskytu, terapii a diagnostice. Kazuistika: 40letá žena s anamnézou laparoskopické myomektomie a hysteroskopické transcervikální resekce myomu. Pacientka byla opakovaně vyšetřována pro bolesti břicha. Dle CT břicha a pánve vyslovena suspekce na metastatická ložiska tumoru neznámého origa či ložiska endometriózy. Závěr: Diseminovaná peritoneální leiomyomatóza a parazitární leiomyomy jsou vzácné intraabdominální tumory, nomenklaturně řazené pod typ 8 dle systému Mezinárodní federace gynekologů a porodníků. S plošným užíváním power morcelace v endoskopické operativě jejich incidence v posledních letech stoupá. Parazitární leiomyomy či diseminovná peritoneální leiomyomatóza je většinou diagnostikována u mladých žen s anamnézou předchozí laparoskopické myomektomie. Klinicky se manifestují intraabdominální bolestí, tlakem, nadýmáním či nevolností.
Klíčová slova:
parazitární leiomyomy – intraperitoneální morcelace – leiomyomatóza
Úvod
Parazitární leiomyomy (LP) jsou vzácné intraabdominální tumory. S rostoucím počtem laparoskopicky provedených myomektomií a používáním elektrického morcelátoru jejich incidence v posledních letech stoupá. Nejrizikovější skupinou, stran této diagnózy, jsou právě ženy s anamnézou laparoskopické myomektomie s využitím intraperitoneální morcelace. Parazitární myomy byly popsány i u žen bez jakékoli předchozí operace. V dostupné literatuře je však uvedeno pouhých 30 případů [1,2]. Patogeneze jejich vzniku není zcela objasněna, předpokládá se de novo vznik z myoblastů pánevní mezenchymální tkáně [3]. Právě zvýšené riziko diseminace buněk myometria i endometria vedlo roku 2014 americkou FDA (Food and Drug Administration) k vydání dokumentu, který varuje před plošným využitím intraperitoneální power morcelace. Kromě zhoršení prognózy, v případě morcelace maligního tumoru bez použití saku, byly publikovány také případy vzniku parazitárního myomu, peritoneální adenomyózy či leiomyomatózy [4,5]. Morcelací preparátu jsou drobné fragmenty myomů diseminovány intraperitoneálně. Ty pak mohou, za vhodných podmínek, vytvořit implantáty s neovaskularizací, postupně se zvětšovat a růst [6–8]. Klinicky se manifestují progredující intraabdominální bolestí, tlakem, nadýmáním či nevolností. V případě anamnézy předchozí myomektomie je tedy při stanovování diagnózy velmi důležité myslet i na možnost parazitární leiomyomatózy. Dle klasifikace (0–8) Mezinárodní federace gynekologů a porodníků (FIGO – International Federation of Gynecology and Obstetrics) se parazitární myomy řadí do skupiny 8.
Kazuistika
Dosud zdravá žena, 40 let, byla opakovaně vyšetřována na chirurgické a gynekologické ambulanci pro chronické bolesti břicha. Pacientka udávala intenzivní bolesti břicha tupého charakteru, které progredovaly během posledních 2 let. Pravidelná analgetická terapie byla bez adekvátní odezvy. Bolest lokalizovala do levého hypogastria s propagací do levé dolní končetiny. Charakter bolesti byl kontinuální, bez závislosti na poloze, pohybu a činnosti. Dyschezie, dysurie, dyspareunie či dysmenoreu negovala, menstruační cyklus udávala pravidelný. Pacientka v minulosti podstoupila dvě laparoskopické myomektomie s intraadominální morcelací, dvě diagnostické laparoskopie, dvě hysteroskopické transcervikální resekce myomu (TCRM) a jeden císařský řez. Poslední laparoskopická myomektomie byla provedena před 5 lety.
Při fyzikálním vyšetření byla v levém hypogastriu, v místě největší bolestivosti, hmatná cca 2–3 cm tuhá, volně pohyblivá rezistence. Při palpačním gynekologickém vyšetření byla popsána myomatózně zvětšená děloha s dominantním 5cm myomem ze zadní stěny, okolí bez patologického nálezu.
Laboratorní vyšetření ukázalo elevaci CA 125 až 60,6 kIU/l, ostatní laboratorní parametry byly negativní.
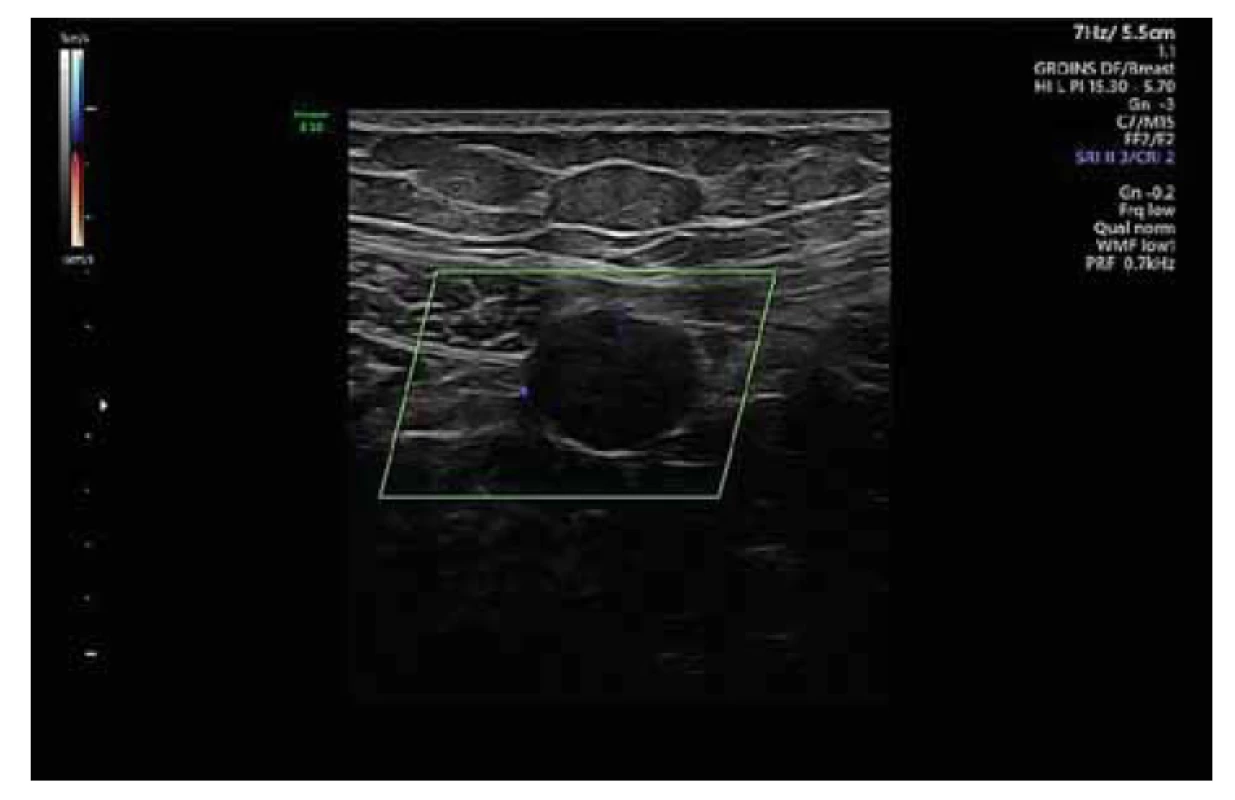
Primární zobrazovací vyšetření provedené již na chirurgické ambulanci, CT s kontrastem, vyjádřilo podezření na ložiska endometriózy či primární tumor neznámého origa. Na vstupním CT bylo popsáno výrazně se sytící ložisko zadní stěny dělohy velikosti 45 x 58 x 47 mm nativně denzit 40 HU, postkontrastně 150, dále stejně se sytící ložisko imprimující do stěny břišní vlevo velikosti 20 mm mezi přímým a šikmým břišním svalem, ložisko 12 mm těsně u pravého ovaria, dvě drobná sytící se ložiska při lienální flexuře a ložisko v oblasti rektosigmoidea do 5 mm, dalších několik drobných ložisek v tukové tkáni (obr. 1). Pacientka byla referována k expertnímu onkogynekologickému ultrazvukovému vyšetření, které popsalo subserózní (SS) myom na zadní stěně dělohy celkové velikosti 47 x 57 x 48 mm, deformující dutinu děložní, barevná škála (CS – color scale) 3 (obr. 2). Při pravém ovariu dobře ohraničený homogenní kulovitý útvar 11 x 7 x 10 mm, CS 3. V levém hypogastriu cca 2cm od předchozí minilaparotomie (po morcelátoru) hypoechogenní, dobře ohraničené retroperitoneálně uložené ložisko 17 x 13 x 17 mm, CS 2 (obr. 3).
Fig. 1. CT finding of parasitic leiomyoma located retroperitoneally
between the rectus abdominus and the oblique abdominal
muscle.
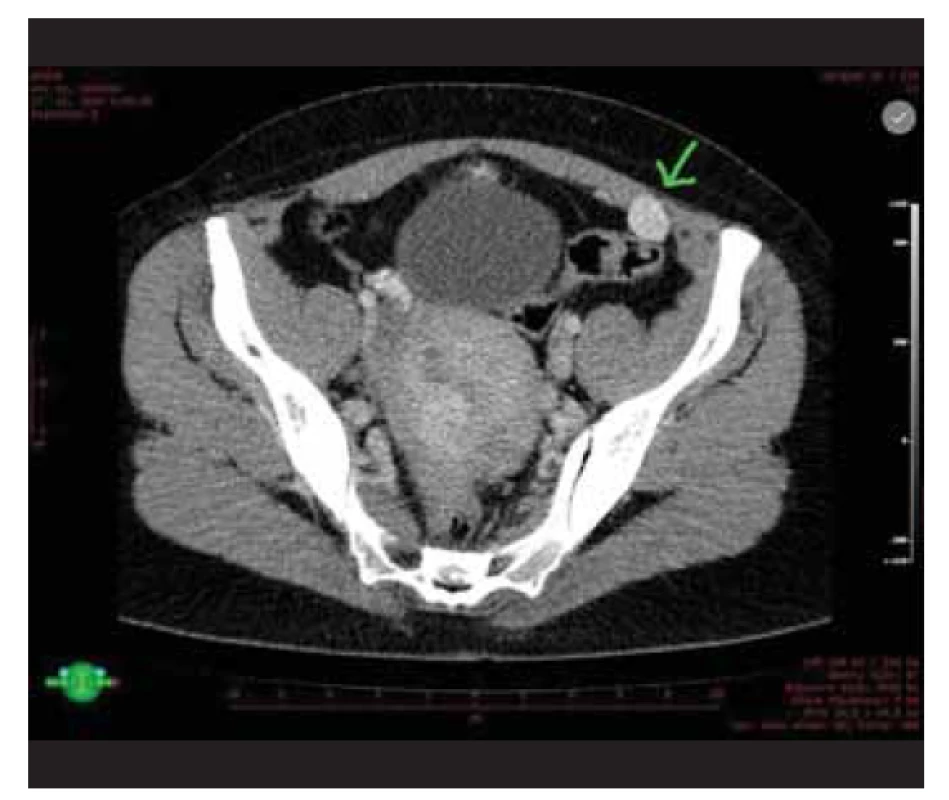
Fig. 2. Ultrasound finding of subserous fibroids with more
pronounced blood supply, color scale 3.
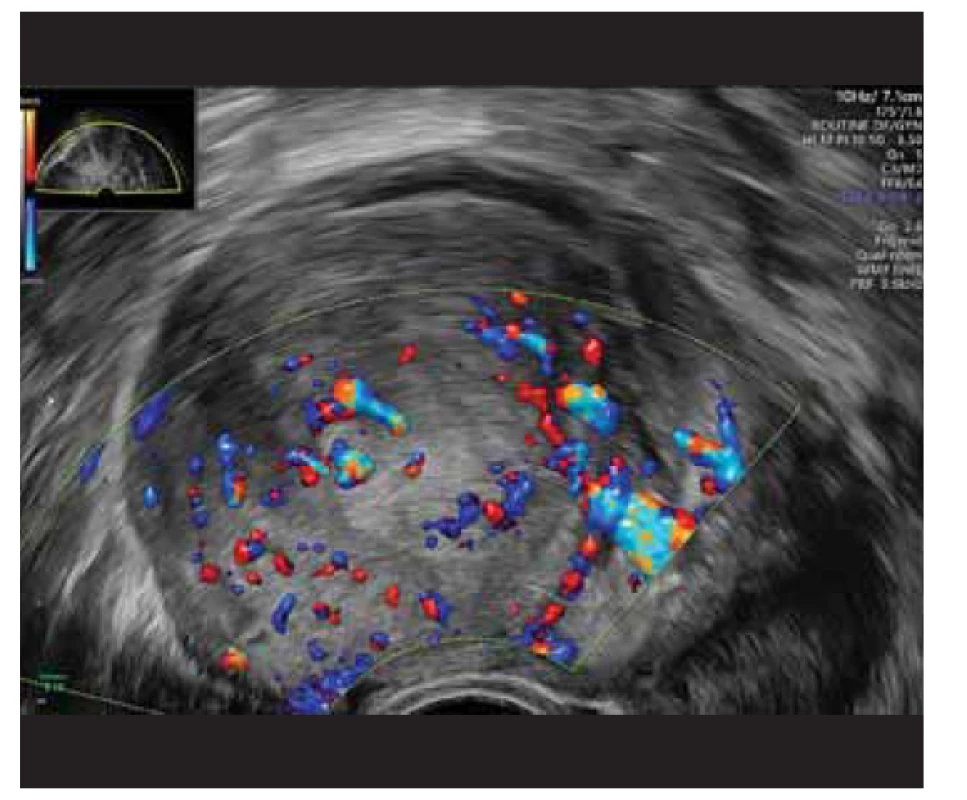
Fig. 3. Ultrasound finding of parasitic leiomyoma located retroperitoneally
between the rectus abdominus and the oblique abdominal muscle.
Pacientka byla konzultována v rámci endoskopického týmu ve spolupráci s onkogynekologickým týmem a chirurgy. S přihlédnutím k přání pacientky, která preferovala fertilitu zachovávající výkon, byla primárně referována k laparoskopické reintervenci. Peroperačně in situ: děloha s dominantním 5cm SS/IM myomem ze ZS více vlevo, dále 2cm parazitární myom v oblasti předchozího vpichu portu v levém hypogastriu, 1cm parazitární myom při pravém ovariu a drobné implantační myomky v oblasti céka. Peroperační nález odpovídal CT i sonografickému zobrazovacímu vyšetření. Během operace byla provedena kompletní adheziolýza a enukleace všech myomů. Myomy byly extrahovány v endobagu, aby se předešlo dalšímu potenciálnímu rozsevu tkáně. Výkon proběhl bez komplikací. Pacientka byla následující den propuštěna do domácí péče. Histopatologické vyšetření definitivně potvrdilo diagnózu leiomyomu běžného histologického typu.
Diskuze
Laparoskopická myomektomie, hysterektomie a použití intraperitoneální morcelace se stává běžně dostupnou a používanou metodou. Jak již bylo uvedeno, malé fragmenty myometria a také endometria, které nejsou peroperačně detekovatelné, mohou být rozsety během morcelace po dutině břišní, což může vést k tvorbě implantátů, jejich neovaskularizaci a následnému růstu. Cévní zásobení těchto myomů je zajištěno z omenta či mezenteriálních cév [9]. Incidence parazitárních myomů rezultující z provedené laparoskopické myomektomie je udávána mezi 0,2 a 1,25 %. Průměrná doba stanovení diagnózy od primární operace je 48 měsíců [10–13]. Parazitární myomy se nejčastěji objevují na povrchu peritonea malé pánve, močového měchýře, tenkého střeva, rekta, céka a v oblasti zavedených portů [7,13]. Většina pacientek je asymptomatických a parazitární myomy jsou u nich pouze vedlejším perioperačním nálezem při výkonu z jiné indikace. Symptomatické pacientky si nejčastěji stěžují na zhoršující se chronickou bolest v podbřišku, pocity tlaku a intraabdominální distenze [13]. I z naší kazuistiky vyplývá, že určení diagnózy není vždy jednoduché a jednoznačné a je potřeba na ni, zejména v rizikové skupině pacientek, pomýšlet. V rámci diagnostického postupu je jasnou metodou první volby expertní ultrasonografické vyšetření. K upřesnění lokalizace a vztahu tumoru k okolí můžeme doplnit magnetickou rezonanci (MRI – magnetic resonance imaging) [14]. Pokud je na základě výsledků zobrazovacích vyšetření vysloveno podezření na maligní leiomyosarkom, je primárním operačním přístupem laparotomie, jinak se snažíme, s ohledem na lokalizaci a velikost tumoru, volit miniinvazivní laparoskopický přístup. K odstranění odoperované tkáně by v případě laparoskopie měla být použita tzv. in-bag morcelace.
Abychom předešli vzniku parazitárních myomů, je důležitá pečlivá explorace dutiny břišní po provedení morcelace a pečlivé odstranění zbylých fragmentů děložní tkáně jak myometria, tak endometria. Gasper et al provedli retrospektivní analýzu dat 423 žen po laparoskopické myomektomii s využitím intraabdominální morcelace. Prevalence výskytu LP byla 0,9 [15]. Až do roku 2014, kdy FDA na základě rozsevu buněk leiomyosarkomu při intraperitoneální morcelaci zakázala její použití, byla intraabdominální morcelace metodou volby při vybavení odoperované tkáně [16]. Po vydání tohoto prohlášení byl zaznamenán větší návrat k otevřené operativě [17]. V současnosti však existují studie, které detekují buňky leiomyomu ve výplachu dutiny břišní jak před provedením laparotomické myomektomie, tak i po ní [18]. Taktéž byly přítomny po laparoskopické myomektomii s využitím in-bag morcelace [19]. Yu et al ve své recentní studii prokazují, že hojný výplach dutiny břišní až 3 l fyziologického roztoku po morcelaci signifikantně snižuje množství diseminovaných buněk, a tím riziko vzniku parazitárního leiomyomu [20].
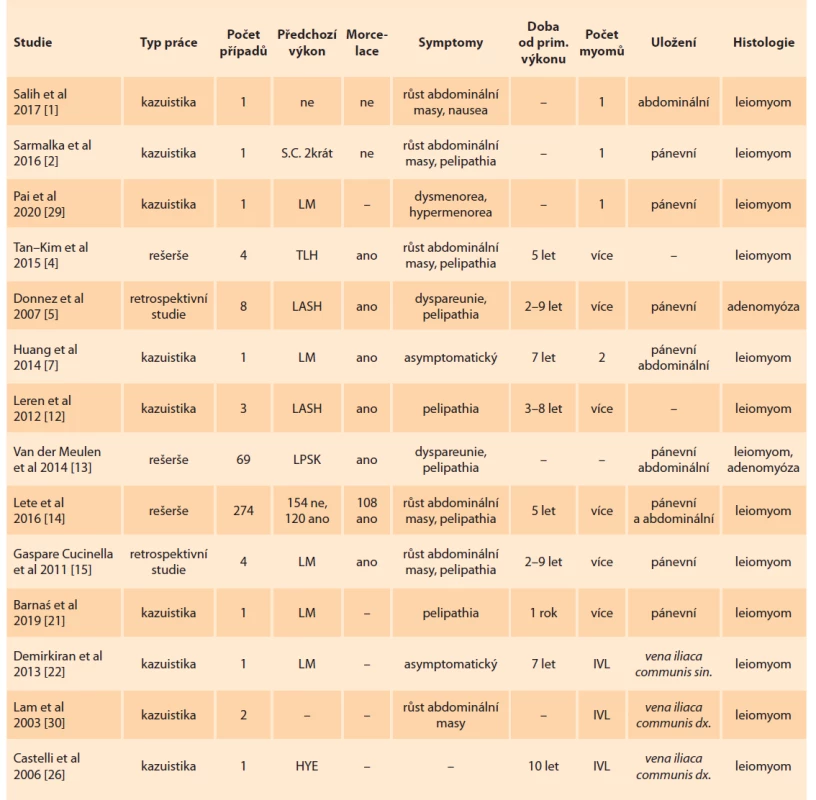
V roce 2019 publikovali Barnaś et al zajímavou kazuistiku, kde popsali parazitární leiomyom lokalizovaný intravenózně intra vena cava inferior. Čtyřiatřicetiletá pacientka byla v letech 2014–2018 opakovaně operována pro myomatózu s použitím otevřené intraperitoneální morcelace. Rok po první operaci byla pacientka vyšetřena pro bolesti břicha, dle výsledku CT byla vyslovena suspekce na parazitární leiomyomatózu v levých parametriích. Pacientka podstoupila operaci, kde bylo peroperačně odstraněno 32 myomů, jeden z těchto myomů se nacházel intravenózně. Po 13 měsících se u pacientky opět objevila bolest břicha, kde CT vyšetření prokázalo výskyt tumoru v levých parametriích. Při dalším operačním řešení bylo odstraněno 132 myomů. Měsíc po laparotomii byl proveden follow-up CT scan, kde byl zjištěn útvar uvnitř vena cava inferior. Pacientka byla referována na kardiochirurgii, kde excidovali intravenózní tumor. Histologicky byl potvrzen benigní leiomyom [21]. Diagnóza intravenózní leiomyomatózy (IVL) je velmi obtížná. Incidence výskytu je nízká, do roku 2018 bylo zaznamenáno pouze 300 případů [22]. První záznam pochází z roku 1896 [23]. Etiopatogeneze IVL není zcela objasněna, existují různé názory. Norris a Parmley podrobně popsali diagnostická kritéria IVL. Dle jejich názoru vznikají parazitární leiomyomy ze stěny intramyometrálních vén nebo neobvyklou invazí buněk leiomyomů intravazálně [24]. V literárních zdrojích se uvádí, že více než 50 % intravenózních leiomyomů vznikne diseminací nádorových buněk do uterinních a interních ilických cév, u 25 % do ovarických vén [25]. Dle Castelli et al může LP vena cava inferior vzácně zasahovat až k srdci [26]. IVL může vést k postupné okluzi cév a je spojena s vysokou mortalitou. I přes benignitu tumoru totiž může expandovat do vena cava inferior, pravé srdeční komory a pulmonálních cév [27]. Tato expanze IVL do pravé komory je označována jako intrakardiální leiomyomatóza (ICL – intracardiac leiomyomatosis). Je to vzácná forma IVL a může vést k srdeční blokádě a smrti [28]. I přes vzácnost této diagnózy je jistě důležité mít na paměti její existenci a závažnost. Přehled literatury zaměřené na diagnózu LP a diseminované peritoneální leiomyomatózy (LPD – leiomyomatosis peritonealis disseminata) je uveden v tab. 1 [1,2,4,5,7,12–15,21,22,26, 29,30].
Tab. 1. Review of the literature dealing with the diagnosis of parasitic leiomyomas and disseminated peritoneal
leiomyomatosis.
Závěr
Parazitární leiomyomy jsou vzácnou pozdní komplikací laparoskopické operativy s využitím intraperitoneální morcelace. Mohou se ale vyskytnout i u žen bez předchozí operace. Je na ně třeba pomýšlet zejména u pacientek s anamnézou gynekologického výkonu. Vzhledem k absenci jasných symptomů, často atypické lokalizaci tumorů a obtížnější diagnostice patří tyto pacientky do péče specializovaného pracoviště. Tyto tumory snižují kvalitu života pacientek a v případě cévního růstu mohou i přes svou benignitu pacientku ohrozit až na životě. Vzhledem k rozsahu nálezu, uložení, počtu a povaze tumoru je důležité pečlivě zvážit operační přístup a event. konzultovat chirurga. U primárních výkonů pro děložní myomatózu s využitím morcelace je důležitá důsledná revize dutiny břišní a její dostatečný výplach v závěru operace s důrazem na odstranění veškerých fragmentů potenciálně rozseté tkáně. Vždy je vzhledem k předoperačním zobrazovacím metodám a peroperačnímu nálezu vhodné zvážit tzv. in-bag morcelaci.
Doručeno/Submitted: 16. 10. 2021
Přijato/Accepted: 22. 10. 2021,
MUDr. Kristýna Hlinecká
Gynekologicko-porodnická klinika,1. LF UK a VFN v Praze
Apolinářská 18
128 00 Praha 2
Publikační etika: Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Publication ethics: The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Konflikt zájmů: Autoři deklarují, že v souvislosti s předmětem studie/ práce nemají žádný konflikt zájmů.
Conflict of interests: The authors declare they have no potential conflicts of interest concerning the drugs, products or services used in the study.
Zdroje
1. Salih AM, Kakamad FH, Dahat AH et al. Parasitic leiomyoma: a case report with literature review. Int J Surg Case Rep 2017; 41: 33–35. doi: 10.1016/j.ijscr.2017.10.003.
2. Sarmalkar M, Nayak A, Singh N et al. A rare case of primary parasitic leiomyoma mimicking as ovarian mass: a clinical dilemma. Int J Reprod Contracept Obstet Gynecol 2016 2016; 5 (2): 545–548. doi: 10.18203/2320-1770.ijrcog20160409.
3. Pai AH, Yen CF, Lin SL. Parasitic leiomyoma. Gynecol Minim Invasive Ther 2020; 9 (2): 108–109. doi: 10.4103/GMIT.GMIT_35_20.
4. Tan-Kim J, Hartzell KA, Reinsch CS et al. Uterine sarcomas and parasitic myomas after laparoscopic hysterectomy with power morcellation. Am J Obstet Gynecol 2015; 212 (5): 594.e1 –594.e10. doi: 10.1016/j.ajog.2014.12.002.
5. Donnez O, Squifflet J, Leconte I et al. Posthysterectomy pelvic adenomyotic masses observed in 8 cases out of a series of 1,405 laparoscopic subtotal hysterectomies. J Minim Invasive Gynecol 2007; 14 (2): 156–160. doi: 10.1016/j.jmig.2006.09.008.
6. Pereira N, Buchanan TR, Wishall KM et al. Electric morcellation-related reoperations after laparoscopic myomectomy and nonmyomectomy procedures. J Minim Invasive Gynecol 2015; 22 (2): 163–176. doi: 10.1016/j.jmig.2014.09.006.
7. Huang PS, Chang WC, Huang SC. Iatrogenic parasitic myoma: a case report and review of the literature. Taiwan J Obstet Gynecol 2014; 53 (3): 392–396. doi: 10.1016/j.tjog.2013.11.007.
8. Kotani Y, Tobiume T, Fujishima R et al. Recurrence of uterine myoma after myomectomy: open myomectomy versus laparoscopic myomectomy. J Obstet Gynaecol Res 2018; 44 (2): 298–302. doi: 10.1111/jog.13519.
9. Brody S. Parasitic fibroid. Am J Obstet Gynecol 1953; 65 (6): 1354–1356. doi: 10.1016/0002- 9378 (53) 90380-9.
10. Tulandi T, Leung A, Jan N. Nonmalignant sequelae of unconfined morcellation at laparoscopic hysterectomy or myomectomy. J Minim Invasive Gynecol 2016; 23 (3): 331–337. doi: 10.1016/j.jmig.2016.01.017.
11. Cohen A, Tulandi T. Long-term sequelae of unconfined morcellation during laparoscopic gynecological surgery. Maturitas 2017; 97: 1–5. doi: 10.1016/j.maturitas.2016.11.007.
12. Leren V, Langebrekke A, Qvigstad E. Parasitic leiomyomas after laparoscopic surgery with morcellation. Acta Obstet Gynecol Scand 2012; 91 (10): 1233–1236. doi: 10.1111/j.1600-0412.2012.01453.x.
13. Van der Meulen JF, Pijnenborg JM, Boomsma CM et al. Parasitic myoma after laparoscopic morcellation: a systematic review of the literature. BJOG 2016; 123 (1): 69–75. doi: 10.1111/1471-0528.13541.
14. Lete I, González J, Ugarte L et al. Parasitic leiomyomas: a systematic review. Eur J Obstet Gynecol Reprod Biol 2016; 203: 250–259. doi: 10.1016/j.ejogrb.2016.05.025.
15. Cucinella G, Granese R, Calagna G et al. Parasitic myomas after laparoscopic surgery: an emerging complication in the use of morcellator? Description of four cases. Fert Steril 2011; 96 (2): e90–e96. doi: 10.1016/j.fertnstert.2011.05.095.
16. Levitz J. Fibroid Surgery Puts Doctor Fighting Cancer Diagnosis in Spotlight. The Wall Street Journal, 19.12. 2013. 2013 [online]. Available from: https: //www.wsj.com/articles/fibroid-surgery-puts-doctor-fighting-cancer-diagnosis-in-spotlight-1387457121.
17. Odejinmi F, Aref-Adib M, Liou N et al. Rethinking the issue of power morcellation of uterine fibroids: is morcellation the real problem or is this another symptom of disparity in healthcare provision? In Vivo 2019; 33 (5): 1393–1401. doi: 10.21873/invivo.11616.
18. Sandberg EM, van den Haak L, Bosse T et al. Disseminated leiomyoma cells can be identified following conventional myomectomy. BJOG 2016; 123 (13): 2183–2187. doi: 10.1111/1471-0528.14265.
19. Takeda A, Tsuge S, Shibata M et al. Identification of leiomyoma cell sheets in peritoneal washings retrieved by an intraoperative red blood cell salvage device during laparoscopic-assisted myomectomy with in-bag manual tissue extraction: a pilot study. J Minim Invasive Gynecol 2018; 25 (7): 1266–1273. doi: 10.1016/j.jmig.2018.03.026.
20. Yu SP, Lee BB, Han MN et al. Irrigation after laparoscopic power morcellation and the dispersal of leiomyoma cells: a pilot study. J Minim Invasive Gynecol 2018; 25 (4): 632–637. doi: 10.1016/j.jmig.2018.01.027.
21. Barnaś E, Raś R, Skręt-Magierło J et al. Natural history of leiomyomas beyond the uterus. Medicine (Baltimore) 2019; 98 (25): e15877. doi: 10.1097/md.0000000000015877.
22. Demirkiran F, Sal V, Kaya U et al. Intravenous leiomyoma with extension to the heart: a case report and review of the literature. Case Rep Obstet Gynecol 2013; 2013: 602407. doi: 10.1155/2013/602407.
23. Förster A. Lehrbuch der pathologischen anatomie. Jena: Fridrich Mauke 1896.
24. Norris HJ, Parmley T. Mesenchymal tumors of the uterus. V. Intravenous leiomyomatosis. A clinical and pathologic study of 14 cases. Cancer 1975; 36 (6): 2164–2178. doi: 10.1002/cncr. 2820360935.
25. Lam PM, Lo KW, Yu MY et al. Intravenous leiomyomatosis: two cases with different routes of tumor extension. J Vasc Surg 2004; 39 (2): 465–469. doi: 10.1016/j.jvs.2003.08.012.
26. Castelli P, Caronno R, Piffaretti G et al. Intravenous uterine leiomyomatosis with right heart extension: successful two-stage surgical removal. Ann Vasc Surg 2006; 20 (3): 405–407. doi: 10.1007/s10016-006-9024-0.
27. Li B, Chen X, Chu YD et al. Intracardiac leiomyomatosis: a comprehensive analysis of 194 cases. Interact Cardiovasc Thorac Surg 2013; 17 (1): 132–138. doi: 10.1093/icvts/ivt117.
28. Shi T, Shkrum MJ. A case report of sudden death from intracardiac leiomyomatosis. Am J Forensic Med Pathol 2018; 39 (2): 119–122. doi: 10.1097/paf.0000000000000377.
29. Pai AH, Yen CF, Lin SL. Parasitic leiomyoma. Gynecol Minim Invasive Ther 2020; 9 (2): 108–109. doi: 10.4103/gmit.Gmit_35_20.
30. Lam PM, Lo KW, Yu MM et al. Intravenous leiomyomatosis with atypical histologic features: a case report. Int J Gynecol Cancer 2003; 13 (1): 83–87. doi: 10.1136/ijgc-00009577200301000-00015.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2021 Číslo 6
Nejčtenější v tomto čísle
- Úloha mikrobiomu v těhotenství
- Srovnání využití dinoprostonu, misoprostolu a amniotomie při indukci vaginálního porodu
- Rekonstrukce prsou u pacientek s BRCA mutací a karcinomem prsu – náš přístup
- Covid-19 jako rizikový faktor intrauterinního úmrtí plodu
