Nová kombinovaná perorální antikoncepce obsahující estetrol: přehledový článek evropského panelu odborníků
Autoři:
Kristina Gemzell-Danielsson 1; Angelo Cagnacci 2; Nathalie Chabbert-Buffet 3; Jonathan Douxfils 4; Jean-Michel Foidart 5; Ali Kubba 6; Luis Ignacio Lete Lasa 7; Diana Mansour 8; Joseph Neulen 9; Jaoquim Neves 10; Fátima Palma 11; Thomas Römer 12; Robert Spaczy Ski 13; Vera Tóth 14
Působiště autorů:
Department of Women’s and Children’s Health, Karolinska Institutet and Karolinska University Hospital Solna, Stockholm, Sweden
1; IRCCS-Policlinic Hospital San Martino, Obstetrics and Gynecology Unit, University of Genoa, DINOGMI, Genoa, Italy
2; Service de gynécologie obstétrique, médecine de la reproduction, APHP Sorbonne Université, Site Tenon, Paris, France
3; Department of Pharmacy, Namur Thrombosis and Hemostasis Center, Namur Research Institute for LIfe Sciences, University of Namur, Namur, Belgium, Qualiblood s. a., Namur, Belgium
4; Estetra SRL, an affiliate company of Mithra Pharmaceuticals, University of Liège, Liège, Belgium
5; Department of Obstetrics And Gynaecology, Guy’s and St Thomas’ NHS Foundation Trust, London, UK
6; Obstetrics and Gynecology Clinical Management Unit, Araba University Hospital, Vitoria, Spain
7; Department of Obstetrics And Gynaecology, Newcastle upon Tyne Hospitals NHS Foundation Trust, Newcastle upon Tyne, UK
8; Klinik für Gynäkologische Endokrinologie und Reproduktionsmedizin, RWTH Aachen, Aachen, Germany
9; Hospital de Santa Maria, Centro Hospitalar Universitário Lisboa Norte, Lisbon, Portugal
10; Department of Obstetrics, Maternidade Alfredo da Costa, Centro Hospitalar Universiário Lisboa Central, Lisbon, Portugal
11; Department of Obstetrics and Gynecology, Academic Hospital of Obstetrics and Gynecology, University of Cologne, Cologne, Germany
12; Klinika Niepłodności I Endokrynologii Rozrodu Uniwersytet Medyczny im. Karola Marcinkowskiego ul, Polna, Poznań, Poland
13; Medical Information Scientifi c Service, Gedeon Richter Plc, Budapest, Hungary
14
Vyšlo v časopise:
Ceska Gynekol 2022; 87(6): 440-452
Kategorie:
Přehledový článek
doi:
https://doi.org/10.1080/ 13625187.2022.2093850
Souhrn
Cíl: Navzdory značným pokrokům s nedávno vyvinutými formami kombinované perorální antikoncepce (COC – combined oral contraceptive), které vedly ke sníženému výskytu nežádoucích příhod při plném zachování antikoncepční účinnosti, zájem o další inovace přetrvává. Materiály a metody: Nový typ COC kombinuje přirozený estrogen estetrol (E4) a gestagen drospirenon (DRSP). Evropský panel odborníků hodnotil farmakologické vlastnosti, účinnost, bezpečnost a snášenlivost této kombinace. Zjištění jsou prezentována formou přehledového článku. Výsledky: Kombinace 15 mg E4/3 mg DRSP v režimu 24+4 představuje účinnou antikoncepci s dobrou regulací cyklu, charakterizovanou pravidelným krvácením a minimálním neplánovaným krvácením, a stejně tak i dobrým bezpečnostním profilem. Spojován je s vysokou spokojeností uživatelek, dobrým zdravotním stavem a minimálními změnami tělesné hmotnosti. Účinky na endokrinní a metabolické parametry jsou omezeny a kombinace má též omezený vliv na jaterní funkce a metabolizmus lipidů a sacharidů. Na hemostatické parametry má menší vliv než porovnatelná léčiva s obsahem 20 µg etinylestradiolu (EE) /3 mg DRSP a 30 µg EE/150 µg levonorgestrelu. Závěr: Kombinace 15 mg E4/3 mg DRSP poskytuje bezpečnou a účinnou antikoncepci s vysokou mírou spokojenosti uživatelek a předvídatelným krvácením. Další výzkum se bude věnovat hodnocení dlouhodobé bezpečnosti COC.
Klíčová slova:
krvácení – drospirenon – estetrol – kombinovaná perorální antikoncepce – antikoncepční účinnost – spokojenost – bezpečnostní profil
Úvod
Kombinovanou perorální antikoncepci (COC – combined oral contraceptive) užívají ženy po celém světe již déle než 60 let, přičemž za tuto dobu bylo dosaženo řady pokroků vedoucích ke snížení počtu nežádoucích příhod při zachování antikoncepční účinnosti [1,2]. Mezi ně patří snížení dávek estrogenu a gestagenu, nahrazení novými estrogeny, využití selektivnějších gestagenů a úprava dávkovacích schémat [1]. Navzdory těmto pokrokům se při používání COC objevují problémy, vč. zvýšeného rizika vzácných, avšak závažných zdravotních problémů, například venózního tromboembolizmu (VTE) a rakoviny prsu [2] a nahlášených nežádoucích účinků, které negativně ovlivňují kvalitu života žen – bolesti hlavy, změny nálad či neočekávané krvácení [2]. Regulační orgány, jako například Evropská léková agentura, však konstatovaly, že pro většinu žen výhody COC nadále převyšují rizika [3] a přetrvává zde zájem o vývoj nových typů COC, které mohou poskytnout uspokojivou antikoncepční účinnost, zlepšení snášenlivosti, dobrou regulaci cyklu a méně časté či méně závažné nežádoucí účinky. Kombinace estradiolvalerátu s dienogestem (E2V/DNG) a estradiolu s nomegestrol-acetátem (E2/NOMAC) uvedené na trh v letech 2009 a 2011 představují novou třídu COC, kdy je etinylestradiol (EE) [4,5] nahrazen přirozeným estrogenem za příznivého ovlivnění hemokoagulace [6] a výskytu VTE [7].
Tento přehledový článek shrnuje diskuze mezinárodních odborníků z celé Evropy na setkání v prosinci 2020 o vývoji nové COC složené z estetrolu (E4), estrogenu tvořeného výhradně v játrech plodu a syntetizovaného z rostlinného zdroje, a gestagenu drospirenonu (DRSP). Článek vychází z přehledu literatury, znalostí a zkušeností autorů.
Estetrol: první přirozený (nativní) estrogen se selektivním účinkem na tkáně (NEST – native estrogen with selective tissue activity)
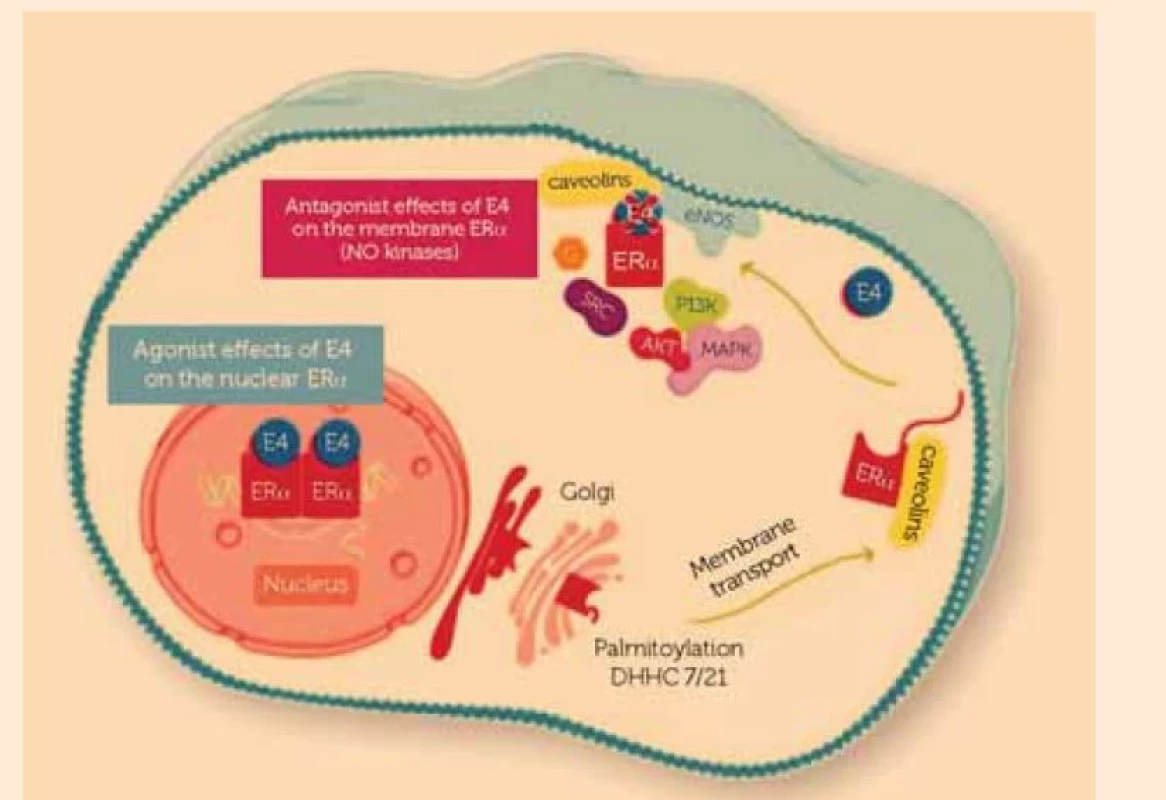
Estetrol (E4) je přirozený estrogen tvořený během těhotenství [8], jenž byl objeven roku 1965 dr. Diczfalusym et al v Karolinska Institute ve Stockholmu [9]. E4 (obr. 1b) se primárně vyskytuje u těhotných žen [10]. Tvoří se v játrech plodu, přechází přes placentu a lze jej detekovat v matčině krvi i moči počínaje 19. týdnem těhotenství [9,10]. Působí unikátním způsobem odlišným od jiných estrogenů. E4 se vysoce selektivně váže na lidské estrogenové receptory (ER) a a b, má 5krát vyšší vazebnou afinitu na ERa v porovnání s ERb, přičemž afinita na receptory je v porovnání s estradiolem (E2) asi 6 % [11]. Na obr. 2 je znázorněna diferenciální aktivita E4 na jaderném a membránovém ERa, jinými slovy aktivace jaderného ERa a inhibice membránového ERa, které vedou ke specifickým jevům v různých tkáních, vč. tkáně prsu, proto je E4 označován jako první přirozený estrogen se selektivním účinkem na tkáně (NEST) [10]. E4 jako agonista jaderného ERa prokazuje intenzivní estrogenovou aktivitu in vitro i in vivo na epitelu pochvy, děložní sliznici, v kostech, mozku a krevních cévách, na něž má příznivé účinky [10,12–16]. V modelu osteoporózy u potkanů měl E4 příznivé účinky na minerální denzitu kostí (BMD – bone mineral density), mineralizaci obratlových těl L3–L5, odolnost vůči biomechanickému poškození a hladinu osteokalcinu v plazmě [15]. U ovarektomovaných potkaních samic léčených E4 vzrostla hladina alopregnanolonu a b-endorfinů a pozorovány byly změny v některých oblastech mozku [17,18]. Při dlouhodobém podávání se u myší prodloužil tail-bleeding čas, přičemž byly současně chráněny před arteriální a venózní trombózou in vivo. Léčba E4 navíc zpomalila tvorbu krevních sraženin v arteriích. Venózní a arteriální antitrombotické vlastnosti E4 jsou zprostředkovány receptory ERa přítomnými v hematopoetických buňkách a jsou ověřeny v různých modelech u myší [19]. V první fázi klinického zkoušení ve skupině zdravých postmenopauzálních žen zlepšil E4 cytologický nález s postupnou změnou parabazálních na povrchové buňky a snížil frekvenci návalů horka a pocení [16]. E4 má navíc omezený vliv na játra, metabolizmus jater a hemostatické, koagulační a fibrinolytické parametry [10,13,20–22] (viz. níže v odstavci E4 v kombinaci s DRSP: bezpečnostní profil). V mechanizmu účinku se E4 liší od selektivních modulátorů estrogenových receptorů (SERM) [10,12–14,23] a jeho vlastnosti naznačují, že bude působit jako NEST [24] s méně závažnými vedlejšími účinky než tamoxifen (návaly horka, nevolnost, hypertenze, tromboembolické příhody) [24–28].
Fig. 1. Chemical structures of (a) ethinyl oestradiol, (b) estetrol, (c) progesterone,
and (d) drospirenone.
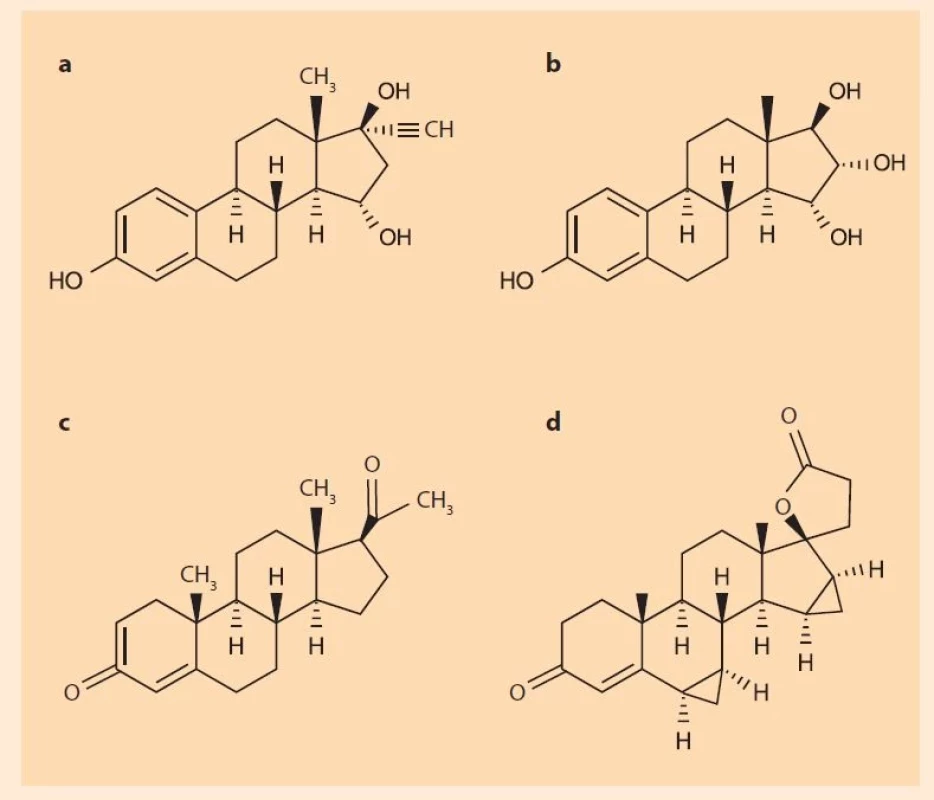
Fig. 2. Estetrol (E4) has a distinctive profile of oestrogen receptor alpha (ERα) activation.
E4 activates the nuclear ERα and inhibits/antagonises the activity of the
membrane ERα.
Vlastnosti E4 specifické pro jednotlivé tkáně se projevují i omezeným vlivem na proliferaci zdravé či nádorově změněné tkáně prsu, což lze pozorovat na vícero modelech buněčných kultur [29,31], v animálních modelech rakoviny prsu [29,32], xenograftových modelech s lidskými buňkami implantovanými do myší [33] a dokonce i u žen v terminálním stadiu rakoviny prsu [25]. V těchto podmínkách se nezdá, že by E4 podávaný v terapeutické dávce zrychloval nádorový růst nebo metastazování [25,29–33]. Klinické studie fáze Ib/IIa u aktivně léčených pacientek s progresivním pokročilým karcinomem prsu rezistentním na estrogen kromě toho ukázaly pravděpodobnou bezpečnost a snášenlivost 20–60 mg E4 bez toxicity závislé na dávce a protinádorové účinky byly pozorovány u pěti z devíti pacientek, které absolvovaly 12týdenní léčbu E4 [25]. V xenograftovém modelu u myší s hormonálně dependentním nádorem prsu dávka E4 (0,3 mg/kg/den) růst nádoru nezrychlila, nicméně 10násobně vyšší dávka (3 mg/kg/den) zapříčinila podobné nežádoucí účinky jako E2 [33]. E4 může mít menší vliv na riziko rakoviny prsu než E2 [23,34]. Při zkoumání in vitro modelu izolovaných lidských epitelových buněk prsu a in vivo modelu mléčné žlázy myší se zjistilo, že E4 stimuloval proliferaci tkáně prsu se 100násobně nižší účinností v porovnání s E2 [29]. E4 podávaný současně s E2 navíc částečně dokázal antagonizovat proliferaci lidských epitelových buněk prsu a růst mléčné žlázy myší indukované E2 [29]. V současnosti na základě těchto preklinických zjištění nelze odhadnout klinické riziko rakoviny prsu u žen užívajících COC s obsahem E4 [23]. Při riziku vzniku rakoviny prsu u žen užívajících současné typy hormonální antikoncepce jsou hlášeny protichůdné informace a dle Mørchové et al by se 20% nárůst relativního rizika projevil jako přibližně jeden další případ rakoviny prsu na každých 7 690 žen užívajících hormonální antikoncepci nejméně po dobu 1 roku [35].
Perorální biologická dostupnost E4 dosahuje přibližně 70 % [15]. Kromě toho se neprokázala žádná vazba na pohlavní hormony vázající globulin (SHBG – sex hormone-binding globulin) a přístup do cílových tkání by měly mít pouze steroidy nevázané na bílkovinu (volné steroidy) [36]. Po vstřebání E4 podstupuje rozsáhlou druhou fázi metabolizace za vzniku neaktivních konjugátů – glukuronidů a sulfátů [37]. Ve výsledku je E4 konečným produktem metabolizmu, nemění se nazpět na aktivní metabolity a není zdrojem ani potenciálně karcinogenních metabolitů [37–39]. Protože se E4 v těle dále nemetabolizuje, nejsou očekávány žádné účinky málo aktivních metabolitů; na rozdíl od E2 se E4 nepřeměňuje na hydroxylované metabolity, prekurzory chinonů estrogenů, které mohou reagovat s a poškodit DNA, což souvisí s vývojem rakoviny prsu [28].
Farmakokinetické parametry E4 se dále vyhodnocovaly ve studii fáze 0 (první podání člověku), kde se u E4 zjistila vysoká perorální biologická dostupnost, pomalá eliminace a dlouhý biologický poločas (přibližně 24 hod), což naznačuje, že je pravděpodobně vhodný pro perorální užívání v režimu jednou denně [28,40].
Na rozdíl od jiných estrogenů nehraje cytochrom P450 (CYP450) v metabolizmu E4 větší roli a E4 má na hlavní enzymy skupiny CYP450 minimální vliv [37]. E4 tedy může mít menší potenciál lékových interakcí než ostatní estrogeny.
Drospirenon: gestagen se specifickým farmakodynamickým profilem
Kromě gestagenního působení se DRSP (obr. 1d) vyznačuje kombinací antimineralokortikoidního, antiandrogenního a antiestrogenního účinku [41,42]. Antimineralokortikoidní účinek DRSP může pomoci zmírnit zadržování vody a jeho antiandrogenní účinek snížit riziko vedlejších účinků, které jsou běžně spojeny s androgenní aktivitou [43]. Řada gestagenů je odvozena z 19-nortestosteronu a běžně uváděné vedlejší účinky COC, jako například akné, hirsutizmus, mastné vlasy, změny v lipidogramu a nárůst tělesné hmotnosti, jsou pravděpodobně spojeny s androgenními vlastnostmi nebo glukokortikoidními účinky gestagenů odvozených z pregn-4-en-3,20-dionu [43]. Celkový účinek COC závisí na typu zvoleného gestagenu, dávky a typu estrogenu [44].
DRSP (obr. 1d) je analogem spironolaktonu s farmakodynamickým profilem podobným endogennímu progesteronu (obr. 1c) [41,43,45]. DRSP má dlouhý terminální biologický poločas (přibližně 32 hod) a biologickou dostupnost přibližně 76 % [43]. Z farmakologického profilu vyplývá, že DRSP se může směle srovnávat s jinými gestageny stran příznivé regulace hmotnosti (díky antimineralokortikoidní a antiandrogenní aktivitě), má převážně neutrální vliv na krevní tlak [45] a zlepšení seborey a akné (díky antiandrogenní aktivitě) [41,43]. Kromě toho se u přípravků s výhradním obsahem DRSP neukazuje žádná spojitost s významnými změnami v hemostatických parametrech [46] a v klinických studiích antikoncepčních tablet s obsahem 4 mg DRSP v režimu podávání 24+4 není zdokumentován žádný případ VTE [47].
DRSP je metabolizován prostřednictvím enzymu CYP3A4 [48]. Mezi DRSP (podávaným společně s EE nebo E2) a ketokonazolem, inhibitorem CYP3A4, byla pozorována mírná farmakokinetická interakce, jejímž výsledkem byl nárůst hladiny DRSP, avšak nesouvisela se žádnými relevantními změnami zdravotního stavu [48]. Na základě in vitro studií zaměřených na inhibici a in vivo studií zaměřených na interakci u dobrovolnic užívajících omeprazol, simvastatin a midazolam jako markerový substrát je interakce drospirenonu v dávkách 3 mg s metabolizmem jiných účinných látek nepravděpodobná [40].
E4 v kombinaci s DRSP: klinická účinnost, snášenlivost, profil krvácení
Klinické studie fáze II
Klinické studie fáze II vyhodnocovaly kombinovanou léčbu různých dávek E4 (5 mg, 10 mg, 15 mg, 20 mg) buď s 3 mg DRSP, nebo se 150 µg levonorgestrelu (LNG) [20–22,49–53], přičemž při kombinaci 15 mg E4 a 3 mg DRSP, kde se 24 dní užívá jedna aktivní tableta denně a 4 dny jedna placebo tableta denně po dobu 3–6 po sobě jdoucích cyklů, byla zjištěna adekvátní inhibice ovulace a potlačení funkce vaječníků bez zaznamenaných obav o bezpečnost a s limitovaným vlivem na triglyceridy a hemostatické parametry [20,22,50,53]. Ve druhé studii porovnávající 15 mg E4/3 mg DRSP s COC s obsahem 20 µg etinylestradiolu (obr. 1a) a 3 mg DRSP během třech po sobě jdoucích cyklů neproběhla u žádné z žen, které užívaly kombinaci E4/DRSP, ovulace; v souboru žen léčených EE/DRSP proběhla ovulace pouze u dvou z nich, a sice jednou a 2krát [53].
Pravidelnost krvácení a regulace menstruačního cyklu u COC s obsahem E4 (15 mg nebo 20 mg) v kombinaci s DRSP (3 mg) nebo LNG (150 µg) podávané v režimu 24+4 byly posuzovány ve druhé fázi otevřené studie primárně zaměřené na dávku (FIESTA; NCT01221831) [50,51]. Studie kromě toho zahrnovala i referenční vzorek dávkovacího režimu přirozeného estrogenu estradiolvalerátu (E2V) kombinovaného s gestagenem dienogestem (QlairaVR, Bayer Healthcare, Germany) [50,51]. Do šestého cyklu byla pozorována nejnižší míra neplánovaného krvácení a/nebo špinění (33,8 vs. 47,8 % ve skupině E2V/DNG) a absence krvácení z vynechání (3,5 vs. 27,1 % ve skupině E2V/DNG) u 15 mg E4/3 mg DRSP (obr. 3) [50].
Fig. 3. Frequency (%) of women with absence of withdrawal bleeding/spotting
and with unscheduled bleeding in each treatment group (per protocol population)
in cycle 6 of a phase II dose-finding study (FIESTA) [50]. Absence of withdrawal
bleeding 20% and/or 20% unscheduled intracyclic bleeding after 6 treatment
cycles was set as a limit (broken line). Published with permission from
Apter et al [50].
![Frekvence (%) žen bez krvácení z vysazení/ špinění a s neplánovaným
krvácením v každé léčebné skupině (populace podle protokolu) v cyklu 6 studie
fáze II pro zjištění dávky (FIESTA) [50]. Absence krvácení z vysazení < 20 %
a/nebo < 20 % neplánované intracyklické krvácení po 6 léčebných cyklech
bylo stanoveno jako limit (přerušovaná čára). Publikováno se svolením Apter
et al [50].<br>
Fig. 3. Frequency (%) of women with absence of withdrawal bleeding/spotting
and with unscheduled bleeding in each treatment group (per protocol population)
in cycle 6 of a phase II dose-finding study (FIESTA) [50]. Absence of withdrawal
bleeding 20% and/or 20% unscheduled intracyclic bleeding after 6 treatment
cycles was set as a limit (broken line). Published with permission from
Apter et al [50].](https://www.cs-gynekologie.cz/media/cache/resolve/media_object_image_small/media/image_pdf/b06f8501663d3c8786c4b882ac534195.jpg)
LNG: levonorgestrel.
Ve studii fáze II FIESTA byla kombinace 15 mg E4/3 mg DRSP provázena nejvyšší spokojeností s léčbou (73,1 %), zatímco kombinace 20 mg E4/150 µg LNG s nejnižší (50,6 %) [51]. Poměr žen ochotných pokračovat s předepsanou léčbou byl rovněž nejvyšší ve skupině s kombinací 15 mg E4/3 mg DRSP (82,1 %) a nejnižší ve skupině 20 mg E4/150 µg LNG (58,3 %) [51]. Kombinace 15 mg E4/3 mg DRSP byla spojena s vysokou spokojeností uživatelek a příznivou regulací tělesné hmotnosti [51]. Podíl žen s poklesem tělesné hmotnosti o > 2 kg mezi 3. a 6. cyklem byl nejvyšší ve skupině 15 mg E4/3 mg DRSP (30,7 vs. 36,7 %) a nejnižší ve skupině 15 mg E4/150 µg LNG (7,7 vs. 13 %) [51]. To může přispět k důslednějšímu dodržování léčby, protože nárůst hmotnosti je častým důvodem ukončení užívání COC u žen, které chtějí regulovat svoji plodnost [54,55].
Z výsledků různých studií fáze II vyplynulo, že kombinace 15 mg E4/3 mg DRSP vede k nejslibnějšímu režimu krvácení, regulaci cyklu, regulaci tělesné hmotnosti, spokojenosti uživatelek, a proto byla tato kombinace vybrána pro další zkoumání [23,28,50,51].
Klinické studie fáze III
Kombinace 15 mg E4/3 mg DRSP byla hodnocena ve dvou multicentrických otevřených studiích fáze III (E4FREEDOM – Female Response Concerning Efficacy and Safety of Estretrol/Drospirenone as Oral Contraceptive in a Multicentric Study) provedených v Evropě/Rusku (EU/RUS studie; ClinicalTrials.gov: NCT 02817828) a v USA/Kanadě (US/CAN studie; ClinicalTrials.gov: NCT02817 841 [56,57].
Studií se zúčastnily ženy ve věku od 18 (EU/RUS studie), resp. od 16 let (US/CAN studie) do 50 let s primárním cílem zhodnocení antikoncepční účinnosti kombinace 15 mg E4/3 mg DRSP, dávkované po jedné aktivní tabletě denně prvních 24 dní a jedné placebo tabletě denně po zbylé 4 dny, po dobu 13 cyklů u žen ve věku 18–35 (EU/RUS studie) nebo 16–35 let (US/CAN studie) výpočtem Pearl indexu jakožto primárního ukazatele účinnosti [56,57]. Užívání 15 mg E4/3 mg DRSP v obou studiích ukázalo vysokou antikoncepční účinnost v těchto skupinách žen (tab. 1): vypočtený Pearl index pro rizikový léčebný cyklus (americký Úřad pro kontrolu potravin a léčiv (FDA) jej definuje jako ten, v němž žena ve svém denním záznamu potvrzuje, že neužila žádné jiné typy antikoncepce, vč. kondomů, a zároveň že v daném cyklu měla pohlavní styk) byl 0,47 (95% IS: 0,15–1,11) v EU/RUS studii (pět otěhotnění během léčby) a 2,65 (95% IS: 1,73–3,88) v US/CAN studii (26 otěhotnění během léčby) [56,57]. Podle definice Evropské lékové agentury (EMA; nepoužívaly se žádné jiné metody antikoncepce, vč. kondomů) byly vypočtené Pearl indexy 0,44 (95% IS: 0,14–1,03) ve studii EU/RUS a 2,42 (95% IS: 1,58–3,54) ve studii US/CAN [56,58].
Tab. 1. Efficacy of E4 15 mg/DRSP 3 mg: results from two phase 3 clinical studies [56–58].
![Účinnost E4 15 mg/DRSP 3 mg: výsledky ze dvou klinických studií fáze 3 [56–58].<br>
Tab. 1. Efficacy of E4 15 mg/DRSP 3 mg: results from two phase 3 clinical studies [56–58].](https://www.cs-gynekologie.cz/media/cache/resolve/media_object_image_small/media/image_pdf/a776f93c5dd082df30e948930acc30a6.jpg)
a Rizikový cyklus: nepoužívání jiných metod antikoncepce (včetně kondomů a nouzové antikoncepce), byl hlášen pohlavní styk, bylo zvažováno
těhotenství „při léčbě“, kdy předpokládané datum početí bylo 7 dní po posledním užití studijní léčby;
b Selhání metody: vyloučení těhotenství v důsledku selhání uživatele, tj. neužívání studované léčby podle protokolu během cyklu početí
nebo užívání souběžné medikace v interakci s COC;
c Kaplan-Meir odhady.
Pravidelnost krvácení a parametry bezpečnosti byly zjišťovány v populaci žen ve věku 18–50 let v EU/RUS studii a 16–50 let v US/CAN studii. Počet žen v analýze krvácení v EU/RUS studii se pohyboval od 1 507 během cyklu 1 do 1 183 v cyklu 12 (příloha v primární publikaci [56]) a odpovídající počty v US/CAN studii byly 1 758 a 1 006 žen [57]. Užívání kombinace 15 mg E4/3 mg DRSP mělo za následek předvídatelné vaginální krvácení, přičemž většina žen měla plánované krvácení v každém cyklu a neplánované krvácení, při němž bylo třeba použít hygienické pomůcky na ochranu, se neobjevilo [56,57]. V EU/RUS studii se neplánované krvácení snížilo z 23,5 % v prvním cyklu na < 16 % od cyklu 6 a dále [56]; v US/CAN studii se snížilo z 30,3 % v prvním cyklu na 21,3–22,1 % v cyklech 2–4 a nadále zůstalo stabilní (15,5–19,2 %) [57].
V otevřené randomizované komparativní klinické studii s kombinací 20 µg EE/150 µg DSG proběhnuvší ve čtyřech evropských zemích (n = 230) byl poměr neplánovaného krvácení/špinění během cyklů 2–6 v rozmezí 8,8–17,3 % [59]. V souhrnné analýze dvou klinických studií E2/NOMAC v porovnaní s 30 µg EE/3 mg DRSP užívaly zdravé ženy EE/DRSP v režimu 21+7 (n = 938). Výskyt neplánovaného krvácení/špinění časem klesl ze 17,4 % v cyklu 2 na 12,8 % v cyklu 6 a 10,9 % v cyklu 12 [60]. V téže analýze se výskyt neplánovaného krvácení/špinění při užívaní E2/NOMAC (n = 2 835) časem snížil z 23,2 % v cyklu 2 na 19,1 % v cyklu 6 a 15,4 % v cyklu 12. Zdravé ženy ve věku 18–50 let (n = 2 266) dostávaly multifázovou tabletu E2V/DNG na 7 až 28 cyklů ve třech pilotních studiích, jedné v Severní Americe a dvou v Evropě. Během prvních 13 léčebných cyklů byl podíl žen, u nichž se vyskytlo neplánované krvácení/špinění v průběhu cyklů 2–13, v rozmezí 13–23 % [61]. Ačkoli pro nedostatek přímých komparativních studií fáze III je možné provést pouze nepřímá srovnání, souhrnné analýzy krvácení ze studií fáze III prováděné s jinými typy COC ukazují četnost absence plánovaného krvácení/špinění během cyklů mezi 8 a 12 % u 20 µg EE/3 mg DRSP v dávkovém režimu 24+4 [62], 18–32 % u 1,5 mg E2/2,5 mg NOMAC v režimu 24+4 [60] a 19–24 % při kombinaci 1/2/3 mg E2V s 2/3 mg DNG v režimu 26+2 [61]. Absence plánovaného krvácení/špinění u E4/DRSP (5,6–8,1 % v EU/RUS studii a 13,1–18 % v US/CAN studii) se zdá být srovnatelná s EE/DRSP a vyskytuje se méně často v porovnání s kombinacemi s E2.
E4 v kombinaci s DRSP: bezpečnostní profil
Užívání kombinace 15 mg E4/3 mg DRSP je provázeno celkově dobrou snášenlivostí, o čemž svědčí nízký výskyt nežádoucích účinků spojených s léčbou. Ve studiích fáze III přibližně polovina pacientek hlásila jakoukoli nežádoucí příhodu (50,5 % v EU/RUS studii a 53,8 % v US/CAN studii) a přibližně 29 % žen v obou studiích hlásilo nežádoucí příhody, které investigátoři na příslušném pracovišti označili za účinky spojené s léčbou [56,57]. Nežádoucí účinky spojené s léčbou, které nahlásily nejméně 2 % zúčastněných ve dvou studiích fáze III, jsou shrnuty v tab. 2 [56,57]. Mezi nejčastější nežádoucí účinky spojené s léčbou v obou studiích patřily metroragie, akné či bolesti hlavy [56,57]. K ukončení léčby pro nežádoucí příhody v EU/RUS studii došlo v 9,1 % [56] a v US/CAN studii v 7,1 % případech [57]. Profil nežádoucích příhod v těchto studiích byl srovnatelný jako při užívání jiných typů COC [63–65].
Tab. 2. Treatment-related adverse events reported in at least 2% of subjects in
the phase 3 studies of E4 15 mg/DRSP 3 mg use for up to 13 cycles (12 months)
[56,57].
![Nežádoucí účinky související s léčbou hlášené u nejméně 2 % subjektů
ve studiích fáze 3 E4 15 mg/DRSP 3 mg používané až 13 cyklů (12 měsíců)
[56,57].<br>
Tab. 2. Treatment-related adverse events reported in at least 2% of subjects in
the phase 3 studies of E4 15 mg/DRSP 3 mg use for up to 13 cycles (12 months)
[56,57].](https://www.cs-gynekologie.cz/media/cache/resolve/media_object_image_small/media/image_pdf/b49153416ed7dad91bb645180ea6ca67.jpg)
Bezpečnostní populace: všichni zařazení jedinci, kteří dostali alespoň jednu dávku studijní
léčby.
NÚ: nežádoucí účinky; DRSP: drospirenon; E4: estetrol; NA: údaje nejsou k dispozici.
† Souvislost zjištěná investigátorem.
V otevřené nekomparativní studii s 20 µg EE/3 mg DRSP (13 cyklů, režim 24+4) byla četnost nežádoucích příhod spojených s léčbou 38,5 % a četnost ukončení léčby pro nežádoucí příhody 7,5 %. Pět závažných nežádoucích příhod u třech žen bylo nahlášeno jako pravděpodobně související s léčbou [66]. Ve třech klinických studiích, kde se kombinace EE30/DRSP použila jako referenční COC v klinickém vývojovém programu E2/NOMAC, byla četnost nežádoucích příhod souvisejících s léčbou 69 %, nežádoucích příhod souvisejících přímo s léčbou 37,3 % a četnost ukončení léčby pro nežádoucí příhody související s léčbou 10,1 % u EE30/DRSP [67]. Bezpečnost E2V/DNG jakožto COC byla hodnocena ve třech rozsáhlých multicentrických studiích. Při užívání kombinace E2V/DNG nahlásilo alespoň jednu nežádoucí příhodu spojenou s léčbou 62 % žen, závažné nežádoucí účinky pravděpodobně související s léčbou zaznamenalo 0,3 % žen a pro nežádoucí příhody ukončilo účast ve studii 10 % zúčastněných [61]. V šesti klinických studiích E2/NOMAC byla četnost nežádoucích příhod souvisejících s léčbou 75,3 %, četnost nežádoucích příhod spojených s léčbou 49,1 % a četnost ukončení léčby pro nežádoucí příhody související s léčbou 17,1 % [67].
Vážnou obavou v souvislosti s dostupnými přípravky COC je zvýšené riziko tromboembolických příhod [44,68–70]. Jakkoli je absolutní incidence těchto příhod nízká, v případných dalších klinických studiích s vysokým počtem žen nebo cyklů nastává povinnost poskytovat spolehlivé odhady takového rizika s konkrétním COC, což může trvat 5–10 let [10]. Biologické proměnné, které mohou reflektovat různé farmakologické účinky potenciálně spojené s rizikem VTE, jsou zkoumány při vývoji nových typů kombinované antikoncepce [71]. K získání detailnějších informací o pravděpodobnosti výskytu této nežádoucí příhody u žen užívajících E4/DRSP jako COC se proto zjišťovaly hemostatické vlivy E4 kombinovaného s DRSP [20,52,70]. V randomizované studii s délkou sledování šesti cyklů byly účinky 15 mg E4/3 mg DRSP porovnávány s účinky 20 µg EE/3 mg DRSP a 30 µg EE/150 µg LNG [20]. Po šesti cyklech se v porovnání s výchozí hodnotou zvýšila rezistence na aktivovaný protein C (APCr) ve skupině E4/DRSP o 30 %, ve skupině EE/LNG o 165 % a ve skupině EE/DRSP o 219 % [20]. Skupiny EE/LNG a EE/DRSP měly zvýšený protrombinový fragment 1+2 a EE/DRSP nárůst SHBG výrazně vyšší než E4/DRSP (p < 0,05); další hemokoagulační parametry, včetně antikoagulačních a fibrinolytických proteinů, byly u E4/DRSP podobné nebo nižší než u EE/LNG a EE/DRSP [20]. Tyto výsledky potvrdily předchozí údaje získané u žen užívajících některou z kombinací 5 mg E4/3 mg DRSP, 10 mg E4/3 mg DRSP či 20 µg EE/3 mg DRSP [52]. Na konci léčebného cyklu 3 žádná léčba kombinací E4/DRSP neovlivnila antitrombin, aktivitu proteinu S nebo ACPr a projevil se pouze malý vliv na volný inhibitor tkáňové cesty (TFPI – tissue free factor pathway inhibitor), zatímco kombinace EE/DRSP měla významný účinek na veškeré čtyři markery inhibice koagulace, které srážení krve podporují [52]. Ve studii US/CAN fáze III klinického hodnocení případy VTE nebyly zaznamenány u žádné z 1 864 uživatelek, ze kterých 23 % mělo BMI > 30 kg/m2, což je rizikový faktor VTE [57], a mezi 1 553 ženami ve studii EU/RUS byl nahlášen jediný případ VTE [56].
Vliv různých typů COC na hemostázu závisí na typu estrogenu a kombinaci s gestagenem, jakkoli změny koagulačních faktorů vyvolané COC zůstávají ve stejném rozmezí, synergické účinky mají tendenci zvyšovat trombogenicitu [72]. Zjištění těchto dvou studií naznačují, že E4/DRSP má menší vliv na koagulační a fibrinolytické systémy v porovnání s EE/LNG či EE/DRSP a pravděpodobnost, že vyvolá VTE, je nižší. Tuto domněnku však budou muset ještě potvrdit rozsáhlejší studie bezpečnosti po registraci léčivého přípravku.
Rozdíly v koagulačních parametrech a fibrinolytických systémech pozorované u EE/DRSP a E4/DRSP též naznačují, že vliv COC na hemostatické parametry závisí převážně na typu estrogenu [20].
Zkřížená studie Klippingové et al porovnávající E2V/DNG a 30 µg EE/150 µg LNG neprokázala intraindividuální změny v hladině protrombinového fragmentu 1+2, zatímco u EE/LNG bylo pozorováno mírné zvýšení, jakkoli rozdíly mezi těmito dvěma přístupy nebyly statisticky signifikantní [73]. Naopak oproti skupině EE/LNG (intraindividuální relativní změna 88,1–99,3 %) se u E2V/DNG koncentrace D-dimerů mírně zvýšila (intraindividuální relativní změna 37,3–69,3 %) [73].
V randomizované otevřené studii porovnávající E2V/DNG nebo EE/LNG [74] zůstala hladina protrombinového fragmentu 1+2 a D-dimerů ve skupině E2V/DNG v zásadě stabilní, ale ve skupině EE/LNG vzrostla (o 117,3 % ± 358,0 % u protrombinového fragmentu 1+2 a 62,9 % ± 99,5 % u D-dimerů). Vliv E2V/DNG na další parametry související s játry (SHBG, globulin vázající kortikosteroidy (CBG)) byly méně výrazné než u EE/LNG.
Tab. 3 znázorňuje účinky COC obsahující přirozený estrogen na různé hemokoagulační parametry [72].
Tab. 3. Changes in haemostasis parameters according to the type of natural oestrogen-containing combined oral contraceptives.
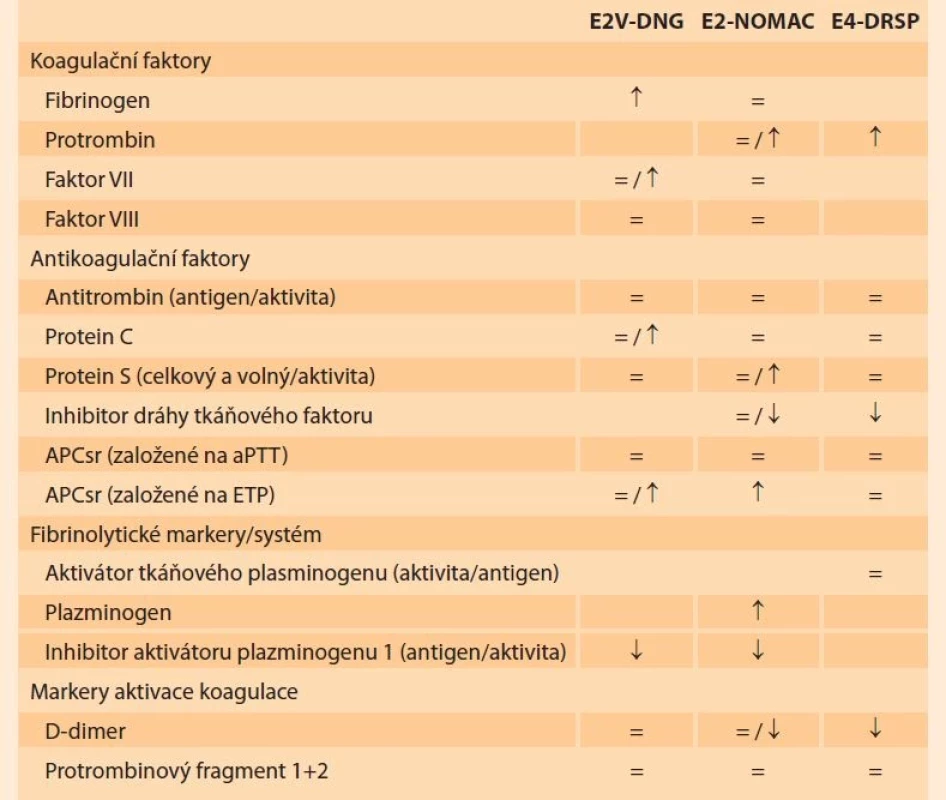
aPTT: aktivovaný parciální tromboplastinový čas; DNG: dienogest; DRSP: drospirenon; ETP:
endogenní trombinový potenciál; E2: estradiol; E2V: estradiolvalerát; E4: estetrol; NOMAC:
nomegestrol acetát.
V etiologii VTE je za důležitý faktor považována APCr [70,75]. Déle než dvě desetiletí je zmiňována souvislost mezi získanou rezistencí k APC a rizikem trombózy u žen užívajících COC, přičemž nedávné výzkumy s cílem standardizace vyhodnocování rezistence k APC navozené užíváním COC ukázaly souvislost mezi relativním rizikem vzniku VTE s normalizovaným poměrem citlivosti na APC [72,76,77], nicméně na charakterizaci a potenciální posílení korelace mezi APCr a rizikem VTE jsou potřebné další studie. Obr. 4 ukazuje korelaci mezi normalizovaným poměrem citlivosti k APC (nAPCsr) a relativním rizikem VTE, která byla zjištěna v metaanalýze De Bastosa et al v Cochrane Library [78]. Nízký vliv E4 na nAPCsr a jiné hemostatické parametry je v souladu s domněnkou, že riziko způsobuje přítomnost EE [72] a že výběr estrogenové komponenty v tomto směru modifikuje účinky COC [20]. Relativní riziko VTE získané z modelu EE/DNG či E2/NOMAC je blízké upravenému relativnímu riziku pozorovanému v epidemiologických studiích [7,79], což umocňují zjištění, že kombinace E4/DRSP by měla být provázena nižším nebo stejným rizikem VTE ve srovnání s referenční kombinací EE/LNG.
Fig. 4. The nAPCsr has been computed against the relative risk of VTE as extracted
from the publication of De Bastos et al [78]. Based on this mathematical model,
the relative risk of combined oral contraceptives not included in the initial metaanalysis
has been intrapolated, i.e. EE/DNG, E2/NOMAC and E4/DRSP. For EE/DNG
and E2/NOMAC, the intrapolated relative risk corresponds to the adjusted relative
risk observe in the meta-analysis of Dinger et al [7] and in the PRO-E2 study for
E2/NOMAC [79].
![nAPCsr byl vypočítán proti relativnímu riziku VTE, dle publikace De Bastos
et al [78]. Na základě tohoto matematického modelu byly interpolovány
údaje EE/DNG, E2/NOMAC, E4/DRSP. Pro EE/DNG a E2/NOMAC, interpolované
relativní riziko odpovídá upravenému relativnímu riziku pozorovanému v metaanalýze
Dinger et al [7] a ve studii PRO-E2 pro E2/NOMAC [79].<br>
Fig. 4. The nAPCsr has been computed against the relative risk of VTE as extracted
from the publication of De Bastos et al [78]. Based on this mathematical model,
the relative risk of combined oral contraceptives not included in the initial metaanalysis
has been intrapolated, i.e. EE/DNG, E2/NOMAC and E4/DRSP. For EE/DNG
and E2/NOMAC, the intrapolated relative risk corresponds to the adjusted relative
risk observe in the meta-analysis of Dinger et al [7] and in the PRO-E2 study for
E2/NOMAC [79].](https://www.cs-gynekologie.cz/media/cache/resolve/media_object_image_small/media/image_pdf/fa3974424e9e4352e437edeed630d8d3.jpg)
Nedávno byla vyvinuta COC s obsahem přirozeného estrogenu estradiolu (E2) nebo jeho esteru estradiolvalerátu (E2V) zaměřená na snížení rizika kardiovaskulárních onemocnění. Údaje jsou již dostupné z rozsáhlých observačních studií vlivu COC s obsahem E2 nebo E2V. V poregistrační studii bezpečnosti po registraci přípravku (PASS – post-authorisation safety study) „International Active Surveillance Study – Safety of Contraceptives: Role of Estrogens“ (INAS-SCORE) [7,80] se v konečných výsledcích ukázalo, že riziko VTE spojené s užíváním COC obsahující E2V a dienogest bylo významně nižší v porovnání s veškerými typy COC s obsahem EE (HR 0,4; 95% IS: 0,2–0,9), ale nikoli ve srovnání s kombinací EE/LNG COC [80,81]. Autoři dospěli k závěru, že neexistuje náznak vyššího rizika VTE nebo arteriálního tromboembolizmu (ATE) u uživatelek COC s obsahem E2V a dienogestem ve srovnání s uživatelkami jiných typů COC [80]. Další PASS posloužila ke stanovení kardiovaskulárních a jiných zdravotních rizik u uživatelek kombinace E2 s nomegestrol-acetátem (NOMAC-E2) či COC s obsahem LNG (COC-LNG) [79]. Výsledky studie nenaznačují, že by užívání NOMAC-E2 bylo spojeno s vyšším rizikem VTE nebo ATE v porovnaní s LNG [79]. Závěry těchto rozsáhlých observačních studií tedy společně naznačují, že riziko VTE může být nižší u COC s obsahem E2 nebo E2V než u jiných typů COC. Riziko při užívaní 15 mg E4/3 mg DRSP není známo a musí být stanoveno v rámci postmarketingových studií [40].
Ve studiích fáze II s COC s obsahem E4 (5 mg nebo 10 mg E4/3 mg DRSP; 5 mg, 10 mg nebo 20 mg E4/150 mg LNG) byl zjištěn omezený vliv na činnost jater a metabolizmus lipidů [21] a kombinace 15 mg E4/3 mg DRSP má též omezené účinky na endokrinní a metabolické parametry s minimálním vlivem na parametry lipidů (vliv na triglyceridy byl menší než u EE/DRSP) a žádným vlivem na metabolizmus sacharidů [22].
Potenciální přínosy kombinace estetrolu a drospirenonu v budoucnosti
Dlouhodobá bezpečnost
Celková incidence tromboembolických příhod při užívání 15 mg E4/3 mg DRSP hlášená ve studiích fáze III byla nízká a hemostatické údaje z fáze II byly uspokojivé [20,56,57]. Výsledky naznačují, že při E4/DRSP může existovat stejná nebo dokonce nižší pravděpodobnost výskytu VTE než u EE/LNG [20,70,77]. Na potvrzení závěrů fáze III testování o tom, že užívání E4/DRSP je spojeno s nízkým rizikem klinické trombózy, jsou však potřebné studie fáze IV [58].
E4 má omezený vliv na proliferaci zdravé i nádorově změněné tkáně prsu [25,29–33] a na riziko vzniku rakoviny prsu může mít menší vliv než E2 [23,33,34]. DRSP na rozdíl od některých androgenních gestagenů navíc nestimuluje proliferaci buněk mléčné žlázy v animálních xenograftových modelech [82]. Je však potřebné dále zkoumat, jak se dané promítne do dlouhodobého kombinovaného užívání E4 a DRSP u žen.
Sexuální zdraví
I když užívání COC souvisí s kvalitou pohlavního života, její účinek je komplexní: zlepšení či zhoršení sexuálních funkcí se projeví u malého procenta žen, přičemž většinu z nich neovlivní vůbec [83]. Předpokládá se, že stávající formy COC jsou schopny negativně ovlivnit sexuální aktivitu u žen zvyšováním hladiny proteinů vázajících androgeny a navozením hypoandrogenizmu [84].
V některých studiích byly hlášeny negativní změny v sexuální apetenci [85,86] nebo snížená vaginální lubrikace [87], v jiných negativní účinky prokázány nebyly [88,89] a pozorována byla zvýšená četnost pohlavního styku a intenzita orgazmu [90–92], vyšší vzrušivost [93] či zmírnění sexuální dysfunkce spojené s perorální antikoncepcí [4].
U žen se sexuální dysfunkcí (FSD – female sexual dysfunction) se dané symptomy změnou antikoncepce na kombinaci E2V/DNG nebo EE/LNG zlepšily [94]. Sexuální touha u žen, které chtěly ukončit užívání antikoncepce pro nízkou sexuální touhu, se změnou na kombinaci E2/NOMAC zlepšila [84], přičemž při follow up studie u žen s premenstruační dysforickou poruchou došlo při užívání E2/NOMAC ke zhoršení, nikoli však při užívání EE/DRSP [95]. Kombinace 30 µg EE/150 µg LNG v porovnání s placebem nevykazovala žádný negativní vliv na celkovou sexuální funkci, jakkoli oblast touhy, vzrušení a uspokojení v profilu ženských sexuálních funkcí (PFSF – profile of female sexual function) bylo významně zhoršeno [96]. V otevřené multicentrické studii se při sledování zaměřeném na dávku po dobu šesti cyklů ukázalo přímé porovnání 15 mg E4/DRSP s E2V/DNG jako srovnatelně příznivé stran celkového vlivu na sexuální funkce [51].
V metaanalýze 36 studií uživatelek COC (n = 8 422) hlásilo zvýšení (n = 1 826) nebo žádnou změnu (n = 5 358) v libidu 85 % žen a snížení (n = 1 238) 15 % žen, přičemž primárně šlo o COC s nízkou dávkou estrogenu (EE < 20 µg) [97]. Jakkoli ve studiích fáze III, US/CAN a EU/RUS, nebylo hlášeno snížené libido jako nežádoucí příhoda při užívání 15 mg E4/3 mg DRSP u > 97 % žen [56,57], je žádoucí zkušenost z běžného života na potvrzení, že tato kombinace skutečně neovlivňuje sexuální zdraví.
Ekotoxikologie
Estrogeny v perorální antikoncepci jsou ve velkém vypouštěny do životního prostředí a vzrůstá obava stran environmentálních vlivů endokrinních disruptorů [98,99]. Standardní environmentální testy aplikované na vodní živočišné druhy s cílem zkoumat jejich růst, rozmnožování a životní cyklus naznačují, že předpokládaná koncentrace E4 ve vodním prostředí pravděpodobně nevykazuje negativní účinky [100]. Evropská hodnocení environmentálních rizik E4, včetně reprodukčních testů u medaky japonské, naznačují, že environmentální expozice E4 vodní ekosystém neovlivňuje [40].
Hodnocení environmentálních rizik však ukázala, že kombinace etinylestradiolu a drospirenonu mohou být potenciálně rizikové pro vodní prostředí [101–103].
Závěr
Na rozdíl od jiných estrogenů působí E4 jako aktivátor nukleárních ERa, avšak současně jako antagonista membránových ERa. Jeho účinek na kosti, vaginální epitel, centrální nervový systém, dělohu a (i když méně známý) dopad na mléčné žlázy naznačuje, že E4 může být užitečným a bezpečným doplňkem hormonální terapie. Významné použití E4 je právě v kombinovaných perorálních kontraceptivech [24].
Kombinace 15 mg E4/3 mg DRSP v režimu 24+4 představuje účinnou antikoncepci s uspokojivou regulací cyklu, který je charakterizován předvídatelným a pravidelným krvácením a minimálním neplánovaným krvácením a zároveň je prokazována dobrá snášenlivost a bezpečnostní profil [56,57]. Kombinace estrogenu se selektivními účinky na tkáně a gestagenu DRSP má řadu výhodných vlastností, vč. antimineralokortikoidní a antiandrogenní aktivity [41,42] a dlouhého biologického poločasu [43]. V klinických studiích fáze II měla kombinace 15 mg E4/3 mg DRSP významně nižší vliv na hemokoagulační parametry než kombinace 20 µg EE/3 mg DRSP a byla provázena příznivým vlivem na zdraví, vč. minimálních změn tělesné hmotnosti [20,51]. Stejně tak prokázala příznivý metabolický profil s limitovaným vlivem na metabolizmus lipidů (vč. minimálního vlivu na triglyceridy) a toleranci glukózy [22].
Ekotoxikologické studie naznačují, že použití E4 v kombinaci E4/DRSP pravděpodobně nemá negativní vliv na životní prostředí [40].
Kombinace 15 mg E4/3 mg DRSP prokazuje vysokou antikoncepční účinnost, předvídatelné krvácení, nízké procento nežádoucích příhod spojených s léčbou a příznivý bezpečnostní profil [56,57]. Pro pochopení celkových výhod této kombinace jsou naplánovány další studie.
Článek byl převzat z: Eur J Contracept Reprod Health Care 2022; 27(5): 373–383. doi: 10.1080/13625187.2022.2093850
ORCID autorů
K. Gemzell-Danielsson 0000-0001-6516-1444
A. Cagnacci 0000-0003-2714-623X
N. Chabbert-Buffet 0000-0002-6525-4154
J. Douxfils 0000-0002-7644-5298
J. M. Foidart 0000-0001-8285-3573
A. Kubba 0000-0001-8693-9964
L. I. Lete Lasa 0000-0002-0266-3970
J. Neulen 0000-0001-7783-2604
F. Palma 0000-0002-3498-1594
T. Römer 0000-0001-5241-8095
R. Spaczyński 0000-0002-4306-6590
Přijato/Received: 26. ledna 2022
Revidováno/Revised: 10. června 2022
Schváleno/Accepted: 21. června 2022
Korespondující autor:
Vera Tóth
Medical information Scientigic Service
Gedeon Richter Plc
Györmröi út 19-21
1103 Budapest
Hungary
Autor překladu:
doc. MU Dr. Jiří Slíva, Ph.D.
Ústav farmakologie
3. LF UK
Ruská 2411/ 87
100 00 Praha 10
Publikováno s licenčním souhlasem.
Zdroje
1. Szarewski A, Mansour D, Shulman LP. 50 years of “the Pill”: celebrating a golden anniversary. J Fam Plann Reprod Health Care. 2010; 36 (4): 231–238.
2. FSRH. Faculty of Sexual & Reproductive Healthcare Clinical Effectiveness Unit. FSRH Clinical Guideline. Combined Hormonal Contraception. London, UK: FSRH; January 2019; [amended November 2020. cited 2021 May 12]. Available from: https: //www.fsrh.org/documents/combined-hormonalcontraception/.
3. European Medicines Agency (EMA). Assessment report for combined hormonal contraceptives containing medicinal products – Procedure number: EMEA/H/A-31/1356. 2014; [cited 2022 April 27]. Available from: https: //www.ema.europa.eu/en/documents/referral/combined-hormonal-contraceptivesarticle-31-referral-prac-assessment-report_en.pdf.
4. Fruzzetti F, Tremollieres F, Bitzer J. An overview of the development of combined oral contraceptives containing estradiol: focus on estradiol valerate/dienogest. Gynecol Endocrinol. 2012; 28 (5): 400–408.
5. Pintiaux A, Gaspard U, Nisolle M. [Zoely, a combined oral contraceptive, monophasic pill containing estradiol and nomegestrol acetate]. Rev Med Liege. 2012; 67 (3): 152–156.
6. Lete I, Chabbert-Buffet N, Jamin C, et al. Haemostatic and metabolic impact of estradiol pills and drospirenone-containing ethinylestradiol pills vs. levonorgestrel-containing ethinylestradiol pills: a literature review. Eur J Contracept Reprod Health Care. 2015; 20 (5): 329–343.
7. Dinger J, Do Minh T, Heinemann K. Impact of estrogen type on cardiovascular safety of combined oral contraceptives. Contraception. 2016; 94 (4): 328–339.
8. Thomas MP, Potter BV. The structural biology of oestrogen metabolism. J Steroid Biochem Mol Biol. 2013; 137: 27–49.
9. Hagen AA, Barr M, Diczfalusy E. Metabolism of 17-beta-oestradiol-4-14-C in early infancy. Acta Endocrinol. 1965; 49: 207–220.
10. Foidart JM, Gaspard U, Pequeux C, et al. Unique vascular benefits of estetrol, a native fetal Estrogen with Specific actions in Tissues (NEST). In: Brinton RD, Genazzani AR, Simoncini T, editors. Sex steroids’ effects on brain, heart and vessels. Volume 6: Frontiers in Gynecological Endocrinology. ISGE Series. Switzerland: Springer International Publishing; 2019. p. 169–195.
11. Coelingh Bennink HJ, Holinka CF, Diczfalusy E. Estetrol review: profile and potential clinical applications. Climacteric. 2008; 11 (Suppl 1): 47–58.
12. Abot A, Fontaine C, Buscato M, et al. The uterine and vascular actions of estetrol delineate a distinctive profile of estrogen receptor alpha modulation, uncoupling nuclear and membrane activation. EMBO Mol Med. 2014; 6 (10): 1328–1346.
13. Arnal JF, Lenfant F, Metivier R, et al. Membrane and nuclear estrogen receptor alpha actions: from tissue specificity to medical implications. Physiol Rev. 2017; 97 (3): 1045–1087.
14. Guivarc’h E, Buscato M, Guihot AL, et al. Predominant role of nuclear versus membrane estrogen receptor alpha in arterial protection: implications for estrogen receptor alpha modulation in cardiovascular prevention/safety. J Am Heart Assoc. 2018; 7 (13): e008950.
15. Coelingh Bennink HJ, Heegaard AM, Visser M, et al. Oral bioavailability and bone-sparing effects of estetrol in an osteoporosis model. Climacteric. 2008; 11 (Suppl 1): 2–14.
16. Coelingh Bennink HJ, Verhoeven C, Zimmerman Y, et al. Clinical effects of the fetal estrogen estetrol in a multiple-rising-dose study in postmenopausal women. Maturitas. 2016; 91: 93–100.
17. allopregnanolone in intact and ovariectomized rats. J Steroid Biochem Mol Biol. 2014; 143: 285–290.
18. Pluchino N, Drakopoulos P, Casarosa E, et al. Effect of estetrol on Beta-Endorphin level in female rats. Steroids. 2015; 95: 104–110.
19. Valéra M-C, Noirrit-Esclassan E, Dupuis M, et al. Effect of estetrol, a selective nuclear estrogen receptor modulator, in mouse models of arterial and venous thrombosis. Mol Cell Endocrinol. 2018; 477: 132–139.
20. Douxfils J, Klipping C, Duijkers I, et al. Evaluation of the effect of a new oral contraceptive containing estetrol and drospirenone on hemostasis parameters. Contraception. 2020; 102 (6): 396–402.
21. Mawet M, Maillard C, Klipping C, et al. Unique effects on hepatic function, lipid metabolism, bone and growth endocrine parameters of estetrol in combined oral contraceptives. Eur J Contracept Reprod Health Care. 2015; 20 (6): 463–475.
22. Klipping C, Duijkers I, Mawet M, et al. Endocrine and metabolic effects of an oral contraceptive containing estetrol and drospirenone. Contraception. 2021; 103 (4): 213–221.
23. Voedisch AJ, Fok WK. Oestrogen component of COCs: have we finally found a replacement for ethinyl estradiol? Curr Opin Obstet Gynecol. 2021; 33 (6): 433–439.
24. Fruzzetti F, Fidecicchi T, Montt Guevara MM, et al. Estetrol: a new choice for contraception. J Clin Med. 2021; 10 (23): 5625.
25. Schmidt M, Lenhard H, Hoenig A, et al. Tumor suppression, dose-limiting toxicity and wellbeing with the fetal estrogen estetrol in patients with advanced breast cancer. J Cancer Res Clin Oncol. 2021; 147 (6): 1833–1842.
26. Jozan S, Kreitmann B, Bayard F. Different effects of oestradiol, oestriol, oestetrol and of oestrone on human breast cancer cells (MCF-7) in long term tissue culture. Acta Endocrinol. 1981; 98 (1): 73–80.
27. Coelingh Bennink HJT, Singer C, Simoncini T, et al. Estetrol, a pregnancy-specific human steroid, prevents and suppresses mammary tumor growth in a rat model. Climacteric. 2008; 11 (sup1): 29.
28. Gérard C, Arnal J-F, Jost M, et al. Profile of estetrol, a promising native estrogen for oral contraception and the relief of climacteric symptoms of menopause. Expert Rev Clin Pharmacol. 2022; 15 (2): 121–137.
29. Gerard C, Blacher S, Communal L, et al. Estetrol is a weak estrogen antagonizing estradiol-dependent mammary gland proliferation. J Endocrinol. 2015; 224 (1): 85–95.
30. Giretti MS, Montt Guevara MM, Cecchi E, et al. Effects of estetrol on migration and invasion in T47-D breast cancer cells through the actin cytoskeleton. Front Endocrinol. 2014; 5: 80. 5:
31. Yue W, Verhoeven C, Bernnink HC, et al. Pro-apoptotic effects of estetrol on long-term estrogen-deprived breast cancer cells and at low doses on hormone-sensitive cells. Breast Cancer. 2019; 13: 1178223419844198.
32. Visser M, Kloosterboer HJ, Bennink HJ. Estetrol prevents and suppresses mammary tumors induced by DMBA in a rat model. Horm Mol Biol Clin Investig. 2012; 9 (1): 95–103.
33. Gallez A, Blacher S, Maquoi E, et al. Estetrol combined to progestogen for menopause or contraception indication is neutral on breast cancer. Cancers. 2021; 13 (10): 2486.
34. Grandi G, Del Savio MC, Lopes da Silva-Filho A, et al. Estetrol (E4): the new estrogenic component of combined oral contraceptives. Expert Rev Clin Pharmacol. 2020; 13 (4): 327–330.
35. Morch LS, Skovlund CW, Hannaford PC, et al. Contemporary hormonal contraception and the risk of breast cancer. N Engl J Med. 2017; 377 (23): 2228–2239.
36. Hammond GL, Hogeveen KN, Visser M, et al. Estetrol does not bind sex hormone binding globulin or increase its production by human HepG2 cells. Climacteric. 2008; 11 (Suppl 1): 41–46.
37. Visser M, Foidart JM, Coelingh Bennink HJ. In vitro effects of estetrol on receptor binding, drug targets and human liver cell metabolism. Climacteric. 2008; 11 (Suppl 1): 64–68.
38. Stanczyk FZ, Archer DF, Bhavnani BR. Ethinyl estradiol and 17beta-estradiol in combined oral contraceptives: pharmacokinetics, pharmacodynamics and risk assessment. Contraception. 2013; 87 (6): 706–727.
39. Bagot CN, Marsh MS, Whitehead M, et al. The effect of estrone on thrombin generation may explain the different thrombotic risk between oral and transdermal hormone replacement therapy. J Thromb Haemost. 2010; 8 (8): 1736–1744.
40. Gedeon Richter Plc. Drovelis Summary of Product characteristics; [updated 29 April 2022. cited 2022 May 19]. Available from: https: //www.ema.europa.eu/en/documents/productinformation/drovelis-epar-product-information_en.pdf.
41. Muhn P, Fuhrmann U, Fritzemeier KH, et al. Drospirenone: a novel progestogen with antimineralocorticoid and antiandrogenic activity. Ann NY Acad Sci. 1995; 761: 311–335.
42. Regidor PA, Schindler AE. Antiandrogenic and antimineralocorticoid health benefits of COC containing newer progestogens: dienogest and drospirenone. Oncotarget. 2017; 8 (47): 83334–83342.
43. Sitruk-Ware R. Pharmacology of different progestogens: the special case of drospirenone. Climacteric. 2005; 8 (Suppl 3): 4–12.
44. Bitzer J, Simon JA. Current issues and available options in combined hormonal contraception. Contraception. 2011; 84 (4): 342–356.
45. Archer DF, Ahrendt HJ, Drouin D. Drospirenone-only oral contraceptive: results from a multicenter noncomparative trial of efficacy, safety and tolerability. Contraception. 2015; 92 (5): 439–444.
46. Regidor PA, Colli E, Schindler AE. Drospirenone as estrogenfree pill and hemostasis: coagulatory study results comparing a novel 4mg formulation in a 24þ4 cycle with desogestrel 75 mug per day. Gynecol Endocrinol. 2016; 32 (9): 749–751.
47. Palacios S, Colli E, Regidor PA. Efficacy and cardiovascular safety of the new estrogen-free contraceptive pill containing 4mg drospirenone alone in a 24/4 regime. BMC Womens Health. 2020; 20 (1): 218.
48. Wiesinger H, Berse M, Klein S, et al. Pharmacokinetic interaction between the CYP3A4 inhibitor ketoconazole and thehormone drospirenone in combination with ethinylestradiol or estradiol. Br J Clin Pharmacol. 2015; 80 (6): 1399–1410.
49. Duijkers IJ, Klipping C, Zimmerman Y, et al. Inhibition of ovulation by administration of estetrol in combination with drospirenone or levonorgestrel: results of a phase II dose-finding pilot study. Eur J Contracept Reprod Health Care. 2015; 20 (6): 476–489.
50. Apter D, Zimmerman Y, Beekman L, et al. Bleeding pattern and cycle control with estetrol-containing combined oral contraceptives: results from a phase II, randomised, dose-finding study (FIESTA). Contraception. 2016; 94 (4): 366–373.
51. Apter D, Zimmerman Y, Beekman L, et al. Estetrol combined with drospirenone: an oral contraceptive with high acceptability, user satisfaction, well-being and favourable body weight control. Eur J Contracept Reprod Health Care. 2017; 22 (4): 260–267.
52. Kluft C, Zimmerman Y, Mawet M, et al. Reduced hemostatic effects with drospirenone-based oral contraceptives containing estetrol vs. ethinyl estradiol. Contraception. 2017; 95 (2): 140–147.
53. Duijkers I, Klipping C, Kinet V, et al. Effects of an oral contraceptive containing estetrol and drospirenone on ovarian function. Contraception. 2021; 103 (6): 386–393.
54. Huber LR, Hogue CJ, Stein AD, et al. Contraceptive use and discontinuation: findings from the contraceptive history, initiation, and choice study. Am J Obstet Gynecol. 2006; 194 (5): 1290–1295.
55. Hall KS, White KO, Rickert VI, et al. An exploratory analysis of associations between eating disordered symptoms, perceived weight changes, and oral contraceptive discontinuation among young minority women. J Adolesc Health. 2013; 52 (1): 58–63.
56. Gemzell-Danielsson K, Apter D, Zatik J, et al. Estetrol-Drospirenone combination oral contraceptive: a clinical study of contraceptive efficacy, bleeding pattern, and safety in Europe and Russia. BJOG. 2022; 129 (1): 63–71.
57. Creinin MD, Westhoff CL, Bouchard C, et al. Estetrol-Drospirenone combination oral contraceptive: North American efficacy and safety results. Contraception. 2021; 104 (3): 222–228.
58. European Medicines Agency (EMA). Drovelis Assessment Report; [updated 25 March 2021. cited 2021 Nov 24]. Available from: https: //www.ema.europa.eu/en/documents/assessment-report/drovelis-epar-public-assessment-report_en.pdf.
59. Anttila L, Kunz M, Marr J. Bleeding pattern with drospirenone 3mgþethinyl estradiol 20 mcg 24/4 combined oral contraceptive compared with desogestrel 150 mcgþethinyl estradiol 20 mcg 21/7 combined oral contraceptive. Contraception. 2009; 80 (5): 445–451.
60. Mansour D, Westhoff C, Kher U, et al. Pooled analysis of two randomized, open-label studies comparing the effects of nomegestrol acetate/17beta-estradiol and drospirenone/ ethinyl estradiol on bleeding patterns in healthy women. Contraception. 2017; 95 (4): 390–397.
61. Nelson A, Parke S, Makalova D, et al. Efficacy and bleeding profile of a combined oral contraceptive containing oestradiol valerate/dienogest: a pooled analysis of three studies conducted in North America and Europe. Eur J Contracept Reprod Health Care. 2013; 18 (4): 264–273.
62. Marr J, Gerlinger C, Kunz M. A historical cycle control comparison of two drospirenone-containing combined oral contraceptives: ethinylestradiol 30 mug/drospirenone 3mg administered in a 21/7 regimen versus ethinylestradiol 20 mug/drospirenone 3mg administered in a 24/4 regimen. Eur J Obstet Gynecol Reprod Biol. 2012; 162 (1): 91–95.
63. De Leo V, Musacchio MC, Cappelli V, et al. Hormonal contraceptives: pharmacology tailored to women’s health. Hum Reprod Update. 2016; 22 (5): 634–646.
64. Ahrendt HJ, Makalova D, Parke S, et al. Bleeding pattern and cycle control with an estradiol-based oral contraceptive: a seven-cycle, randomized comparative trial of estradiol valerate/dienogest and ethinyl estradiol/levonorgestrel. Contraception. 2009; 80 (5): 436–444.
65. Palacios S, Wildt L, Parke S, et al. Efficacy and safety of a novel oral contraceptive based on oestradiol (oestradiol valerate/dienogest): a Phase III trial. Eur J Obstet Gynecol Reprod Biol. 2010; 149 (1): 57–62.
66. Bachmann G, Sulak PJ, Sampson-Landers C, et al. Efficacy and safety of a low-dose 24-day combined oral contraceptive containing 20 micrograms ethinylestradiol and 3mg drospirenone. Contraception. 2004; 70 (3): 191–198.
67. European Medicines Agency (EMA). Assessment Report. Zoely. Procedure No. EMEA/H/C/001213 p44, Table 8; [cited 2022 May 19]. Available from: https: //www.ema.europa.eu/en/documents/assessment-report/zoely-epar-public-assessment-report_en.pdf.
68. Bitzer J. Pharmacological profile of estrogens in oral contraception. Minerva Ginecol. 2011; 63 (3): 299–304.
69. Hugon-Rodin J, Gompel A, Plu-Bureau G. Epidemiology of hormonal contraceptives-related venous thromboembolism. Eur J Endocrinol. 2014; 171 (6): R221–R230.
70. Paton DM. Estetrol and drospirenone: a novel oral contraceptive. Drugs Today. 2022; 58 (1): 1–8.
71. Guideline on Clinical Investigation of Steroid Contraceptives in Women. Available from: https: //www.ema.europa.eu/en/documents/scientific-guideline/guideline-clinical-investigation-steroid-contraceptives-women_en.pdf.
72. Douxfils J, Morimont L, Bouvy C. Oral contraceptives and venous thromboembolism: focus on testing that may enable prediction and assessment of the risk. Semin Thromb Hemost. 2020; 46 (8): 872–886.
73. Klipping C, Duijkers I, Parke S, et al. Hemostatic effects of a novel estradiol-based oral contraceptive: an open-label, randomized, crossover study of estradiol valerate/dienogest versus ethinylestradiol/levonorgestrel. Drugs RD. 2011; 11 (2): 159–170.
74. Junge W, Mellinger U, Parke S, et al. Metabolic and haemostatic effects of estradiol valerate/dienogest, a novel oral contraceptive: a randomized, open-label, single-Centre study. Clin Drug Investig. 2011; 31 (8): 573–584.
75. Castoldi E, Rosing J. APC resistance: biological basis and acquired influences. J Thromb Haemost. 2010; 8 (3): 445–453.
76. Morimont L, Haguet H, Dogne JM, et al. Combined oral contraceptives and venous thromboembolism: review and perspective to mitigate the risk. Front Endocrinol. 2021; 12: 769187.
77. Morimont L, Dogne JM, Douxfils J. Letter to the editors-in-Chief in response to the article of Abou-Ismail, et al. entitled “estrogen and thrombosis: a bench to bedside review” (thrombosis research 192 (2020) 40–51). Thrombosis Research. 2020; 193: 221–223.
78. De Bastos M, Stegeman BH, Rosendaal FR, et al. Combined oral contraceptives: venous thrombosis. Cochrane Database Syst Rev. 2014; 3 (3): CD010813.
79. Reed SK, DiBello J, Becker K, et al. Prospective controlled cohort study on the safety of a monophasic oral contraceptive containing nomegestrol acetate (2.5mg) and 17b-oestradiol (1.5mg) (PRO-E2 study): risk of venous and arterial thromboembolism. Eur J Contracept Reprod Health Care. 2021; 26 (6): 439–446.
80. Heinemann K, Franke C, Moehner S, et al. Cardiovascular safety in users of different combined oral contraceptives – Final results from the INAS-SCORE study abstract FC-03, book of abstracts: 15th congress of the European society of contraception and reproductive health. Eur J Contracept Reprod Health Care. 2018; 23 (Suppl 1): 40.
81. Fruzzetti F, Cagnacci A. Venous thrombosis and hormonal contraception: What’s new with estradiol-based hormonal contraceptives? Open Access J Contracept. 2018; 9: 75–79.
82. Shamseddin M, De Martino F, Constantin C, et al. Contraceptive progestins with androgenic properties stimulate breast epithelial cell proliferation. EMBO Mol Med. 2021; 13 (7): e14 314.
83. Burrows LJ, Basha M, Goldstein AT. The effects of hormonal contraceptives on female sexuality: a review. J Sex Med. 2012; 9 (9): 2213–2223.
84. Caruso S, Cianci S, Cariola M, et al. Improvement of low sexual desire due to antiandrogenic combined oral contraceptives after switching to an oral contraceptive containing 17betaestradiol. J Womens Health. 2017; 26 (7): 728–734.
85. Sanders SA, Graham CA, Bass JL, et al. A prospective study of the effects of oral contraceptives on sexuality and well-being and their relationship to discontinuation. Contraception. 2001; 64 (1): 51–58.
86. Graham CA, Ramos R, Bancroft J, et al. The effects of steroidal contraceptives on the well-being and sexuality of women: double-blind, placebo-controlled, two-Centre study of combined and progestogen-only methods. Contraception. 1995; 52 (6): 363–369.
87. Caruso S, Agnello C, Intelisano G, et al. Sexual behavior of women taking low-dose oral contraceptive containing 15 microg ethinylestradiol/60 microg gestodene. Contraception. 2004; 69 (3): 237–240.
88. Lee J-J, Low LL, Ang SB. Oral contraception and female sexual dysfunction in reproductive women. Sex Med Rev. 2017; 5 (1): 31–44.
89. Nappi RE, Serrani M, Jensen JT. Noncontraceptive benefits of the estradiol valerate/dienogest combined oral contraceptive: a review of the literature. Int J Womens Health. 2014; 6: 711–718.
90. Trussell J, Westoff CF. Contraceptive practice and trends in coital frequency. Fam Plann Perspect. 1980; 12 (5): 246–249.
91. Oddens BJ. Women’s satisfaction with birth control: a population survey of physical and psychological effects of oral contraceptives, intrauterine devices, condoms, natural family planning, and sterilization among 1466 women. Contraception. 1999; 59 (5): 277–286.
92. Caruso S, Iraci Sareri M, Agnello C, et al. Conventional vs. extended-cycle oral contraceptives on the quality of sexual life: comparison between two regimens containing 3mg drospirenone and 20 microg ethinyl estradiol. J Sex Med. 2011; 8 (5): 1478–1485.
93. Jensen JT, Bitzer J, Serrani M. Comparison of the pharmacologic and clinical profiles of new combined oral contraceptives containing estradiol. Open Access J Contracept. 2013; 4: 39–50.
94. Davis SR, Bitzer J, Giraldi A, et al. Change to either a nonandrogenic or androgenic progestin-containing oral contraceptive preparation is associated with improved sexual function in women with oral contraceptive-associated sexual dysfunction. J Sex Med. 2013; 10 (12): 3069–3079.
95. Robertson E, Thew C, Thomas N, et al. Pilot data on the feasibility and clinical outcomes of a nomegestrol acetate oral contraceptive pill in women with premenstrual dysphoric disorder. Front Endocrinol. 2021; 12: 704488.
96. Zethraeus N, Dreber A, Ranehill E, et al. Combined oral contraceptives and sexual function in women-a double-blind, randomized, placebo-controlled trial. J Clin Endocrinol Metab. 2016; 101 (11): 4046–4053.
97. Pastor Z, Holla K, Chmel R. The influence of combined oral contraceptives on female sexual desire: a systematic review. Eur J Contracept Reprod Health Care. 2013; 18 (1): 27–43.
98. Garmshausen J, Kloas W, Hoffmann F. 17alpha-Ethinylestradiol can disrupt hemoglobin catabolism in amphibians. Comp Biochem Physiol C Toxicol Pharmacol. 2015; 171: 34–40.
99. Wedekind C. Fish populations surviving estrogen pollution. BMC Biol. 2014; 12: 10.
100. Kestemont P, Creinin MD, Nfon E, et al. P51. The potential environmental impact of estetrol, a native estrogen in development for oral contraception. Contraception. 2020; 102 (4): 293.
101. Bayer Limited. Yaz. Summary of Product Characteristics; [updated 19 November 2021. cited 2022 May 19]. Available from: https: //www.medicines.ie/medicines/yaz-0-02mg-3mgfilm-coated-tablets-34275/spc.
102. Bayer plc. Yasmin. Summary of Product Characteristics; [updated 23 November 2021cited 2022 May 19. Available from: www.medicines.org.uk/emc/product/1607/smpc#gref.
103. Bayer Limited. Yasminelle. Summary of Product Characteristics; [updated 19 November 2021. cited 2022 May 19. Available from: https: //www.medicines.ie/medicines/yasminelle-0-02- mg-3- mg- film-coated-tablets-34274/spc.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2022 Číslo 6
Nejčtenější v tomto čísle
- Nová kombinovaná perorální antikoncepce obsahující estetrol: přehledový článek evropského panelu odborníků
- Endometrióza v postmenopauze
- Vybrané patologické stavy ovlivňující receptivitu endometria
- Karcinom vulvy a jeho recidivy – zásady operační léčby
