Epidemiologie a význam chirurgických okrajů v managementu HPV asociovaných vulvárních prekanceróz (HSIL) – analýza vlastního souboru
Epidemiology and significance of surgical margins in the management of HPV-associated vulvar precancers (H-SIL) – analysis of own data
Objective: Epidemiology and evaluation of the importance of surgical margins in the treatment of vulvar H-SIL – analysis of own data. Material and methods: The prospective study included women diagnosed with HPV-associated vulvar epithelial neoplasia from 10/2016 to 1/2022. A total of 65 women were included. After surgical treatment, the women were distributed to groups according to surgical margins and were followed-up at regular intervals. Results: Seventeen women (26%) diagnosed with HPV-associated vulvar intraepithelial neoplasia were under 49 years, whereas 48 women (74%) were older than 49 years. Recurrence rates of HPV-associated precancers were 12.3%, 1.5% and 3.1% in excisions with positive margins up to 1 mm peripheral margins and 1–3 mm peripheral margins, respectively. The risk of recurrence when the lesion reaches the margin is statistically significant, compared to a healthy margin of 1–3 mm. Conclusion: Keeping the minimal healthy margin (1–3 mm) seems to be an acceptable risk of recurrence of HPV-associated vulvar intraepithelial neoplasia with positive cosmetic effect and minimal risk of disturbing the psychosexual functions of women. Long-term regular follow-up is necessary.
Keywords:
Epidemiology – vulvar intraepithelial neoplasia – H-SIL – surgical margins
Autoři:
Tomáš Pichlík 1,2
; Lukáš Rob 1
; Michael Jiří Halaška 1
; Jana Drozenová 3
; Helena Robová 1
Působiště autorů:
Gynekologicko-porodnická klinika 3. LF UK a FNKV, Praha
1; Lékařská fakulta, UK v Plzni
2; Ústav patologie 3. LF UK a FNKV, Praha
3
Vyšlo v časopise:
Ceska Gynekol 2022; 87(6): 384-387
Kategorie:
Původní práce
doi:
https://doi.org/10.48095/cccg2022384
Souhrn
Cíl: Epidemiologie a zhodnocení významu chirurgických okrajů v léčbě HSIL vulvy – analýza vlastního souboru. Soubor a metodika: Do studie byly prospektivně zařazovány ženy s nálezem histologicky potvrzené HPV asociované prekancerózy vulvy od 10/2016 do 1/2022. Celkem bylo zařazeno 65 žen. Po chirurgickém ošetření byly ženy podle chirurgického okraje rozděleny do skupin a sledovány v pravidelných intervalech. Výsledky: Sedmnáct žen (26 %) s diagnostikovanou HPV asociovanou prekancerózou vulvy bylo ve věku do 49 let, 48 žen (74 %) bylo ve věku nad 49 let. Recidivy HPV asociovaných prekanceróz byly v excizích s dosahem HSIL do okraje, resp. okrajem do 1 mm vč. a okrajem 1–3 mm diagnostikovány ve 12,3 %, resp. 1,5 % a 3,1 % případů. Riziko recidivy při dosahu léze do okraje je ve srovnání se zdravým okrajem 1–3 mm statisticky významné. Závěr: Při zachování minimálního zdravého okraje (1–3 mm) je riziko recidivy HPV asociovaných prekanceróz vulvy akceptovatelné při současném příznivém kosmetickém efektu a minimalizaci narušení psychosexuální funkcí žen. Nutností jsou dlouhodobé pravidelné kontroly.
Klíčová slova:
epidemiologie – vulvární itraepiteliální neoplazie – HSIL – chirurgické okraje
Úvod
Poprvé byla prekancerózy vulvy popsaná před 100 lety v roce 1922 jako dyskeratóza erythroplasiforme de la muqueusa [1]. Od té doby klasifikace vulvárních intraepiteliálních neoplazií (VIN) prodělala značný vývoj [2]. Aktuálně užívaná terminologie LAST (lower anogenital squamous terminilogy) dělí prekancerózy vulvy na HPV asociované (LSIL – low-grade intraepithelial lesions, HSIL – high-grade intraepithelial lesions) a prekancerózy non HPV asociované (d-VIN – differentiated VIN) [3,4]. Během vývoje léčby HSIL došlo k ústupu od rozsáhlých chirurgických zákroků (vulvektomie), které nahradily konzervativní zákroky na vulvě (excize) [5]. Důvodem bylo zjištění, že vulvektomie nezabrání vniku recidiv HSIL a přítomnost pozitivních okrajů není prediktivním faktorem ke vzniku invaze [6]. Navíc dochází u žen k nárůstu psychosexuální morbidity [7,8]. Excize patří ke standardu léčby a je nejčastěji prováděným zákrokem na vulvě. Přesto i v dnešní době zůstává v klinických postupech léčby HSIL řada nezodpovězených otázek, které s sebou přináší odlišné postupy v managementu těchto lézí. Ideálním léčebným postupem je takový, který kompletně odstraní lézi, povede k vymizení symptomů, vyloučí invazi, bude maximálně šetrný k původní tkáni, zachová původní funkci vulvy, bude minimalizovat možný psychosexuální dopad chirurgické léčby a zabrání recidivám [9]. Do dnešního dne žádná z léčebných modalit nedosahuje takových výsledků. Recidivy po chirurgickém zákroku na vulvě bez ohledu na typ výkonu nebo léčby dosahují 20–50 % [10,11,5]. Zda se jedná o recidivu původní HPV infekce, nebo „novou“ reinfekci, není zcela jasné [12]. Mezi udávané rizikové faktory patří dosah HSIL do okrajů, věk > 50 let, HIV pozitivita, imunosuprese, multifokalita a předchozí radioterapie vulvy [11,13,14]. V současné době není shoda na optimální velikosti laterálních okrajů HSIL. Jako dostatečně zdravý lem je v literatuře uváděno 5 mm, robustní data podporující toto tvrzení však chybí [15–17].
Soubor pacientek a metodika
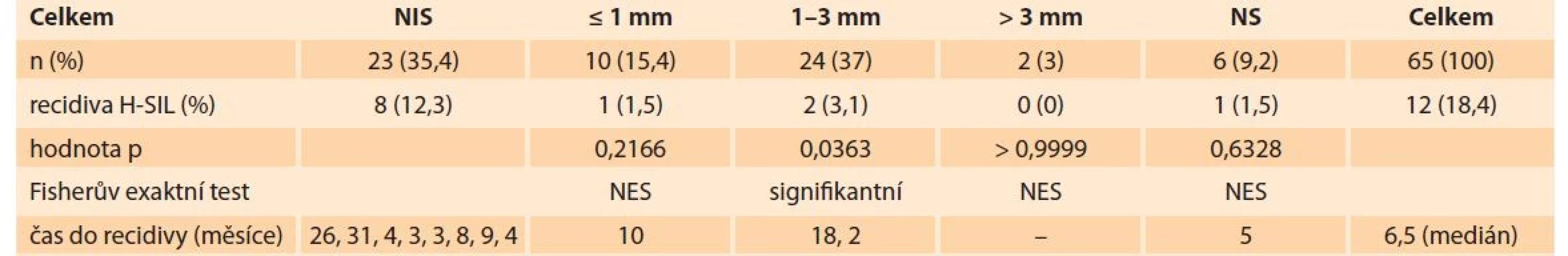
Celkem do studie od 10/2016 do 1/2021 bylo prospektivně zařazeno 65 žen s histologicky potvrzeným HSIL. U 53 žen (81,5 %) byla provedena excize, u sedmi (10,8 %) žen byla provedena vulvektomie, u pěti (7,7 %) žen laser skinning vulvektomie. Podle histologicky popsaného dosahu nebo vzdálenosti HSIL od okraje byly ženy rozděleny do skupin. U 23 (35,4 %) žen dosahoval HSIL do okraje (NIS – non in sano), u 10 (15,4 %) žen byl okraj ≤ 1 mm, u 24 (37 %) žen byl okraj 1–3 mm, u dvou (3 %) žen byl okraj > 3 mm a šest (9,2 %) žen bylo ve skupině, kde se okraje nedaly blíže specifikovat (NS) (tab. 1). Multifokální léze byly zařazeny do skupiny podle nejmenšího popsaného okraje. Po zákroku byly ženy sledovány v kolposkopické ambulanci v pravidelných 3–6měsíčních intervalech. Při každém vyšetření byla provedena expertní vulvoskopie s aplikací 5% kyseliny octové a současně byly ženy dotazovány na přítomnost symptomů, které mohou souviset s přítomností HSIL. V případě podezření na recidivu byla indikovaná histologická verifikace (biopsie/excize). Výsledky mezi jednotlivými skupinami byly vyhodnoceny statisticky pomocí Fischerova exaktního testu.
Tab. 1. HSIL surgical margins – recurrences of HSIL.
Výsledky
Celkem u 17 žen byla indikovaná biopsie/excize pro podezření na recidivu, v histologii u 12 (18,5 %) žen byl potvrzen HSIL, u čtyř (6,2 %) byl potvrzen pouze LSIL, u jedné ženy (1,5 %) byl potvrzen pouze d-VIN.
Medián follow-up byl 23 měsíců (3–56 měsíců). Medián věku byl 59 let (22–87 let). Pouze 26 % žen bylo ve věku do 49 let, 74 % žen bylo starších 50 let (tab. 2).
Tab. 2. Age distribution at time of diagnosis.

U 49 (75,4 %) žen v primární histologii byl HSIL unifokální, u 16 (24,6 %) žen multifokální. Podle okrajů bylo osm (12,3 %) recidiv ve skupině NIS, jedna (1,5 %) recidiva ve skupině s okrajem ≤ 1 mm, dvě (3,1 %) ve skupině s okrajem 1–3 mm, žádná recidiva ve skupině s okrajem > 3 mm a jedna (1,5 %) recidiva ve skupině s nespecifikovaným okrajem (tab. 1). Pomocí Fisherova exaktního testu (p < 0,05) byl statisticky vyhodnocen počet recidiv skupiny NIS vs. ostatní podskupiny. Jako signifikantní (p = 0,0363) byl pouze ve skupině s okrajem 1–3 mm, ve skupině do 1 mm bylo riziko statisticky nesignifikantní.
Medián času od primární léčby do potvrzení recidivy je 6,5 měsíců. Dvě recidivy ze skupiny NIS a jedna recidiva ve skupině 1–3 mm byly diagnostikovány s odstupem 26, resp. 31 a 18 měsíců. Zbylých devět recidiv bylo diagnostikováno do 10 měsíců od primární léčby (tab. 1). Ve skupině s dosahem HSIL do okraje byla ve dvou případech (3,1 %) zastižena mikroinvaze (< 1 mm) v odstupu 3 a 24 měsíců od primárního výkonu.
U třech žen (4,6 %) byla anamnéza předchozího zákroku na vulvě, ve dvou případech pro HSIL, v jednom případě pro HPV asociovaný ca IA s odstupem 11, 12 a 13 let. Ve skupině NIS bylo pět recidiv (62,5 %) lokalizováno v místě předchozího zákroku, tři recidivy (37,5 %) byly lokalizovány v místech vzdálených primárnímu ošetření. Dvě z těchto třech vzdálených recidiv byly multifokální. Při primární chirurgické léčbě byla multifokalita diagnostikovaná v 16 ze 65 (24,6 %) žen. Ze dvanácti recidiv byly čtyři (33,3 %) recidivy primárně multifokální, tři ve skupině NIS, jedna ve skupině s okrajem 1–3 mm.
Diskuze
V našem souboru je medián pro histologicky potvrzený HSIL 59 let (22–87 let), což je v rozporu s literárně udávanými údaji věkové distribuce HSIL. V systematickém review obsahujícím 97 studií s více než 3 200 ženami je průměrný věk v době diagnózy HSIL 46 let [5]. Další studie uvádí výskyt HSIL u žen < 50 let v 75 % [18,19]. Tato data jsou v opačném poměru k našemu zjištění, kdy naopak 76 % žen bylo > 50 let. To lze vysvětlit histopatologickými kritérii nové klasifikace pro skvamózní intraepiteliální léze (SIL), kdy ve starších souborech byly zařazovány i ženy s u-VIN (usual VIN), které dnes řadíme do LSIL a v našem souboru nebyly zahrnuty. V recentně publikované studii je medián věku v době stanovení diagnózy HSIL 49,2 let, ale současně dochází ke zvýšení mediánu věku HSIL mezi lety 1995 a 2006 na 53 let ve srovnání s mediánem věku 44,9 let mezi lety 1991 a 1995 [20]. Dalším možným vysvětlením současné distribuce HSIL ve vyšším věku je stárnutí populace, neboť většina publikovaných studií výskytu HSIL je starých 10–22 let a během této doby se výskyt HSIL mohl přirozeně posunout do vyššího věku výskytu.
Ve studii jsme zaznamenali 18,4 % recidiv HSIL vulvy během mediánu follow-up 23 měsíců, což je ve shodě s údaji udávanými v literatuře [5,14,21]. Nejvyšší počet recidiv (12,3 %) byl ve skupině, kde HSIL dosahoval do okraje, naproti tomu pouze u 4,6 % žen se objevila recidiva při zdravém okraji < 3 mm, při mediánu follow-up 23 měsíců. V literatuře 41,7 % recidiv při pozitivních a 8,9 % recidiv při negativních okrajích bylo zjištěno při mediánu follow-up 15,6, resp. 43,5 měsíců [14]. Obdobně 46 % recidiv při pozitivních okrajích a 17 recidiv při negativních okrajích bylo diagnostikováno při průměrném follow-up 22, resp. 44 měsíců [22]. Prakticky stejné výsledky byly zaznamenány v další studii [5]. U 50 % žen s pozitivními okraji bylo provedeno alespoň jedno chirurgické ošetření během následných 5 let, oproti tomu pouze 15 % žen s negativními okraji vyžadovalo další léčbu [21]. Přítomnost pozitivních okrajů zvyšuje riziko recidiv a současně časnějšího nástupu. V současné době neexistuje jednoznačný konsenzus na velikost zdravých okrajů, přesto se v literatuře doporučuje zdravý lem, alespoň 5 mm v histopatologickém preparátu. Sami dnes považujeme 1–3mm lem zdravé tkáně za bezpečný, který redukuje rozsah zákroku na vulvě, zlepšující kosmetický efekt a snižující možný psychosexuální dopad.
Pouze ve skupině NIS byly zastiženy dvě (3,1 %) recidivy s patrnou mikroinvazí. Riziko progrese HSIL do invaze u žen s předchozím ošetřením pro HSIL se v literatuře udává mezi 2,3 a 6,6 % [20]. Ve stejné studii bylo 10leté kumulační riziko vzniku karcinomu vulvy z HSIL 9,7 %, což je výrazně méně při srovnání s 50% rizikem vzniku karcinomu vulvy na podkladě d-VIN. Multifokální HSIL ve srovnání s unifokálním výskytem není rizikovým faktorem progrese do karcinomu [13].
V našem souboru u třech (4,6 %) žen byla anamnestická data o léčbě prekanceróz vulvy s historií 11, resp. 12 a 13 let, pravděpodobně se tedy jedná o pozdní recidivy. Naše výsledky potvrzují riziko pozdních recidiv. Až 25% riziko pro pozdní recidivy bylo zjištěno v odstupu 44–196 měsíců od primární léčby [14]. Považujeme proto za nutné všechny ženy léčené pro HSIL bez ohledu na velikost zdravého okraje dlouhodobě nebo spíše trvale sledovat v pravidelných 6měsíčních intervalech a optimálně jednou ročně provést expertní kolposkopii. Současně by měly být ženy důkladně poučeny o riziku pozdních recidiv i s mnohaletým odstupem.
Ve skupině NIS jsme diagnostikovali u třech žen z osmi (37,5 %) recidivy na jiném místě vulvy než odpovídalo původní topografii, což je v kontrastu s pozitivními okraji. U dvou ze třech těchto žen byly primární léze multifokální. Multifokalita primárních lézí je rizikovým faktorem pro vznik recidiv [11].
Otázkou zůstává následný management žen, u nichž HSIL dosahoval do okraje, kde je riziko recidiv nejvyšší. Význam vakcinace považujeme za sporný, zejména s ohledem na vyšší věk žen. Za perspektivnější považujeme v těchto případech aplikaci imiquimodu. Terlou et al udávají 89% kompletní léčebnou odpověď žen léčených pro HSIL vulvy imiquimodem při mediánu follow-up > 7 let [23]. Trutnovski et al v recentní studii udávají kompletní léčebnou odpověď HSIL vulvy imiquimodu (80 %) srovnatelnou s chirurgickým ošetřením vulvy (79 %) [24]. Aplikace imiqumodu u žen, u nichž nebyl HSIL kompletně odstraněn, by mohla zvýšit clearence HPV infekce, snížit nutnost opakovaných chirurgických intervencí, a minimalizovat tak morbiditu žen. Bohužel léčba by měla trvat 3–6 měsíců a v současnosti u nás není hrazena, což je pro většinu žen limitací.
Při hodnocení slabších stránek studie je potřeba zmínit omezený počet žen v souboru, relativně krátký follow-up a neuvedenou hloubku preparátů. Protože HPV infekce může postihovat kožní adnexa a zasahovat do vlasovým folikulů, měla by hloubka excize v ochlupené části vulvy dosahovat 4 mm. V neochlupené části vulvy se za dostatečnou hloubku excize považuje 1 mm [15].
Závěr
Recidivy HSIL při pozitivních okrajích zdaleka nedosahují 100 % a obráceně recidivy HSIL a karcinomy vulvy mohou vzniknout po chirurgickém ošetření s dostatečným zdravým lemem. Úspěšná léčba HSIL není závislá pouze na dosažení zdravých okrajů, ale i na biologickém chování HPV HR virové infekce. Proto není předpoklad, že rozsáhlejší excizní výkony zvyšují úspěch léčby HSIL, naopak mohou výrazně zhoršit kvalitu života žen. Progrese HSIL je ve srovnání s d-VIN výrazně nižší, proto se u žen bez přítomnosti rizikových faktorů přikláníme ke konzervativní léčbě vulvy. Při NIS výkonu doporučujeme follow-up v 1. roce à 3 měsíce a indikovat reexcizi až při jasném klinickém nálezu. Za perspektivní v těchto případech považujeme aplikaci imiquimodu. Chirurgické ošetření HSIL s lemem zdravé tkáně 1–3 mm s následnou trvalou dispenzarizací považujeme za výkon dostatečný s příznivým kosmetickým efektem a minimálním dopadem na psychosexuální funkce žen.
ORCID autorů
T. Pichlík 0000-0001-6732-1421
L. Rob 0000-0003-3770-651X
M. J. Halaška 0000-0001-6055-2569
H. Robová 0000-0002-6136-7602
Doručeno/Submitted: 31. 5. 2022
Přijato/Accepted: 8. 6. 2022
MUDr. Tomáš Pichlík
Gynekologicko-porodnická klinika
3. LF UK a FNKV
Šrobárova 1150/50
100 34 Praha 10
Zdroje
1. Hudelo ML, Oury C. Dyskeratose erythroplasiforme de la muqueuse vulvaire. Bull Soc Franc Dermatol Et Syph 1922; 29: 139–142.
2. Ševčík L, Škapa P, Vantuchová Y et al. Dlaždicobuněčné prekancerózy vulvy. Historie a současný stav problematiky. Ceska Gynekol 2016; 81 (3): 172–176.
3. Bornstein J, Bogliatto F, Haefner HK et al. ISSVD Terminology Committee. The 2015 International Society for the Study of Vulvovaginal Disease (ISSVD) terminology of vulvar squamous intraepithelial lesions. Obstet Gynecol 2016; 127 (2): 264–268. doi: 10.1097/AOG.0000 000000001285.
4. Yang EJ, Kong CS, Longacre TA. Vulvar and anal intraepithelial neoplasia: terminology, diagnosis, and ancillary studies. Adv Anat Pathol 2017; 24 (3): 136–150. doi: 10.1097/PAP.00000 00000000149.
5. van Seters M, van Beurden M, de Craen AJ. Is the assumed natural history of vulvar intraepithelial neoplasia III based on enough evidence? A systematic review of 3,322 published patients. Gynecol Oncol 2005; 97 (2): 645–651. doi: 10.1016/j.ygyno.2005.02.012.
6. Ioffe YJ, Erickson BK, Foster KE et al. Low yield of residual vulvar carcinoma and dysplasia upon re-excision for close or positive margins. Gynecol Oncol 2013; 129 (3): 528–532. doi: 10.1016/j.ygyno.2013.02.033.
7. Likes WM, Stegbauer C, Tillmanns T et al. Correlates of sexual function following vulvar excision. Gynecol Oncol 2007; 105 (3): 600–603. doi: 10.1016/j.ygyno.2007.01.027.
8. Green MS, Naumann RW, Elliot M et al. Sexual dysfunction following vulvectomy. Gynecol Oncol 2000; 77 (1): 73–77. doi: 10.1006/gyno. 2000.5745.
9. Todd RW, Luesley DM. Medical management of vulvar intraepithelial neoplasia. J Low Genit Tract Dis 2005; 9 (4): 206–212. doi: 10.1097/01.lgt.0000179858.21833.0d.
10. Hillemanns P, Wang X, Staehle S et al. Evaluation of different treatment modalities for vulvar intraepithelial neoplasia (VIN): CO (2) laser vaporization, photodynamic therapy, excision and vulvectomy. Gynecol Oncol 2006; 100 (2): 271–275. doi: 10.1016/j.ygyno.2005.08.012.
11. Lebreton M, Carton I, Brousse S et al. Vulvar intraepithelial neoplasia: classification, epidemiology, diagnosis, and management. J Gynecol Obstet Hum Reprod 2020; 49 (9): 101801. doi: 10.1016/j.jogoh.2020.101801.
12. Hoang LN, Park KJ, Soslow RA. Squamous precursor lesions of the vulva: current classification and diagnostic challenges. Pathology 2016; 48 (4): 291–302. doi: 10.1016/j.pathol.2016.02.015.
13. van de Nieuwenhof HP, van der Avoort IA, de Hullu JA. Review of squamous premalignant vulvar lesions. Crit Rev Oncol Hematol 2008; 68 (2): 131–156. doi: 10.1016/j.critrevonc.2008.02. 012.
14. Satmary W, Holschneider CH, Brunette LL et al. Vulvar intraepithelial neoplasia: risk factors for recurrence. Gynecol Oncol 2018; 148 (1): 126–131. doi: 10.1016/j.ygyno.2017.10.029.
15. Preti M, Scurry J, Marchitelli CE et al. Vulvar intraepithelial neoplasia. Best Pract Res Clin Obstet Gynaecol 2014; 28 (7): 1051–1062. doi: 10.1016/j.bpobgyn.2014.07.010.
16. Ahr A, Rody A, Kissler S et al. Risk factors for recurrence of vulvar intraepithelial neoplasia III (VIN III). Zentralbl Gynakol 2006; 128 (6): 347–351. doi: 10.1055/s-2006-942280.
17. Olawaiye AB, Cuello MA, Rogers LJ. Cancer of the vulva: 2021 update. Int J Gynaecol Obstet 2021; 155 (Suppl 1): 7–18. doi: 10.1002/ijgo.13881.
18. Judson PL, Habermann EB, Baxter NN et al. Trends in the incidence of invasive and in situ vulvar carcinoma. Obstet Gynecol 2006; 107 (5): 1018–1022. doi: 10.1097/01.AOG.000021026 8.57527.a1.
19. Joura EA, Lösch A, Haider-Angeler MG et al. Trends in vulvar neoplasia. Increasing incidence of vulvar intraepithelial neoplasia and squamous cell carcinoma of the vulva in young women. J Reprod Med 2000; 45 (8): 613–615.
20. Thuijs NB, van Beurden M, Bruggink AH et al. Vulvar intraepithelial neoplasia: incidence and long-term risk of vulvar squamous cell carcinoma. Int J Cancer 2021; 148 (1): 90–98. doi: 10.1002/ijc.33198.
21. Jones RW, Rowan DM, Stewart AW. Vulvar intraepithelial neoplasia: aspects of the natural history and outcome in 405 women. Obstet Gynecol 2005; 106 (6): 1319–1326. doi: 10.1097/01.AOG.0000187301.76283.7f.
22. Modesitt SC, Waters AB, Walton L et al. Vulvar intraepithelial neoplasia III: occult cancer and the impact of margin status on recurrence. Obstet Gynecol 1998; 92 (6): 962–966. doi: 10.1016/s0029-7844 (98) 00350-0.
23. Terlou A, van Seters M, Ewing PC et al. Treatment of vulvar intraepithelial neoplasia with topical imiquimod: seven years median follow-up of a randomized clinical trial. Gynecol Oncol 2011; 121 (1): 157–162. doi: 10.1016/ j.ygyno.2010.12.340.
24. Trutnovsky G, Reich O, Joura EA et al. Topical imiquimod versus surgery for vulvar intraepithelial neoplasia: a multicentre, randomised, phase 3, non-inferiority trial. Lancet 2022; 399 (10337): 1790–1798. doi: 10.1016/S0140- 6736 (22) 00469-X.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2022 Číslo 6
Nejčtenější v tomto čísle
- Nová kombinovaná perorální antikoncepce obsahující estetrol: přehledový článek evropského panelu odborníků
- Endometrióza v postmenopauze
- Vybrané patologické stavy ovlivňující receptivitu endometria
- Karcinom vulvy a jeho recidivy – zásady operační léčby
