Význam HE4 v diferenciální diagnostice patologií endometria
The importance of HE4 in differential diagnosis of endometrial cancer
Objective:
The aim of the present study was to evaluate the use of human epididymis protein 4 (HE4) and cancer antigen 125 (CA 125) biomarkers in differential diagnosis of malignant and benign endometrial tumours in a population of Czech women.
Design:
Prospective study.
Setting:
Department of Gynaecology and Obstetrics, Faculty of Medicine at Masaryk University and Faculty Hospital in Brno.
Methods:
Our prospective study includes 115 patients with endometrioid adenocarcinoma and 106 patients with benign endometrial tumours in the control group. They were diagnosed with endometrial biopsy in the period from 7/2010 to 6/2013. The patients with cancer underwent definitive surgical treatment to determine the stage of disease. The median and ranges of serum levels were determined in relation to the histological result (benign vs malignant disease). Statistical analysis operates with logarithm values of markers because their distribution is not normal and uses logistic regression.
Results:
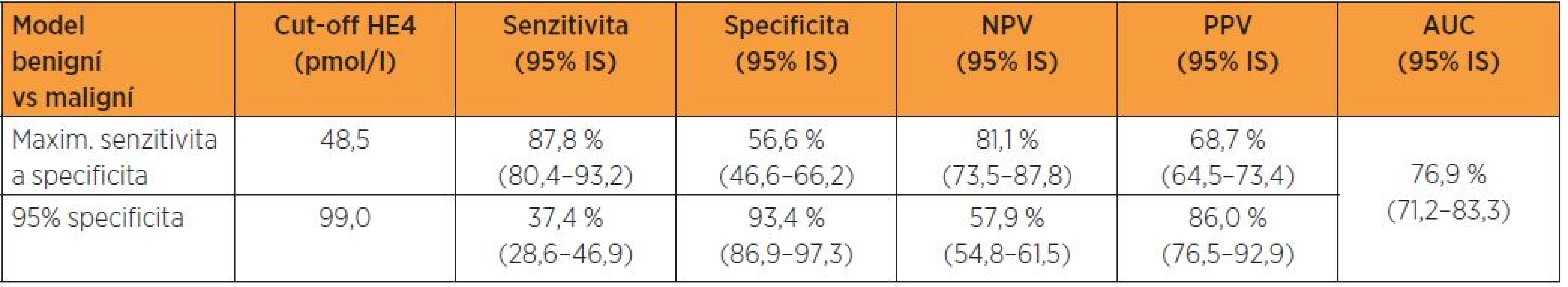
While analysing two groups of patients with different histology, there was demonstrated a statistically significant difference (p < 0.05), only in HE4, by cut-off 48,5 pmol/l there was achieved sensitivity of 87.8%, specificity of 56.6% and negative predictive value of 81.1%.
Coclusion:
Diagnostic benefit of HE4 can be considered especially in patients with increased risk of endometrial cancer and in patients with serious internal co-morbidities. HE4 could help in combination with clinical and ultrasound finding in the differentiation of prognostically various groups of patients and in decision-making in relation to the individualization of the treatment plan. However, the optimal cut-off for HE4 has not been solved yet, and to do so, it will require more research with larger studies and their comparative analysis..
Keywords:
benign endometrial tumours, endometrial cancer, human epididymis protein 4 (HE4), cancer antigen 125 (CA 125), surgical staging, stage of disease
Authors:
Luboš Minář 1
; I. Klabenešová 2; E. Jandáková 3
Authors‘ workplace:
Gynekologicko-porodnická klinika LF MU a FN, Brno, přednosta prof. MUDr. P. Ventruba, DrSc.
1; Oddělení klinické biochemie FN, Brno, primář doc. MUDr. M. Dastych, CSc.
2; Ústav patologie LF MU a FN, Brno, přednosta doc. MUDr. L. Křen, PhD.
3
Published in:
Ceska Gynekol 2015; 80(4): 256-263
Overview
Cíl studie:
Cílem studie bylo zhodnotit využití lidského epididymálního proteinu 4 (HE4) v diferenciální diagnostice biologické povahy patologií endometria při současném srovnání s konvenčním nádorovým antigenem 125 (CA 125) v populaci českých žen.
Typ studie:
Původní práce.
Název a sídlo pracoviště:
Gynekologicko-porodnická klinika klinika LF MU a FN Brno.
Metodika:
Do naší prospektivní studie bylo v období 7/2010 – 6/2013 zařazeno 115 pacientek s endometroidním adenokarcinomem endometria a 106 pacientek v kontrolním souboru s benigní lézí endometria. Histologický nález byl získán vyšetřením biopsie endometria. U všech pacientek byla po bioptické verifikaci stanovena sérová hladina HE4 a CA 125 a pacientky s malignitou byly indikovány k chirurgickému stagingu k určení stadia nemoci. Medián a rozsahy sérových hladin obou biomarkerů byly analyzovány ve vztahu k biologické povaze nemoci. Statistická analýza pracuje s logaritmovanými hodnotami stanovených markerů vzhledem k tomu, že HE4 a CA 125 v obou souborech nevykazují normální rozdělení a využívá logistické regrese.
Výsledky:
Při analýze dvou souborů biologicky odlišné povahy byl prokázán vysoce signifikantní rozdíl (p < 0,05) pouze v případě HE4, při cut-off48,5 pmol/l bylo dosaženo senzitivity 87,8 %, specificity 56,6 % a negativní prediktivní hodnoty 81,1 %.
Závěr:
Diagnostický přínos biomarkeru HE4 lze zvažovat zejména v kohortě pacientek se zvýšeným rizikem karcinomu endometria a u pacientek výrazně interně kompromitovaných s limitací operačního výkonu. Tento marker by tedy mohl v kombinaci s ultrazvukovým vyšetřením pomoci v diferenciaci prognosticky odlišných skupin pacientek a v individualizaci léčebného postupu. Nevyřešená však zůstává otázka optimálního cut-off, k čemuž by měly přispět výsledky dalších rozsáhlejších studií a jejich komparativní analýza.
Klíčová slova:
benigní léze endometria, karcinom endometria, lidský epididymální protein 4 (HE4), nádorový antigen 125 (CA 125), chirurgický staging, stadium nemoci
ÚVOD
Česká republika se vyznačuje vysokou incidencí maligních onemocnění ženských pohlavních orgánů ve světovém i evropském kontextu. Karcinom endometria je nejčastější gynekologický nádor v ČR, jeho incidence patří společně s incidencí v USA dokonce mezi nejvyšší na světě [27]. V posledních pěti letech se incidence v České republice pohybuje v rozmezí 34–35/100 tisíc žen/rok, což v absolutním počtu představuje 1750–1870 nových onemocnění. Mortalita se pohybuje v rozmezí 8,5–10,5/100 tisíc žen/rok, což odpovídá celkovému počtu 470–550 úmrtí [9]. Prognóza pacientek s karcinomem endometria je ve srovnání s dalšími gynekologickými malignitami poměrně příznivá, což je podmíněno dominujícím záchytem nemoci v I. stadiu podle FIGO 2009, které zahrnuje téměř 75 % všech pacientek. Pětileté přežití v I. stadiu nemoci se týká přibližně 86 % pacientek, ve II. stadiu zahrnuje 66 % pacientek, ve III. stadiu 44 % pacientek a ve IV. stadiu se týká již pouze 16 % pacientek [6]. Prostředkem k dalšímu zlepšení parametrů mortality a morbidity u gynekologických malignit je snaha o centralizaci péče do onkogynekologických center, což se v případě karcinomu endometria týká pacientek s high risk statutem nemoci [11]. Nejčastější histologickou variantou karcinomu endometria je endometroidní adenokarcinom, který představuje více než 75 % všech karcinomů této oblasti [8]. I přes neexistenci efektivního a zároveň ekonomického screeningu a poměrně příznivou prognózu onemocnění se i v této oblasti výzkum zaměřuje na detekci markeru pro screening a včasnou diagnózu, z něhož by mohly profitovat zejména ženy se zvýšeným rizikem (např. pacientky s karcinomem prsu v léčbě Tamoxifenem, ženy postižené Lynchovým syndromem nebo s pozitivním výsledkem mutační analýzy BRCA).
PŘEHLED SOUČASNÉHO STAVU PROBLEMATIKY
Jednou z charakteristických vlastností zhoubných nádorů je produkce tzv. nádorových markerů. Konvenčním nádorovým markerem v onkogynekologii v problematice patologií endometria je antigen CA 125. Biochemicky se jedná o glykoprotein, který jako nádorový marker není orgánově ani nádorově specifický. Z hlediska gynekologických malignit je CA 125 především markerem ovariálního karcinomu, negativní hodnoty však nevylučují maligní nález, protože až u 50 % žen s ovariálním karcinomem I. stadia je tento marker negativní. Elevace CA 125 se může vyskytovat rovněž u adenokarcinomů endocervixu, zvýšené hodnoty zjišťujeme i u karcinomu prsu [21]. Vysoké hladiny CA 125 před zahájením terapie v případě karcinomu endometria mohou signalizovat extrauterinní diseminaci [10, 16], diskutován byl i přínos ve follow-up, který však nebyl potvrzen [1, 20]. Z negynekologických malignit mohou být zvýšené hodnoty CA 125 u karcinomů v oblasti gastrointestinálního traktu (pankreas, žaludek, střevo) nebo u bronchogenního karcinomu, CA 125 je produkován rovněž při primárním nebo sekundárním maligním postižení serózních blan, tj. peritonea, pleury a perikardu. Zvýšené hodnoty CA 125 jsou však detekovány i u zdravých žen za fyziologických stavů (např. menstruace, gravidita), zvýšené hladiny CA 125 v séru způsobené nemaligním gynekologickým onemocněním mohou být asociovány s benigními ovariálními nádory, endometriózou nebo leiomyomem. Elevaci hladiny CA 125 nalézáme rovněž u patologických stavů jiných orgánových systémů, např. u chronických onemocnění jater, autoimunitních nemocí, peritonitidy nebo renálního selhání. Byla publikována řada studií zaměřených na vyhledávání nových kandidátů na nádorové markery, které by se vyznačovaly vyššími parametry senzitivity a specificity ve vztahu k diagnostice karcinomu endometria. Mezi markery, jejichž diagnostická hodnota byla předmětem výzkumu, patří např. apolipoprotein-1, prealbumin, transferin [12], prolaktin [25], sérový amyloid A [24] nebo Soluble Mesothelin Related Peptides (SMRP) [22].
Analyzovaným markerem v naší práci je lidský epididymální protein 4 a jeho diagnostický přínos u dominantního endometroidního histotypu karcinomu endometria. HE4 patří do skupiny proteinů označovaných jako „whey acidic four-disulfide core“ (WFDC) s vlastnostmi podobnými inhibitoru trypsinu [4, 17]. Příslušný gen, který jej kóduje, je jedním ze 14 homologních genů dlouhého raménka chromozomu 20. Tyto geny kódují další proteiny s funkcí proteázových inhibitorů, které sehrávají roli v imunitních pochodech a vyznačují se antimikrobiální a protizánětlivou aktivitou [3]. Jeho produkce byla zjištěna primárně v epitelu distálního nadvarlete a předpokládalo se, že jako proteázový inhibitor je zapojen do imunitních pochodů a ovlivňuje mj. proces zrání spermií [18, 19]. Následně bylo zjištěno, že HE4 je exprimován v celé řadě tkání. Z mnoha studií vyplynulo, že vyšší expresi z fyziologických tkání vykazují průdušnice a slinné žlázy, menší expresí se vyznačují plíce, prostata, hypofýza, štítná žláza a ledviny. Nejvyšší expresi z maligně transformovaných epiteliálních tkání vykazují kromě tkáně ovaria (serózní, ev. endometroidní adenokarcinom) a plic, rovněž některé adenokarcinomy endometria, tj. endometroidní histotyp. Středně vysoká úroveň exprese HE4 byla zjištěna u karcinomu prsu, ledvin, pankreatu, mezoteliomu, většinově nízkou úroveň exprese HE4 měly karcinomy trávicího ústrojí (tlusté střevo, játra, žaludek) a prostaty [7, 13, 14].
MATERIÁL A METODIKA
Pro využití markeru HE4 v diferenciální diagnostice patologií endometria jsme použili dvou základních souborů pacientek. První soubor tvořilo 115 pacientek, u kterých byl na našem pracovišti v časovém období červenec 2010 až červen 2013 diagnostikován karcinom endometria, resp. endometroidní subtyp tohoto karcinomu. Druhý soubor představovala kontrolní skupina pacientek s benigní lézí endometria. Šlo o celkem 106 pa-cientek, u kterých byla v identickém časovém období jako u prvního souboru provedena biopsie endometria k vyloučení prekancerózy či maligního nálezu. Indikací k biopsii byly klinické potíže (tj. nepravidelné krvácení pre- a perimenopauzální, krvácení po menopauze) nebo suspektní ultrazvukový nález (tj. podezření na hyperplazii endometria u postmenopauzálních pacientek nebo nález s podezřením na korporální polyp). Věkový průměr pacientek s maligním nálezem byl 65,6 roku (40–87 let), ve skupině žen s nálezem benigním 61,8 roku (43–81 let), věkové rozložení je prezentované distribučním grafem (graf 1).

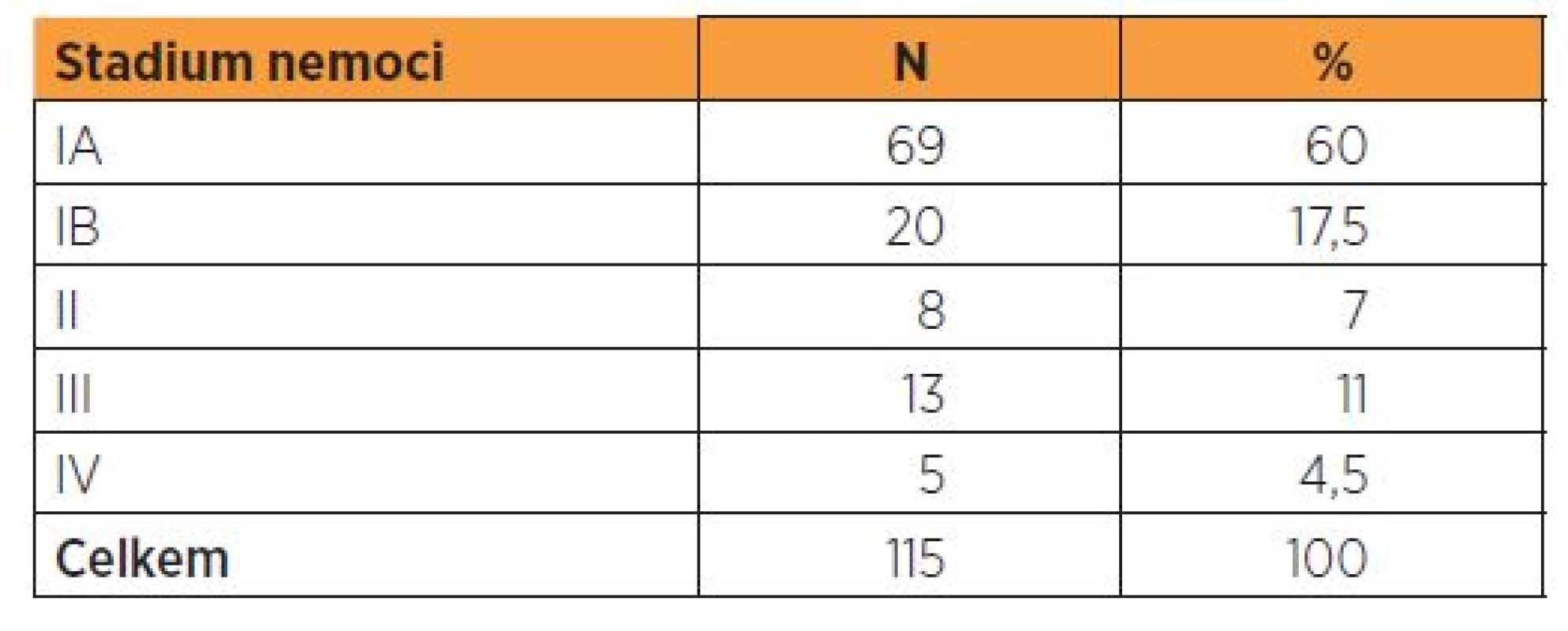
Histopatologická diagnóza byla u všech pa-cientek stanovena vyšetřením biopsie endometria získaného kyretáží nebo hysteroskopicky, po stanovení diagnózy byl proveden odběr krve z kubitální žíly ke zjištění sérových hladin analyzovaných markerů, tj. HE4 a CA 125. Sérum bylo odděleno centrifugací a vzorky byly okamžitě zpracovány. V případě, že je nebylo možno zpracovat do 24 hodin, byly zmraženy a uchovávány při -80 °C až do doby stanovení koncentrací, což bylo provedeno na přístroji Architect 1000i chemiluminiscenční imunoanalýzou. Vylučovacími kritérii pro zařazení do obou skupin byla přítomnost jiného maligního onemocnění, zařazené pacientky nebyly rovněž léčeny pro benigní negynekologické komorbidity, které jsou spojeny s elevací HE4 a CA 125 (onemocnění ledvin a jater). Všechny pacientky zařazené do souboru malignit podstoupily definitivní operační řešení s cílem stanovit stadium nemoci. Standardní postup operačního řešení spočíval v provedení extrafasciální hysterek-tomie s bilaterální adnexektomií (u 3 pacientek s histologicky potvrzenou infiltrací děložního hrdla z kyretáže byla provedena radikální hysterektomie typu B). Peroperačně bylo provedeno vyšetření dělohy (při makroskopicky suspektním nálezu i vyšetření adnex nebo jiných odebraných biopsií) k potvrzení přítomnosti endometroidního adenokarcinomu, ke zjištění rozsahu nádorové infiltrace a k určení grade tumoru.
V případě low risk varianty karcinomu endometria (tj. v I. stadiu při grade 1, 2 a současné myoinvazi < 50 %), která se vyskytla u 56 (49 %) pacientek, byl operační výkon ukončen (v souladu s negativním předoperačním stagingem). High risk varianta nemoci se týkala 59 (51 %) pacientek. U 29 z nich bylo provedeno odstranění regionálních mízních uzlin, ve formě systematické lymfadenektomie. U druhé, téměř identicky velké skupiny, tj.u 30 pacientek, lymfadenektomie provedena nebyla pro vysoké anesteziologické riziko (vysoký věk, interní komorbitidy) většinou kombinované s různým stupněm obezity.
V případě neprovedené lymfadenektomie u high risk varianty nemoci se jednalo o pacientky s popisem nezvětšených a normálně strukturovaných retroperitonálních lymfatických uzlin při užití dvou zobrazovacích metod (CT a UZ vyšetření). I když zařazení pacientek do jednotlivých stadií nemoci podle FIGO 2009 v těchto případech stritkně nenaplňovalo kritéria chirurgického stagingu, bylo provedeno podle rozsahu postižení děložní stěny, ev. adnex či jiných odebraných tkání (zejména omenta a nástěnného peritonea).
V popisovaných souborech pacientek s benigním a maligním nálezem jsou jednotlivé charakteristiky definovány vždy rozsahem sérových hladin CA 125 a HE4 a pracují s parametrem mediánu. Ten byl v popisné charakteristice použit místo aritmetického průměru z důvodu, že rozdělení obou markerů je silně zešikmené směrem doprava v souboru benigních i maligních nálezů a v takových situacích není použití průměru korektní, neboť jeho hodnota silně závisí na extrémních hodnotách. Z tohoto důvodu byla pro další úroveň hodnocení použita logaritmická transformace, tj. místo naměřených hodnot CA 125 a HE4 se použil jejich přirozený logaritmus. Pomocí této transformace se zešikmení výrazně zmenšilo a bylo dosaženo jednak změn v distribuci markerů v analyzovaných souborech a jednak změn rozptylů porovnávaných souborů. Podle rozdělení porovnávané veličiny v souborech a podle rozptylů porovnávaných souborů byl zvolen adekvátní statistický test, v tomto případě se jednalo o t-test, resp. Kolmogorovův-Smirnovův test. Pomocí logistické transformace byly vytvořeny rovněž logistické regresní modely, které při statistickém hodnocení udávají příslušné statistické veličiny, tj. senzitivitu, specificitu, negativní prediktivní hodnotu (NPV), pozitivní prediktivní hodnotu (PPV) a plochu pod ROC (Receiver Operating Characteristic) křivkou (AUC – Area Under Curve) a pro zjištěné hodnoty cut-off jsou prezentovány vždy dvěma modely, tj. modelem maxima součtu senzitivity a specificity a modelem dané 95% specificity [5, 28].
VÝSLEDKY
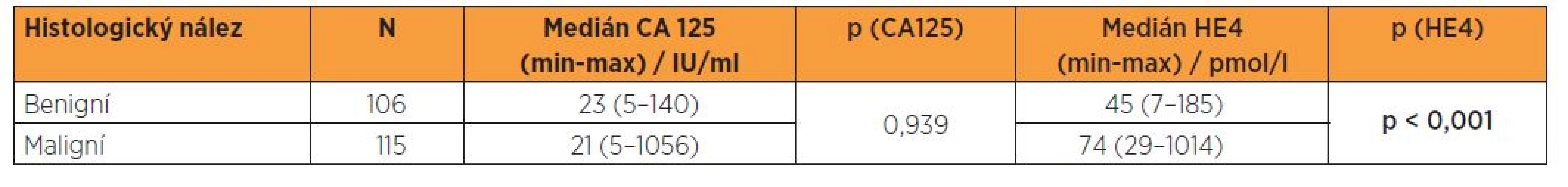
Tabulka 2 prezentuje medián a rozsahy sérových koncentrací CA 125 a HE4 u souborů pacientek s benigní lézí endometria a s endometroidním adenokarcinomem všech stadií. V případě CA 125 byl paradoxně medián ve skupině benigních nálezů vyšší, v případě HE4 jsme zaznamenali nárůst mediánu v souboru maligních nálezů. Distribuční grafy signalizují rozložení logaritmovaných sérových hladin CA 125 a HE4 v případech benigních a maligních nálezů (graf 2, 3). Výsledky sérových koncentrací biomarkerů byly dále podrobeny statistickým analýzám ve vztahu k biologické povaze nálezu. Pro porovnání sérových hladin CA 125 a HE4 mezi skupinami žen s maligním onemocněním a s benigním nálezem byl použit t-test, který pracoval s logaritmovanými hodnotami analyzovaných markerů. Byl prokázán statisticky významný rozdíl pouze v případě HE4 a nikoliv CA 125 (tab. 2).


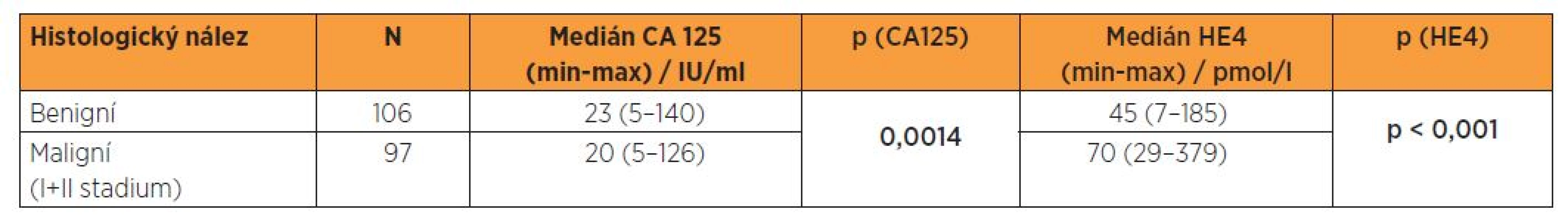
Tabulka 3 prezentuje medián a rozsahy sérových koncentrací CA 125 a HE4 ve skupině benigních lézí endometria a ve skupině malignit prvních dvou stadií nemoci, které dominují v procentuálním zastoupení nejen v našem souboru, ale obecně v klinické praxi. Podle uvedených výsledků je medián CA 125 paradoxně nižší ve skupině malignit, v případě HE4 dochází k vzestupu mediánu, i když méně výraznému než při srovnání benigních nálezů s malignitami všech stadií. Byla provedena rovněž statistická analýza sérových hladin CA 125 a HE4 mezi skupinou žen s benigní lézí endometria a s malignitou I. a II. stadia. V tomto případě nebyl splněn předpoklad pro použití t-testu, a to ani po logaritmické transformaci. Data v tomto případě nebyla transformována a byl použit Kolmogorovův-Smirnovův test, jehož výsledek ukazuje na statisticky významně odlišné distribuční funkce u obou souborů, přičemž účinnějším prediktorem diferenciace je HE4 (tab. 3).
Pro další hodnocení byl vytvořen logistický regresní model, v němž jako nezávisle proměnné vystupují CA 125 a HE4 a závisle proměnnou je histologický nález. CA 125 se ukázal v obou modelech (benigní nálezy vs všechny stadia malignity, resp. vs I.+II. stadium malignity) nevýznamný a vznikly konečné modely s jedinou nezávisle proměnnou, a to je logaritmicky transformovaná hladina HE4.
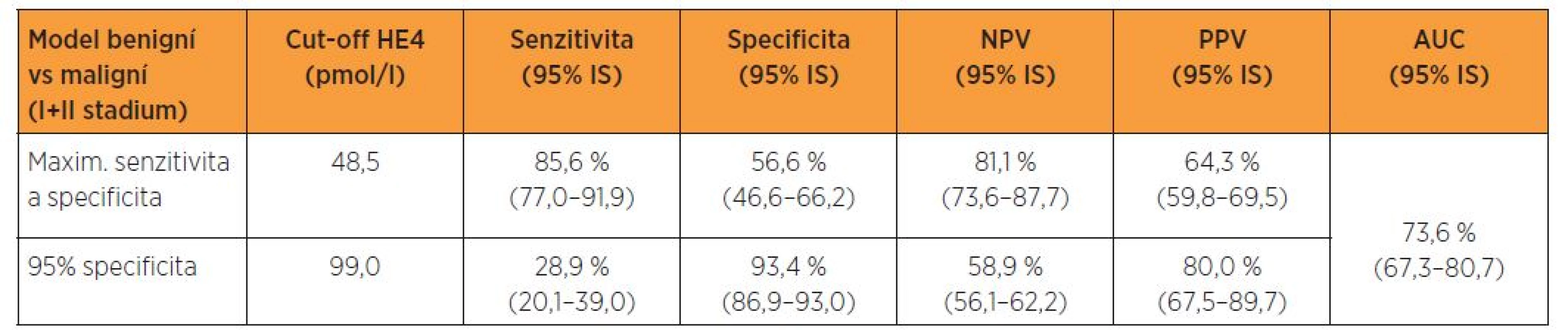
Tabulka 4 udává prediktivní schopnost HE4 v diferenciální diagnostice biologické povahy lézí endometria na modelu dosažení maxima součtu senzitivity a specificity a při dané 95% specificitě a graf 4 prezentuje ROC křivku s příslušnou plochou pod křivkou. Na modelu dosažení maxima součtu senzitivity a specificity vykazuje cut-off HE4 48,5 pmol/l pro tuto diferenciaci senzitivitu 87,8 %, specificitu 56,6 %, NPV 81,1 %, PPV 68,7 % a AUC 76,9 %. Pro danou 95%, resp. jí se nejvíce blížící 93,4% specificitu, dochází při cut-off99,0 pmol/l k hlubokému poklesu senzitivity (tab. 4, graf 4).

Tabulka 5 udává prediktivní schopnost HE4 v diferenciální diagnostice benigních lézí endometria a malignit I. a II. stadia nemoci rovněž na modelu dosažení maxima součtu senzitivity a specificity a při dané 95% specificitě a následný graf 5 prezentuje ROC křivku s příslušnou plochou pod křivkou. Na modelu dosažení maxima součtu senzitivity a specificity vykazuje cut-off HE4 48,5 pmol/l pro tuto diferenciaci senzitivitu 85,6 %, specificitu 56,6%, NPV 81,1 %, PPV 64,3 % a AUC 73,6 %. Pro danou 95%, resp. jí se nejvíce blížící 93,4% specificitu, dochází při cut-off 99,0 pmol/l k dramatickému poklesu senzitivity (tab. 5, graf 5).

DISKUSE
Karcinom endometria je charakteristický typickou klinickou symptomatologií, která umožňuje diagnózu dominantně v iniciálním stadiu onemocnění, z čehož vyplývá velmi dobrá prognóza pacientek. Potřeba nádorového markeru, který by byl efektivním screeningovým nástrojem, zde tedy není tak kritická jako např. v případě ovariálního karcinomu. I zde se objevují různé studie, jejichž cílem je identifikovat citlivé biochemické markery využitelné pro diagnostiku u pacientek se zvýšeným rizikem vzniku onemocnění, pokračuje úsilí v hledání nových algoritmů pro efektivní využití biomarkerů, resp. jejich kombinací. Předmětem těchto studií v diagnostice karcinomu endometria jsou jak konvenční nádorové markery, jako antigeny CA 125, CA 72-4, CA 15-3 [15], tak novější parametry, např. apolipoprotein-1, prealbumin, transferin [12], prolaktin [25], sérový amyloid A [24] nebo Soluble Mesothelin Related Peptides (SMRP) [22].
V posledních několika letech se objevují práce, které se zaměřují na potenciální využitelnost lidského epididymálního proteinu 4 v této problematice. Částečně se tento marker již na některých pracovištích etabloval v diagnostice a follow-up některých histotypů ovariálního karcinomu, a to prostřednictvím tzv. ROMA indexu (Risk of Ovarian Malignancy Algorithm), který pracuje s logaritmovanými hodnotami hladin HE4 a CA 125 a reflektuje současně menopauzální status pacientek [23]. Prvním autorem, který přenesl otázku klinické využitelnosti HE4 do problematiky karcinomu endometria, byl Moore a postupně se objevily i práce dalších autorů, které zpravidla srovnávají diagnostický přínos HE4 s konvenčním markerem CA 125. V pracích Moora závěry zpravidla konstatují elevaci tohoto biomarkeru ve všech stadiích onemocnění a větší senzitivitu pro detekci časných stadií nemoci ve srovnání s CA 125. Při specificitě 95 % signalizují senzitivitu 45,5 % pro HE4 a 24,6 % pro CA 125 bez ohledu na stadium nemoci, ve stadiu I vykazuje HE4 senzitivitu přibližně o 17 % vyšší než CA 125 [22]. Recentní práce Angioliho pracuje v případě HE4 s dvěma hodnotami cut-off – 70, resp. 150 pmol/l, kdy při 100% specificitě je dosaženo senzitivity 59,4 %, resp. 35,6 %. Pro CA 125 při cut-off 35 IU/ml při specificitě 62,14 % dosahuje senzitivita 19,8 % [2]. Zanotti ve své práci analyzuje 195 pacientek s karcinomem endometria a 125 zdravých žen. Sérové koncentrace HE4 jsou u pacientek s malignitou signifikantně vyšší bez ohledu na stadium a grade tumoru ve srovnání se zdravými kontrolami. Při dané 95% specificitě vykazuje vyšší senzitivitu pro detekci endo-metriálního karcinomu HE4, a sice 66 %, v případě CA 125 je senzitivita 35 % [26].
V našem souboru při srovnání dvou skupin biologické odlišné povahy je zřejmý vysoce signifikantní rozdíl (p < 0,001) v mediánech sérových hladin HE4, medián dosahuje v souboru pacientek s benigním nálezem 45 pmol/l, v souboru malignit 74 pmol/l. Naopak porovnání mediánů CA 125 (paradoxně s hodnotami pro ženy s benigním nálezem 23 IU/l a pro pacientky s malignitou 21 IU/l) vychází statisticky nesignifikantně (p = 0,939). Při logistické regresi se CA 125 z hlediska diferenciace benigních a maligních lézí ukázal nevýznamným a v případě HE4 je při cut-off 48,5 pmol/l dosaženo senzitivity 87,8 %, specificity 56,6 % a NPV 81,1 %, podle ROC křivky je hodnota AUC 0,769. V běžné klinické praxi dominuje zastoupení iniciálních stadií, proto jsme provedli rovněž srovnání souborů žen s benigním nálezem a pacientek s karcinomem endometria ve stadiích I. a II., kdy při logistické regresi se CA 125 z hlediska diferenciace benigních a maligních lézí ukázal rovněž nevýznamným a v případě HE4 je při cut-off 48,5 pmol/l dosaženo senzitivity 85,6 % a PPV 64,3 %, podle ROC křivky je hodnota AUC 0,736.
ZÁVĚR
Naše prospektivní studie vyhodnocuje poten-ciální diagnostický přínos lidského epididymálního proteinu 4 u nejčastější gynekologické malignity v populaci českých žen. Diagnostický přínos HE4 je nesporný při srovnání s konvenčním markerem CA 125, kvalitu použitého testu lze hodnotit jako dobrou podle ROC křivky s AUC 0,769. Klinický přínos lze spatřovat zejména v depistáži žen se zvýšeným rizikem. Prezentovaný soubor diagnostikovaných malignit zahrnuje jeden dominantní histologický subtyp karcinomu endometria. Je sice malého rozsahu a zahrnuje pouze pět pacientek stadia IV podle FIGO 2009, na druhou stranu poměrně věrně reflektuje skutečnou klinickou prezentaci endometroidního adenokarcinomu, včetně převažujícího zastoupení pacientek diagnostikovaných v časných stadiích nemoci. Analýza sérové hladiny HE4 by mohla podle našich výsledků napomoci v rozhodování v souvislosti s individualizací diagnostického plánu žen rizikových, nevyřešená však zůstává otázka optimálního cut-off HE4, k čemuž by měly přispět výsledky dalších rozsáhlejších studií a jejich komparativní analýza.
Práce vznikla za podpory MZ ČR – RVO (FNBr, 65269705).
MUDr. Luboš Minář
Gynekologicko-porodnická klinika
LF MU a FN Brno
Obilní trh 11
602 00 Brno
e-mail: lubosminar@seznam.cz
Sources
1. Adam, Z., Vorlíček, J., Vaníček, J., et al. Diagnostické a léčebné postupy u maligních chorob. Praha: Grada Publishing, 2004, s. 231–235.
2. Angioli, R., Plotti, F., Capriglione, S., et al. The role of novel biomarker HE4 in endometrial cancer: a case control prospective study. Tumour Biol, 2013, 34(1), p. 571–576.
3. Bingle, L., Singleton, V., Bingle, CD. The putative ovarian tumor marker gene HE4 (WFDC2), is expressed in normal tissues and undergoes komplex alternative splicing to yield multiple protein isoforms. Oncogene, 2002, 21(17), p. 2768–2773.
4. Bouchard, D., Morriset, D., Bourbonnais, Y., et al. Proteins with whey-acidic-protein motifs and cancer. Lancet Oncol, 2006, 7(2), p. 167–174.
5. Budíková, M., Králová, M., Maroš, B. Průvodce základními statistickými metodami. Praha: Grada Publishing, 2010, p. 193–204.
6. DiSaia, PJ., Creasman, WT. Clinical Gynaecologic Oncology. 7th ed. Philadelphia: Mosby, 2007, p. 812.
7. Drapkin, R., von Horsten, HH., Lin, Y., et al. Human epididymis protein 4 (HE4) is a secreted glycoprotein that is overexpressed by serous and endometrioid ovaria carcinomas. Cancer Res, 2005, 65(6), p. 2162–2169.
8. Dundr, P. Histopatologická klasifikace nádorů děložního těla In: Cibula, D., Petruželka, L., et al. Onkogynekologie. Praha: Grada Publishing, 2009, s. 459.
9. Dušek, L., Mužík, J., Kubásek, M., et al. Epidemiologie zhoubných nádorů v České republice [online]. Masarykova univerzita, [2005], [cit. 2014-07-14]. Dostupný z : http://www.svod.cz.
10. Ebina, Y., Sakuragi, N., Hareyama, H., et al. Para-aortic lymphnode metastasis in relation to serum CA 125 levels and nuclear grade in endometrial carcinoma. Acta Obstet Gynecol Scand, 2002, 81(5), p. 458–465.
11. Engelen, MJ., Kos, HE., Willemse, PH., et al. Surgery by consultant gynecologic oncologists improves survival in patiens with ovarian carcinoma. Cancer, 2006 106(3), p. 589–598.
12. Farias-Eisner, G., Su, F., Robbins, T., et al. Validation of serum biomarkers for detection of early- and ate-stage endometrial cancer. Am J Obstet Gynecol, 2010, 202(1), p. 73.e1–73.e5.
13. Galgano, MT., Hampton, GM., Frierson, HF. jr. Compre-hensive analysis of HE4 expression in normal and malignant human tissues. Mod Pathol, 2006, 19(6), p. 847–853.
14. Hellström, I., Raycraft, J., Hayden-Ledbetter, M., et al. The HE4 (WFCD2) protein is a biomarker for ovarian carcinoma. Cancer Res, 2003, 63(13), p. 3695–3700.
15. Cherchi, PL., Dessole, S., Ruiu, GA., et al. The value of serum CA 125 and association CA 125/CA19-9 in endometrial carcinoma. Eur J Gynecol Oncol, 1999, 20(4), p. 315–317.
16. Chung, HH., Kim, JW., Park, NH., et al. Use of preoperative serum CA 125 levels for prediction of lymph node metastasis and prognosis in endometrial cancer. Acta Obstet Gynecol Scand, 2006, 85(12), p. 1501–1505.
17. Israeli, O., Goldring-Aviram, A., Rienstein, S., et al. In silico chromosomal clustering of genes displaying altered expression patterns in ovarian cancer. Cancer Genet Cytogenet, 2005, 160(1), p. 35–42.
18. Kirchoff, C. Molecular characterization od epididymal proteins. Rev Reprod, 1998, 3(2), p. 86–95.
19. Kirchhoff, C., Habben, I., Ivell, R., et al. A major human epididymis-specific cDNA encodes a protein with sequence homology to extracellular proteinase inhibitors. Biol Reprod, 1991, 45(2), p. 350–357.
20. Klener, P. Klinická onkologie. Praha: Galén, 2002, s. 85–88.
21. Masák, L. Sérové nádorové markery. In Cibula, D., Petružel-ka, L., et al. Onkogynekologie. Praha: Grada Publishing, 2009, s. 132–141.
22. Moore, RG., Brown, AK., Miller, MC., et al. Utility of a novel serum tumor biomarker HE4 in patients with endome-trioid adenocarcinoma of the uterus. Gynecol Oncol, 2008, 110(2), p. 196–201.
23. Moore, RG., Miller, MC., Disilvestro, P., et al. Evaluation of the diagnostic accuracy of the risk of ovarian malignancy algorithm in women with a pelvic mass. Obstet Gynecol, 2011, 118(2, Pt 1), p. 280–288.
24. Omer, B., Genc, S., Takmaz, O., et al. The diagnostic role of human epididymis protein 4 and serum amyloid-A in early-stage endometrial cancer patients. Tumour Biol, 2013, 34(5), p. 2645–2650.
25. Yurkovetsky, Z., Ta’asan, S., Skates, S., et al. Development of multimarker panel for early detection of endometrial cancer. High diagnostic power of prolactin. Gynecol Oncol, 2007, 107(1), p. 58–65.
26. Zanotti, L., Bignotti, E., Calza, S., et al. Human epididymis protein 4 as a serum marker for diagnosis of endometrial carcinoma and prediction of clinical outcome. Clin Chem Lab Med, 2012, 50(12), p. 2189–2198.
27. http://www-dep.iarc.fr/usefullinks/NationalCancerInsti-tute(USA)/EndometrialCancer.
28. http://www.wikiskripta.eu/index.php/ROC křivka.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2015 Issue 4
Most read in this issue
- Syndrom polycystických ovarií a metabolický syndrom
-
Problematika niektorých infekčných ochorení tehotných žien v každodennej praxi
Časť II. Vírusové ochorenia - Kouření v těhotenství – důsledky pro matku a dítě Současné názory na nikotinovou substituci
-
Surogace, ano či ne?
Kazuistika
