miRNA profil luminálnych podtypov karcinómu prsníka v súbore slovenských žien
miRNA profile of luminal breast cancer subtyptes in Slovak women
Objective: Aberrant expression of short, non-coding RNA molecules (miRNA) leads to breast cancer initiation, progression and metastasing. The miRNA expression level associates with imunohistochemical profile, histopathological parameters, clinical outcomes, prognoses and therapeutical response. The aim of this study was to analyse the whole spectrum of miRNA by microarray method and to define relevant miRNAs describing biological characteristics of luminal breast cancer subtypes.
Design: Cross-sectional study, basic research.
Setting: Biomedical center Martin, Jessenius Faculty of Medicine in Martin, Comenius University in Bratislava, Martin, Slovakia.
Methods: We analysed 16 tissue samples of Luminal A/B breast cancer types and 16 breast tissue samples without pathological findings. The microarray technology by Agilent was used to analyse 2549 miRNAs by SurePrint G3 Human miRNA kit v.21. The results were assessed by AgiMicroRNA Bioconductor library within Limma pack.
Results: The analyses of the lowest FDR p-value and the highest logFC value selected the oncomiR miR-182 as the most dominant with higher expression in cancer tissues than in normal tissues, followed by miR-21, miR342-3p/5p and miR-6826. The miR-4324 and cluster of miR-99a/let7c/miR-125b dominated in the group of miRNAs with lower expression in cancer tissues compared to normal tissues.
Conclusion: The first results of this study complement biological characteristics of luminal breast cancer subptypes, represent basis for follow-up projects focused on the clarification of relevant signaling pathways and promise new and innovative breast cancer treatment based on the precise, tailored therapy by targeting specific miRNAs involved in the most important carcinogenesis mechanisms.
Keywords:
miRNA – breast cancer – microarray
Authors:
Z. Danková 1; M. Grendár 1; D. Dvorská 1; D. Braný 1; I. Stastny 1; M. Bobrovská 2; T. Balhárek 2; P. Zubor 3
Authors‘ workplace:
Martinské centrum pre biomedicínu, Jesseniova lekárska fakulta v Martine, Univerzita Komenského v Bratislave, Martin, Slovensko
1; Ústav patologickej anatómie, Univerzitná nemocnica Martin, Slovensko
2; Gynekologicko-pôrodnícka klinika, JLF UK a Univerzitná nemocnica Martin, Slovensko
3
Published in:
Ceska Gynekol 2020; 85(3): 174-180
Category:
Overview
Cieľ štúdie: Aberantná expresia krátkych, nekódujúcich molekúl RNA (miRNA) sa podieľa na vzniku, progresii a metastázovaní karcinómu prsníka. Úroveň expresie vybraných miRNA je úzko spojená nielen s imunohistochemickým profilom a histopatologickými parametrami, ale aj s klinickými výsledkami, prognózou a terapeutickou odpoveďou. Cieľom tohto výskumu bola analýza celého spektra miRNA metódou microarray a zadefinovanie panelu relevantných miRNA objasňujúcich biologickú charakteristiku luminálnych podtypov karcinómu prsníka.
Typ štúdie: Prierezová, základný výskum.
Názov a sídlo pracoviska: Martinské centrum pre biomedicínu, Jesseniova lekárska fakulta v Martine, Univerzita Komenského v Bratislave, Martin, Slovenská republika.
Metodika: Sledovaný súbor pozostával zo 16 tkanív Luminal A/Luminal B karcinómu prsníka a 16 tkanív prsného tkaniva bez patologického nálezu. miRNA profil sa analyzoval microarray technológiou na sklíčku SurePrint G3 Human miRNA kit v.21, ktoré obsahuje 2549 miRNA. Výsledky sa hodnotili knižnicou AgiMicroRNA Bioconductor library v rámci balíka Limma.
Výsledky: Analýza najnižšej hodnoty FDR p-value a najvyššej hodnoty logFC označila za najdôležitejšiu onkogénnu miRNA s vyššou expresiou v súbore nádorových tkanív v porovnaní s normálnymi tkanivami miR-182, nasledovala miR-21, miR-342-3p a miR-342-5p a miR6826. Medzi miRNA s nižšou expresiou dominovala miR-4324 a kluster miR-99a/let7c/miR-125b.
Záver: Získané výsledky prispievajú k biologickej charakterizácií skupiny luminálnych typov karcinómu prsníka, ponúkajú východisko pre nadväzujúce projekty v kontexte objasnenia príslušných signálnych dráh mechanizmov karcinogenézy a sľubujú nové a inovatívne možnosti cielenej terapie zameranej na špecifické miRNA zapojené v dôležitých mechanizmoch karcinogenézy.
Klíčová slova:
miRNA – karcinóm prsníka – microarray
ÚVOD
Karcinóm prsníka (KP) je najčastejším zhubným nádorom u žien s celosvetovou incidenciou 2 088 849 nových prípadov v roku 2018 [5]. Najčastejšie vzniká v dvoch typoch prsného tkaniva, v duktoch alebo lobuloch. Podľa estrogénového a progesterónového hormonálneho statusu a podľa HER2 stavu receptorov sa delí karcinóm prsníka do podtypov: luminálny A, luminálny B, HER2 pozitívny a triple negatívny nádor [29]. Jednotlivé nádory majú nielen odlišné biologické vlastnosti, ale aj histológiu, klinické prejavy, prognózu, odpoveď na liečbu a prežívanie pacientok [27]. Luminálne typy predstavujú najčastejší typ KP (70 %) s pomalým rastom, dobrou prognózou a nižším rizikom mortality v porovnaní s ostatnými typmi. Nakoľko exprimujú estrogénový receptor, adjuvantná endokrinná terapia je vysoko senzitívna. Avšak aj napriek tomu u 40 % pacientov dochádza k relapsu ochorenia [1, 4].
Na správnu identifikáciu, klasifikáciu nádoru a vytvorenie efektívnej terapie na princípe personalizovanej liečby „ušitej na mieru“ podľa špecifického podtypu nádoru, vstupujú v poslednom období do algoritmov aj tzv. omic dáta predstavujúce napríklad génovú signatúru, globálnu génovú expresiu a epigenetické markery [11, 21, 24, 29]. Veľký význam v biologickej charakterizácií a správaní sa nádoru majú aj krátke, nekódujúce molekuly miRNA, ktoré kontrolujú génovu expresiu na posttranskripčnej úrovni. Mechanizmus regulácie spočíva v naviazaní miRISC komplexu (miRNA induced silencing complex) na komplementárnu sekvenciu v 3´UTR oblasti cieľovej mRNA, čím dochádza k jej vyblokovaniu, spôsobujúcej inhibíciu translácie, alebo mRNA degradáciu [2, 9, 15]. Väzba miRNA-mRNA je komplexná, nakoľko jedna miRNA sa môže viazať na stovky cieľových génov a zároveň jedna cieľová mRNA môže byť regulovaná viacerými miRNA. miRNA tak v bunkách zabezpečujú rozmanité fyziologické funkcie, ako bunkovú diferenciáciu, proliferáciu, bunkovú smrť a zachovanie biologickej homeostázy [19, 23]. V procese karcinogenézy zohrávajú miRNA tumor supresorovú ako aj onkogénnu funkciu spojenú s iniciáciou nádoru, rezistenciou na liečbu a s metastatickými procesmi [14, 23].
Cieľom nášho výskumu bolo stanoviť komplexný miRNA profil luminálnych typov karcinómu prsníka metódou microarray v súbore slovenských žien a doplniť tak biologické charakteristiky tohto častého ochorenia.
SÚBOR
Zo 66 odobraných tkanív (28 karcinómov prsníka, 28 tkanív priľahlého tkaniva, 10 vzoriek prsného tkaniva bpn) sme do tejto analýzy vyselektovali 16 tkanív luminálneho typu KP a 16 vzoriek bez patologických nálezov. Vzorky pochádzali od žien, ktoré boli hospitalizované a liečené na Gynekologicko-pôrodníckej klinike Univerzitnej nemocnice Martin. Ženy boli informované a podpísali informovaný súhlas pacienta. Histopatologická špecifikácia nádorov ako histologický typ a molekulárny podtyp boli poskytnuté z Ústavu patologickej anatómie UNM. Projekt bol schválený etickou komisiou č. 1866/2016.
METODIKA
Izolácia
Celková RNA so subfrakciou miRNA bola izolovaná z čerstvého tkaniva uchovávaného v RNA later stabilizačnom roztoku pri -80°C kitom mirVana™ miRNA Isolation Kit (Thermo Fisher Scientific). Kvalitatívna a kvantitatívna analýza prebehla na prístroji Qubit 2.0 a Bioanalyser 2100. Na miRNA analýzu sa použili iba vzorky s koncentráciou RNA > 50 ng/µl a RIN > 7.5.
Microarray miRNA analýza
Na analýzu expresie miRNA sme použili sklíčko SurePrint G3 Human miRNA kit v.21, na ktorom sa nachádza 2549 miRNA podľa miRBase 21.0 [12]. Príprava vzoriek na microarray analýzu prebiehala podľa protokolu Agilent verzia 3.1.1 s použitím Spike-in transkriptov v nasledovných krokoch: defosforylácia (CIP), ligácia (Cyanine 3-pCp), purifikácia (Micro Bio-Spin P-6 Gel Coumn), hybridizácia (20 hod, 55 °C), premývanie, skenovanie (SureScan Microarray Scanner, Agilent) a extrakcia dát (Feature Extraction Software). Kontrola kvality microarray miRNA expresie každej vzorky bola posúdená na základe QC správy. Na ďalšiu analýzu postúpili iba vzorky vykazujúce výbornú a dobrú kvalitu vo všetkých ôsmych sledovaných parametroch.
Štatistická analýza
Získané dáta boli analyzované knižnicou AgiMicroRNA Bioconductor library v rámci balíka Limma. V tejto fáze prebehla posledná kontrola kvality vzoriek na základe MA plot-ov. Rozdielna expresia miRNA bola vyhodnotená finálne medzi 16 vzorkami karcinómu prsníka luminálneho typu a 16 kontrolnými vzorkami. Na selekciu najvýznamnejších 20 miRNA sme použili Volcano plot, ktorý zohľadňuje korigované FDR p-hodnoty, ako aj výšku log2 fold change.
VÝSLEDKY
Zo všetkých 2549 miRNA sme zachytili hybridizačný signál pri 307 miRNA, z toho 171 malo vyššiu expresiu a 136 nižšiu expresiu v súbore KP v porovnaní s kontrolnou skupinou. Panel 20 najviac relevantných miRNA, podľa Volcano plot analýzy, je uvedený v Tabuľke 1 aj s hodnotami log2 násobku expresie (log2FC) a FDR p-hodnotami.
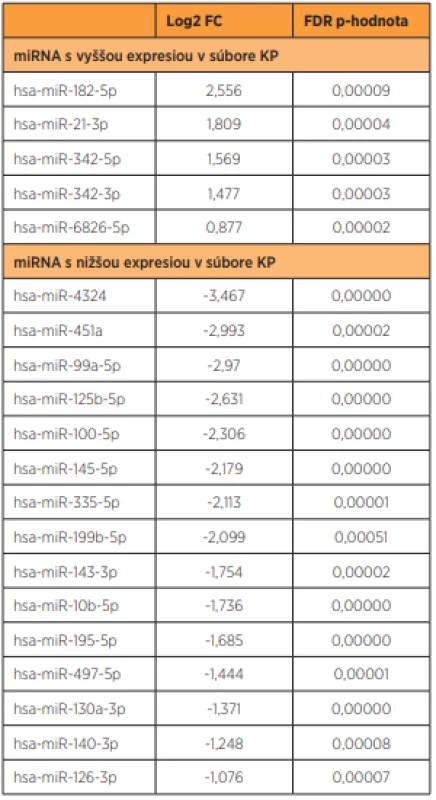
Normalizované hodnoty log2 expresie podľa Z-skóre sme využili na zostrojenie heatmapy zobrazujúcej nielen expresiu miRNA v jednotlivých vzorkách, ale aj hierarchické zoskupovanie vzoriek a miRNA (obr. 1).
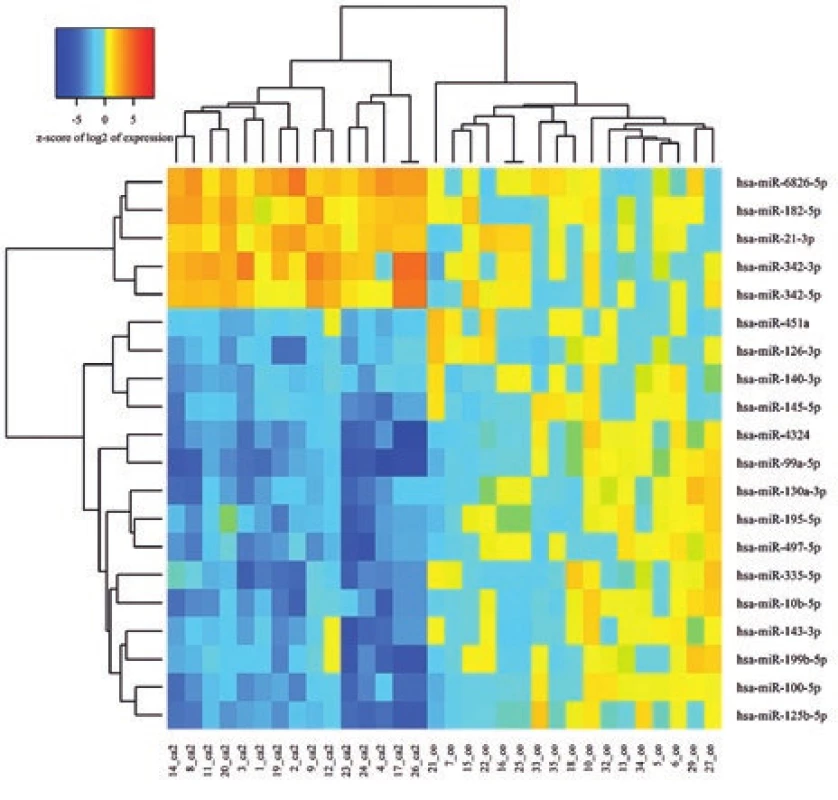
V prípade výberu miRNA iba podľa najväčšieho rozdielu expresie (log2FC) by bolo poradie prvých 10 miRNA s vyššou expresiou v súbore s KP: miR-182- 5p, miR-183-5p, miR-4455, miR-141-3p, miR-4428, miR-6785-5p, miR-21-3p, miR-1973, miR-96-5p, miR-4485-3p a poradie 10 miRNA s nižšou expresiou: miR-4324, miR-451a, miR-99a-5p, miR-205- 5p, 125b-5p, miR-144-3p, miR-100-5p, miR-145-5p, miR-335-5p a miR-199b-5p. (obr. 2).
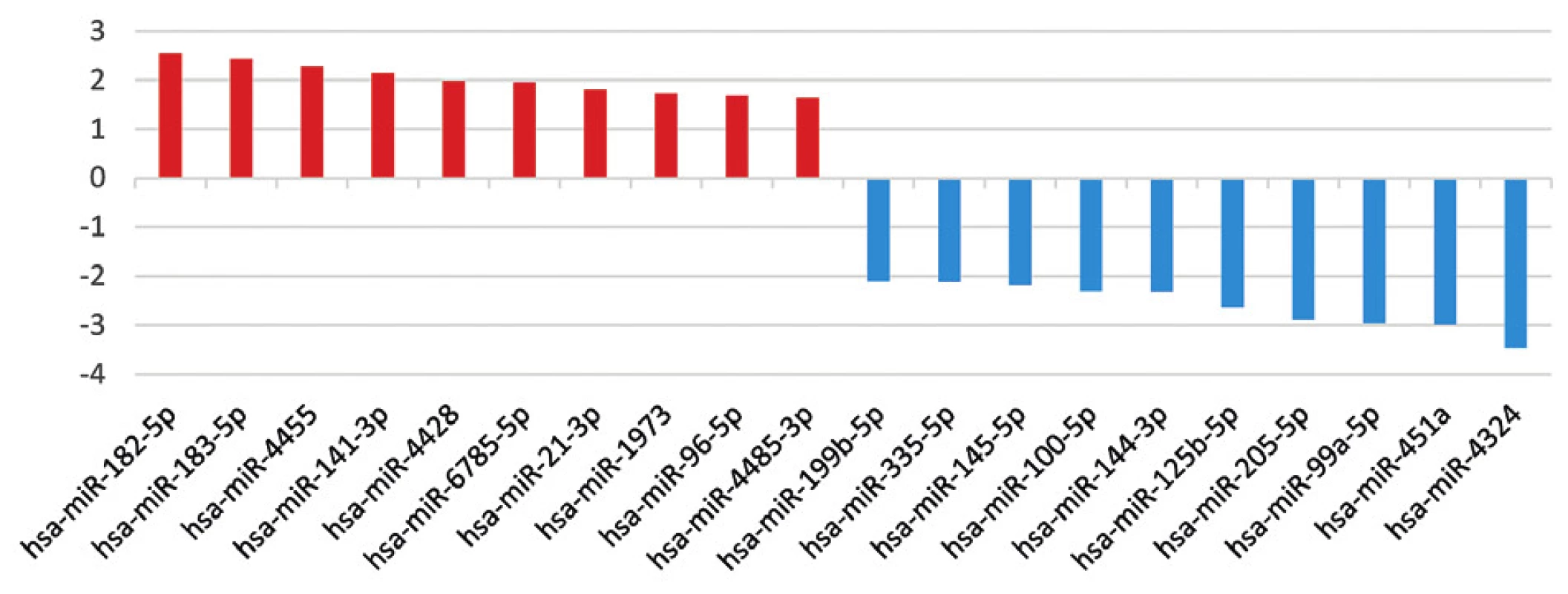
V prípade výberu najvýznamnejších miRNA iba podľa FDR p-hodnôt je poradie 10 miRNA s vyššou expresiou: miR-6826-5p, miR-342-3p, miR-21-3p, miR-182-5p, miR-342-5p, miR-4485-3p, miR-4443, miR-210-3p, miR-181b-5p, miR-96-5p a 10 miRNA s nižšou expresiou v súbore s KP: miR-4324, miR99a-5p, miR-125b-5p, miR-100-5p, miR-145-5p, miR-10b-5p, miR-195-5p, miR-130a-3p, miR-335-5p a miR-497-5p.
DISKUSIA
Aberantná expresia miRNA v kontexte nádorových ochorení bola prvýkrát opísaná v roku 2002 u pacientov s B-chronickou lymfocytovou leukémiou [3], u pacientov s karcinómom prsníka v roku 2005 [7]. Odvtedy sa zrealizovalo veľké množstvo štúdií, ktoré potvrdili dereguláciu miRNA ako charakteristický znak rakoviny v dôsledku mutácií, delécií, amplifikácií a dysregulácie transkripčných regulačných kaskád [13]. Postupom času pribúdali nielen novo objavené molekuly miRNA, ale sa aj klasifikovali podľa funkcie a úlohy v celom klinickom manažmente rakoviny. miRNA sú zapojené do iniciácie, proliferácie, progresie, rezistencie na apoptózu, metastatického procesu, invazivity, ako aj odpovede na liečbu [10, 13].
Cieľom nášho výskumu bolo stanoviť expresný profil luminálnych typov karcinómu prsníka v súbore slovenských žien. Silnou stránkou tejto analýzy bola použitá microarray technológia, ktorá umožnila analýzu všetkých známych miRNA, v tomto prípade 2549, podľa poslednej dostupnej databázy miRBase 21.0. Na základe recentnej literatúry sme spomedzi definovaných onkogénnych miRNA očakávali vyššiu expresiu predovšetkým miR-10b, miR-21, miR-155, miR-210 a miR-373 [6, 8, 18]. Avšak analýza najnižšej hodnoty FDR p-value a najvyššej hodnoty log2FC označila za najdôležitejšiu onkogénnu miR-182, nasledovala miR21, miR-342 a miR-6826. Relevantnosť miR-182 sa potvrdila aj selekciou iba podľa log2FC, alebo FDR p-value.
Gén pre miR-182 sa nachádza na 7. chromozóme a miR-182 tvorí klaster spolu s miR-183 a miR-96 [12]. Onkogénny charakter tejto miRNA spočíva v podpore proliferácie a invazivity nádorových buniek a vysoká expresia miRNA sa spája s horším prežívaním. Deplécia miR-182-5p, ako sa ukázalo na myšacom xenoimplantátovom modeli, potláča rast nádoru prostredníctvom zvýšenej regulácie expresie PTEN [30]. Výskum inhibície miR-182 na bunkových líniách KP MCF-7 poukazuje na zníženú viabilitu buniek v dôsledku indukcie apoptózy, pravdepodobne cez zvýšenú expresiu CASP9, pričom túto asociáciu potvrdila aj western blot analýza [17]. Práca autorov Amorim et al. [1] označuje miR-182 za nezávislý prediktor endokrinnej terapie, ale aj za nezávislý marker prognózy rekurencie ochorenia po endokrinnej terapii a to práve v prípade pacientov s luminálnymi typmi KP. Prvé štúdie zamerané na prepojenie miRNA s reakciou na liečivá zistili okrem iného aj asociáciu miR-182 s rezistenciou na Veliparib [26]. Poznatky týchto prác poskytujú nové informácie vplyvu miRNA na jednotlivé metabolické dráhy, objasňujú funkcie a biologické úlohy a predstavujú potenciálne nové terapeutické ciele liečby karcinómu prsníka.
Tumor supresorové miRNA majú v nádorových bunkách obvykle nižšiu expresiu vzhľadom na ich charakter potláčania onkogénnej aktivity cieľových génov. Medzi hlavné miRNA z tejto skupiny patrí let-7, miR-31, miR-99a, miR-125a/b, miR-200, miR-205, miR-206, miR-335 [6, 8, 18, 28]. V našom projekte boli najdôležitejšie miRNA s nižšou expresiou v nádorovom tkanive v porovnaní s normálnym tkanivom: miR-4324, miR-99a a miR-125b a to vo všetkých troch prístupoch selekcie. Aspoň v dvoch metódach dominovala ešte miR-100 a miR- -451a. Sú to pomerne známe miRNA molekuly, predovšetkým kluster miR-99a/let7c/miR-125b [16, 20, 25]. Interpretácia expresie miR-4324 však zostáva menej jasná, nakoľko sa jej venovalo iba málo vedeckých prác.
Rozmanitosť miRNA panelov špecifických pre karcinóm prsníka v odbornej literatúre je odôvodniteľná predovšetkým: 1. – typom použitej metódy a jej citlivosti (niektoré umožňujú sledovať miRNA iba jednotlivo, čím sa pri selekcii nemusia zachytiť viaceré relevantné miRNA, iné metódy sledujú už hotové panely miRNA; nami zvolená metóda microarray analyzuje všetky existujúce miRNA); 2. – obdobím výskumu: počet známych miRNA neustále rastie, a teda výskumy z roku 2020 nemusia prinášať koherentné výsledky s predchádzajúcimi štúdiami; 3. – štruktúrou výskumu: niektoré práce porovnávajú podtypy KP medzi sebou, prípadne KP podľa histopatologických charakteristík (veľkosť, TNM, grade), iné práce porovnávajú KP so zdravým tkanivom / resp. priľahlým tkanivom, čo v konečnom dôsledku identifikuje rôzne špecifické miRNA podľa kategorizácie, či priebehu ochorenia.
Komplexnosť miRNA problematiky dopĺňa aj samotný fenomén väzby akejkoľvek miRNA na niekoľko desiatok cieľových mRNA s vplyvom na rozmanité biologické procesy súčasne [22]. Niektoré miRNA tak podľa typu nádoru zohrávajú onkogénnu, alebo aj tumor supresorovú funkciu, a to predovšetkým ovplyvňovaním tumor supresorových génov alebo onkogénov [10]. Okrem priameho vplyvu môžu miRNA modulovať aj vonkajšie faktory meniace nádor, ako napríklad interakciu s imunitným systémom, interakciu stromálnych buniek, onkovírusy a odpoveď na liečbu. Až výsledná rovnováha medzi týmito procesmi určuje, či má špecificka miRNA onkogénny alebo tumor supresorový účinok.
Komplexné pochopenie celej problematiky väzby miRNA-mRNA a jednotlivých signálnych dráh by mohlo umožniť skorú detekciu, presnú diagnostiku, spoľahlivú prognózu, ako aj identifikáciu špecifických cieľov liečby s dôrazom rozvoja personalizovanej terapeutickej stratégie [10, 22].
ZÁVĚR
Analýza 2549 molekúl miRNA potvrdila 171 miRNA s vyššou expresiou a 136 miRNA s nižšou expresiou v súbore tkanív luminálnych typov karcinómu prsníka v porovnaní z tkanivami bez histopatologického nálezu. Top 20 miRNA s najväčším rozdielom a teda predpokladaným vplyvom na jednotlivé procesy karcinogenézy s onkogénnym potenciálom sú: miR-182-5p, miR-21-3p, miR-342-5p, miR-342-3p, miR-6826-5p a s tumor supresorovým charakterom: miR-4324, miR-451a, miR-99a-5p, miR-125b-5p, miR-100-5p, miR-145-5p, miR-335-5p, miR-199b-5p, miR-143-3p, miR-10b-5p, miR-195-5p, miR-497-5p, miR-130a-3p, miR-140-3p, miR-126-3p.
Tieto prvotné výsledky prinášajú doplňujúce informácie biologickej charakteristiky vybraných nádorov prsnej žľazy a otvárajú potenciál ďalších analýz zameraných na podrobnejšiu charakterizáciu jednotlivých podtypov KP a interpretáciu klinickej a predikčnej relevantnosti.
Táto práca bola podporená projektami APVV-16-0021 a VEGA 1/0199/17.
doc. RNDr. Zuzana Dankova, PhD.
Martinské centrum pre biomedicínu
Jesseniova lekárska fakulta
Univerzita Komenského
Malá hora 4C
036 01 Martin
Slovenská republika
e-mail: zuzana.dankova@uniba.sk
Sources
1. Amorim, M., Lobo, J., Fontes-Sousa, M., et al. Predictive and prognostic value of selected microRNAs in luminal breast cancer. Front Genet, 2019, 11, 10, p. 815.
2. Bartel, DP. MicroRNA Target recognition and regulatory functions. Cell, 2009, 23, 136(2), p. 215–233.
3. Calin, GA., Dumitru, CD., Shimizu, M., et al. Frequent deletions and down-regulation of micro-RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia. Proc Natl Acad Sci USA, 2002, 99, p. 15524–15529.
4. Dunnwald, LK., Rossing, MA., Li, CI. Hormone receptor status, tumor characteristics, and prognosis: a prospective cohort of breast cancer patients. Breast Cancer Res, 2007, 9(1), R6.
5. Globocan 2018: https://gco.iarc.fr/today/data/factsheets/populations/900-world-fact-sheets.pdf.
6. Hayes, J., Peruzzi, PP., Lawler, S. MicroRNAs in cancer: biomarkers, functions and therapy. Trends Mol Med, 2014, 20(8), p. 460–469.
7. Iorio, MV., Ferracin, M., Liu, CG., et al. MicroRNA geneexpression deregulation in human breast cancer. Cancer Res, 2005, 65, p. 7065–7070.
8. Kurozumi, S., Yamaguchi, Y., Kurosumi, M., et al. Recent trends in microRNA research into breast cancer with particular focus on the associations between microRNAs and intrinsic subtypes. J Hum Genet, 2017, 62(1), p. 15–24.
9. Leoni, G., Tramontano, A. A structural view of microRNA-target recognition. Nucleic Acids Res. 2016, 19:44(9), p. e82.
10. Loh, HY., Norman, BP., Lai, KS., et al. The regulatory role of microRNAs in breast cancer. Int J Mol Sci, 2019, 20(19), p. 4940.
11. Ma, S., Ren, J., Fenyö, D. Breast cancer prognostics using Multi-Omics Data. AMIA Jt Summits Transl Sci Proc, 2016, 20, p. 52–59.
12. MirBase. http://www.mirbase.org/cgi-bin/mirna_entry.pl?acc=MIMAT0000259
13. Orellana, EA., Kasinski, AL. MicroRNAs in cancer: a historical perspective on the path from discovery to therapy. Cancers (Basel), 2015, 7(3), p. 1388–1405.
14. Price, C., Chen, J. MicroRNAs in cancer biology and therapy: Current status and perspectives. Genes Dis, 2014, 1(2), p. 53–63.
15. Seok, H., Ham, J., Jang, ES., Chi, SW. MicroRNA target recognition: insights from transcriptome-wide non-canonical interactions. Mol Cells, 2016, 31, 39(5), p. 375–381.
16. Shams, R., Dianatpour, A., Omrani, MD., Ghafouri-Fard, S. Expression analysis of miR-100 and selected genes from mTOR pathway in breast cancer patients. Meta Gene, 2019, 21, p. 100577.
17. Sharifi, M., Moridnia, A. Apoptosis-inducing and antiproliferative effect by inhibition of miR-182-5p through the regulation of CASP9 expression in human breast cancer. Cancer Gene Ther, 2017, 24(2), p. 75–82.
18. Schooneveld, E., Wildiers, H., Vergote, I., et al. Dysregulation of microRNAs in breast cancer and their potential role as prognostic and predictive biomarkers in patient management. Breast Cancer Res, 2015, 17, p. 21.
19. Sohel, MH. Extracellular/circulating microRNAs: release mechanisms, functions and challenges. Achiev Life Sci, 2016, 10, 2, p. 175–186.
20. Søkilde, R., Persson, H., Ehinger, A., et al. Refinement of breast cancer molecular classification by miRNA expression profiles. BMC Genomics, 2019, 20, 503, p. 5887–5889.
21. Stefansson, OA., Esteller, M. Epigenetic modifications in breast cancer and their role in personalized medicine. Am J Pathol, 2013, 183(4), p. 1052–1063.
22. Svoronos, AA., Engelman, DM., Slack, FJ. OncomiR or tumor suppressor? The duplicity of microRNAs in cancer. Cancer Res, 2016, 1, 76(1), p. 3666–3670.
23. Takahashi, R., Miyazaki, H., Ochiya, T. The roles of microRNAs in breast cancer. Cancers, 2015, 7(2), p. 598–616.
24. Toss, A., Venturelli, M., Peterle, C., et al. Molecular biomarkers for prediction of targeted therapy response in metastatic breast cancer: trick or treat? Int J Mol Sci, 2017, 4, 18(1), p. e85.
25. Truini, A., Coco, S., Nadal, E., et al. Downregulation of miR-99a/let- -7c/miR-125b miRNA cluster predicts clinical outcome in patients with unresected malignant pleural mesothelioma. Oncotarget, 2017, 2, 8(40), p. 68627–68640.
26. Uhr, K., Prager-Vander Smissen, WJC., Heine, AAJ., et al. MicroRNAs as possible indicators of drug sensitivity in breastcancer celllines. Plos One, 2019, 14(5), p. 0216400.
27. Weigelt, B., Geyer, FC., Reis-Filho, S. Histological types of breast cancer: How special are they? Mol Oncol, 2010, 4, 3, p. 192–208.
28. Yan, L., Yu, MC., Gao, GL., et al. MiR-125a-5p functions as a tumour suppressor in breast cancer by downregulating BAP1. J Cell Biochem, 2018, 119(11), p. 8773–8783.
29. Yersal, O., Barutca, S. Biological subtypes of breast cancer: Prognostic and therapeutic implications. World J Clin Oncol, 2014, 10, 5(3), p. 412–424.
30. Zhao, YS., Yang, WC., Xin, HW., et al. MiR-182-5p knockdown targeting PTEN inhibits cell proliferation and invasion of breast cancer cells. Yonsei Med J, 2019, 60(2), p. 148–157.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2020 Issue 3
Most read in this issue
- Nativní IVF cyklus u 46leté pacientky s následnou klinickou graviditou rysy
- Prodloužená gravidita: nezvyklý případ
- Nový, estrogeny neobsahující přípravek perorální hormonální antikoncepce (Estrogene free pill-EFP)
- Disekující leiomyom dělohy s neobvyklými klinickými a patologickými rysy
