Predikcia výsledku gravidity po embryotransfere na základe sérových koncentrácií choriového gonadotropínu
Pregnancy outcome prediction after embryo transfer based on serum human chorionic gonadotrophin concentrations
Objective: The aim of the study was to evaluate the predictive value of the human chorionic gonadotropin (hCG) concentration on the 14th and 16th post-ovulation day after embryo transfer/cryoembryo transfer as well as the dynamics of its increase with respect to the outcome of pregnancy. Materials and methods: In total, 130 embryo transfers and cryoembryo transfers in women aged 22 to 38 years who experienced a single embryo transfer or single cryoembryo transfer with confirmed pregnancy (hCG level over 15 IU/l on 14th post-ovulation day – D14) were selected. The input parameters (hCG D14, hCG D16, hCG D16-D14, hCG D16/D14 and positivity of at least 2.5-fold increase in hCG D16 compared to hCG D14) were evaluated by regression analysis in relation to the outcome parameters (biochemical pregnancy, clinical pregnancy, clinical pregnancy terminated by abortion up to 12 weeks of gestation, clinical pregnancy terminated by childbirth). Results: Single concentrations of hCG D14 and D16, as well as the difference between these concentrations, were a statistically significant indicator of the prediction of biochemical pregnancy (P = 0.000215, P = 0.000227 and P = 0.000421). Contrary to expectations, the proportion of hCG D16 and D14 concentrations did not show statistical significance for either parameter, as well as the fulfilment of the condition of at least a 2.5fold increase in hCG D16 compared to D14. None of the studied input parameters was confirmed as a statistically significant marker for the prediction of miscarriage in the whole group of patients. However, in the group of confirmed clinical pregnancies, the serum concentration of hCG D16 (P = 0.0248) and the difference between concentrations D16 and D14 (P = 0.0185) were confirmed as a positive predictor of the progression of pregnancy until delivery. Conclusions: Single hCG concentrations are a good prognostic factor for predicting the outcome of pregnancy, but the determination of the cut-off limit is limited by inter-laboratory deviation as well as by timing of blood collection for hCG determination on the exact post-ovulatory day. The results of individual studies are therefore difficult to use in clinical practice. The dynamics of hCG concentrations appear to be a more reliable predictor of pregnancy outcome. In our cohort, we confirmed the statistical significance of the difference in hCG concentration between the 16th and 14th post-ovulation day not only for the prediction of biochemical pregnancy, but also as a predictor of the progression of clinical pregnancy into childbirth. To determine the optimal values of this difference, it is necessary to evaluate a larger group of patients. Conversely, the statistical significance of the proportion of hCG concentrations between the 16th and 14th post-ovulation day was not confirmed.
Keywords:
Embryo transfer – in vitro fertilisation – human chorionic gonadotrophin – cryoembryo transfer – biochemical pregnancy – hCG dynamics – ongoing pregnancy – childbirth after embryo transfer
Authors:
Balasičová K. 1,2; Kraus A. 3; Peterová L. 1; Nykolaichuk R. 4; Toporcerová S. 1,2
Authors‘ workplace:
Centrum pre asistovanú reprodukciu Gyncare, s. r. o., Košice, Slovenská republika
1; Gynekologicko-pôrodnícka klinika LF UPJŠ v Košiciach, Slovenská republika
2; Ústav matematiky a statistiky, Přirodovědecká fakulta, MU Brno, Česká republika
3; Gynekologicko-porodnické oddělení, Karlovarská krajská nemocnice a. s., Česká republika
4
Published in:
Ceska Gynekol 2022; 87(1): 4-12
Category:
Original Article
doi:
https://doi.org/10.48095/cccg20224
Overview
Cieľ: Cieľom štúdie bolo vyhodnotiť prediktívnu hodnotu koncentrácie ľudského choriového gonadotropínu (hCG) 14. a 16. postovulačný deň po embryotransfer/kryoembryotransfere ako aj dynamiky vzostupu tejto koncentrácie vzhľadom na výsledok tehotnosti. Súbor a metodika: Retrospektívne boli na skupine 130 pacientok s potvrdenou graviditou po embryotransfere/kryoembryotransfere regresnou analýzou vyhodnotené vstupné parametre (hCG D14, hCG D16, D16–D14, D16/D14 a splnenie podmienky aspoň 2,5násobného vzostupu hCG D16 oproti hCG D14) vo vzťahu ku výstupným parametrom (biochemická gravidita, klinická gravidita, klinická gravidita ukončená potratom do 12. týždňa tehotnosti, klinická gravidita ukončená pôrodom). Výsledky: Jednorazové koncentrácie hCG D14 a D16, ako aj rozdiel týchto koncentrácií bol štatisticky signifikantným ukazovateľom predikcie biochemickej tehotnosti (p = 0,000215, p = 0,000227 a p = 0,000421). Podiel koncentrácií hCG D16 a D14 nevykazoval štatistickú významnosť ako prediktívny ukazovateľ ukončenia tehotnosti v štádiu biochemickej gravidity. Ani jeden zo sledovaných vstupných markerov sa nepotvrdil ako štatisticky významný marker pre predikciu spontánneho potratu v celej skupine pacientok. Avšak v skupine potvrdených klinických gravidít bola ako pozitívny prediktor progresie tehotnosti až do pôrodu potvrdená tak sérová koncentrácia hCG D16 (p = 0,0248), ako aj rozdiel koncentrácií D16–D14 (p = 0,0185). Násobok tohto vzostupu ani pri týchto parametroch nebol štatisticky významný. Ani pri jednom sledovanom výstupnom parametri sa nepotvrdila štatistická významnosť dosiahnutia aspoň 2,5-násobku sérovej koncentrácie hCG D16 oproti D14. Záver: Jednorazové koncentrácie hCG sú dobrým prognostickým faktorom pre predikciu výsledku gravidity, stanovenie cut-off hranice je však limitované interlaboratórnou odchýlkou, ako aj datovaním odberu hCG. Preto sú aj výsledky jednotlivých štúdií v klinickej praxi ťažko použiteľné. Dynamika sledovania koncentrácií hCG sa javí ako spoľahlivejší prediktor výsledku tehotnosti. V našom súbore sme potvrdili štatistický význam rozdielu koncentrácie hCG 16. a 14. postovulačný deň nielen pre predikciu biochemickej tehotnosti, ale aj ako prediktora progresie klinickej tehotnosti do pôrodu. Na stanovenie optimálnych hodnôt tohto rozdielu je potrebné vyhodnotenie väčšieho súboru pacientov. Naopak, štatistický význam podielu koncentrácií hCG medzi 16. a 14. postovulačným dňom nebol potvrdený.
Klíčová slova:
in vitro fertilizácie – ľudský choriogonadotropný hormón – embryotransfer – kryoembryotransfer – biochemické tehotenstvo – dynamika hCG – pokračujúca tehotnosť – pôrod po embryotransfere
Úvod
Ľudský choriogonadotropný hormón (hCG – human chorionic gonadotrophin) je glykoproteín pozostávajúci z α- a ß- podjednotky. hCG je tvorený syncytiotrofoblastom aj cytotrofoblastom, pričom jeho hodnota zodpovedná veľkosti trofoblastickej hmoty [1,2]. hCG sa dá detegovať aj v kultivačnom médiu embrya a mRNA traskriptázy sa dajú identifikovať už v dvojbunkových embryách [3]. Dokonca bola potvrdená korelácia medzi koncentráciou hCG v kultivačnom médiu a implantačným potenciálom embrya [4,5]. V rannej gravidite je možné zistiť hCG v sére už 6.–8. deň po oplodnení, pričom jeho sérová koncentrácia sa dynamicky zdvojnásobuje v prvých týždňoch každých 48 hod u väčšiny fyziologických tehotností a tento model platí u koncepcií in vivo aj in vitro [3,6,7].
Neplodnosť je jedným z najväčších zdrojov stresu v živote človeka a považuje sa za psychologickú traumu pre väčšinu párov [8,9]. V rámci procesu in vitro fertilizácie (IVF – in vitro fertilisation) je najvyššia úroveň stresu práve v období tehotenského testu [9]. Navyše, časový interval od potvrdenia gravidity až po ultrasonografickú verifikáciu klinickej tehotnosti s viditeľnou akciou srdca plodu, považuje 46 % pacientov za extrémne alebo veľmi stresujúce obdobie [10].
Preto je skorá predpoveď úspešnosti IVF liečby pre pacientky veľmi dôležitá [11]. Rovnako je to však dôležité pre samotného lekára, aby tehotnosť adekvátnym spôsobom manažoval, a predovšetkým v prípade včasných tehotenských strát tieto informácie môžu pomôcť optimalizovať nasledujúcu liečbu neplodnosti.
V minulosti bolo hodnotených niekoľko markerov s cieľom predikovať výsledok gravidity po IVF, ako napr. sérový estradiol, progesterón, CA 125 a inhibín [8,12,13]. Viacero štúdií udáva rôzne medzné sérové koncentrácie hCG s primeranou senzitivitou a špecificitou v konkrétny deň po oplodnení, aby boli nápomocné pri rozlíšení perspektívnych gravidít od tehotností patologických alebo rizikových. Preto je stále dopyt po hľadaní spoľahlivejšieho biologického markera alebo medznej hodnoty. Napriek testovaniu viacerých biomolekúl ako prediktorov úspešnosti gravidity po embryotransfere, hCG môžeme stále považovať za najpotentnejší biomarker v tomto smere [3,13]. S rastom včasného gestačného vačku rastie počet buniek trofoblastu a tým stúpa aj ich produkcia hCG [14]. hCG je považovaný za kvantitatívny marker funkcie trofoblastu. Maximálne koncentrácie v sére dosahuje v 8.–10. týždni tehotnosti. Včasné tehotenské koncentrácie hCG sa dnes považujú za prognostický marker tehotnosti, špeciálne v skupine pacientok po embryotransfere [3,7]. Napriek tomu nie sú jasne stanovené cut-off hranice pre jednotlivé dni, rovnako ani charakteristika jeho optimálneho vzostupu. Výsledky štúdií sú v tomto smere diskrepantné. V našom súbore pacientok po embryotransfere sme sa preto pokúsili štatisticky vyhodnotiť koncentrácie hCG ale predovšetkým charakteristiky jeho vzostupu v závislosti od výsledku tehotnosti.
Súbor pacientok a metodika
Do štúdie boli zaradené pacientky, ktoré absolvovali embryotransfer alebo kryoembrytransfer jedného embrya v štádiu expandovanej blastocysty v období od januára 2017 do decembra 2019 a bola u nich potvrdená koncentrácia hCG viac ako 15 IU/l 9. deň po transfere 5dňového embrya (D14 – 14. postovulačný deň). Podmienkou zaradenia do súboru bol vek od 20 do 42 rokov, BMI v rozmedzí 18–28 a max. jeden spontánny potrat v anamnéze. Súčasne boli do súboru zaradené len tie pacientky, ktoré absolvovali kontrolný odber hCG 48 hod po prvom pozitívnom výsledku v rovnakom biochemickom laboratóriu (D16 – 16. postovulačný deň) a pacientky, u ktorých bol známy priebeh tehotenstva až do jeho ukončenia.
V prípade čerstvých embryotransferov sa embryotransfer realizoval 5. deň po odbere oocytov (štádium expandovanej až hatchujúcej blastocysty) za štandardnej podpory luteálnej fázy pri min. výške endometria 8 mm (6 mg estradiol denne v troch dávkach, 600 mg mikronizovaného progesterónu denne v troch dávkach lokálne do pošvy a 2 850 IU nadroparínu subkutánne denne odo dňa odberu oocytov). V prípade kryoembryotransferov bol transfer 5dňového embrya realizovaný buď v cykle prirodzenom (7. deň po aplikácii hCG pri minimálnej veľkosti dominantného folikulu 18 mm, výške endometria nad 8 mm a vylúčení endogénneho vzostupu luteinizačného hormónu (LH – luteinizing hormone) za štandardnej luteálnej podpory (200 mg mikronizovaného progesterónu denne v dvoch dávkach lokálne do pošvy a 2 850 IU nadroparínu subkutánne denne od 2. dňa po podaní bolusu hCG), alebo v cykle plne substituovanom pri štandardnom protokole (6 mg estradiol denne v troch dávkach, 1 000 mg mikronizovaný progesterón denne lokálne do pošvy rozdelených do troch dávok a 2 850 IU nadroparínu subkutánne denne odo dňa pridania progesterónu) pri min. výške endometria 8 mm.
Zo súboru boli vylúčené pacientky s potvrdenou ektopickou graviditou a pacientky so spontánnym potratom po 12. gestačnom týždni. Vylúčené boli aj gravidity po transfere embrya po preimplantačnej genetickej diagnostike (PGT – preimplantation genetic testing), pretože viacerými štúdiami bolo potvrdené, že tento faktor ovplyvňuje koncentráciu hCG [15]. Sérové koncentrácie hCG boli vyšetrované u všetkých vzoriek v tom istom laboratóriu kitom Elycsys hCG+b firmy Roche Diagnostics GmbH na imunoanalyzátore Cobas e 602.
U každej pacientky bolo prvé sonografické vyšetrenie realizované 25. deň po embryotransfere (D30 – 30. postovulačný deň).
Sledované vstupné rizikové parametre boli:
- koncentrácia hCG D14,
- koncentrácia hCG D16,
- rozdiel koncentrácií hCG D16–D14,
- pomer koncentrácií hCG D16/D14,
- splnenie podmienky dosiahnutia aspoň 2,5-násobku koncentrácie D16 oproti koncentrácii hCG D14.
Regresnou analýzou boli hľadané rizikové faktory pre výstupné parametre, za ktoré boli považované biochemické tehotenstvo v skupine všetkých pacientok zaradených do súboru (pozitívne hCG D14 nad 15 IU/l avšak bez následného optimálneho vzostupu a bez dosiahnutia štádia klinického tehotenstva), klinické tehotenstvo ukončené spontánnym potratom v skupine všetkých pacientok zaradených do súboru (prítomnosť gestačného vačku na ultrazvukovom obraze avšak bez potvrdenia pokračujúcej gravidity po 12. týždni tehotnosti), klinické tehotenstvo ukončené pôrodom v skupine všetkých pacientok zaradených do súboru (prítomnosť gestačného vačku na ultrazvukovom obraze s progresiou gravidity až do pôrodu živého plodu najskôr po ukončenom 26. týždni tehotnosti) a klinické tehotenstvo ukončené pôrodom v skupine všetkých pacientok s potvrdeným klinickým tehotenstvom D30 (s vylúčením pacientok len s biochemickou graviditou).
Kvantitatívne údaje boli udávané ako priemerná hodnota ± smerodajná odchýlka. Dáta boli spracované v programovacom jazyku R na štatistickej úrovni p < 0,05.
Výsledky
Do skupiny bolo zaradených 130 pacientok, z toho u 83 pacientok šlo o čerstvý embryotransfer a u 47 pacientok o kryoembryotransfer. Len biochemické tehotenstvo bolo potvrdené u 23 pacientok, spontánny potrat do ukončeného 12. týždňa tehotnosti po potvrdení klinickej gravidity D30 bol potvrdený u 17 pacientok a tehotenstvo progredovalo do pôrodu u 90 pacientok.
Priemerný vek pacientok v dobe embryotransferu alebo kryoembryotransferu bol v celej skupine 34,61 ± 1,68 rokov. V prípade gravidít ukončených pôrodom bol priemerný vek 32,72 ± 3,99 rokov a bol nižší ako v prípade biochemických gravidít (35,96 ± 5,23 rokov) a klinických gravidít ukončených spontánnym potratom (35,18 ± 4,85 rokov).
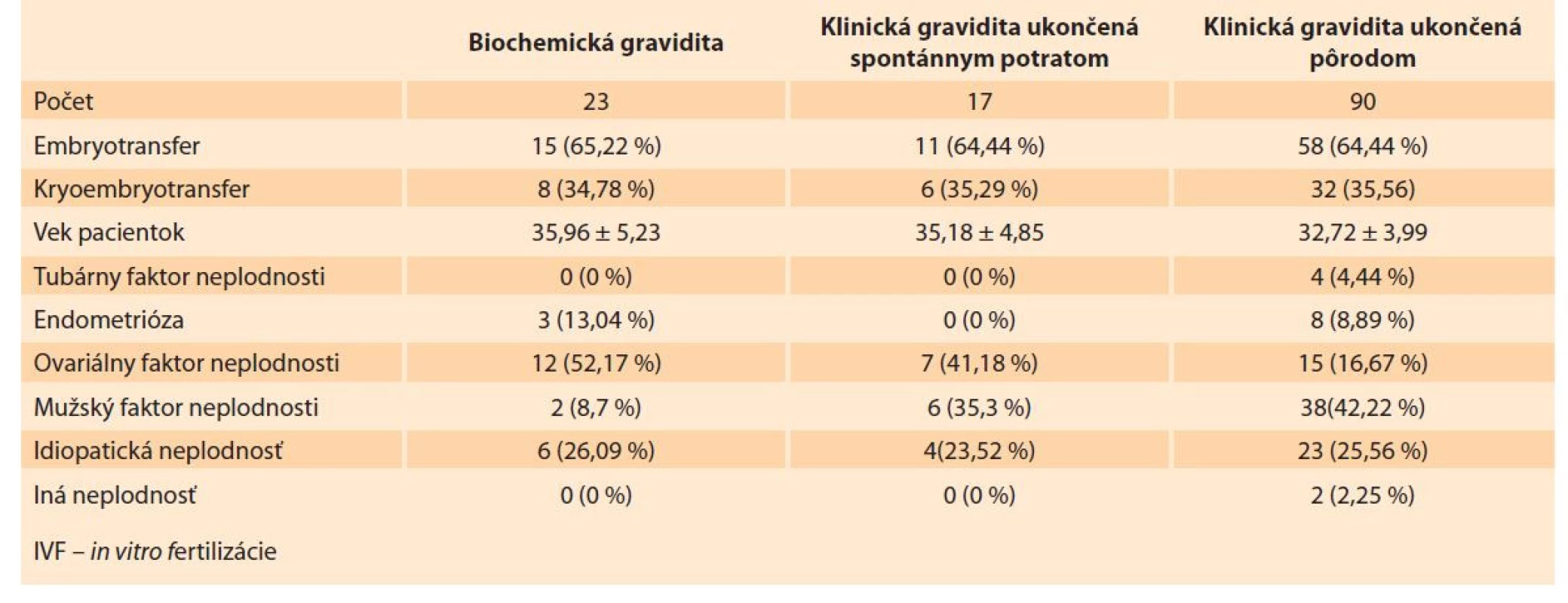
V prípade biochemickej gravidity bol čerstvý embryotransfer realizovaný u 15 žien (65,22 %) a kryoembryotransfer u ôsmich žien (34,78 %). V prípade klinickej gravidity ukončenej spontánnym potratom bol čerstvý embryotransfer realizovaný u 11 pacientok (64,71 %) a kryoembryotransfer u šiestich pacientok (35,29 %). V prípade klinickej gravidity ukončenej pôrodom bol čerstvý transfer realizovaný u 58 pacientok (64,44 %) a o kryoembryotransfer u 32 pacientok (35,56 %) Etiológiu neplodnosti udáva tab. 1.
Tab. 1. Distribution of patients with achieved pregnancy after IVF cycle according to the result of pregnancy.
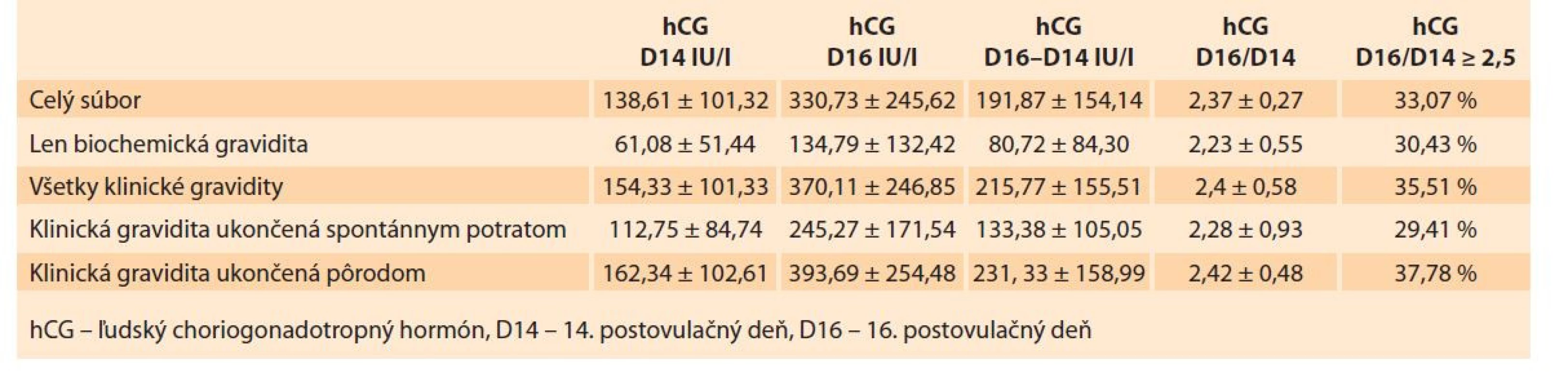
Priemerná koncentrácia hCG na D14 v celej skupine sledovaných 130 žien bola 138,61 IU/l ± 101,32. Priemerná hodnota hCG na D16 v celej skupine 130 žien bola 330,73 IU/l ± 245,62. Priemerná hodnota hCG na D14 v skupine pacientok s biochemickou tehotnosťou bola 61,08 IU/l ± 51,44. Ostatné hodnotené vstupné parametre vo vzťahu ku výstupným parametrom udáva tab. 2, grafy 1–5.
Tab. 2. Average values of input parameters in relation to output parameters.
Graph 1. Mean serum concentrations of hCG D14.

Graph 2. Mean serum concentrations of hCG D16.

Graph 3. Difference between hCG D16 and D14 concentrations.

Graph 4. Proportion of hCG D16/D14 concentrations.

Graph 5. Fulfillment of the condition min. 2.5-times the concentration of hCG D16
compared to D14.

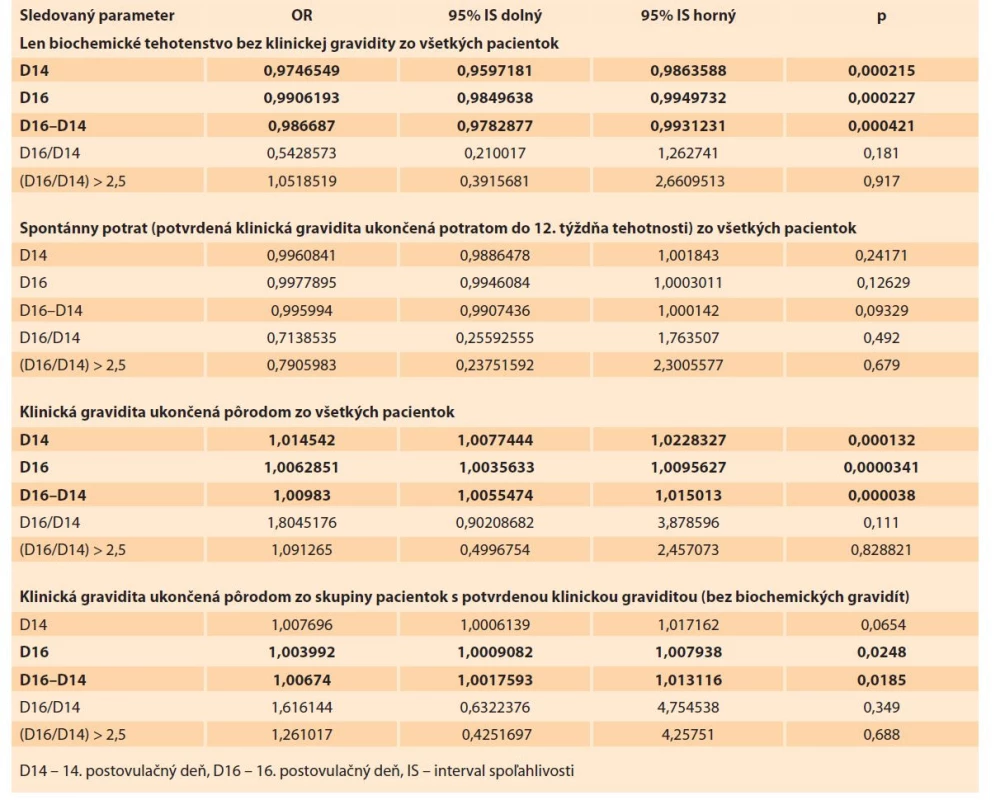
Regresnou analýzou boli následne vyhodnotené vzťahy medzi jednotlivými vstupnými a výstupnými parametrami (tab. 3). Z výsledkov vyplýva, že pre predikciu len biochemického tehotenstva bez ďalšej progresie do klinickej gravidity sú štatisticky dôležité tak koncentrácia hCG D14 ako aj D16, rovnako však aj rozdiel medzi týmito dvomi koncentráciami. Možnosť predikcie spontánneho potratu v celej skupine pacientok nebola potvrdená pri žiadnom sledovanom parametri. Štatisticky významné ukazovatele predikcie pôrodu v celej skupine boli koncentrácie hCG D14, D16, ako aj rozdiel týchto koncentrácií. V skupine pacientok s potvrdenou klinickou graviditou je však možné predikovať pôrod na základe sérovej koncentrácie D16, ako aj rozdielu koncentrácií D16 a D14. Samotná koncentrácia hCG D14 v súbore v tomto prípade nebola štatisticky významná a nepredikovala šance na pôrod v skupine pacientok s potvrdenou klinickou graviditou.
Tab. 3. Relationship between individual statistical indicators.
Diskusia
Skupina žien, ktoré otehotneli po IVF je špecifická v tom, že väčšina pacientok absolvuje odber krvi na stanovenie koncentrácie hCG, preto sú zaznamenané takmer všetky gravidity, vrátane tých najvčasnejších tehotenských strát. Väčšina pacientok absolvuje odber krvi na hCG určitý daný deň po embryotransfere alebo kryoembryotransfere, datovanie tohto odberu sa medzi jednotlivými pracoviskami líši (väčšinou 9.–18. deň po embryotransfere). U väčšiny potvrdených gravidít je ešte indikovaný aj kontrolný odber hCG za účelom sledovania jeho dynamiky. Existuje len málo údajov týkajúcich sa predvídateľnosti priebehu gravidity po IVF na základe dynamiky dvoch hodnôt hCG odobratých s určitým časovým odstupom. Práve preto sme sa na našom súbore sústredili na sledovanie dynamiky koncentrácií hCG odobratých s odstupom 48 hod a to 14. a 16. deň po odbere oplodnení oocytov.
Väčšina autorov hodnotí priebeh a výsledok gravidity na základe jednej hodnoty hCG a pokúša sa stanoviť cut-off hranicu, ktorá by daný deň mala mať schopnosť predikcie ďalšieho vývoja tehotnosti. Naredi et al publikovali vo svojej štúdii, že ak bola hodnota hCG na 16. deň po embryotransfere viac ako 500 mIU/ml, bola štatisticky významná pravdepodobnosť pokračujúcej gravidity po I. trimestri [16]. Zbořilová et al zase udávajú priemerné koncentrácie hCG na 14. deň po embryotransfere v skupine žien, ktoré porodili 321 IU/l, u žien, ktoré potratili hodnotu 82 IU/l a u žien s viacplodovou graviditou 1 070 IU/l [17]. Sung et al potvrdili signifikantne vyššie koncentrácie hCG na 12. a 14. postovulačný deň v skupine žien, u ktorých bola gravidita ukončená pôrodom v porovnaní so ženami s biochemickou graviditou a ženami, ktoré spontánne potratili [3]. Autori porovnávali osobitne koncentrácie hCG po čerstvých embryotransferoch a kryoembryotransferoch. Viaceré štúdie totižto potvrdili, že koncentrácie hCG po kryoembryotransfere sú vyššie ako po čerstvom embryotransfere [15,18,19]. Hobeika et al dokonca v roku 2017 publikovali, že najvyššie koncentrácie hCG boli po transfere embrya po PGT, a to 182,4 mIU/ml 9. deň po kroembryotransfere blastocysty (D14). U žien po kryoembryotransfere geneticky nevyšetrených embryí to bola koncentrácia 124 mIU/ml a u žien po čerstvom embryotransfere geneticky nevyšetrených embryí koncentrácia 87,1 mIU/ml ten istý deň (D14) [15]. Xiong et al dokonca publikovali, že aj pohlavie embrya ovplyvňuje iniciálne sérové koncentrácie hCG v ranej gravidite po IVF [20]. Koncentrácia hCG na 11. deň po embryotransfere bola signifikantne vyššia u žien, ktoré porodili plod mužského pohlavia v porovnaní so ženami, ktoré porodili plod ženského pohlavia (549,82 ± 253,24 IU/l vs. 439,03 ± 198,41 IU/l, p < 0,05), podobný trend zistili aj po kryoembryotransfere (894, 43 ± 622,17 IU/l vs. 758,05 ± 624,33 IU/ml, p < 0,05) [20]. Tanbo et al publikovali, že iniciálna koncentrácia hCG ovplyvňuje celkové trvanie gravidity. Medián trvania gravidity od embryotransferu bol 266 dní, pričom priemerná koncentrácia hCG vyšetrená na 12. deň po embrytransfere bola 117 IU/l. Podľa autorov sa trvanie tehotnosti znižovalo s narastajúcou iniciálnou koncentráciou hCG [14].
Priemerná sérová koncentrácia hCG v našom súbore na D14 bola 138,61 IU/l, pričom sme nediferencovali medzi čerstvým transferom a kryoembryotransferom. Avšak zastúpenie kryoembryo- transferov bolo porovnateľné vo všetkých podskupinách (34,78 % v prípade biochemických tehotností vs. 35,29 % v prípade klinických gravidít ukončených spontánnym potratom vs. 35,56 % v prípade klinických gravidít ukončených pôrodom). Týmto sme sa možnosť, aby rôzne zastúpenie kryoembryotransferov pri jednotlivých výstupných parametroch ovplyvňoval sledovanú koncentráciu hCG, snažili eliminovať.
Vo vzťahu k jednorazovému meraniu koncentrácie hCG ako prediktora výsledku gravidity sa však objavujú štúdie, že cut-off hranice sú ťažko hodnotiteľné tak z hľadiska rôznych diagnostických kitov na stanovenie koncentrácie hCG, ako aj kvôli rôznemu datovaniu odberu hCG v jednotlivých centrách, a preto sa ako sľubnejší prediktívny ukazovateľ javí hodnotenie trendu vzostupu koncentrácie hCG [21].
V našej štúdii sme potvrdili v súlade s ostatnými autormi, že z hľadiska predikcie ukončenia tehotnosti v štádiu biochemickej gravidity je dôležitá koncentrácia hCG nameraná tak na D14 ako aj D16. Predikovať patologický vývoj včasného tehotenstva a ukončenie gravidity v štádiu biochemického tehotenstva je možné nielen na základe koncentrácií hCG D14, D16, ale aj na základe rozdielu týchto hodnôt. Potvrdenie štatistickej významnosti nízkej koncentrácie hCG D14 aj D16 v rámci predikcie biochemického tehotenstva je v súlade s pozorovaniami aj ostatných autorov. V roku 2020 Wang et al napríklad publikovali štúdiu, že koncentrácie hCG D17 sú významným prediktívnym markerom na rozlíšenie biochemickej a klinickej gravidity [22]. Na stanovenie cut-off hranice je však potrebná väčšia skupina pacientok a pravdepodobne aj oddiferencovanie čerstvých transferov a kryoembryotransferov. Je zaujímavé, že hoci sa bežne v odbornej literatúre popisuje, že za optimálny sa hodnotí násobný vzostup hCG po 48 hod, v našom súbore sme nepotvrdili štatistický význam sledovania podielu hodnôt D16 a D14. Rovnako sa nepotvrdila ani štatistická významnosť dosiahnutia aspoň 2,5-násobku predchádzajúcej koncentrácie hCG D16 oproti D14. V porovnaní s pacientkami s progresiou tehotnosti do štádia klinickej gravidity boli násobok koncentrácie hCG po 2 dňoch obdobný a percento splnenia podmienky 2,5-násobného vzostupu štatisticky porovnateľné.
Ďalšou zaujímavou skutočnosťou je, že jednorazové koncentrácie hCG vo väčšine štúdií neboli dostatočným markerom pre predikciu pokračujúcej gravidity po 12. týždni, rovnako ani pre predikciu úspešného ukončenia tehotnosti pôrodom. V prípade potvrdenia klinického tehotenstva teda neboli schopné predpokladať ďalší osud tehotnosti.
Niektorí autori preto na predikciu priebehu gravidity okrem koncentrácií hCG vyhodnocovali aj iné biomarkery. V štúdii Kima et al to bola napríklad sérová koncentrácia progesterónu. V štúdii potvrdili, že koncentrácia hCG 126,5 mIU/ml a koncentrácia progesterónu vyššia ako 25,2 ng/ml 14. deň po odbere oocytov je prediktívnym markerom pokračujúcej tehotnosti [12]. Vzhľadom na rôzne typy suplementácie luteálnej fázy v absolútnej väčšine všetkých embryotransferov, je stanovenie koncentrácií progesterónu ako prediktívneho markera dosť rozporuplné. Všeobecne sú v jednotlivých štúdiách stanovované koncentrácie hCG rôzne postovulačné dni, používajú sa rôzne vyšetrovacie kity, častokrát ide aj o transfery dvoch embryí do maternice. Preto nie je možné publikované výsledky paušálne porovnávať.
Je však dôležité, že korelácia medzi iniciálnymi koncentráciami hCG a priebehom gravidity existuje, a je v záujme každého centra asistovanej reprodukcie určiť si svoje hraničné ukazovatele, na základe ktorých môžu vyselektovať skupinu pacientok s vyšším rizikom patologického priebehu tehotenstva.
Je všeobecne akceptovaným faktom, že pri fyziologickej tehotnosti sa koncentrácia hCG zdvojnásobí o 48–72 hod. V našej štúdii sme potvrdili, že približne rovnaké hodnoty násobku hCG po 48 hod od prvého odberu boli dosiahnuté v skupine biochemických tehotností, ako aj v prípade klinických gravidít bez závislosti od toho, či boli ukončené spontánnym potratom, alebo progredovali do pôrodu. Ani pri jednom výstupnom parametri nevyšiel tento pomer štatisticky významný. Následne sme preto na základe klinickej skúsenosti štatisticky vyhodnotili ešte aj splnenie podmienky 2,5-násobku vzostupu hCG po 48 hod. Aj v tomto prípade nebol tento vstupný parameter štatisticky významný ani pri jednom výstupnom parametri a nebol schopný predikovať ďalší vývoj tehotnosti. Prekvapivo, aj v skupine gravidít ukončených pôrodom túto podmienku spĺňalo len necelých 38 % pacientok.
Násobky medzi koncentráciou hCG vyšetrovanou na D14 a D12 hodnotili aj Sung et al [3]. V cykloch s čerstvým embryotransferom bola u klinických tehotností koncentrácia hCG na D14 2,56-násobkom koncentrácie hCG hodnoty vyšetrenej na D12. Po kryoembryotransferoch bola u žien s klinickou graviditou koncentrácia hCG na D14 2,38-násobkom hodnoty hCG vyšetrenej na D12. Avšak, ak sa hodnotili len tehotenstvá ukončené pôrodom živého plodu, po čerstvom transfere bola koncentrácia hCG na D14 2,87-násobkom hodnoty hCG zisťovanej na D12 [3]. Po kryoembryotransferoch v skupine žien, u ktorých bola gravidita ukončená pôrodom, bola koncentrácia hCG na D14 2,56-násobkom koncentrácie hCG vyšetrenej na D12. Autori dokonca uvádzajú, že čím je nižšia iniciálna koncentrácia hCG odobratá na 12. postovulačný deň, tým vyšší musí byť násobok koncentrácie hCG na 14. postovulačný deň, aby bola gravidita ukončená pôrodom [3].
Obdobný výstup sme potvrdili aj v našom súbore, avšak na základe sledovania rozdielu koncentrácií hCG D16 a D14. Významnejším ukazovateľom ako násobok koncentrácií hCG medzi D16 a D14 je totižto podľa našich výsledkov práve rozdiel koncentrácií hCG D16 a D14. Ten je štatisticky významný nielen na odlíšenie biochemického a klinického tehotenstva, ale dokonca je schopný predikovať aj ďalší vývoj tehotnosti po potvrdení klinickej gravidity. Po potvrdení klinickej tehotnosti by sme tak mohli byť schopní vyselektovať skupinu pacientok, ktoré vyžadujú prísnejšie sledovanie, a je u nich vyššie riziko predčasného ukončenia tehotenstva spontánnym potratom.
Záver
Sérová koncentrácia hCG odobratá na 14. a 16. postovulačný deň u pacientok po embryotransfere a kryoembryotransfere predstavuje podľa väčšiny autorov spoľahlivý prediktívny marker na odlíšenie biochemickej a klinickej gravidity. Tento fakt sme potvrdili aj v našom súbore. Problémom je stanovenie medznej hodnoty, a to tak kvôli použitiu rôznych diagnostických kitov v jednotlivých laboratóriách, ako aj kvôli tomu, že datovanie odberu krvi na stanovenie hCG sa líši podľa zvyklostí pracoviska. Preto sa pre prax použiteľnejšie javí sledovanie dynamiky vzostupu hCG. Násobok vzostupu koncentrácie hCG po 48 hod 14. a 16. postovulačný deň podľa našich výsledkov nie je vhodným markerom na predikciu ďalšieho priebehu tehotnosti. Prognostický význam na odlíšenie rizika biochemickej gravidity, spontánneho potratu a predikciu progresie tehotenstva do pôrodu, by však mohol mať rozdiel koncentrácií hCG medzi 16. a 14. postovulačným dňom. Na stanovenie medzných hodnôt tohto rozdielu je potrebné vyhodnotenie týchto parametrov na väčšom súbore pacientov a pravdepodobne aj odlíšenie čerstvých transferov a kryoembryotransferov.
ORCID autorů
K. Balasičová 0000-0001-5322-4276
S. Toporcerová 0000-0003-3562-7703
Doručené/Submitted: 6. 10. 2021
Prijaté/Accepted: 10. 11. 2021
MUDr. Katarína Balasičová, PhD.
Centrum pre asistovanú reprodukciu
Gyncare, s. r. o.
Magnezitárska 2/C
040 13 Košice
Slovenská republika
Sources
1. Lin S, Li R, Wang Y et al. Increased maternal serum hCG concentrations in the presence of a female fetus as early as 2 weeks after IVF-ET. J Gynecol Onstet Hem Reprod 2021; 50 (7): 102053. doi: 10.1016/j.jogoh.2020.102053.
2. Kuspinar G, Kasapoglu I, Cakir C et al. What is the effect of embryo morfology on serum b-hCG levels? Eur Obstet Gynecol Reprod Biol 2019; 233 (2): 107–113. doi: 10.1016/j.ejogrb.2018. 12.001.
3. Sung N, Kwak-Kim J, Koo HS et al. Serum hCG-b levels of postovulatory day 12 and 14 with the sequential application of hCG-b fold change significantly increased predictability of pregnancy outcome after IVF-ET cycle. J Assist Reprod Genet 2016; 33 (9): 1185–1194. doi: 10.1007/s10815-016-0744-y.
4. Ramu S, Acacio B, Adamowicz M et al. Human chorionic gonadotropin from day 2 spent embryo culture media and its relationship to embryo development. Fertil Steril 2011; 96 (3): 615–617. doi: 10.1016/j.fertnstert.2011.06.035.
5. Butler SA, Luttoo J, Freire MO et al. Human chorionic gonadotropin (hCG) in the secretome of cultured embryos: hyperglycosylated hCG and hCG-free beta submit are potential markers for infertility management and treatment. Reprod Sci 2013; 20 (9): 1038–1045. doi: 10.1177/ 1933719112472739.
6. Han X, Yin B, Lin S et al. Increased maternal hCG concentration in early in vitro pregnancy with elevated basal FSH. PLoS One 2018; 13 (9): e0203610. doi: 10.1371/journal.pone.0203 610.
7. Wu Y, Liu H. Possibility of live birth in patients with low serum b-hCG 14 days after blastocyst transfer. J Ovarian Res 2020; 13 (1): 132. doi: 10.1186/s13048-020-00732-6.
8. Kahyoğlu İ, Demir B, Aksakal SE et al. Value of post-transfer day-12 beta human chorionic gonadotropin levels of pregnancy outcome predicition of intracytoplasmic sperm injection cycles. Balkan Med J 2017; 34 (5): 450–457. doi: 10.4274/balkanmedj.2016.1769.
9. Yuan L, Yu L, Sun Z et al. Association between 7-day serum b-hCG levels after frozen-thawed embryo transfer and pregnancy outcomes: a single centre retrospective study from China. BMJ Open 2020; 10 (10): e035332. doi: 10.1136/bmjopen-2019-035332.
10. Hammarberg K, Astbury J, Baker H. Women‘s experience of IVF: a follow-up study. Hum Reprod 2001; 16 (2): 374–383. doi: 10.1093/ humrep/16.2.374.
11. Ryniec J, Esfandiari N. Early serum hCG in IVF: are we trending in the right direction? Reprod Sci 2021; 28 (7): 1827–1838. doi: 10.1007/s43032-020-00347-8.
12. Kim YJ, Shin JH, Hur JY et al. Predicitive value of serum progesterone level on b-hCG check day in women with previous repeated miscarriages after in vitro fertilization. PloS One 2017; 12 (7): e0181229. doi: 10.1371/journal.pone.0181229.
13. McCoy TW, Nakajima ST, Bohler HC jr. Age and single day-14 beta-HCG can predict onogoing pregnancy following IVF. Reprod Biomed Online 2009; 19 (1): 114–120. doi: 10.1016/ s1472-6483 (10) 60054-5.
14. Tanbo TG, Zucknick M, Eskild A. Maternal concentrations of human chorionic gonadotrophin in very early IVF pregnancies and duration of pregnancy: a follow-up study. Reprod Biomed Online 2018; 37 (2): 208–215. doi: 10.1016/j.rbmo.2018.04.048.
15. Hobeika E, Singh S, Malik S et al. Initial maternal serum human chorionic gonadotropin levels in pregnancies achieved after assisted reproductive technology are higher after preimplantation genetic screening and after frozen embryo transfer: a retrospective cohort. J Assist Reprod Genet 2017; 34 (10): 1333–1340. doi: 10.1007/s10815-017-0987-2.
16. Naredi N, Singh SK, Sharma R. Does first serum beta-human chorionic gonadotropin value prognosticate the early pregnyncy outcome in an in-vitro fertilisation cycle? J Hum Reprod Sci 2017; 10 (2): 108–113. doi: 10.4103/jhrs.JHRS_50_16.
17. Zbořilová B, Březinová J, Tkadlec E et al. HCG level after embryo transfer as a prognostic indicator of pregnancy finished with delivery. Ceska Gynekol 2018; 83 (5): 329–336.
18. Grin L, Indurski A, Leytes S et al. Trends in primeval b-hCG level increment after fresh and frozen- thawed IVF embryo transfer cycles. Gynecol Endocrinol 2019; 35 (3): 261–266. doi: 10.1080/09513590.2018.1519789.
19. Zhao WE, Li YJ, Ou JP et al. Predicitive value of initial serum human chorionic gonadotropin levels for pregnancies after single fresh and frozen blastocyst transfer. J Huazhong Univ Sci Technolog Med Sci 2017; 37 (3): 395–400. doi: 10.1007/s11596-017-1746-4.
20. Xiong F, Sun Q, Li GG et al. Initial serum HCG levels are higher in pregnant women with a male fetus after fresh or frozen single blastocyst transfer: a retrospective cohort study. Taiwan J Obstet Gynecol 2019; 58 (6): 833–839. doi: 10.1016/j.tjog.2019.09.019.
21. Al Mamari N, Al Zawawi N, Khayat S et al. Revisiting serum b HCG cut-off levels and pregnancy outcomes using single embryo transfer. J Assist Reprod Genet 2019; 36 (11): 2307–2313. doi: 10.1007/s10815-019-01 583-x.
22. Wang ZM, Gao Y, Zhang D et al. Predictive value of serum b-human chorionic gonadotropin for early pregnancy outcomes. Arch Gynecol Obstet 2020; 301 (1): 295–302. doi: 10.1007/s00404-019-05388-2.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2022 Issue 1
Most read in this issue
- Pregnancy outcome prediction after embryo transfer based on serum human chorionic gonadotrophin concentrations
- Hand-foot-mouth disease in puerperium
- Accuracy of the Edinburgh Postnatal Depression Scale in screening for major depressive disorder and other psychiatric disorders in women towards the end of their puerperium
- Indocyanine green as a new trend in sentinel lymphatic node detection in oncogynecology
