Role elektrické „power“ morcelace v minimálně invazivní gynekologické operativě
The role of power morcellation in minimally invasive gynecologic surgery
Objective: To summarize recent data and knowledge of laparoscopic power morcellation. Methods: Review of articles. Results: Laparoscopic morcellation has been introduced to gynecologic surgery in 90’s. In 2014, Food and Drug Administration announced negative statement about the morcellation use due to the risk of potential spreading of malignant tumor cells. This statement reduced utilization of morcellation, especially in the United States. Since that, many health institutions and organizations started new researches focused on the safety of this surgical technique. After a couple of years, the morcellation is considered as a useful tool if certain rules are followed. Conclusion: Morcellation has a place in laparoscopic operative procedures even in 2022, in condition of correct selection of patients and possible utilization of contained in-bag morcellation.
Keywords:
Hysterectomy – myomectomy – laparoscopy – morcellation
Autoři:
B. Boudová 1,2
; A. Richtárová 1
; Filip Frühauf 1
; Daniela Fischerová 1
; Michal Mára 1
Působiště autorů:
Gynekologicko porodnická klinika 1. LF UK a VFN v Praze
1; Gynekologicko-porodnické oddělení, Oblastní nemocnice Trutnov a. s.
2
Vyšlo v časopise:
Ceska Gynekol 2022; 87(4): 289-294
Kategorie:
Přehledový článek
doi:
https://doi.org/10.48095/cccg2022289
Souhrn
Cíl: Podat aktuální pohled na problematiku laparoskopické elektrické morcelace. Metodika: Rešerše dostupné literatury na vybrané téma. Výsledky: Laparoskopická morcelace byla zavedena do gynekologické operativy v 90. letech. V roce 2014 bylo americkým Úřadem pro kontrolu potravin a léčiv vydáno negativní stanovisko stran jejího užívání pro riziko možného rozsevu maligních buněk. Od té doby se použití morcelace snížilo, a to především ve Spojených státech. Některé zdravotnické organizace a instituce započaly nové výzkumy stran bezpečnosti této chirurgické metody. Po dalších letech mnohé z nich přistupují k morcelaci opět smířlivě za dodržení určitých podmínek. Závěr: Morcelace má prostor v laparoskopické operativě i v roce 2022 za předpokladu správné selekce pacientek a případně využití možnosti chráněné „in-bag“ morcelace.
Klíčová slova:
laparoskopie – myomektomie – hysterektomie – morcelace
Úvod
Přednosti minimálně invazivní chirurgie v léčbě benigních gynekologických onemocnění jsou nezpochybnitelné a již desítky let uznávané [1–3]. Laparoskopická myomektomie, poprvé popsaná Kurtem Semmem v roce 1979 [4], je stále považována za zlatý standard v léčbě symptomatických děložních myomů u pacientek s neuzavřenými reprodukčními plány. Dle Cochranovy databáze jsou pro pacientky v případě benigního nálezu minimálně invazivní operace (vaginální a laparoskopická hysterektomie) nadřazeny otevřené abdominální hysterektomii, a to vzhledem k rychlejší rekonvalescenci a návratu do běžného života [5]. Minimálně invazivní operace zvětšené dělohy s sebou ale v obou případech, ať už se jedná o dělohu šetřící, či odstraňující výkon, přináší problematiku extrakce odoperované tkáně.
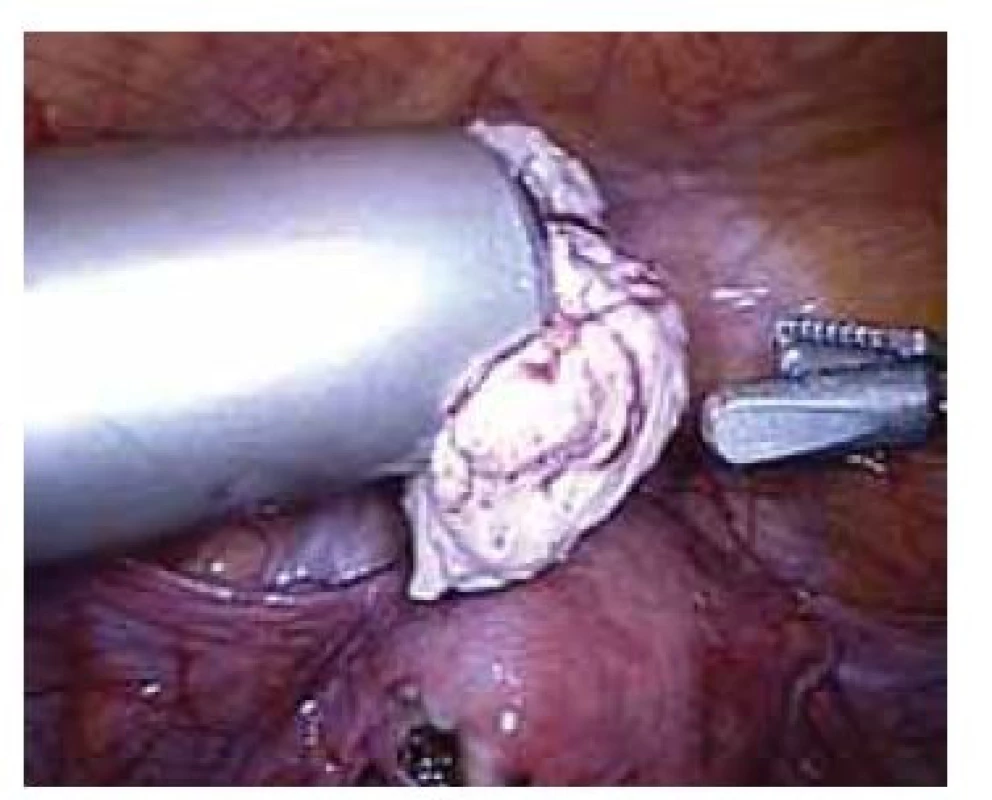
Elektrický „power“ morcelátor byl poprvé v gynekologii popsán v roce 1993 [6]. Jedná se o cylindrický ostrý nůž, který se zavádí místo trokaru, a za jeho pomoci je možné intraabdominálně rozřezat a následně po kouskách extrahovat tkáň bez nutnosti výraznějšího rozšíření laparoskopických incizí (obr. 1). Morcelátory jsou vyráběny o různých průměrech (12–20 mm) s možností nastavení otáček 100–1 200 za minutu [7]. Jedná se o přístroj, který zkracuje operační čas a vzhledem k absenci doplňující minilaparotomie či kolpotomie k extrakci tkáně přispívá k zachování všech výhod minimálně invazivní chirurgie. Nejčastěji je tato technika (obr. 2) využívaná při laparoskopické hysterektomii pro objemnou myomatózní dělohu (zejména při úzké pochvě vaginálně nerodivších žen), laparoskopické myomektomii a laparoskopické supracervikální hysterektomii.
Fig. 1. Laparoscopic power morcellator with a diameter of 20 mm.

Fig. 2. Laparoscopic morcellation
of myoma.
Historie kontroverze používání elektrického morcelátoru
Americký úřad pro kontrolu potravin a léčiv (FDA – Food and Drug Administration) schválil použití morcelátoru v gynekologii v květnu roku 1995. Již dříve byl tento přístroj schválen pro použití v urologii či obecné chirurgii a již v 90. letech minulého století zněla doporučení jasně; v případě maligního onemocnění má být morcelátor použit v kombinaci s odpovídajícím ochranným sáčkem [8].
V prosinci roku 2013 zveřejnil Wall Street Journal případ anestezioložky bostonské nemocnice, jež podstoupila hysterektomii s následnou morcelací dělohy pro předpokládané myomy. Výsledky histologického vyšetření ukázaly, že se jednalo o leiomyosarkom. Článek poukazoval na fakt, že morcelace mohla kvůli rozsevu buněk zhoršit stadium, a tak i prognózu nemocné lékařky. Po medializaci této kazuistiky FDA započal s přehodnocováním elektrické morcelace a v dubnu roku 2014 vydává nové prohlášení, které varuje před použitím elektrické morcelace u děložních myomů ať už v případě myomektomie, či hysterektomie. Varování bylo podloženo analýzami výskytu neočekávaného sarkomu v případě morcelace, jež uváděly riziko sarkomu 1: 351 a riziko leiomyosarkomu 1: 498. Tato čísla byla výrazně varovnější než dříve uváděná, která hovořila o riziku sarkomu 1: 1 000 až 1: 10 000 [9,10]. Prohlášení FDA mělo zásadní vliv na minimálně invazivní gynekologickou operativu ve Spojených státech a zároveň nastartovalo novou éru analýz dat a vylepšování bezpečnosti morcelace.
Neonkologická rizika morcelace
Morcelace je jako každý jiný lékařský úkon spojena s určitým rizikem komplikací. Odhlédneme-li na chvíli od onkologických aspektů morcelace, musíme si uvědomit, že morcelátor je ostrý nástroj, při jehož použití nelze vyloučit závažné poranění okolních tkání. Podle dat shromážděných v přehledovém článku z roku 2014 vycházejících z databáze FDA je incidence poranění okolních orgánů naštěstí velmi nízká a za 20 let užívání tohoto přístroje bylo zaznamenáno celkem 55 hlášení. V některých případech došlo k poranění dvou a více orgánových systémů, nejčastěji se jednalo o poranění střeva (31 případů) či cévního systému (27 případů). Další případy poranění okolních orgánů, např. ledviny, ureteru, močového měchýře či bránice, byly registrovány pouze v rámci několika ojedinělých kazuistik. Bylo zaznamenáno šest úmrtí připisovaných komplikacím spojeným s morcelací. I sami autoři článku hovoří o podhodnocení incidence poranění okolních orgánů v průběhu morcelace, nicméně i tak lze konstatovat, že tyto komplikace jsou vzácné. Podle záznamů z databáze MAUDE (Manufacturer and User Facility Device Experience) byly komplikace nejčastěji spojeny s nezkušeností operatéra a nedostatkem kontroly, dále pak s nepřehledným operačním polem či s poruchou samotného přístroje [7].
Mezi další možné komplikace patří riziko rozsevu buněk morcelované tkáně a s tím související výskyt parazitárního leiomyomu v případě hladkosvalových buněk a endometriózy či adenomyózy v případě buněk endometria. Riziko vzniku parazitární leiomyomatózy se dle literatury pohybuje kolem 0,1–0,9 % [11,12], přičemž ve většině případů je její výskyt vázán na premenopauzální stav pacientky. Riziko pooperačního výskytu endometriózy se pohybuje okolo 1,4 % [11].
Onkologická rizika morcelace
Porušení pouzdra maligního nádoru či jeho rozřezání vede k tzv. upstagingu onemocnění, a tím může dojít ke zhoršení prognózy. Tento fakt je již dlouhodobě známý např. ve stagingu karcinomu ovaria [13]. Proto v případě již stanoveného maligního onemocnění v předoperační diagnostice dominuje často otevřená operativa či užívání ochranných sáčků (tzv. endobag). U patologií děložního těla (s výjimkou zhoubného nádoru endometria) je ale předoperační diagnostika svízelná. Neexistují žádné postupy, které by byly schopny předoperačně s jistotou odlišit děložní benigní mezenchymový nádor od maligního, tj. sarkomu. Sonografie, která je dominantní zobrazovací metodou v gynekologii, dokáže rozpoznat rizikové znaky a vyslovit podezření na suspektní myometriální lézi, avšak zcela odlišit sarkom od myomu či jiné patologie neumí, což platí i pro magnetickou rezonanci [14–16]. V předoperační diagnostice by mohla pomoci předoperační biopsie myometriální patologie, která ale zatím nepatří mezi běžná předoperační vyšetření. Senzitivita a specificita tohoto vyšetření v identifikaci sarkomu v dostupné literatuře dosahuje až 92, resp. 100 % [17]. Tato diagnostická metoda s sebou sice nese mnohá úskalí, kvůli nimž není zařazena do běžného vyšetřovacího algoritmu, ale v rukou erudovaného gynekologa a patologa by mohla nabídnout validní pomoc v plánování managementu pacientek se suspektním děložním tumorem. Naopak biopsie endometria aspirační pipelou, kyretáží či hysteroskopií, která hraje nezastupitelnou roli v diagnostice endometriálních patologií [18], má v diagnostice myometriálních lézi jen malou výtěžnost. V případě záchytu leiomyosarkomu je senzitivita v literatuře udávána 36 % [19].
Incidence neočekávaného sarkomu
Děložní leiomyom je nejčastějším benigním ženským nádorem s výskytem až u 70 % žen [20]. Oproti tomu děložní sarkom patří mezi raritní onkologická onemocnění a jeho incidence se pohybuje mezi 0,5 a 3 případy na 100 000 žen za rok [21–23]. Podstatnou otázkou ale zůstává, jaké je riziko sarkomu v případě morcelace předpokládaného myomu. Jak již bylo zmíněno výše, FDA v roce 2014 uveřejnila riziko neočekávaného leimyosarkomu při operaci pro myomy ze svých analýz až 1: 498, v roce 2017 toto riziko upravuje na 1: 750 až 1: 570 [24]. V reakci na prohlášení FDA vyšlo od roku 2014 několik metaanalýz hodnotících riziko neočekávaného sarkomu či přímo leiomyosarkomu, z nichž převážná většina shromáždila retrospektivní data. Pritts et al uvádí ve své metaanalýze riziko leiomyosarkomu 0,51/1 000 výkonů, a budou-li brány v potaz pouze prospektivní studie, toto riziko vychází na 0,12/1 000 výkonů, tj. jeden případ na přibližně 8 300 operací [25]. Výsledky největší metaanalýzy pak zveřejnila americká Agentura pro výzkum a kvalitu ve zdravotnictví (AHRQ – Agency for Healthcare Research and Quality) v roce 2017, která uvádí riziko leiomyosarkomu 1: 10 000 až 1: 770 [26].
Vliv morcelace na onkologické onemocnění
Medializovaná kazuistika s morcelací děložního leiomyosarkomu vzbudila rozruch především z důvodu možného zhoršení prognózy u pacientek, jimž byl morcelován maligní děložní nádor. Mimo konvenční benigní leiomyomy může v průběhu minimálně invazivní operace dojít k morcelaci hladkosvalového tumoru s nejistým maligním potenciálem (STUMP – smooth muscle tumor of uncertain malignant potential) či sarkomu. Mezi maligní mezenchymální nádory se řadí leiomyosarkom jakožto nejčastější zástupce, dále pak endometriální stromální sarkomy (LG-ESS – low-grade endometrial stromal sarcoma, HG-ESS – high-grade endometrial stromal sarcoma), nediferencovaný stromální sarkom a velmi vzácný adenosarkom [27]. Podle dostupných dat z literatury nemá morcelace signifikantní vliv na prognózu v případě STUMP, LG-ESS či nediferencovaného sarkomu [28]. V prvních dvou případech (STUMP, LG-ESS) se jedná o tumory s velmi dobrou prognózou, kterou morcelace nijak nezhoršuje. Opačně je tomu u nediferencovaného sarkomu, neboť se jedná o nádor s velmi špatnou prognózou, a to bez ohledu na použití morcelace. Odlišná situace je tak pouze u leiomyosarkomu, u něhož byl prokázán negativní vliv morcelace na celkové přežití, které je po morcelaci tumoru signifikantně nižší [26,29]. Pětileté přežití u pacientek s leiomyosarkomem po elektrické morcelaci bylo 30 %, po morcelaci pomocí skalpelu 59 % a bez použití morcelace 60 % [26]. Data získaná o vlivu morcelace na prognózu pacientek s děložním sarkomem jsou ale limitovaná, a to retrospektivním charakterem studií a dále malým počtem pacientek v souborech.
Další aspekty morcelace
Varování FDA se odrazilo na volbě chirurgického přístupu, a to převážně v prvních letech po jeho vydání [30]. V případě hysterektomií byl zaznamenán nárůst laparotomické operativy ve srovnání s minimálně invazivní, což se nejvíce projevilo u supracervikální hysterektomie. Před rokem 2014 dominoval u tohoto výkonu přístup laparoskopický proti otevřenému (71 vs. 29 %), přičemž v prvním roce po FDA varování se tento rozdíl prakticky vyrovnal (53,7 vs. 46,3 %) [31]. Nutno ale zdůraznit, že navýšení otevřené operativy s sebou může přinášet jiné komplikace. Siedhoff et al publikovali studii [32], která popisuje modelovou situaci založenou na metaanalýzách a přehledových článcích. V hypotetických kohortách 100 000 postmenopauzálních žen indikovaných k hysterektomii pro předpokládané myomy v průběhu 5 let byla jedna větev výsledků počítána pro otevřenou hysterektomii (skupina A) a druhá pro laparoskopickou hysterektomii s morcelací (skupina B). Ve skupině B byla popisována celkově vyšší mortalita z důvodu přítomnosti leiomysarkomů (86 vs. 71: 100 000), oproti tomu byla ve skupině A vyšší mortalita na komplikace přidružené k operaci (32 vs. 12: 100 000), což v celkovém součtu vychází v neprospěch laparotomické operativy (o pět úmrtí více), nehledě na fakt, že většina nefatálních komplikací, např. hernie, infekce operační rány či tromboembolická nemoc, byla taktéž častěji zastoupena ve skupině s otevřenou operací. Rutstein et al následně na tuto analýzu navázali s výpočtem předpokládaných finančních nákladů na zdravotní péči, přičemž laparoskopická hysterektomie vycházela o 2 193 dolarů na pacientku méně [33]. Tuto modelovou situaci podporuje i jiná studie analyzující data z 603 amerických nemocnic, která popisuje signifikantní vzestup výskytu pooperačních komplikací po hysterektomii v prvních 30 dnech po operaci v období po vydání varování FDA [34].
Dalším faktem je, že rozsev buněk v dutině břišní je popisován i při konvenční laparotomické myomektomii či při laparoskopické myomektomii s následnou extrakcí tkáně v ochranném sáčku minilaparotomií [35,36]. Lze tedy říci, že určité riziko zhoršení stadia maligního nádoru s sebou přináší již samotná myomektomie. Při elektrické morcelaci je riziko rozsevu ještě zvýrazněno, a proto byly vyvinuty systémy chráněné tzv. in-bag morcelace. Jedná se o morcelaci uvnitř ochranného sáčku, který je možné využít při vaginální či abdominální morcelaci. Pro laparoskopii byly vytvořeny různé systémy využívající jeden či více portů [37]. Mezi nevýhody použití morcelačních sáčků patří prodloužení operačního času a přítomnost rozsevu buněk již před započetím morcelace z důvodu porušení pouzdra nádoru při myomektomii [38,39].
Morcelace v roce 2022
Ve světle všech doposud dostupných informací už v roce 2017 vyšlo doporučení Evropské společnosti gynekologické onkologie (ESGO – European Society of Gynaecological Oncology), které je ve shodě s následně publikovaným vyjádřením FDA z února 2020 stran použití elektrické morcelace [18,40]. Obě odborné skupiny dávají důraz na správnou selekci pacientek na podkladě předoperačního vyšetření. Kromě běžného gynekologického vyšetření je třeba posoudit přítomnost rizikových faktorů a zejména vyhodnotit výsledky zobrazovacích metod. Hlavním rizikovým faktorem je rostoucí věk, s nímž roste také riziko neočekávaného sarkomu. Věk pacientek > 50 let je spojen se signifikantně vyšším rizikem leiomyosarkomu. Mezi další rizikové faktory patří černošská rasa, u níž je popisována dvojnásobná incidence leiomyosarkomu oproti kavkazské rase, předchozí ozařování pánve, dlouhodobé užívání tamoxifenu (> 5 let) či mutace genu pro fumaráthydratázu spojená s Reedovým syndromem (hereditární leiomyomatóza a renální karcinom) [41]. Pacientka by měla být informována jednak o rizicích morcelace, zároveň pak o rizicích laparotomie. Za splnění těchto podmínek je použití morcelace u nízkorizikové pacientky přípustné. Je-li morcelace nutná, je u hysterektomie preferována vaginální a při nutnosti abdominální extrakce tkáně by měla být upřednostněna chráněná morcelace. Dále se doporučuje dutinu břišní po výkonu opakovaně vypláchnout, což může snížit množství rozesetých buněk [42]. Souhlasné stanovisko s použitím morcelace za dodržování určitých pravidel vydaly i další společnosti, např. Mezinárodní společnost pro gynekologickou endoskopii (ISGE – Internation Society for Gynecologic Endoscopy), Americká společnost gynekologů a porodníků (ACOG – American College of Obstetricians and Gynecologists) či Americká asociace gynekologické laparoskopie (AAGL – American Association of Gynecologic Laparoscopists) [23,43,44].
Závěr
Onkologická bezpečnost použití elektrické morcelace v případě objemných děložních myomů operovaných minimálně invazivní chirurgií byla v posledních letech často zpochybňována. Na základě výsledků recentních metaanalýz mezinárodní odborné společnosti umožnily využití této metody se všemi svými benefity v klinické praxi, ovšem za podmínek minimalizace rizika přítomnosti a rozsevu zhoubného nádoru. Správná selekce pacientek s nízkým rizikem přítomnosti děložního sarkomu a případné využití nových ochranných systémů hrají zásadní roli v bezpečnosti této metody.
ORCID autorů
B. Boudová 0000-0003-0444-7160
A. Richtárová 0000-0001-7635-4858
F. Frühauf 0000-0002-4161-1890
D. Fischerová 0000-0001-8222-3141
M. Mára 0000-0001-8222-3141
Doručeno/Submitted: 4. 3. 2022
Přijato/Accepted: 13. 5. 2022
MUDr. Barbora Boudová
Gynekologicko-porodnické oddělení
Oblastní nemocnice Trutnov a. s.
Maxima Gorkého 77
541 01 Trutnov
Zdroje
1. Mais V, Ajossa S, Guerriero S et al. Laparoscopic versus abdominal myomectomy: a prospective, randomized trial to evaluate benefits in early outcome. Am J Obstet Gynecol 1996; 174 (2): 654–658. doi: 10.1016/s0002-9378 (96) 70445-3.
2. Silva BA, Falcone T, Bradley L et al. Case-control study of laparoscopic versus abdominal myomectomy. J Laparoendosc Adv Surg Tech A 2000; 10 (4): 191–197. doi: 10.1089/1092 64200421568.
3. Wiser A, Holcroft CA, Tulandi T et al. Abdominal versus laparoscopic hysterectomies for benign diseases: evaluation of morbidity and mortality among 465,798 cases. Gynecol Surg 2013; 10: 117–122. doi: 10.1007/s10397-013-0781-9.
4. Semm K. New methods of pelviscopy (gynecologic laparoscopy) for myomectomy, ovariectomy, tubectomy and adnectomy. Endoscopy 1979; 11 (2): 85–93. doi: 10.1055/s-00 28-1098329.
5. Aarts JW, Nieboer TE, Johnson N et al. Surgical approach to hysterectomy for benign gynaecological disease. Cochrane Database Syst Rev 2015; 2015 (8): CD003677. doi: 10.1002/14651858.CD003677.pub5.
6. Steiner RA, Wight E, Tadir Y et al. Electrical cutting device for laparoscopic removal of tissue from the abdominal cavity. Obstet Gynecol 1993; 81 (3): 471–474.
7. Milad MP, Milad EA. Laparoscopic morcellator-related complications. J Minim Invasive Gynecol 2014; 21 (3): 486–491. doi: 10.1016/j.jmig.2013.12.003.
8. Kamp J, Burton TM. How FDA approved hysterectomy tools it now disfavors. Wall Street Journal. 2014 [online]. Available from: https: //www.wsj.com/articles/how-fda-approved-hysterectomy-tools-it-now-disfavors-1418700 781.
9. Bose D. Fate of laparoscopic morcellation post-FDA warning: a literature review. Int J Med Res Rev 2016; 4 (10): 1871–1878. doi: 10.17511/ijmrr.2016.i10.26.
10. Laparoscopic uterine power morcellation in hysterectomy and myomectomy: FDA Safety Communication. Silver Spring: US Food and Drug Administration. 2014 [online]. Available from: https: //wayback.archive-it.org/7993/20170722215727/https: //www.fda.gov/MedicalDevices/Safety/AlertsandNotices/ucm424443.htm.
11. Tulandi T, Leung A, Jan N. Nonmalignant sequelae of unconfined morcellation at laparoscopic hysterectomy or myomectomy. J Minim Invasive Gynecol 2016; 23 (3): 331–337. doi: 10.1016/j.jmig.2016.01.017.
12. Van der Meulen JF, Pijnenborg JM, Booms- ma CM et al. Parasitic myoma after laparoscopic morcellation: a systematic review of the literature. BJOG 2016; 123 (1): 69–75. doi: 10.1111/ 1471-0528.13541.
13. Šišovská I, Minář L, Felsinger M et al. Novinky ve FIGO stagingu karcinomu ovaria, tuby a peritonea. Ceska Gynekol 2017; 82 (3): 230–236.
14. Ludovisi M, Moro F, Pasciuto T et al. Imaging in gynecological disease (15): clinical and ultrasound characteristics of uterine sarcoma. Ultrasound Obstet Gynecol 2019; 54 (5): 676–687. doi: 10.1002/uog.20270.
15. Sun S, Bonaffini PA, Nougaret S et al. How to differentiate uterine leiomyosarcoma from leiomyoma with imaging. Diagn Interv Imaging 2019; 100 (10): 619–634. doi: 10.1016/j.diii.2019.07.007.
16. Van den Bosch T, Dueholm M, Leone FP et al. Terms, definitions and measurements to describe sonographic features of myometrium and uterine masses: a consensus opinion from the Morphological Uterus Sonographic Assessment (MUSA) group. Ultrasound Obstet Gynecol 2015; 46 (3): 284–298. doi: 10.1002/uog.14 806.
17. Kawamura N, Ichimura T, Ito F et al. Transcervical needle biopsy for the differential diag- nosis between uterine sarcoma and leiomyoma. Cancer 2002; 94 (6): 1713–1720. doi: 10.1002/cncr.10382.
18. Halaska MJ, Haidopoulos D, Guyon F et al. ESGO Council. European Society of Gynecological Oncology statement on fibroid and uterine morcellation. Int J Gynecol Cancer 2017; 27 (1): 189–192. doi: 10.1097/IGC.0000000000000 911.
19. Hinchcliff EM, Esselen KM, Watkins JC et al. The role of endometrial biopsy in the preoperative detection of uterine leiomyosarcoma. J Minim Invasive Gynecol 2016; 23 (4): 567–572. doi: 10.1016/j.jmig.2016.01.022.
20. Stewart EA, Cookson CL, Gandolfo RA et al. Epidemiology of uterine fibroids: a systematic review. BJOG 2017; 124 (10): 1501–1512. doi: 10.1111/1471-0528.14640.
21. Hosh M, Antar S, Nazzal A et al. Uterine sarcoma: analysis of 13,089 cases based on surveillance, epidemiology, and end results database. Int J Gynecol Cancer 2016; 26 (6): 1098–1104. doi: 10.1097/IGC.0000000000000720.
22. Sehnal B, Benková K, Kmoníčková E et al. Současný staging zhoubných nádorů děložního těla a jeho význam pro klinickou praxi. Cesk Patol 2014; 50 (2): 100–105.
23. Soto-Wright V, McLellan R. Chapter 46 – Uterine Sarcomas. In: Bieber EJ, Sanfilippo JS, Horowitz IR (eds). Clinical gynecology. Philadelphia: Churchill Livingstone 2006: 677–685.
24. ACOG committee opinion no. 770: uterine morcellation for presumed leiomyomas. Obstet Gynecol 2019; 133 (3): e238–e248. doi: 10.1097/AOG.0000000000003126.
25. Pritts EA, Vanness DJ, Berek JS et al. The prevalence of occult leiomyosarcoma at surgery for presumed uterine fibroids: a meta-analysis. Gynecol Surg 2015; 12 (3): 165–177. doi: 10.1007/s10397-015-0894-4.
26. Hartmann KE, Fonnesbeck C, Surawicz T et al. Management of uterine fibroids. 2017 [online]. Available from: https: //www.ncbi.nlm.nih.gov/books/NBK537742/.
27. Oliva E, Carcangiu ML, Carinelli SG, et al. Tumours of the uterine corpus: mesenchymal tumours. In: Kurman RJ, Carcangiu ML, Herrington CS (eds). World Health Organisation Classification of Tumours of the Female Reproductive Organs. 4th ed. Lyon: International Agency for Research on Cancer 2014: 135–147.
28. Raspagliesi F, Bogani G, Lorusso D. The impact of morcellation on survival outcomes of undiagnosed uterine sarcoma. Gynecol Oncol Rep 2018; 23: 37–38. doi: 10.1016/j.gore.2018.01.007.
29. Park JY, Park SK, Kim DY et al. The impact of tumor morcellation during surgery on the prognosis of patients with apparently early uterine leiomyosarcoma. Gynecol Oncol 2011; 122 (2): 255–259. doi: 10.1016/j.ygyno.2011.04.021.
30. Stentz NC, Cooney LG, Sammel M et al. Changes in myomectomy practice after the U.S. food and drug administration safety communication on power morcellation. Obstet Gynecol 2017; 129 (6): 1007–1013. doi: 10.1097/AOG.0000000000002035.
31. Jorgensen EM, Modest AM, Hur HC et al. Hysterectomy practice patterns in the postmorcellation era. Obstet Gynecol 2019; 133 (4): 643–649. doi: 10.1097/AOG.000000000000 3181.
32. Siedhoff MT, Wheeler SB, Rutstein SE et al. Laparoscopic hysterectomy with morcellation vs abdominal hysterectomy for presumed fibroid tumors in premenopausal women: a decision analysis. Am J Obstet Gynecol 2015; 212 (5): 591.e1–591.e8. doi: 10.1016/j.ajog.2015.03. 006.
33. Rutstein SE, Siedhoff MT, Geller EJ et al. Cost-effectiveness of laparoscopic hysterectomy with morcellation compared with abdominal hysterectomy for presumed myomas. J Minim Invasive Gynecol 2016; 23 (2): 223–233. doi: 10.1016/j.jmig.2015.09.025.
34. Multinu F, Casarin J, Hanson KT et al. Practice patterns and complications of benign hysterectomy following the FDA statement warning against the use of power morcellation. JAMA Surg 2018; 153 (6): e180141. doi: 10.1001/jamasurg.2018.0141.
35. Sandberg EM, van den Haak L, Bosse T et al. Disseminated leiomyoma cells can be identified following conventional myomectomy. BJOG 2016; 123 (13): 2183–2187. doi: 10.1111/1471-0528.14265.
36. Takeda A, Tsuge S, Shibata M et al. Identification of leiomyoma cell sheets in peritoneal washings retrieved by an intraoperative red blood cell salvage device during laparoscopic-assisted myomectomy with in-bag manual tissue extraction: a pilot study. J Minim Invasive Gynecol 2018; 25 (7): 1266–1273. doi: 10.1016/j.jmig.2018.03.026.
37. Taylan E, Sahin C, Zeybek B et al. Contained morcellation: review of current methods and future directions. Front Surg 2017; 4: 15. doi: 10.3389/fsurg.2017.00015.
38. Frascà C, Degli Esposti E, Arena A et al. Can in-bag manual morcellation represent an alternative to uncontained power morcellation in laparoscopic myomectomy? A randomized controlled trial. Gynecol Obstet Invest 2018; 83 (1): 52–56. doi: 10.1159/000477171.
39. Lambat Emery S, Pluchino N, Petignat P et al. Cell spillage after contained electromechanical morcellation using a specially designed in-bag system for laparoscopic myomectomy: prospective cohort pilot study. J Minim Invasive Gynecol 2019; 26 (7): 1351–1356. doi: 10.1016/j.jmig.2019.01.014.
40. Food and Drug Administration. UPDATE: the FDA recommends performing contained morcellation in women when laparoscopic power morcellation is appropriate. 2020 [online]. Available from: https: //www.fda.gov/medical-devices/safety-communications/update-fda-recommends-performing-contained-morcellation-women-when-laparoscopic-power-morcellation.
41. Halaska MJ, Gracia M, Laky R et al. Morcellation of the uterus: is there any place? Curr Oncol Rep 2020; 22 (7): 68. doi: 10.1007/s11912- 020-00927-6.
42. Yu SP, Lee BB, Han MN et al. Irrigation after laparoscopic power morcellation and the dispersal of leiomyoma cells: a pilot study. J Minim Invasive Gynecol 2018; 25 (4): 632–637. doi: 10.1016/j.jmig.2018.01.027.
43. Brown J. AAGL advancing minimally invasive gynecology worldwide: statement to the FDA on power morcellation. J Minim Invasive Gynecol 2014; 21 (6): 970–971. doi: 10.1016/j.jmig.2014.08.780.
44. Sizzi O, Manganaro L, Rossetti A et al. Assessing the risk of laparoscopic morcellation of occult uterine sarcomas during hysterectomy and myomectomy: literature review and the ISGE recommendations. Eur J Obstet Gynecol Reprod Biol 2018; 220: 30–38. doi: 10.1016/j.ejogrb.2017.10.030.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Česká gynekologie

2022 Číslo 4
Nejčtenější v tomto čísle
- Perforace dělohy při nitroděložních výkonech a její řešení
- Dělohu zachovávající operace adenomyózy a její vliv na reprodukční výsledky
- Gravidita v jizvě po císařském řezu – retrospektivní analýza případů z let 2012–2021
- Embolie plodovou vodou – přehled a multicentrická případová analýza
