Izolace a imunologická identifikace spermaglutinační protilátky z lidského séra
Isolation and immunology identification of spermagglutinating antibodies from human serum
Objective:
Isolation of spermagglutinating antibodies and their assesment.
Design:
Retrospective study.
Setting:
Special consulting for reptoduction immunology, Department of Obstetrics and Gynecology, Charles University and Faculty Hospital, Plzeň.
Methods:
Fractionation of serum samples by liquid exclusion chromatography, examination of full sera and their chromatographic fractions by Friberg teste (Tray Agglutination Test – TAT), indirect antiimmunoglobulin reaction test (i-MAR test) and by supplementar radial immunodiffusiona (RID).
Results:
Isolation of spermagglutinating fractions of antisperm antibodies positive sera preserved spermagglutinating aktivity and confirmed great spermagglutinating potential of IgM.
Conclusion:
According to assesment of the presence of IgG and IgG we reported possible states of immunisation: actual immunisation with IgM activity, perpetual stimulation (IgG and IgM) and, finaly, anamnestic titres in IgG. These findings can help us to choose an optimal way of treatment. Excluding gel chromatography is suitable method for serum proteins fractionation, but not their identification – presence of antisperm antibodies does not affect the chromatographic spectrum, nor the RID patterns.
Key words:
reproduction immunology, infertility, antisperm antibodies, i-MAR test, TAT test, excluding gel chromatography.
Authors:
J. Cibulka 1; Z. Ulčová-Gallová 1; M. Balvín 2; K. Bibková 1; Z. Mičanová 1
Authors‘ workplace:
Gynekologicko-porodnická klinika LF UK a FN Plzeň, přednosta doc. MUDr. Z. Rokyta, CSc.
1; Ústav soudního lékařství LF UK, Plzeň, přednostka doc. MUDr. H. Kvapilová, CSc.
2
Published in:
Ceska Gynekol 2009; 74(3): 201-208
Overview
Cíl studie:
Izolace spermaglutinačních protilátek a jejich stanovení.
Typ studie:
Retrospektivní.
Název a sídlo pracoviště:
Poradna reprodukční imunologie při Gynekologicko-porodnické klinice LF UK a FN v Plzni.
Metodika:
Frakcionace sér pomocí vylučovací kapalinové chromatografie, vyšetřování plných sér a jejich frakcí Fribergovým testem (též Tray Agglutination Test – TAT), nepřímým smíšeným antiimunoglobulinovým testem (i-MAR test) a doplňkově i radiální imunodifuzí (RID).
Výsledky:
Izolace spermaglutinujících frakcí vybraných sér. Identifikace zodpovědných tříd imunoglobulinů biologickými pokusy potvrzuje velký spermaglutinační potenciál IgM.
Závěr:
Pomocí vyšetřovaných imunoglobulinů třídy IgG a IgM jsme u čtyř vybraných sér zdokumentovali možná stadia imunizace od právě probíhajícího, s jednoznačnou a výraznou aktivitou IgM, přes přechodné/chronické (IgG a IgM), až po stadium anamnestických titrů IgG. Tato zjištění nám mohou pomoci při volbě adekvátního terapeutického přístupu. Vylučovací kapalinová chromatografie je vhodnou metodou izolace sérových protilátek, ne však jejich identifikace. Přítomnost ASA neovlivňuje chromatografické spektrum sérových proteinů ani velikost precipitačních prstenců u RID.
Klíčová slova:
reprodukční imunologie, neplodnost, antispermatozoidální protilátky, i-MAR test, TAT test, vylučovací kapalinová chromatografie.
ÚVOD
Neplodností se dnes označuje nemožnost otěhotnění po dobu 12 měsíců nechráněného pohlavního styku běžné frekvence [41]. Jde o celosvětový problém postihující zejména ekonomicky vyspělé státy. Předpokládá se, že antispermatické protilátky (ASA) spermaglutinačního typu sehrávají často závažnou roli v jinak nevysvětlitelné příčině neplodnosti [39].
Podle různých zdrojů okolo 20 až 40 % příčin neplodnosti nalézáme v ženském, 38 až 50 % v mužském faktoru. V 10 až 27 % případů jde o příčiny na straně obou partnerů; až v 15 % však nelze s jistotou identifikovat příčinu u žádného z partnerů. Je dnes obecně přijímaným názorem, že jakkoli jinak nevysvětlitelná neplodnost je obvykle spojená s imunologickými faktory [6, 9, 17, 33]. Antispermatozoidální protilátky (ASA) se mohou vyskytovat u mužů i žen a jsou dokumentovány u 9 až 12,8 % neplodných párů [1, 8, 16].
Na první výskyt sérových ASA u neplodných mužů, jakožto příčinu jejich neplodnosti, poukázali již v roce 1954 Rumke [27] a Wilson [42]. ASA jsou detekovány u 7 až 15 % jinak nevysvětlitelně neplodných mužů a u 13 až 80 (!)% obdobně vyšetřovaných žen [20]. Tyto ASA, zejména tříd IgG, IgA a IgM (jen velmi raritně IgE), jsou identifikovány v séru, seminální plazmě, cervikálním hlenu, peritoneální a folikulární tekutině [39]. Vliv na spermie se odvíjí nejen od kvality a kvantity těchto protilátek, ale především od charakteru antigen-protilátkové interakce [24]. ASA pak mohou způsobovat snížení až inhibici motility spermií [12], jejich poškození [11], útlum až nemožnost akrozomální reakce [4], bránění penetrace cervikálním hlenem [5, 7, 13], ovlivňují interakci spermie-zona pellucida [16, 18, 19] a v neposlední řadě mohou zcela zabránit splynutí spermie s oocytem [26, 43].
Existuje mnoho teorií vysvětlujících porušení tolerance mezi spermiemi, jakožto souborem autoantigenů, a sousedními imunokompetentními buňkami u muže, hovoříme zde o autoimunizaci, jejíž příčina nejčastěji tkví v porušení hemato-testikulární bariéry [15, 20, 29, 31, 32], úraz/operace varlat, infekční onemocnění, záněty, malignity, kryptorchismus, varikokéla [2, 3, 25]. Tyto inzulty zpravidla vedou k expozici spermatozoidálních antigenů imunitnímu systému s následnou tvorbou ASA.
V případě ženy je situace poněkud jiná. Na rozdíl od mužského urogenitálního ústrojí zde jde o proces izoimunizace. Ženský genitální systém je prostoupen imunokompetentními buňkami postkoitálně fagocytujícími spermie, což se jeví jako fyziologický proces [30]. Proč jsou ale antigenní struktury dále postoupeny k rozeznání imunitním systémem, zůstává ne zcela zodpovězenou otázkou. Tento mechanismus, jehož detailní fungování je dosud předmětem intenzivního zkoumání, je spoluurčující pro faktory vedoucí k izoimunizaci proti spermatozoidálním antigenům. Z těch nejpravděpodobnějších uvádíme: chirurgické výkony na děložním hrdle [20, 23], jeho chronická traumatizace, zánětlivé afekce, a zejména infekty, které se považují za významný imunopotenciační faktor [28, 36]. Imunitní odezva formou sérových ASA byla ve významném procentu pozorována u pacientek po transtubální pasáži (arteficiální inseminace), kdy může dojít k instilaci spermií do peritoneální dutiny [20].
Z výše uvedeného je zřejmé, že kapacita imunitní tolerance zejména genitálního ústrojí ženy je limitovaná a je nutné ji chápat jako rezervovanou pro potřeby beztak choulostivých procesů lidské reprodukce.
MATERIÁL A METODIKA
Vybrali jsme čtyři hluboce zamražená ASA pozitivní séra (-80 °C) s klinickou dokumentací Poradny reprodukční imunologie Gynekologicko-porodnické kliniky FN v Plzni (PRI). Jako jednoznačné kritérium vysoké sérové spermaglutinační pozitivity jsme vybrali titr ASA podle Fribergova (TAT) testu [10] větší nebo roven 1:512. K jeho znovupotvrzení jsme test po rozmrazení příslušných sér zopakovali a doplnili kontrolním nepřímým smíšeným antiimunoglobulinovým testem (i-MAR) k ověření třídy spermaglutinující protilátky.
Sériovou chromatografickou separací jednotlivých vzorků sér jsme získali naředěné frakce sérových proteinů, které jsme pak před rekoncentrací odsolili. Dále jsme biologicky testovali chromatograficky získané frakce pomocí TAT a radiální imunodifuze (RID) a posléze identifikovali jednotlivé spermaglutinační frakce ASA pozitivních sér.
Veškerý biologický materiál byl použit s informovaným souhlasem dobrovolných dárců a pacientů.
Séra
S požadavkem na vysoký titr ASA jsme podle databáze PRI vybrali a rozmrazili čtyři séra (titry 1:512 a 1:1024). Tyto titry jsme po rozmrazení ověřili pomocí TAT na destičce s mikrokomůrkami v 6 μl kapkách pod tekutým parafínem: 1μl Backerova roztoku (CaCl2 50 % 0,44 g; KCl 0,2 g; MgS O4 . 7 H2O 0,1 g; NaCl 3,4 g; NaHCO3 1,1 g; NaH2PO4 . H2O 0,07 g; glukóza 0,5g; fenolová červeň 8,3 ml; doplněno do 500 ml destilované sterilní vody) s motilními spermiemi jsme smíchali s 5 μl geometricky naředěného séra. Míra naředění, kde jsou ještě mikroskopicky zjistitelné spermaglutinace, vyjadřuje vyšetřovaný titr protilátek. Spermaglutinace jsme odečítali v inverzním mikroskopu při 200násobném zvětšení. Všechny čtyři vzorky vykazovaly shodně spermaglutinace. Séra ASA negativních dárců jsme použili jako kontroly u všech následujících metod.
Spermie
Sperma jsme získávali od zdravých dárců po 4denní sexuální abstinenci. Sperma jsme pak podrobili rutinnímu seminologickému zpracování a hodnocení podle WHO kritérií [40]. Dárci splňovali parametry normospermatiků. Přítomnost ASA v ejakulátech jsme vyloučili pomocí konvenčních testů, jakými jsou přímý MAR test [14] nebo Immunobead test (IBT- FertiPro) [7, 38]. Frakci živých pohyblivých spermií jsme získali metodou swim-up do Backerova roztoku a inkubovali po dobu 30 minut při 37 °C v atmosféře 5% CO2.
Gelová vylučovací chromatografie
Princip separace pomocí gelové vylučovací chromatografie vysvětlujeme ochotou molekul vstupovat do pórů částic separačního gelu při působícím tlakovém gradientu elučního pufru: čím větší je molekula, tím méně ochotně do těchto pórů vstupuje, a tím rychleji prochází kolonou.
Chromatografie jednotlivých pozitivních sérových vzorků jsme provedli na koloně dextranového gelu SuperdexTh 200 HR 10/30 (Amersham Biosciences). Pro optimální zatížení kolony jsme každé rozmrazené sérum naředili fyziologickým roztokem v poměru 1:3 a odstředili (10 min. 2000 rpm); 100 μl vzorku jsme pak opakovaně nanášeli na chromatografickou kolonu (ÄKTAprime, Amersham Biosciences). Při rychlosti průtoku 0,5 ml za minutu jsme sbírali 1ml frakce, a to v několika sériích pro každý vzorek séra. Jako eluant jsme použili 50 mM Na3PO4; 0,15 M NaCl; 0,02 % NaN3; pH7. Koncentrace proteinu v eluátu byla kontinuálně sledována spektrofotometrem při 280 nm a automaticky zaznamenávána v čase. Z principu gelové vylučovací chromatografie nutně došlo k velkému naředění získaných sérových frakcí, proto jsme pak jednotlivé vzorky opět zkoncentrovali z důvodu dosažení pokud možno původní protilátkové aktivity. Biologické vzorky jsme před samotnou lyofilizací odsolili na odsolovací koloně (Sephadex mini colones).
Nepřímý smíšený antiimunoglobulinový test
Nepřímý smíšený antiimunoglobulinový test (iMAR test) je nejrozšířenějším antiimunoglobulinovým testem [14, 38] a jako standard byl doporučen WHO [40]. MAR test může být proveden ve dvou variantách: přímé a nepřímé. Přímá varianta slouží k identifikaci ASA již přítomných na povrchu spermií; nepřímou variantu využíváme k identifikaci ASA v různých vyšetřovaných biologických materiálech, nejčastěji v ovulačním cervikálním hlenu, seminální plazmě (pokud nejsou přítomny pohyblivé či nejsou žádné spermie), dále v séru nebo v peritoneální tekutině. V případě nepřímého MAR testu používáme k detekci promyté vitální spermie zdravých dárců) s negativním MAR testem. V naší studii jsme pro znázornění reakce využili beraní erytrocyty s navázanými prasečími IgG a IgM; samotná identifikační (spermaglutinační) reakce proběhla po konečném přidání polyvalentního antiimunoglobulinového séra (anti-IgG, nebo anti-IgM). Pomocí nepřímého MAR testu jsme ověřili údaje o povaze ASA vyšetřovaných sér dle databáze naší laboratoře.
Fribergův test
Fribergův test byl proveden podle kapitoly Séra zvlášť s každou jednotlivou zahuštěnou chromatografickou frakcí. Vzhledem k malému objemu takto získaného materiálu jsme již neověřovali titr a zaměřili se jen na sledování biologické aktivity frakcí.
Radiální imunodifuze
Metodu radiální imunodifuze (RID) jsme zařadili jako duplicitní stupeň kontroly. Na komerčních gelech (The Binding Site – Immunotech) nasycených anti-IgM a gelech s anti-IgG jsme v okolí jamek pozorovali vznik precipitačních prstenců, jejichž průměr odpovídá koncentraci vyšetřovaných protilátek, a sice jak u plných sér, tak u jednotlivých chromatografických frakcí. Vzhledem k nespecifičnosti anti-Ig v gelech vůči ASA nebylo možné posuzovat jejich koncentraci, a proto byla RID pouze orientační zkouškou.
VÝSLEDKY
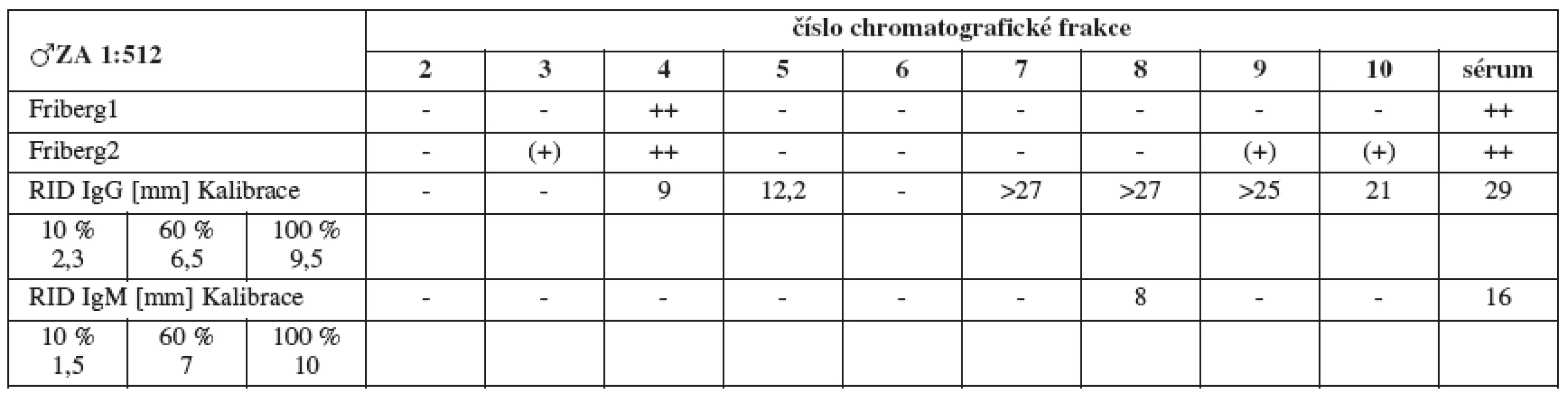
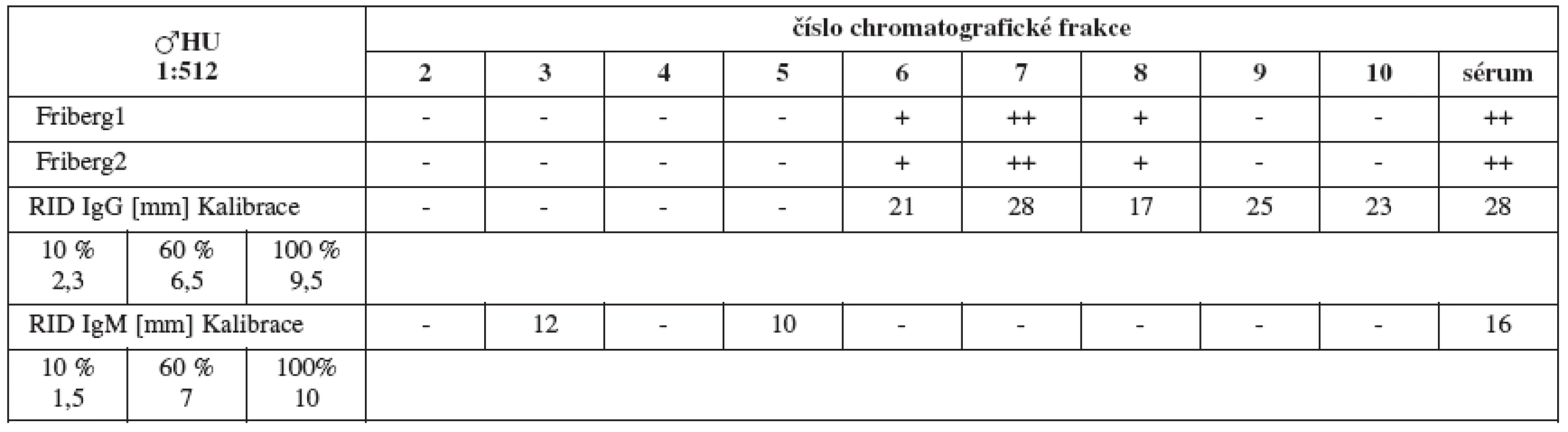
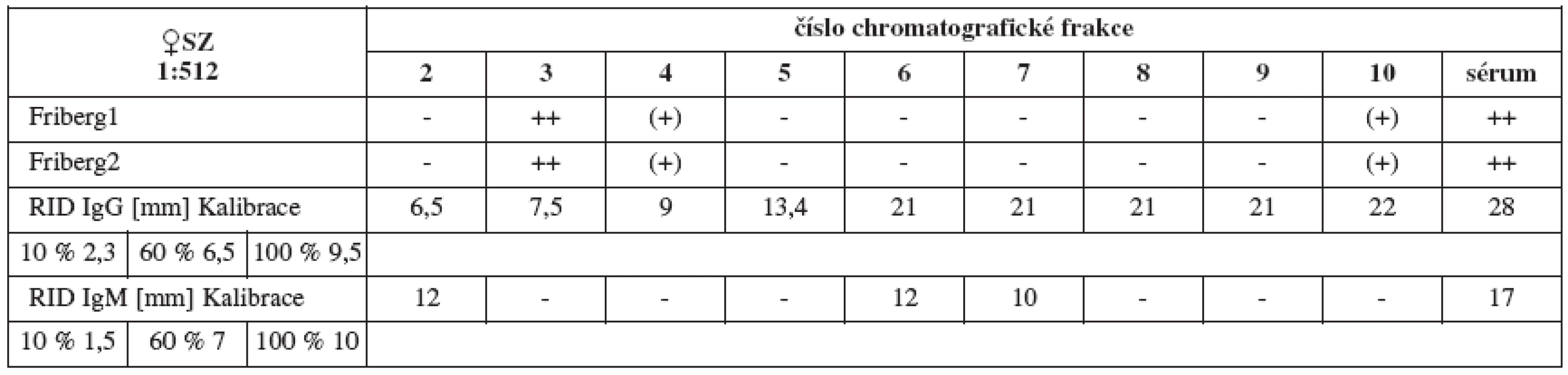
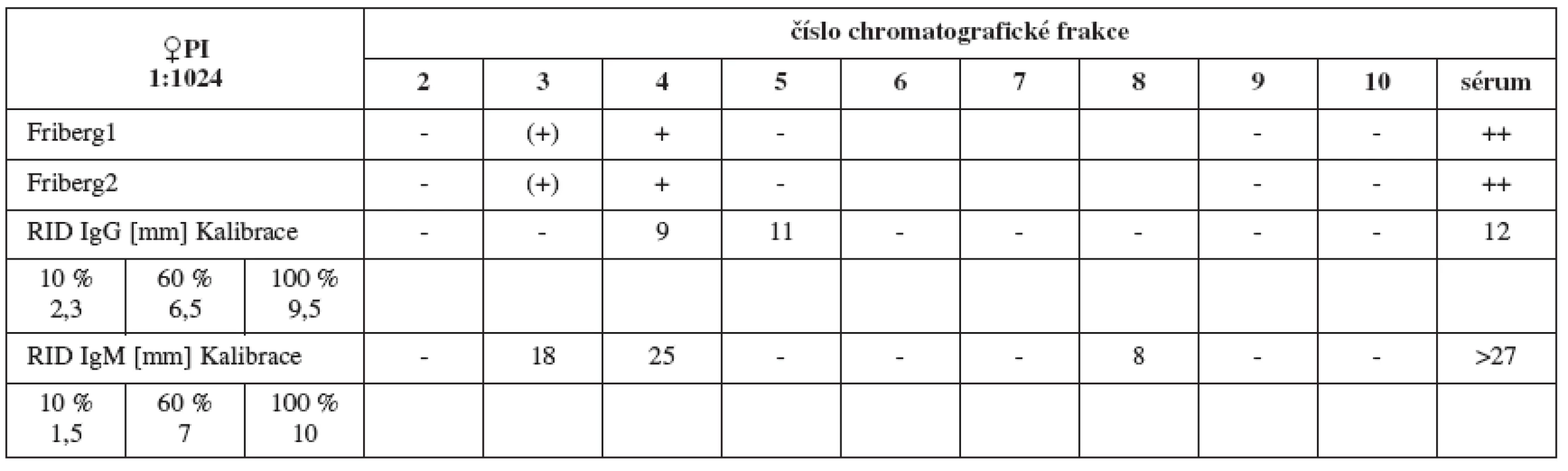
Chromatografickým rozdělením jednotlivých pozitivních sér jsme u každého séra získali celkem 20 frakcí v závislosti na jejich molekulových hmotnostech. Biologickému testování jsme podrobili prvních 10 z nich (oblast molekulových vah imunoglobulinů až albuminu). Fribergovým testem zjištěnou spermaglutinační aktivitu jsme vynesli do tabulek (tab. 1–4).
Sérum ZA (titr 1:512, tab. 1a) vykazuje jednoznačné spermaglutinace ve frakci 4 (IgM), nepřímý MAR test (tab. 1b) naproti tomu jasně vychází pozitivně pro IgG.


Sérum HU (titr 1:512, tab. 2a) vykazuje jednoznačné spermaglutinace ve frakcích 6–8 (odpovídá molekulové váze IgG), iMAR test (tab. 2b) je pozitivní v IgG.


Sérum SZ (titr 1:512, tab. 3a) vykazuje jednoznačné spermaglutinace ve frakci 3, méně pak 4. Jde o frakce časně vylučované obsahující proteiny o vysokých molekulových hmotnostech svědčících spíše pro IgM (971 kDa). Naproti tomu nepřímý MAR test (tab. 3b) plného séra vychází ve prospěch IgG při slabé pozitivitě v IgM.


Sérum PI (titr 1:1024, tab. 4a) vykazuje silné spermaglutinace ve frakci 4 (odpovídá molekulové váze IgM), iMAR test (tab. 4b) je pozitivní v IgM, méně pak v IgG.


Výsledky RID (tab. 5–8) jsou pouze orientační vzhledem k nespecifičnosti testu. Ukazují pouze na koncentraci imunoglobulinů dané třídy ve frakcích a v plném séru, nikoliv na jejich ASA aktivitu.
DISKUSE
V našem příspěvku jsme se snažili izolovat a imunologicky identifikovat charakter spermaglutinačních protilátek u mimořádně vysokých celkových titrů ASA našich pacientů z Poradny pro imunologii reprodukce.
Dělení pomocí gelové vylučovací chromatografie je jednoduchou metodou separace směsi proteinů a jeví se jako dobře použitelná i pro potřeby dělení proteinů sérových, tedy i imunoglobulinů charakteru ASA [34]. Musíme počítat s primárním naředěním vzorku (až 1:3), aby nedošlo k přetížení kolony a zkreslení výsledků. Další naředění (elučním pufrem) pak souvisí se samotnou frakcionací. Je nasnadě, že opětovná rekoncentrace je nutná, stejně tak jako dostatečný objem odpovídajících frakcí (sériové zpracování každého vzorku séra – v našem případě 5krát). Následná lyofilizace ovšem způsobí i zkoncentrování solí elučního pufru včetně konzervantů a biologický pokus je pak nehodnotitelný pro okamžitý spermicidní efekt. Odsolením vzorků dochází k jejich dalšímu naředění. Použití rekoncentrovaných frakcí u Fribergova testu je proto nutné hodnotit s ohledem na tyto skutečnosti. Výpadek aktivity v IgG u vzorku SZ a ZA může ukazovat na nedostatečnou koncentraci v příslušných frakcích; aktivita ve frakcích 3 a 4 naproti tomu potvrzuje známý spermaglutinační potenciál IgM.
Shoda výsledků TAT plného a frakcionovaného séra pacientů HU a PI je podepřena vysokými titry spermaglutinujících ASA (HU 1:512 a PI 1:1024).
Pomocí radiální imunodifuze jsme ověřili, že hladiny celkového sérového IgG a IgM nejsou nijak znatelně ovlivněny přítomností spermaglutinujících ani ostatních ASA ve srovnání s ASA neaktivní kontrolou, přestože jde o pacienty s klinicky signifikantními titry ASA.
Na průřezu výsledků výše uvedených pokusů u sér vybraných jen na základě titru jejich spermaglutinačních protilátek je možné uvažovat o různých stadiích imunizace lidského organismu proti spermatozoidálním antigenům. Obecně přijímaná skutečnost, že imunoglobuliny třídy IgM jsou protilátkami časné imunitní odezvy svědčící též pro permanentní expozici a ve třídě IgG nacházené titry dokazující anamnestickou, tedy paměťovou imunizaci, může být i zde kritériem jejího hodnocení.
Ačkoliv jiní autoři [21, 22] poukazují na spermaglutinační aktivitu zejména lokálně produkovaných slizničních IgA, nelze na plazmatické imunoglobuliny (zejména IgG), vzhledem k jejich prokázané přítomnosti v transsudátech, zapomínat. Plazmatické ASA mají z klinického hlediska i diagnostickou hodnotu markerů intenzity a časového charakteru imunizace spermatozoidálními antigeny. Další terapeutické postupy se pak odvíjejí od těchto zjištění a vlastní léčba pak může být relevantní odpovědí na právě probíhající zánětlivou afekci s tvorbou protilátek akutní fáze, nebo podpůrnou terapií sledující útlum produkce protilátek anamnestických [35, 37].
Současnými rutinními testy na přítomnost ASA sledujeme především projev spermaglutinačních protilátek, dále pak jejich ev. cytotoxický účinek, nebo imobilizaci v ovulačním cervikálním hlenu. Zjištění přítomnosti jiných ASA 4, 5, 7, 11, 12, 13, 16, 18, 19, 26, 43 se specifičtějším účinkem je obtížné a pro rutinní praxi zatím nedostupné.
Podpořeno grantem MŠMT ČR MSM 0021620812.
MUDr. Jan Cibulka
Gynekologicko-porodnická klinika
LF UK a FN
Alej svobody 80
304 60 Plzeň-Lochotín
e-mail: cibulkaj@fnplzen.cz
Sources
1. Ayvaliotis, B., Bronson, R., Rosenfeld, D., et al. Conception rates in couples where autoimmunity to sperm is detected. Fertil Steril, 1985, 43, p. 739–742.
2. Alexander, N,J., Schmidt, SS. Incidence of antisperm antibody levels and granulomas in men. Fertil Steril, 1977, 28, p. 655–657.
3. Ansbacher, R., Keung-Yeung, K., Wurster, JC. Sperm antibodies in vasectomized men. Fertil Steril, 1972, 23, p. 640–643.
4. Bohring, C., Krause, W. Differences in the antigen patterns recognized by antisperm antibodies in patients with infertility and vasectomy. J Urol, 2001, 166, p. 1178-1180.
5. Bronson, RA., Cooper, GW., Rosenfeld, DL. Autoimmunity to spermatozoa: effect on sperm penetration of cervical mucus as reflected by postcoital testing. Fertil Steril, 1984, 41, p. 609–614.
6. Campana, A. Evaluation of infertile couple. Reproductive Health. Area Serono Symposia. Series Frontiers in Endocrinology. Rome, Italy, 1993. p. 1-153.
7. Clarke, GN. Detection of antispermatozoal antibodies of IgG, IgA, and IgM immunoglobulin classes in cervical mucus. Am J Reprod Immunol, 1984, 6, p. 195–197.
8. Collins, JA., Burrows, EA., Yeo, J., YoungLai, EV. Frequency and predictive value of antisperm antibodies among infertile couples. Hum Reprod, 1993, 8, p. 592–598.
9. Eggert-Kruse, WG., Rohr, S., Bockem-Hellwing, K., et al. Immunological aspects of subfertility. Int J Androl, 1995, 18, Suppl. 2, p. 43-52.
10. Friberg, J. A simple and sensitive micro-method for demonstration of sperm-agglutinating activity in serum from infertile men and women. Acta Gynecol Scand, 1974, Suppl. 36, p. 21.
11. Hekman, A., Rümke, P. Auto- and Iso-Immunity against spermatozoa. - In Textbook of Immunopathology, 2nd ed. New York: Grune & Stratton, 1976, p. 947-961.
12. Check, JH., Adelson, HG., Bollendorf, A. Effect of antisperm antibodies on computerized semen analysis, Arch Androl, 27, 1991, p. 61–63.
13. Check, JH., Bollendorf, A., Katsoff, D., et al. The frequency of antisperm antibodies in the cervical mucus of women with poor postcoital tests and their effect on pregnancy rates. Am J Reprod Immunol, 1994, 32, p. 38–42.
14. Jager, S., Kremer, J., Van Slochteren-Draaisma, T. A simple method of screening for antisperm antibodies in human male. Detection of spermatozoal surface IgG with the direct mixed antiglobulin reaction carried out on untreated fresh human semen. Int J Fertil, 1978, 23, p. 12–21.
15. Jones, W. Gamete immunology. Hum Reprod, 1994. 9, p. 821-841.
16. Kamieniczna, M., Domagała, A., Kurpisz, M. The frequency of antisperm antibodies in infertile couples – a Polish pilot study, Med Sci Monit, 2003, 9, p. 194-201.
17. Leke, RJI. Infertility in Africa of South of Sahara. Reproductive Health. Area Serono Symposia. Series Frontiers in Endocrinology. Italy, 1993. p. 1-135.
18. Mahony, MC., Alexander, NJ. Sites of antisperm antibody action, Hum Reprod, 1991, 6, p. 1426–1430.
19. Marin-Briggiler, CI., Vazquez-Levin, MH., Gonzalez-Echeverria, F., et al. Effect of antisperm antibodies present in human follicular fluid upon the acrosome reaction and sperm-zona pellucida interaction. Am J Reprod Immunol, 2003, 50, p. 209–219.
20. Mazumdar, S., Levine, AS. Antisperm antibodies : aetiology, pathogenesis, diagnosis and treatment. Fert Steril, 1998, 70,5, p. 799-810.
21. Mestecky, J., Russell, MW. Induction of mucosal immune responses in the human genital tract. FEMS Immunol Med Microbiol, 2000, 27, 4, p. 351-355.
22. Mestecky, J., Moro, I., Kerr, MA., et al. Woof . Mucosal Immunology. 3rd ed., 2005, p. 153-181.
23. Nicholson, SC., Robinson, JN., Sargent, IL., et al. Does large loop excision of the transformation zone of the cervix predispose to the development of antisperm antibodies in women? Fert Steril, 1996, 65, 4, p. 871-873.
24. Ohl, DA., Naz, RK. Infertility due to antisperm antibodies.. Urology, 1995, 46, 4, p. 591-602.
25. Patrizio, P., Silber, SJ., Ord, T., et al. Relationship of epididymal sperm antibodies to their in vitro fertilization capacity in men with congenital absence of the vas deferens. Fertil Steril, 1992, 58, p. 1006–1010.
26. Peknicova, J., Capkova, J., Geussova, G., et al. Monoclonal antibodies to intra-acrosomal proteins inhibit gamete binding in vitro.. Theriogenology, 2001, 15, 56, 2, p. 211-223.
27. Rumke, P. The presence of sperm antibodies in the serum of two patients with oligospermia. Vox Sang, 1954, 4, p. 135-140.
28. Robertson, SA. Seminal plasma and male factor signalling in the female reproductive tract. Cell Tissue Res, 2005, 322, p. 43–52.
29. Smith, DA., Germolec, DR. Introduction to immunology and auto-immunity. Environ Health Perspect, 1999,107, Suppl. 5, p. 661-665.
30. Tomlinson, MJ., White, A., Barratt, CL., et al. The removal of morphologically abnormal sperm forms by phagocytes: a positive role for seminal leukocytes? Hum Reprod, 1992, 7, p. 517–522.
31. Tung, KSK., Teuscher, C. Mechanisms of autoimmune disease in the testis and ovary. Hum Reprod Update, 1995, 1, 1, p. 35-50.
32. Turek, PJ., Lipshultz, LI. Imminologic infertility. Urol Clin North Am, 1994, 21, 3, p. 447-468.
33. Ulčová-Gallová, Z., Ulč, I. Imunologie ženské sterility. Čes Gynek, 1983, 48, 1, s. 3-6.
34. Ulcova-Gallova, Z., Krauz, V. Identification of Circulating IgG Spermagglutinating Antibody in an Infertile Woman. Biol Immunol Reprod, 1985, 11, p. 41- 44.
35. Ulčová-Gallová, Z., Mráz, L., Pláničková, E., et al. Imunomodulace hydrocortisonem u sterilních žen. 5.kongres Čes. imunologů, 5.-9.7.1988, Plzeň, Imunol. zpravodaj ČSAV, III (XVII), 1988, 1, s. 98.
36. Ulcova-Gallova, Z., Hort, T. Immunoreactivity of Mycoplasma hominis PG21 antigens and human sperm antigens. Ces Gynek, 1992, 57, 8, s. 418-421.
37. Ulcová-Gallova, Z. How to treat the infertility caused by sperm antibodies? Ztrb Gynak, 1993, 115, p. 154-156.
38. Ulcova-Gallova, Z. Mixed antiglobulin reaction and tray agglutination test for detection of sperm antibodies. Int J Fertil, 1994, 39, 3, p. 185-191.
39. Ulcova-Gallova, Z. Diagnosis of infertility - attack of immunity, Grada, 2006, p. 1-144.
40. World Health Organization. Laboratory manual for the examination of human semen and sperm-cervical mucus interaction. University Press, Cambridge, U.K. 1992.
41. World Health Organization. Technical Report. Series n° 820. Recent advances in medically assisted conception. 1995.
42. Wilson, L. Sperm agglutinins in human semen and blood. Proc Soc Exp Biol Med, 1954, 85, p. 652-655.
43. Wolfe, JP., DeAlmeida, M., Ducot, B., et al. High levels of sperm-associated antibodies impair human sperm oolemma interaction after subzonal insemination. Fertil Steril, 1995, 63, p. 584–590.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2009 Issue 3
Most read in this issue
- Nechtěné děti
- Torze těhotné dělohy – neobvyklá porodnická komplikace
- Běžný variabilní imunodeficit v těhotenství (soubor kazuistik)
- Nové diagnostické přístupy k různým typům hydatidózních mol, hydropickým abortům a příslušné klinické postupy
